肉桂酸 (cinnamic acid, CINN), 化学名: E-3-苯基-2-丙烯酸, 是从肉桂皮或安息香中分离出来的有机酸, 在植物中经由苯丙氨酸脱氨降解而生成[1]。肉桂酸及其衍生物作为常见的芳香化合物, 具有香味、防腐等特点, 广泛应用于食品、化妆品等领域; 同时还具有抗肿瘤、抗病毒、抗菌等生物活性, 进而应用于医药、农药等多个领域。文献[2]报道, 肉桂酸及其衍生物可抑制多种肿瘤细胞的增殖, 诱导其分化与凋亡[3], 抑制肿瘤细胞的侵袭[4]、生长及转移[5], 进一步促进肿瘤细胞死亡[6]等作用。
鉴于肉桂酸及其类似物结构简单、易于合成, 代谢迅速、毒性极低, 具有良好的抗肿瘤活性以及对肿瘤细胞较强的选择性, 目前被认为是具有重大开发价值的一类天然产物。以肉桂酸为先导化合物开发低毒、高效和经济的抗肿瘤药物, 具有重要意义和良好的发展前景。
有机磷化合物由于具有丰富的生物活性及多变的结构类型, 一直是药物研究的热点[7]。其中, 在抗肿瘤方面的应用一直受到人们的重点关注, 从早期的抗癌药物环磷酰胺到双磷酸盐类抗肿瘤药物的出现, 人们对含磷抗癌新药的探索始终没有停止。近年研究报道, 部分膦酸酯类衍生物具有抗肿瘤作用[8, 9, 10]。前期, 本课题组设计合成的膦酸酯衍生物对SGC-7901、A549等肿瘤细胞有较好的增殖抑制作用[11, 12, 13, 14, 15]。进一步证实膦酸酯类化合物的潜在抗肿瘤活性。
基于上述实验和理论依据, 在前期研究的基础上, 根据活性结构拼合原理, 将肉桂酸与膦酸酯结构组合, 设计合成系列肉桂酰氧基膦酸酯衍生物, 进行体外抗肿瘤活性评价。目标化合物的合成如合成路线1所示。
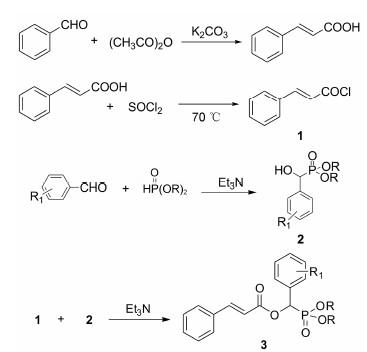 | 3a: R1 = H, R = C2H5; 3b: R1 = 2-F, R = C2H5; 3c: R1 = 4-F, R = C2H5; 3d: R1 = 4-OCH3, R = C2H5; 3e: R1 = H, R = CH(CH3)2; 3f: R1 = 2-F, R = CH(CH3)2; 3g: R1 = 4-F, R = CH(CH3)2; 3h: R1 = 4-OCH3, R = CH(CH3)2; 3i: R1 = H, R = n-C4H9; 3j: R1 = 2-F, R = n-C4H9; 3k: R1 = 4-F, R = n-C4H9; 3l: R1 = 4-OCH3, R = n-C4H9 Scheme 1 Synthetic route of target compounds |
参考相关文献[16]的类似方法制备中间体2, 其理化数据见表 1。
|
|
Table 1 Physical property of compounds 2a-2l |
以3a的合成为例。在功率600 W、温度20 ℃的反应条件下, 考察反应时间对化合物3a的产率影响, 当时间从20 min升至60 min, 化合物3a的产率从10.3% 增加到57.5%, 当反应时间为80 min时, 产率降低到43.4%。其中, 当反应时间从50 min到60 min, 目标物的产率仅仅增加了0.7%, 综合考虑, 确定50 min为最佳反应时间。
2.2 温度对目标化合物3a产率的影响在功率 600 W、反应时间50 min的条件下, 考察反应温度对产率的影响。温度由10 ℃升高至30 ℃, 目标物3a的产率增加了22.1%, 随着反应温度的进一步提高, 产率降低。因此, 确定30 ℃为反应的最佳温度。
2.3 微波辐射功率对目标化合物3a产率的影响控制反应时间在50 min、温度30 ℃的条件下, 考察微波辐射功率对产率的影响。随着功率从200 W增至800 W, 化合物3a的产率从26.4% 上升至74.6%, 当功率进一步上升至900 W、1 000 W时, 产率分别为74.9%、74.8%, 产率变化较小。因此, 800 W为该反应的最佳反应功率。
通过上述试验, 筛选出微波辅助合成目标物3a的最佳条件: 温度30 ℃、功率800 W、反应时间50 min。同时, 以3a为例, 考察了无微波辐射下的合成, 结果表明: 在30 ℃下, 反应10~15 h, 产率可达30.7%。因此, 与传统方法比较, 微波辅助合成具有反应时间短、产率高等优点。
目标化合物结构经IR、1H NMR、13C NMR及元素分析得以确证, 理化数据见表 2和表 3。
|
|
Table 2 Physical property of compounds 3a-3l |
|
|
Table 3 Spectral data of target compounds |
抗肿瘤活性筛选表明: 目标化合物对肿瘤细胞A549和SGC-7901有一定增殖抑制活性, 结果见表 4。从表中可以看出: 目标物对肿瘤细胞A549和SGC-7901有不同程度的增殖抑制作用。目标物3b、3c、3f、3h对所测肿瘤细胞有较好的抑制作用, 在20 μmol·L-1下对A549的抑制率分别为40.7%、53.2%、41.6%、55.3%, 而对SGC-7901的抑制率分别为56.8%、68.8%、56.3%、62.3%; 其中化合物3h在5 μmol·L-1下对SGC-7901抑制率达48.0%, 化合物3c在20 μmol·L-1下对SGC-7901抑制率为68.8%, 与对照药5-FU较为接近, 表现出较好的抗肿瘤活性。初步构效关系分析发现, 当R = C2H5、CH(CH3)2时的化合物有较好的抗肿瘤活性, 当R = n-C4H9, 该类化合物的抗肿瘤活性较差, 表明R取代烷基碳链的增长, 化合物的抗肿瘤活性减弱; 同时, 大多数氟取代的目标物比不含氟的目标物呈现较优的活性, 为后期优化与结构改造提供了依据。
|
|
Table 4 The inhibition rate of target compounds for different tumor cells |
进一步测试了抗肿瘤活性较好的化合物3c、3h的IC50, 对肿瘤细胞A549的IC50分别为 (11.6 ± 1.2) μmol·L-1、(12.1 ± 0.9) μmol·L-1 [对照品IC50 = (6.9 ± 0.7) μmol·L-1], 对肿瘤细胞SGC-7901的IC50分别为 (9.2 ± 1.4) μmol·L-1、(10.0 ± 1.9) μmol·L-1 [对照品IC50 = (5.6 ± 1.0) μmol·L-1], 两个化合物的IC50都接近对照药, 进一步说明对肿瘤细胞有增殖抑制作用。
4 小结一系列肉桂酰氧基膦酸酯衍生物被设计合成, 抗肿瘤活性测试表明, 部分目标物对所测肿瘤细胞有较好的增殖抑制作用, 尤以3c、3h最为突出, 值得进一步结构优化与深入抗肿瘤研究。
实验部分用SGW X-4显微熔点仪测定熔点 (温度未校正, 上海精密科学仪器有限公司); NMR用Bruker Avance 400型核磁共振仪测定 (TMS为内标); 红外光谱采用Varian傅里叶变换红外分光光度计; 元素分析数据用德国Elementar Vavio-III型元素分析仪测得; 96孔板读取用ELX800酶标仪; 药品与试剂均为分析纯。
1 化合物的合成 1.1 中间体1的合成参照文献[17]制备中间体1, 产率: 62.6%, 熔点: 37.5~39.2 ℃, 密封备用。
1.2 中间体2的合成参照文献[16]类似方法合成, 分别将10 mmol苯甲醛和6 mmol三乙胺加入50 mL圆底烧瓶中, 室温下向其滴加10 mmol亚磷酸二烷基酯, 60~80 ℃油浴反应1.5 h, 浓缩溶剂, 用石油醚-乙醚混合溶剂重结晶 [R=C2H5; CH(CH3)2] 或柱色谱纯化 [R=n-C4H9]。
1.3 目标化合物的合成称取2.5 mmol中间体2、2.5 mmol三乙胺加入50 mL三颈瓶中, 向其加入 20 mL无水二氯甲烷, 冰浴下, 搅拌反应, 再向其缓慢滴加2.5 mmol中间体1 (用10 mL二氯甲烷作为溶剂), 然后转移至微波合成仪中, 控制微波功率800 W, 30 ℃下反应50 min。反应完毕, 浓缩溶剂, 柱色谱分离 (乙酸乙酯-石油醚, 4∶1), 得目标化合物3。
2 MTT法抗肿瘤活性实验采用MTT法[18], 以氟尿嘧啶为对照, 测定目标化合物在5和20 μmol·L-1浓度下对肿瘤细胞A549与SGC-7901的抑制活性, 测定结果见表 4。
| [1] | Adedeji J, Hartman TG, Rosen RT, et al. Free and glycosidecally bound aroma compounds in hog plum (Spondias mombins L.)[J]. J Agric Food Chem, 1991, 39:1494-1497. |
| [2] | Huang W, Hu MX. The effects of cinnamic acid on proliferation and nucleolar organizer regions of PGCL3 human lung cancer cell[J]. Pract J Cancer (实用癌症杂志), 1997, 12:175-177. |
| [3] | Kawabata K, Yamamoto T, Hara A, et al. Modifying effects of ferulic acid on azoxymethane-induced colon carcinogenesis in F344 rats[J]. Cancer Lett, 2000, 157:15-21. |
| [4] | Cárdenas M, Marder M, Blank VC, et al. Antitumor activity of some natural flavonoids and synthetic derivatives on various human and murine cancer cell lines[J]. Bioorg Med Chem, 2006, 14:2966-2971. |
| [5] | Schobert R, Kern W, Milius W, et al. Synthesis of the first unnatural schisantherins and their effects in multidrugresistant cancer cells[J]. Tetrahedron Lett, 2008, 49:3359-3362. |
| [6] | De P, Baltas M, Bedos-Belval F. Cinnamic acid derivatives as anticancer agents-a review[J]. Curr Med Chem, 2011, 18:1672-1703. |
| [7] | Zhao YF, Yan XM, Yang CY, et al. Research progress in bioorganic phosphorus chemistry, bioanalysis and biosensing[J]. J Xiamen Univ (厦门大学学报), 2011, 50:319-327. |
| [8] | Liang Y, He HW, He HF, et al. Synthesis, crystal structure and biological activity of α-(5-chloro-3-trifluoromethyl-1-phenylpyrazol-4-carbonyloxy)-α-arylmethyl phosphonates[J]. Chin J Org Chem (有机化学), 2012, 32:1513-1518. |
| [9] | Byun HS, Bittman R, Samadder P, et al. Synthesis and antitumor activity of ether glycerophospholipids bearing a carbamate moiety at the sn-2 position:selective sensitivity against prostate cancer cell lines[J]. ChemMedChem, 2010, 5:1045-1052. |
| [10] | Ning LH, Wang WJ, Liang Y, et al. Synthesis and cytotoxicity of O, O'-dialkyl {[2-(substituted phenoxy) acetamido] (substituted phenyl) methyl} phosphonates[J]. Eur J Med Chem, 2012, 48:379-384. |
| [11] | Yang JQ, Gu Q, Shu B, et al. Synthesis and antitumor activity of O, O'-dialkyl-α-phenyl-α-(substituted benzoylanoxy)-methylphosphonate[J]. Chin J Org Chem (有机化学), 2013, 33:1113-1118. |
| [12] | Yang JQ, Gu Q, Hu YW, et al. Synthesis of O, O'-dialkyl-α-phenyl-α-phenylsulfonyloxy-methylphosphonate under ultrasound and their antitumor activity[J]. Chin J Org Chem (有机化学), 2013, 33:2226-2231. |
| [13] | Yang JQ, Che WL, Ma J, et al. Synthesis and bioactivities of quinolone derivates containing carboxylic ester[J]. Fine Chem (精细化工), 2014, 31:463-466. |
| [14] | Yang JQ, Ma J, Che WL, et al. Microwave-assisted synthesis and antitumor activity of salicyl acyloxy phosphonate derivatives[J]. Chin J Org Chem (有机化学), 2014, 34:2566-2571. |
| [15] | Yang JQ, Liu SL, Che WL, et al. Design, synthesis and antitumor activities of novel E-substituted 2, 3-diaryl propenoic acyloxy phosphonate derivatives[J]. Acta Pharm Sin (药学学报), 2015, 50:464-468. |
| [16] | Texier-Boullet F, Foucaud A. A convenient synthesis of dialkyl 1-hydroxyalkanephosphonates using potassium or caesium fluoride without solvent[J]. Synthesis, 1982, 2:165-166. |
| [17] | He X, Lin ZY, Zhu LY. Synthesis and vasodilative activities of cinnamide and α-phenylcinnamide derivatives[J]. Acta Pharm Sin (药学学报), 1999, 34:192-196. |
| [18] | Mosmann T. Rapid colorimetric assay for cellular growth and survival:applicationto proliferation and cytotoxicity assays[J]. J Immunol Methods, 1983, 65:55-65. |
 2016, Vol. 51
2016, Vol. 51


