2. 西南大学生命科学学院, 重庆 400715;
3. 西南大学?西藏大学农牧学院药用植物联合研发中心, 西藏大学农牧学院, 西藏林芝 860000
2. School of Life Sciences, Southwest University, Chongqing 400715, China;
3. SWU-TAAHC Medicinal Plant R & D Center, Agriculture and Animal Husbandry College, Tibet University, Nyingchi 860000, China
柳兰 (Chamerion angustifolium) 为柳叶菜科 (Onagraceae) 柳兰属 (Chamerion) 植物[1], 在藏医药中以根状茎入药, 具有调经活血、消炎止痛之功效, 临床上广泛用于跌打损伤、良性前列腺增生等疾病治疗[2]。国内外对柳兰的化学成分研究较少, 目前报道其化学成分有黄酮[3, 4]、鞣质[4, 5]、酚酸类[5]、萜类[4, 6]及其他成分[7, 8]; 其提取物具有抗炎[9]、抗氧化[10, 11]、抗增殖[12, 13]以及抗菌[14, 15]等生物活性。本课题组前 期对22种藏药材进行了抗氧化活性筛选, 发现柳兰乙酸乙酯部位和正丁醇部位都具有显著的抗氧化活性[16]。为更好开发利用柳兰药用资源, 本文对采集于西藏林芝地区的柳兰乙酸乙酯活性部位进行了化学成分研究, 分离到一个新的异香豆素, 命名为柳兰内酯甲素 (1)。
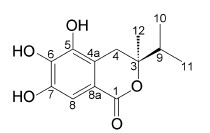
结果与讨论将柳兰根茎95%乙醇提取物依次以石油醚、乙酸乙酯萃取后, 对乙酸乙酯萃取物利用正相硅胶柱、MCI柱、Sephadex LH-20及半制备HPLC分离得到一个新的异香豆素, 命名为柳兰内酯甲素 (1) (图 1)。
 | Figure 1 Structure of compound 1 |
柳兰内酯甲素 (1), 为白色无定形粉末。HR-ESI- MS给出分子式为C13H16O5 (m/z: 251.092 4 [M-H]-,Calcd. 251.092 0), 由分子式计算1的不饱和度为6。紫外光谱 (UV) 显示在234、280 nm处有中等强度吸收, 红外光谱 (IR) 在1 703、1 618、1 450、1 340、866 cm-1有吸收, 显示化合物有苯环及不饱和酮的结构; 红外光谱在3 367、3 286 cm-1的吸收峰及化合物与3%三氯化铁溶液呈阳性反应, 提示存在酚羟基。
13C NMR (表 1) 及HSQC谱显示了13个碳原子, 其中低场的一个酯基碳 (-OCO) 信号δC 164.3和一组苯环信号 (δC 107.4、114.4、117.4、139.1、142.5和144.2)。1H和13C NMR还显示了一个连氧季碳信号δC 84.5, 一组次甲基信号 (δH 1.92, 1H, m; δC35.9), 一组亚甲基信号 (δH 2.78, 1H, d; 2.80, 1H, d; δC28.7) 及3组甲基信号 (分别是δH 1.16, 3H, s; 0.95、0.90, 各3H, d, J = 6.8 Hz; δC 20.5、16.6和17.3)。
|
|
Table 1 1H and 13C NMR data (500 and 125 MHz, respectively, in DMSO-d6) of compound 1 (δ, J in Hz) |
1H NMR谱显示1只有一个芳氢质子信号δH 6.94 (1H, s), 表明苯环上为5取代, 将其归属于H-8。H-8与芳香季碳δC 117.4 (C-8a)、139.1 (C-7) 和144.2 (C-6) 的HMBC相关峰, 以及与酯基碳δC 164.3的HMBC相关关系, 表明苯环上连接了酯基取代基 (图 2)。HMBC谱上还显示了亚甲基信号δH 2.78 (1H, d, J = 13.2 Hz)、δH 2.80 (1H, d, J = 13.2 Hz) 与芳香碳114.4 (C-4a)、117.4 (C-8a)、142.5 (C-5) 的相关峰, 表明该亚甲基是苯环C-4a上的取代基, 并位于C-4。1H NMR低场显示的3个活泼氢信号δH9.52、9.32和8.83 (各1H, brs), 为苯环上的取代基, 并由与羟基相连的3个苯环碳信号向低场方向位移 (δC 142.5、144.2和139.1) 得到证实。1H NMR和13C NMR谱还显示了异丙基信号δH 1.92 (1H, m)、δH 0.95和0.90 (各3H, d, J = 6.8 Hz); δC 35.9、16.6和17.3。HMBC谱上δH 0.95和0.90与δC 35.9的相关峰, 以及δH 1.92与δC 16.6和17.3的HMBC相关, δH 0.95与δC 17.3的相关, 进一步证实了该组信号为异丙基取代基。H2-4与季碳δC 84.5的HMBC相关关系, 表明δC 84.5位于C-3。HMBC谱还显示了一组单峰甲基质子信号δH 1.16 (3H, s) 与δC 84.5的相关峰; 以及异丙基信号δH 1.92、0.90和0.95与δC 84.5的相关峰, 表明甲基和异丙基取代基均是C-3上的取代基。
 | Figure 2 Key HMBC correlation of compound 1 |
以上分析表明化合物1中存在苯环及羰基, 结合高分辨质谱结果, 提示化合物还存在一个不饱和结构是形成了环。由13C NMR结合HSQC表明C-3为季碳信号, 其化学位移δC 84.5表明该碳与氧相连接, 提示羰基与C-3形成了内酯环。其余CH3-12与C-4和C-9的相关; 以及H2-4与C-12、C-1和C-9的HMBC相关关系, 进一步证实了化合物1的结构。C-3的绝对构型可以通过旋光度值来判断, 化合物1测得的旋光度值为[α]D20 −45.0, 而结构类似的已知化合物5,6- dihydroxymellein[17]的旋光度值为[α]D20 -61.7, 因此C-3的构型为R。
综上所述确定化合物1为一个新的异香豆素化合物, 命名为 (3R)-5,6,7-三羟基-3-异丙基-3-甲基异苯并二氢吡喃-1-酮[(3R)-5,6,7-trihydroxy-3-isopropyl- 3-methylisochroman-1-one], 即柳兰内酯甲素。
实验部分Perkin Elmer Spectrum GX型红外光谱仪 (美 国Perkin Elmer公司); Modelu-3010型紫外分光光度仪 (日本日立公司); WZZ-2S/2SS型数字式自动旋光仪 (上海精密科学仪器有限公司); WatersXevo G2-S QTOF型高分辨质谱仪 (美国Waters公司); BrukerAvance-500型核磁共振仪 (德国Bruker公司, TMS为内标); Shimadzu LC-20A半制备型高效液相色谱仪 (日本岛津公司, 检测器: SPD-M20A, 泵: LC-6AD; YMC-Pack ODS-A半制备柱, 250 mm × 10 mm, 5 μm); 正相硅胶 (青岛海洋化工厂); Sephadex LH-20 (日本三菱化学公司); MCIgel chp 20p 75~150 μm (日本三菱化学公司)。
柳兰(Chamerion angustifolium) 干燥根状茎于2011年7月自西藏林芝地区采集, 经西藏大学农牧学院兰小中教授鉴定, 凭证标本 (2011-CM-001) 保存于西南大学药学院药物分析教研室标本室。
1 提取与分离取柳兰干燥根茎粗粉18.5 kg, 室温下用95% 乙醇冷浸法提取3次, 减压浓缩, 得浸膏1 330.3 g, 将浸膏用适量水 (4 L) 分散制成混悬液, 依次用石油醚 (12 L, 萃取3次)、乙酸乙酯 (12 L, 萃取3次) 萃取, 减压浓缩得石油醚萃取物66.1 g, 乙酸乙酯萃取物178.6 g。乙酸乙酯萃取物进行正相硅胶柱色谱, 以石油醚-乙酸乙酯 (100∶0~0∶100) 梯度洗脱, 得到15个组分 (Fr.A-Fr.O)。Fr. N (石油醚-乙酸乙酯5∶5, 26.1 g) 经MCI柱, 用水-甲醇 (100∶0~0∶100) 梯度洗脱得5个组分 (Fr. N(1-5))。Fr. N3 (水-甲醇8∶2, 731.6 mg) 经Sephadex LH-20凝胶柱色谱, 以甲醇洗脱得6个组分 (Fr. N3-(1-6))。Fr. N3-3 (88.4 mg) 通过半制备HPLC以甲醇-水 (45∶55洗脱) 得到化合物1 (4.1 mg, tR 41.6 min)。
2 结构鉴定化合物1 白色无定形粉末; [α]D20 -45.0 (c 0.08, CHCl3); UV (MeOH) λmax (logε)/nm: 234 (2.29)、280 (2.27); IR (KBr) νmax/cm-1: 3 367、3 286、3 060、2 973、1 703、1 618、1 450、1 340、1 252、1 030、866; ESI-MS m/z: 251 [M-H]-; HR-ESI-MS: m/z 251.092 4 [M-H]- (Calcd. C13H16O5, 251.092 0); 1H NMR (500 MHz, DMSO-d6) 和13C NMR (125 MHz, DMSO-d6) 数据见表 1。
| [1] | Wu ZY, Raven PH, Hong DY. Flora of China Illustrations 13[M]. Beijing:Science Press, 2009:409-411. |
| [2] | Ni ZC. Economic Plants of Xizhang (Tibet) (西藏经济植物)[M]. Beijing:Beijing Science & Technology Press, 1990:449-450. |
| [3] | Liu YZ, Wang CF, Zhang ZZ, et al. Studies on chemical constituents of Chamaenerion angustifolium I. Flavonoids from Chamaenerion angustifolium[J]. Chin Tradit Herb Drugs (中草药), 2002, 33:289-291. |
| [4] | Granica S, Piwowarski JP, Czerwinska ME, et al. Phytochemistry, pharmacology and traditional uses of different Epilobium species (Onagraceae):a review[J]. J Ethnopharmacol, 2014, 156:316-346. |
| [5] | Liu YZ, Wang CF, Zhang ZZ, et al. Study on chemical constituents of Chamaenerion angustifolium II. Tannins and related polyphenolic compounds[J]. Chin Tradit Herb Drugs (中草药), 2003, 34:967-969. |
| [6] | Glen AT, Lawrie W, McLean J, et al. Triterpenoid constituents of rose bay willow herb[J]. J Chem Soc C, 1967, 55:510-515. |
| [7] | Hiermann A, Mayr K. The investigation of active compounds from Epilobium species. 3rd Communication:the occurrence of sitosterol derivatives in Epilobium angustifolium L. and Epilobium parviflorum Schreb[J]. Sci Pharm, 1985, 53:39-44. |
| [8] | Hiermann A, Bucar F. Studies of Epilobium angustifolium extracts on growth of accessory sexual organs in rats[J]. J Ethnopharmacol, 1997, 55:179-183. |
| [9] | Kiss AK, Bazylko A, Filipek A, et al. Oenothein B's contribution to the anti-inflammatory and antioxidant activity of Epilobium sp.[J]. Phytomedicine, 2011, 18:557-560. |
| [10] | Onar HC, Yusufoglu A, Turker G, et al. Elastase, tyrosinase and lipoxygenase inhibition and antioxidant activity of an aqueous extract from Epilobium angustifolium L. leaves[J]. J Med Plants Res, 2012, 6:716-726. |
| [11] | Shikov AN, Poltanov EA, Dorman HJD, et al. Chemical composition and in vitro antioxidant evaluation of commercial water-soluble willow herb (Epilobium angustifolium L.) extracts[J]. J Agric Food Chem, 2006, 54:3617-3624. |
| [12] | Vitalone A, Bordi F, Baldazzi C, et al. Anti-proliferative effect on a prostatic epithelial cell line (PZ-HPV-7) by Epilobium angustifolium L.[J]. Il Farmaco, 2001, 56:483-489. |
| [13] | Kujawski R, Bartkowiak-Wieczorek J, Karasiewicz M, et al. Influence of Epilobium angustifolium extract on 5α-reductase type 2 and MAPK3 kinase gene expression in rats prostates[J]. Herba Pol, 2013, 59:72-85. |
| [14] | Kosalec I, Kopjar N, Kremer D. Antimicrobial activity of willowherb (Epilobium angustifolium L.) leaves and flowers[J]. Curr Drug Targets, 2013, 14:986-991. |
| [15] | Battinelli L, Tita B, Evandri MG, et al. Antimicrobial activity of Epilobium spp. extracts[J]. Il Farmaco, 2001, 56:345-348. |
| [16] | Yang LH, Lan XZ, Luo YP, et al. Antioxidant activities of 22 kinds of Tibetan medicine[J]. J Chin Med Mater (中药材), 2012, 35:2007-2009. |
| [17] | Krohn K, Bahramsari R, Flörke U, et al. Dihydroisocoumarins from fungi:isolation, structure elucidation, circular dichroism and biological activity[J]. Phytochemistry, 1997, 45:313-320. |
 2016, Vol. 51
2016, Vol. 51


