肝癌是全球最常见的恶性肿瘤之一, 我国是肝癌发病率和死亡率极高的国家, 发病人数和死亡人数约占全球的50%[1]。目前, 外科手术是治疗肝癌的首选方案, 但是大部分肝癌患者在确诊时已错过手术的最佳时期, 只能依赖于化学药物的治疗, 但是肝癌对于化疗不敏感, 大部分化学药物并不能使患者的生存质量得到提高[2]。目前在抗癌领域的研究中, 天然产物取得了显著的成就, 临床使用的抗癌药物中60% 以上来源于天然产物, 已成为抗癌新药开发的重要途径之一[3, 4]。因此, 为了满足癌症患者的需求, 亟需从天然产物中开发新的药物[5]。
中药珍珠梅 (Sorbaria sorbifolia) 属蔷薇科植物, 广泛分布于云南、贵州、湖北、甘肃、宁夏、四川及东北。民间常利用其活血化瘀、消肿止痛等功效治 疗骨折、跌打损伤等, 并被《抗癌中药大辞典》收录为长白山抗癌药。珍珠梅抗癌的主要成分为5,2',4'- 三羟基-6,7,5'-三甲氧基黄酮 (5,2',4'-trihydroxy-6,7,5'- trimethoxy flavone, TTF1)。前期研究发现TTF1能够抑制小鼠S180肉瘤及人肝癌HepG-2细胞的生长[6], 通过线粒体途径诱导细胞凋亡及抑制肿瘤血管生成[7, 8]。但TTF1溶解性较差, 为了促进TTF1在体内的吸收, 本研究以硬脂酸为载体, 采用乳化低温固化法制备生物体可降解吸收的5,2',4'-三羟基-6,7,5'-三甲氧基黄酮纳米粒 (5,2',4'-trihydroxy-6,7,5'-trimethoxy flavone nanoparticle, TTF1-NP), 大大提高了药物溶解性及利用效率[9]。内质网应激是细胞凋亡的一条新途径, 不同于线粒体和死亡受体两条经典途径[10]。本研究利用人肝癌HepG-2细胞建立裸鼠移植瘤模型, 探讨TTF1-NP诱导裸鼠肝癌移植瘤细胞凋亡的内质网应激作用机制, 为临床肝癌治疗提供理论基础。
材料与方法 药品及试剂小牛血清、青链霉素、DMEM培养液 (Gibco公司); GRP78、p-JNK、Caspase 12、CHOP抗体 (Cell Signaling Technology公司); 羊抗兔LgG、羊抗小鼠LgG (Sigma公司); TUNEL原位细胞凋亡检测试剂盒 (南京凯基试剂公司); 苏木素、伊红、柠檬酸钠抗原修复液、胎牛血清封闭液、3% H2O2 (南京碧云天生物公司); TTF1-NP由延边大学药学院关丽萍教授惠赠。
动物与瘤株BALB/c裸鼠, 由上海斯莱克实验动物有限责任公司提供, 实验动物生产许可证: SCXK (沪) 2007-0005; 合格证编号: 2007000543734; 实验动物使用许可证: SYXK (苏) 2012-0047。裸鼠全部为雄性, 日龄28~35天, 体重18~22 g。收集培养的HepG-2细胞, 计数, 调整细胞悬液浓度为每毫升1×107个, 以每只0.1 mL接种于裸鼠右侧腋窝皮下。
分组与给药用游标卡尺测量裸鼠移植瘤直径, 待移植瘤生长至50~100 mm3时将动物随机分成模型组 (对照组, 生理盐水)、TTF1-NP低剂量组 (5 μmol·kg-1)、中剂量组 (10 μmol·kg-1)、高剂量 (20 μmol·kg-1) 和阿霉素组 (ADM, 2 mg·kg-1), 每组8只。各组裸鼠尾静脉注射给药, 每天1次, 连续10天。
体内抑瘤率用游标卡尺测量移植瘤直径, 隔天测量肿瘤体积和动物体重, 动态观察TTF1-NP的抗肿瘤效应, 给药10天后处死裸鼠, 手术剥取瘤块称重。肿瘤体积 (tumor volume, TV) 计算公式为: TV = 1/2×a×b2, 其中a、b分别表示长和宽。抗肿瘤活性评价指标: 肿瘤生长抑制率(inhibition rate, IR), 计算公式如下: IR (%) = (1 - 给药组平均瘤重 / 模型组平均瘤重) × 100%。
瘤体形态学观察取出浸泡在10% 福尔马林溶液中的裸鼠移植瘤, 选取肿瘤边缘部位, 采用常规方法制备蜡块, 冷却后制成5 μm连续切片, 脱蜡, 水 合, 进行HE染色, 光学显微镜观察并拍照。
TUNEL原位细胞凋亡检测取蜡块制成5 μm连续切片, 进行脱蜡, 水合, 按照TUNEL检测试剂盒说明书进行操作。显微镜下观察染色深浅, 染好后立即中止, 自来水冲洗15 min, 用蒸馏水终止显色反应, 复染, 封片, 光学显微镜观察拍照并计算出细胞凋亡指数 (apoptosis index, AI), 计算公式如下: AI (%) = (凋亡细胞数/细胞总数)×100%。
免疫组织化学检测取蜡块制成5 μm连续切片, 60.℃烤片1 h, 二甲苯脱蜡透明, 梯度酒精脱水, 3% H2O2处理5 min, 柠檬酸钠抗原修复液修复15 min、96 ℃左右, 待其冷却, 5% 封闭液封闭30 min, GRP78 (1∶150)、p-JNK (1∶100)、caspase 12 (1∶100) 一抗4 ℃孵育过夜, PBS洗载玻片后, 相应二抗 (1∶150) 室温孵育2 h, 显色 (二氨基联苯胺, DAB), 显微镜下观察阳性区域, 染好后立即中止, 用自来水轻柔冲洗15 min, 用蒸馏水终止显色反应, 苏木素染色3 min, 梯度酒精处理, 二甲苯20 min, 中性树胶封片, 光学显微镜观察并拍照。
Western blotting检测提取裸鼠移植瘤组织总蛋白, 考马斯亮蓝法测定蛋白含量, 将蛋白与5× 上样缓冲液混匀(4∶1) 后在电磁炉上加热沸腾5 min, 取30 μg上样, 浓缩胶 (80 V、1 h)、分离胶 (100 V、2 h) 使蛋白分离, 切胶, 转膜p-JNK、β-actin、caspase 12 (100 V、60 min), CHOP (100 V、30 min), GRP78 (100 V、75 min), 5% 牛奶室温封闭1 h, 一抗 (1∶ 1 000、4 ℃孵育过夜), TBST洗膜后二抗 (1∶5 000) 室温2 h, ECL显影液孵育5 min, 显影并拍照。
数据处理所有数据均采用x±s表示, 采用单因素方差分析统计, P < 0.05有显著性统计意义, P < 0.01有极显著性统计意义。
结果 1 TTF1-NP对裸鼠肝癌移植瘤细胞的抑制作用对照组裸鼠体重和肿瘤体积增长较快, 5、10、20 μmol·kg-1 TTF1-NP给药组和ADM组对裸鼠移植瘤细胞均有抑制作用, IR分别为51.2%、54.2%、61.8% 和65.9% (P < 0.01), 结果见图 1。
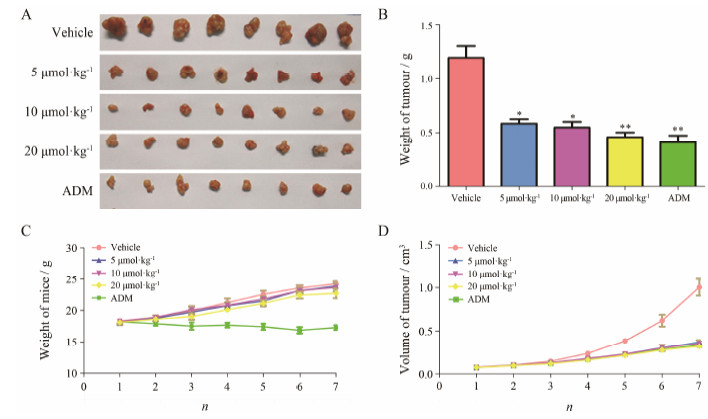 | Figure 1 Effects of 5,2',4'-trihydroxy-6,7,5'-trimethoxy flavone nanoparticle (TTF1-NP, 5, 10 and 20 μmol·kg-1) on implanted HepG-2 cell tumor growth in nude mice. A: Implanted tumor in nude mice; B: Weight of tumor; C: Weight of mice; D: Volume of tumor. ADM: Adriamycin, 2 mg·kg-1. n = 8, x±s |
光镜下观察, 对照组裸鼠移植瘤细胞完整, 细胞核规则, 细胞数目较多。随着给药剂量增加, 肿瘤细胞数逐渐减少, 形态改变, 细胞核固缩、碎裂, 伴有炎症细胞浸润 (图 2)。
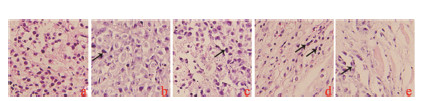 | Figure 2 Morphological changes of apoptosis by HE staining (200×). a: Vehicle; b: 5 μmol·kg-1; c: 10 μmol·kg-1; d: 20 μmol·kg-1 TTF1-NP; e: ADM |
TUNEL原位细胞凋亡检测结果显示: 对照组小鼠 中大部分细胞呈蓝紫色, 阳性细胞极少见, 给药组和ADM组可见明显的棕色阳性区域, 其中20 μmol·kg-1 TTF1-NP组阳性表达超过ADM组, AI高达24%。由此可见TTF1-NP能够诱导裸鼠肝癌移植瘤细胞的凋亡, 结果见图 3。
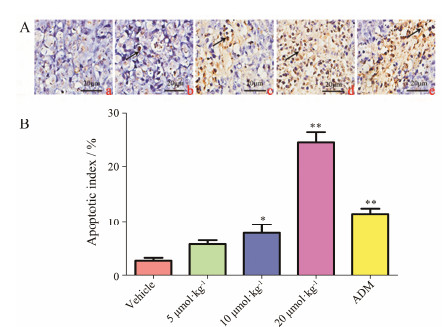 | Figure 3 TTF1-NP promoted implanted tumor cell apoptosis in nude mice. A: Representative images of TUNEL staining. a: Vehicle; b: 5 μmol·kg-1; c: 10 μmol·kg-1; d: 20 μmol·kg-1 TTF1-NP; e: ADM. B: Apoptotic index of implanted tumor cell |
与模型组相比, TTF1-NP给药组中GRP78、caspase 12和p-JNK蛋白表达阳性区域增大, 检测到明显的棕色颗粒, 表明加强内质网应激反应可以促进裸鼠肝癌移植瘤细胞的凋亡, 结果见图 4。
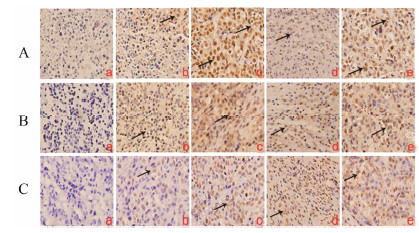 | Figure 4 Expression of GRP78 (A), caspase 12 (B), p-JNK (C) by immunocytochemistry staining in different groups (200×). a: Vehicle; b: 5 μmol·kg-1; c: 10 μmol·kg-1; d: 20 μmol·kg-1 TTF1-NP; e: ADM |
TTF1-NP给药组GRP78、p-JNK、caspase 12和CHOP的表达较对照组均有升高, 表明裸鼠肝癌移植瘤细胞的凋亡可能与内质网应激途径中关键蛋白活化表达有关 (图 5)。
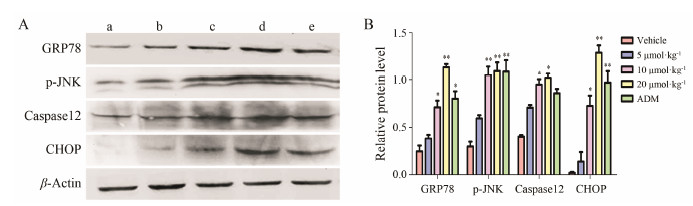 | Figure 5 Effect of TTF1-NP on key protein in implanted tumor cell in nude mice. A: The protein expressions were detected by Western blotting; B: Relative protein level. a: Vehicle; b: 5 μmol·kg-1; c: 10 μmol·kg-1; d: 20 μmol·kg-1 TTF1-NP; e: ADM. n = 8, x±s. P < 0.05, **P < 0.01 vs vehicle group |
在75 ℃下硬脂酸处于液态。由于TTF1在水中的溶解度小, 因此药物存在于硬脂酸所形成的乳滴中, 形成药物的硬脂酸溶液。将体系分散于冰水浴中, 初乳的温度急剧下降, 微乳凝固成固态硬脂酸纳米粒, 药物被包封在硬脂酸纳米粒中。前期研究结果显示: 采用低温超速离心法分离纳米粒与游离药物, 分别测定3个批号TTF1黄酮固体脂质纳米粒的包封率为64.6%、64.5% 及64.7%[9]。TTF1固体脂质纳米粒体外释药先快后慢, 绝大多数药物包封于可生物降解材料骨架内[9]。本研究, 采用乳化低温固化法制备生物体可降解吸收的TTF1-NP, 大大提高了药物溶解性及利用效率, 为TTF1-NP诱导裸鼠肝癌移植瘤细胞凋亡的作用机制研究提供了药物基础。
前期研究发现, 在体外实验中, TTF1-NP能够通过内质网应激途径诱导人肝癌HepG-2细胞的凋亡[11]。珍珠梅作为一种中药抗癌药, 目前尚未报道TTF1-NP对裸鼠肝癌移植瘤细胞有作用, 本实验以人肝癌HepG-2细胞建立裸鼠移植瘤模型, 研究其诱导裸鼠移植瘤细胞凋亡的作用并探讨其内质网应激作用机制。
裸鼠瘤重和抑瘤率是衡量药物抗肿瘤效果最直接的指标[12], 本实验构建裸鼠肝癌移植瘤模型。结果显示, 给药组裸鼠瘤重明显下降, 并且呈现量效关系, 3次重复实验的抑制率均在50%以上, 显示出TTF1-NP具有稳定的抗肿瘤作用。
TTF1-NP诱导裸鼠肝癌移植瘤细胞凋亡的形态学检测, HE染色结果显示, TTF1-NP可以引起裸鼠移植瘤细胞的细胞核固缩, TUNEL检测更形象直观地反映了TTF1-NP可以诱导裸鼠移植瘤细胞的凋亡。
内质网应激是真核细胞的一种自我保护机制, 在各种条件刺激下, 细胞通过一系列信号途径对其应答, 包括增强蛋白折叠、加速蛋白降解等, 以减轻或中止内质网应激[13]。但是当内质网应激强度过强或内质网应激持续时间过长时则会造成细胞损伤[14], 主要通过激活内质网应激的CHOP通路、caspase通路和JNK通路诱导细胞凋亡。内质网应激关键蛋白GRP78与IRE1、PERK、ATF6的解离活化是内质网应激发生发展的必要条件。随着内质网腔内Ca2+水平持续升高会引起钙蛋白酶活化, 激活caspase 12, 该分子是半胱天冬氨酸家族中唯一定位于内质网的分子, 仅在内质网应激通路中被活化, 而在线粒体或死亡受体途径中不被激活[15]。Caspase 12从无活性酶原的形式发生重组, 切割并激活caspase 9酶原, 继而启动caspase家族经典凋亡途径, 最终导致细胞凋亡。大量积累的IRE1、PERK、ATF6的活化可导致CHOP表达增加, CHOP的主要作用是在未折叠蛋白反应过程中通过编码蛋白质促进细胞凋亡。CHOP可能通过降低Bcl-2的表达和耗竭谷胱甘肽下调细胞的抗凋亡能力, Bcl-2可调节内质网的Ca2+ 稳态, 诱导细胞凋亡[16]。活化的IRE1募集TRAF2并与ASK1结合形成IRE1-TRAF2-ASK1复合物, 激活JNK[17]。活化后的JNK可从细胞质转移到细胞核中, 通过磷酸化激活c-jun、c-Fos等转录因子, 而调节下游凋亡相关靶基因的表达。活化的JNK也可以留在细胞质中, 通过磷酸化直接调节Bcl-2家族成员的活性而介导细胞凋亡的发生。本研究运用免疫组织化学技术和Western blotting技术检测GRP78等一系列蛋白的表达, 结果显示, TTF1-NP可以激活内质网应激途径中蛋白的表达从而诱导细胞发生凋亡, 免疫组织化学检测结果与Western blotting检测结果一致。
综上所述, TTF1-NP对裸鼠移植瘤具有一定的抑制作用, 能够诱导肿瘤细胞凋亡, 内质网应激反应可能是其诱导肿瘤细胞凋亡的机制之一, 具体分子作用机制尚待进一步研究。由此可见, TTF1-NP具有一定的抗肿瘤药用价值, 值得进一步研究。
| [1] | EI-Serag HB, Rudolph KL. Hepatocellular carcinoma:epidemiology and molecular carcinogenesis[J]. Gastroenterology, 2007, 132:2557-2576. |
| [2] | Thomas M. Molecular targeted therapy for hepatocellular carcinoma[J]. J Gastroenterol, 2009, 44 suppl 19:136-141. |
| [3] | Newman DJ, Cragg GM. Natural products as sources of new drugs over the 30 years from 1981 to 2010[J]. J Nat Prod, 2012, 75:311-335. |
| [4] | Butler MS. Natural products to drugs:natural product derived compounds in clinical trials[J]. Nat Prod Rep, 2008, 25:475-516. |
| [5] | Guo M, Wu ZL, Wang CG, et al. Synthesis and anti-tumor activity of baicalin-metal complex[J]. Acta Pharm Sin (药学学报), 2014, 49:337-345. |
| [6] | Zhang XW, Cui CX, Chen LY. Inhibition of Sorbaria sorbifolia on proliferarion of hepatoma HepG-2 cell line[J]. J Chin Med Mater (中药材), 2007, 30:681-684. |
| [7] | Li Y, Bian L, Zhang XW, et al. TTF1-induced apoptosis of HepG-2 cells through a mitochondrial pathway[J]. Oncol Rep, 2011, 26:651-657. |
| [8] | Liu C, Li XW, Zhang XW, et al. Inhibition of tumor angiogenesis by TTF1 from extract of herbal medicine[J]. World J Gastroenterol, 2011, 17:4875-4882. |
| [9] | Li Y, Cui FD, Zhang XW. Preparation of flavonoids-loaded solid lipid nanoparticles from Sorbaria sorbifolia[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2012, 23:2549-2550. |
| [10] | Nakagawa T, Zhu H, Morishima N, et al. Caspase-12 mediates endoplasmic-reticulum-specific apoptosis and cytotoxicity by amyliod-beta[J]. Nature, 2000, 403:98-110. |
| [11] | Xiao B, Liu BT, Zhang XW. TTF1-NP induces human hepatoma cell apoptosis through ERS-mediatedand pathway[J]. J Jilin Univ Med (吉林大学学报医学版), 2015, 41:1118-1123. |
| [12] | Wang DY, Zhang HQ, Li X, et al. Apoptosis induced by the C21 sterols in Baishouwu and its mechanism of action in hepatoma[J]. Acta Pharm Sin (药学学报), 2007, 42:366-370. |
| [13] | Meng C, Yuan CH, Zhang CC, et al. Ophiopogonin D protects cardiomyocytes against doxorubicin-induced injury through suppressing endoplasmic reticulum stress[J]. Acta Pharm Sin (药学学报), 2014, 49:1117-1123. |
| [14] | Arensdorf AM, Diedrichs D, Rutkowski DT. Regulation of the transcriptome by ER stress:non-canonical mechanisms and physiological consequences[J]. Front Genet, 2013, 4:256-257. |
| [15] | Chen YH, Wu XD, Yao ST, et al. Calcineurin is involved in cardioprotection induced by ischemic postconditioning through attenuatuing endoplasmic reticulum stress[J]. Chin Med J, 2011, 124:3334-3340. |
| [16] | Iqbal J, Meyer PN, Smith LM, et al. BCL2 predicts survival in germinal center B-cell-like diffuse large B-cell lymphomatreated with CHOP-like therapy and rituximab[J]. Clin Cancer Res, 2011, 17:7785-7795. |
| [17] | Lu SJ, Yang ZT, Sun L, et al. Conservation of IRE1-regulated bZIP74 mRNA unconventional splicing in rice (Oryza sativa L.) involved in ER stress responses[J]. Mol Plant, 2012, 5:504-514. |
 2016, Vol. 51
2016, Vol. 51


