2. 江苏食品药品职业技术学院, 江苏淮安 223001
2. Jiangsu Food and Pharmaceutical Science College, Huaian 223001, China
黄药子为薯蓣科植物黄独 (Dioscoreae bulbifera L.) 的干燥块茎, 药性苦寒, 具有散结消瘿、清热解毒、凉血止血的作用, 传统上常用于治疗瘿瘤、疮疡肿毒、咽喉肿痛及毒蛇咬伤等, 现代临床上主要用于甲状腺疾病和恶性癌症的治疗[1]。有报道[2, 3]显示在发挥临床良好疗效的同时, 黄药子会诱导肝毒性, 从而大大限制了其临床上的广泛应用。
半枝莲为唇形科黄芩属植物半枝莲 (Scutellariae Barbata D. Don) 的干燥全草, 原产于南美洲, 主要分布于阿根廷、巴西南部、乌拉圭以及中国大陆等地。其味辛、苦, 性寒, 具有清热解毒、化瘀利尿的功效, 临床上主要用于治疗疔疮肿毒、咽喉肿痛、跌扑伤痛、水肿、黄疸及虫蛇咬伤。现代药理学研究表明, 半枝莲具有抗菌、抗肿瘤、保肝及抗肝纤维化等活性[4, 5, 6, 7]。但是半枝莲对黄药子诱导的肝损伤是否具有保护作用尚未见报道。本实验观察了半枝莲醇提物对黄药子诱导肝毒性的保护作用及其机制。
材料与方法 药材半枝莲 (产地安徽, 批号: 111123) 购于上海养和堂中药饮片有限公司, 由上海中医药大学吴立宏老师鉴定为唇形科植物半枝莲; 黄药子乙酸乙酯部位 (EF) 是实验室前期由黄药子制备所得, 方法见文献[8]。
试剂和主要仪器谷丙/谷草转氨酶 (alanine/ aspartate aminotransferase, ALT/AST)、碱性磷酸酶 (alkaline phosphatase, ALP)、白蛋白 (albumin, ALB)、总蛋白 (total protein, TP) 及髓过氧化酶 (myeloperoxidase, MPO) 试剂盒 (南京建成生物工程研究所); 2-vinylpyridine、还原型辅酶II (nicotinamide adenine dinucleotide phosphate, NADPH) (德国Roche Diagnostics GmbH公司); 谷胱甘肽还原酶 (glutathione reductase, GR)、5,5'-二硫代双-(2-硝基苯甲酸) [5,5'- dithiobis-(2-nitrobenzoic acid), DTNB] 及蛋白酶抑制剂 (美国Sigma公司); TNF-α、IFN-γ及IL-6酶联免疫检测试剂盒 (上海丰翔生物科技有限公司); 胞浆胞核蛋白提取试剂盒 (美国Thermo Scientific公司); HO-1抗体 (美国Santa Cruze公司); IκB、p65、phospho-p65及β-actin抗体(美国Cell Signaling Technology公司); 山羊抗兔或鼠二抗 (美国Jackson ImmunoResearch公司); 硝酸纤维素膜 (美国Bio-Rad公司); 化学发光检测试剂 (美国Millipore公司); 预染标准蛋白分子 (加拿大Fermentas公司); Tris碱、十二烷基硫酸钠、过硫酸铵、β-巯基乙醇、四甲基乙二胺、甲叉双丙烯酰胺等 (加拿大BBI公司); 甘氨酸购自Amresco; Bradford蛋白检测试剂盒、脱脂奶粉、丙烯酰胺及Tween-20 (上海生工生物工程公司), 其他试剂均为国产分析纯。酶标仪 (Bio-Tek); 蛋白电泳仪 (Bio-Rad); G:BOX Chemi XL1.4化学发光成像系统 (Syngene公司)。
半枝莲醇提物 (SE) 的制备称取半枝莲粗粉, 浸泡2 h后用10倍体积80% 乙醇回流提取2 h, 提取3次, 合并3次滤液, 减压浓缩, 烘干, 即为半枝莲醇提物, 4 ℃冰箱保存备用。
野黄芩苷含量测定取半枝莲醇提物适量, 精密称定, 置于25 mL量瓶中, 加80% 乙醇至约25 mL, 超声提取60 min, 恢复到室温后加80% 乙醇定容至25 mL, 混匀后, 用0.45 µm有机相滤膜滤过, 取续滤液, 即得。取野黄芩苷标准品适量, 精密称定, 加甲醇配成1 mg·mL-1的溶液, 混匀, 即得对照品溶液。液相条件: 高效液相色谱仪 (安捷伦公司); Sepax HP-C18 column (4.6 mm × 250 mm, 5 μm); 流动相 条件为甲醇-水-醋酸=35∶61∶4 (v/v/v), 流速为1.0 mL·min-1, 等度洗脱; 进样体积为5 µL; 柱温为25 ℃; 检测波长为335 nm。
实验动物清洁级ICR小鼠, 雄性, 18~22 g, 购自中国科学院上海实验动物中心, 合格证号: SCXK (沪2007-0005)。饲养条件: 温度 (22 ± 1) ℃, 相对湿度65% ± 10%, 7:00~19:00, 19:00~7:00, 明暗循环照明。
动物处理动物按体重随机分组, 分别为对照组、EF (450 mg·kg-1)、EF (450 mg·kg-1) + SE (100 mg·kg-1)、EF (450 mg·kg-1) + SE (140 mg·kg-1)、EF (450 mg·kg-1) + SE (200 mg·kg-1) 组。各组连续11天灌胃 (ig) 给药EF和SE, 于末次给药晚上动物禁食不禁水, 24 h摘眼球取血, 供测定血清生化指标和细胞因子。另外取肝组织固定于福尔马林液, 用于做病理切片。其余的肝组织用锡箔纸包好后, 液氮速冻, 转移到-80 ℃冰箱保存, 备用。
ALT、AST、ALP、ALB和TP测定血液在室温静置2 h后, 常温840 ×g离心15 min, 吸取上层 血清于新eppendorf管中, -80 ℃保存。血清中ALT、AST、ALP、ALB及TP水平的测定, 按试剂盒说明书的方法进行操作。
肝组织病理观察将固定于福尔马林的部分肝大叶先用石蜡包埋, 然后进行切片, 通过常规苏木素- 伊红 (hematoxylin-eosin, HE) 染色后, 在光学显微镜下观察组织病理变化。
肝组织中还原型谷胱甘肽 (GSH) 含量的测定 将小鼠肝组织放置于冰冷的加有偏磷酸的磷酸盐缓冲液中匀浆。匀浆液于4 ℃、10 000 ×g离心10 min, 上清液转移至新管。反应液由磷酸盐缓冲液、DTNB、ethylene diamine tetraacetic acid、GR、NADPH和样品组成, 30 ℃反应30 min后, 测定412 nm处的吸光度。将测得的吸光度值代入总的GSH标准曲线。同时, 取等量的样本加入6% 三乙醇胺和10 mmol·L-1 2-乙烯基吡啶, 充分混匀后, 离心。37 ℃水浴过夜后, 离心, 上清液再同上测定获得氧化型谷胱甘肽 (oxidizedglutathione, GSSG) 含量。GSH含量 = 总谷胱甘肽含量 - 2× GSSG含量。考马斯亮蓝法测定样品蛋白浓度, 结果以每毫克蛋白中的GSH含量表示。
肝组织中MPO活力的检测称取肝组织, 用生理盐水制备10% 匀浆液, 按照试剂盒中说明书进行测定。
酶联免疫检测实验按照试剂盒说明书进行。以测得的吸光度为纵坐标, 对应的标准物浓度为横坐标建立标准曲线。根据标准曲线和测得的样品吸光 度, 计算样品中该细胞因子的浓度, 再乘以稀释倍数, 即为该细胞因子的含量。
核蛋白提取按照试剂盒说明书制备胞浆和胞核蛋白, 测蛋白并调成等蛋白浓度后变性处理, -20 ℃保存, 待进行电泳分析。
Western blot实验剪取肝组织于eppendorf中, 加入预冷的裂解液 (pH 7.5, 50 mmol·L-1 Tris、150 mmol·L-1 NaCl、1 mmol·L-1乙二胺四乙酸、10% 甘 油、0.5% NP-40、20 mmol·L-1 NaF、1 mmol·L-1苯甲基磺酰氟、10 μg·mL-1亮抑肽酶、10 μg·mL-1抑肽酶和10 μg·mL-1抑肽素A), 冰浴超声制备匀浆液后, 冰上充分裂解。转移到新管的上清液测定蛋白浓度后, 调成等蛋白浓度并变性处理。制备好的蛋白样本进行聚丙烯酰胺凝胶电泳分离, 将胶上的蛋白转移到硝酸纤维素膜上。取出膜后, 进行封闭。然后加入一抗, 过夜孵育。膜取出后, 室温平衡1 h, 抗体清洗液清洗, 二抗室温孵育1 h后, 抗体清洗液清洗。最后加入化学发光液反应1 min, 吸去多余液体后显影。其中β-actin用作参比。结果用GeneTools软件处理并定量。
统计学分析实验数据用均数±标准误 (x±s) 表示, 用统计软件SPSS 16.0中的单因素方差分析进行处理, 组间两两比较采用LSD-t检验, 以P < 0.05表示差异具有显著性。
结果 1 SE中野黄芩苷含量测定野黄芩苷的化学结构如图 1所示。通过HPLC含量测定发现SE中野黄芩苷含量为4.09%。
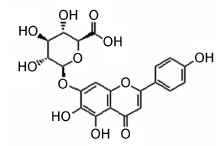 | Figure 1 Chemical structure of scutellarin |
如图 2所示, EF (450 mg·kg-1) 连续灌胃给药后, 小鼠血清ALT、AST及ALP活性均明显升高 (P < 0.001), TP和ALB含量均明显降低 (P < 0.001, P < 0.01), 表明EF诱导了明显的肝毒性。与EF组比较, 同时灌胃给予SE (100 mg·kg-1) 后, ALT、AST与TP水平没有明显差别 (P > 0.05), 而ALP水平明显降低 (P < 0.05), ALB水平明显增加 (P < 0.05); SE (140 mg·kg-1) 组ALT与TP水平没有明显差别 (P > 0.05), AST、ALP水平显著降低 (P < 0.05, P < 0.01), ALB水平显著增加 (P < 0.01), 表明这两个剂量SE有微弱的保护作用。而SE (200 mg·kg-1) 组小鼠血清ALT、AST及ALP水平均明显降低 (P < 0.05), TP和ALB水平明显增加 (P < 0.05), 表明SE (200 mg·kg-1) 对EF连续给药诱导的肝毒性具有明显的保护作用。
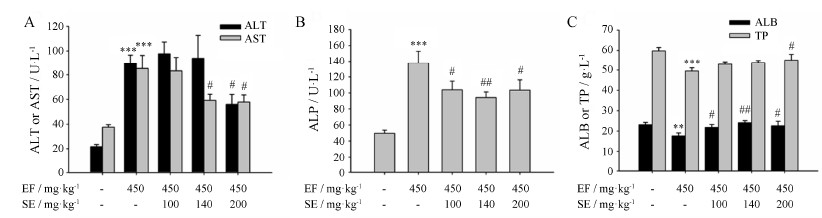 | Figure 2 Serum ALT, AST and ALP activities, and ALB, TP amount in EF-treated mice with or without SE. A: Serum ALT and AST activities; B: Serum ALP activity; C: Serum ALB and TP amount. n = 7-10, x±s. **P < 0.01, ***P < 0.001 vs control; #P < 0.05, ##P < 0.01 vs EF group. ALB: Albumin; ALP: Alkaline phosphatase; ALT: Alanine aminotransferase; AST: Aspartate aminotransferase; EF: Ethyl acetate fraction of Dioscorea bulbiferaL.; SE: Ethanol extract of Scutellaria barbataD. Don; TP: Total protein |
对小鼠肝脏病理学改变的影响, 如图 3所示。从图中可以看到, 对照组肝细胞形状正常, 边界清晰; 图 3B为EF (450 mg·kg-1) 组肝组织, 肝细胞变性, 排列紊乱, 表明EF (450 mg·kg-1) 诱导了小鼠肝组织病理性损伤。而在SE保护组 (图 3C) 中, 肝细胞排列整齐, 边界清晰, 表明SE (200 mg·kg-1) 可抑制EF诱导的肝毒性。
 | Figure 3 Liver histological evaluation of EF-treated mice with or without SE. A: Control; B: EF (450 mg·kg-1); C: EF (450 mg·kg-1) + SE (200 mg·kg-1) (×100). |
如图 4所示, 与对照组比较, EF (450 mg·kg-1) 连续灌胃给药后, 肝组织中MPO的活性显著升高 (P < 0.001)。同时给予不同剂量的SE后, 肝组织中MPO活性均有明显的降低 (P < 0.01, P < 0.05), 提示SE可抑制EF诱导的中性粒细胞浸润。
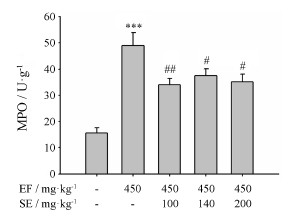 | Figure 4 Liver myeloperoxidase (MPO) activity in EF-treated mice with or without SE. n = 8-10, x±s. ***P < 0.001 vs control; #P < 0.05, ##P < 0.01 vs EF group |
炎症相关细胞因子TNF-α、IL-6及IFN-γ的水平,如图 5所示。与对照组比较, EF (450 mg·kg-1) 连续灌胃给药后, 小鼠血清中TNF-α、IL-6和IFN-γ的含量均显著升高 (P < 0.001, P < 0.01)。与EF组比较, SE (100和140 mg·kg-1) 组TNF-α与IFN-γ含量均没有明显区别 (P > 0.05), 但是IL-6含量明显降低 (P < 0.01)。SE (200 mg·kg-1) 给药后, EF诱导的血清中TNF-α、IL-6、IFN-γ含量的升高均得到显著降低 (P < 0.05, P < 0.01)。
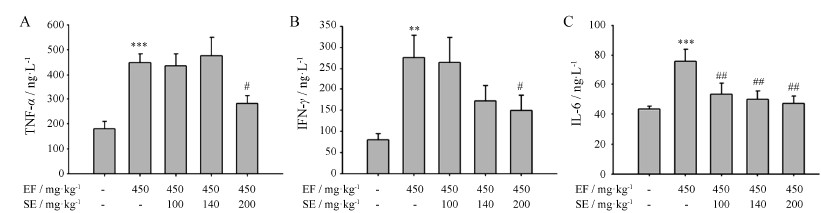 | Figure 5 Serum TNF-α, IL-6 and IFN-γ contents in EF-treated mice with or without SE. A: TNF-α; B: IFN-γ; C: IL-6. n = 8-10, x±s. **P < 0.01, ***P < 0.001 vs control; #P < 0.05, ##P < 0.01 vs EF group |
如图 6A和B所示, 与对照组比较, EF (450 mg·kg-1) 连续灌胃给药后, IκB蛋白表达明显减少 (P < 0.01), 而同时给予SE (200 mg·kg-1) 后, IκB蛋白 表达明显增加 (P < 0.05)。NF-κB p65的磷酸化及转核的结果, 如图 6A、C和D所示, 与对照组比较, EF (450 mg·kg-1) 组磷酸化的p65表达明显增加 (P < 0.05), 并且胞核中p65表达也明显增加 (P < 0.01), 提示EF诱导了p65的磷酸化和随后的入核。与EF组比较, SE (200 mg·kg-1) 组磷酸化的p65表达明显降低 (P < 0.05), 并且胞核中p65表达也明显降低 (P < 0.01), 提示SE能够抑制EF诱导的p65的磷酸化及入核。另外本实验检测了胞浆中p65的表达, 发现EF (450 mg·kg-1) 组p65表达明显增加 (P < 0.01), 同时SE能够抑制p65的表达 (P < 0.05)。
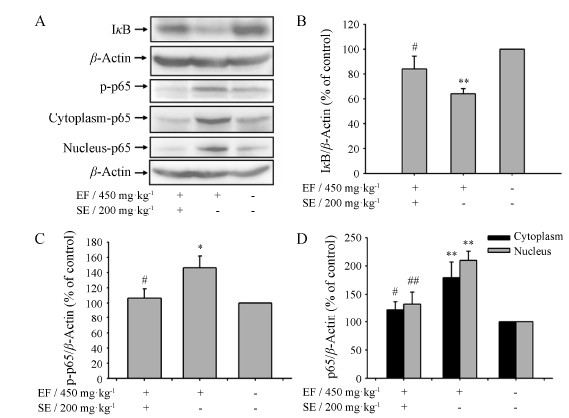 | Figure 6 The expression of NF-κB signaling pathway in EF-treated mice with or without SE. A: The representative protein blots for IκB, p-p65, p65 and β-actin. Results represent at least three separate experiments, and the level of β-actin was used as loading control. B: The bands of IκB were normalized to basal β-actin expression and the vehicle control was set as 100%. C: The bands of p-p65 were normalized to basal β-actin expression and the vehicle control was set as 100%. D: The bands of cytosolic and nuclear p65 were normalized to basal β-actin expression and the vehicle control was set as 100%. n = 3-4, x±s. *P < 0.05, **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs EF group |
如图 7所示, EF (450 mg·kg-1) 连续灌胃给药 后, 与对照组比较, EF (450 mg·kg-1) 组肝组织中GSH含量明显增加 (P < 0.001)。SE (100 mg·kg-1和140 mg·kg-1) 组GSH含量与EF组比较没有明显区别 (P > 0.05), 而SE (200 mg·kg-1) 组GSH含量明显增加(P < 0.05), 提示SE可通过增加GSH的产生来抵御EF诱导的氧化损伤。
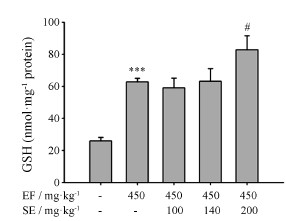 | Figure 7 Liver glutathione (GSH) amount in EF-treated mice with or without SE. n = 8-10, x±s. ***P < 0.001 vs control; #P < 0.05 vs EF group |
如图 8所示, EF (450 mg·kg-1) 连续灌胃给药后, 与对照组比较, HO-1蛋白表达明显升高 (P < 0.05), 提示机体通过增加HO-1蛋白的表达来抵御EF诱导的氧化应激损伤。同时灌胃给予SE后, 与EF组比较, HO-1蛋白表达明显降低 (P < 0.05), 表明机体氧化应激损伤得到了一定的改善。
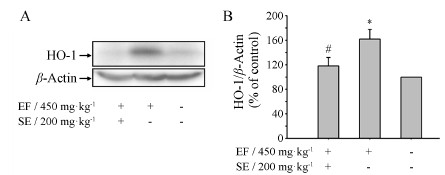 | Figure 8 The expression of heme oxygenase (HO-1) in EF-treated mice with or without SE. A: The representative protein blots for HO-1 and β-actin. Results represent at least three separate experiments, and the level of β-actin was used as loading control. B: The bands of HO-1 were normalized to basal β-actin expression and the vehicle control was set as 100%. n = 3, |
肝脏损伤后, 血清中ALT、AST及ALP活性会升高, 所以用这几个指标来评价肝损伤[9]。EF (450 mg·kg-1) 连续灌胃给药后, 血清中ALT、AST及ALP活性明显升高, 表明EF诱导了小鼠肝损伤。血液中的蛋白由肝脏合成, 当肝细胞损伤时, 蛋白合成发生障碍, 蛋白含量降低[10]。本研究检测了血清中TP和ALB的含量, 发现EF (450 mg·kg-1) 组TP、ALB含量明显降低。而同时给予不同剂量的SE后, 尤其是SE (200 mg·kg-1) 组, 与EF组相比血清中ALT、AST及ALP活性均明显降低, 而TP与ALB水平明显升高, 表明SE对EF连续给药诱导的肝损伤具有明显的保护作用。病理结果显示, 对照组肝细胞形状正常, 边界清晰; 而EF (450 mg·kg-1) 组肝细胞变性, 排列紊乱, 表明EF (450 mg·kg-1) 诱导了小鼠肝组织病理性损伤。而同时给予SE (200 mg·kg-1) 后, 肝细胞排列整齐, 边界清晰, 表明SE (200 mg·kg-1) 可抑制EF诱导的肝毒性。血清生化指标和病理结果共同显示, SE对EF连续给药诱导的肝毒性具有明显的保护作用。
MPO通常被认为是中性粒细胞浸润组织的标志物, 而中性粒细胞浸润组织是大多数炎症疾病的特点[11]。为了确定肝损伤过程中是否有炎症的发生, 本实验检测了肝匀浆液中MPO的活性。结果显示EF组MPO活性显著升高, 而同时给予SE后, MPO活性显著降低。促炎因子TNF-α、IL-6和IFN-γ在炎症的发展过程中起了重要作用, 已经发现它们的含量在很多毒性物质造成的肝损伤中都会升高[12, 13, 14]。本研究发现EF组血清TNF-α、IL-6和IFN-γ的含量升高, 而SE降低了升高的TNF-α、IL-6和IFN-γ的含量。这些研究结果提示, SE可能通过抑制炎症发挥对EF连续给药诱导肝损伤的保护作用。
众所周知, NF-κB在免疫、炎症等方面起着重要作用[15, 16]。在静息状态下, 胞浆中的NF-κB与其抑制蛋白IκB (主要是IκB-α) 相结合, 以无活性的状态存在于胞浆中。在外界病理因素作用下, IκB被降解, NF-κB转移至胞核中与靶基因的κB序列进行结合, 从而诱导炎性因子如TNF-α、IL-6、IFN-γ的表达, 引起炎症反应[17, 18, 19, 20]。本研究检测了肝组织中IκB蛋白 表达、NF-κB p65的磷酸化及转核。结果发现EF连续给药后, IκB蛋白表达明显降低, 磷酸化的p65表达明显增加, 并且胞核中p65表达明显增加。而同时给予SE (200 mg·kg-1) 能够逆转这些变化, 提示SE能够通过抑制EF诱导的IκB减少, 抑制p65转录活化, 进而抑制其下游基因如TNF-α、IL-6和IFN-γ的表达。
氧化应激在肝损伤过程中发挥着重要作用[21, 22, 23]。GSH是体内重要的抗氧化剂, 能够清除体内的自由基, 防止机体损伤[24]。HO-1是机体内重要的抗氧化酶, 在抗肝损伤过程中发挥着重要作用[25]。本实验中, EF组GSH含量明显增加, 这个现象与作者前期的实验发现一致[8]; 同时HO-1蛋白表达明显升高。这些结果提示机体启动了自身防御反应, 通过提升抗氧化能力来抵御EF造成的肝损伤。而SE (200 mg·kg-1) 处理后, GSH含量进一步增加, 表明SE能够通过增加GSH的产生来抵制氧化损伤。同时HO-1抗氧化酶蛋白表达降低, 提示机体氧化损伤得到一定的改善。
临床治疗癌症时黄药子常用量为30 g, 在本实验中EF的剂量450 mg·kg-1相当于黄药子生药剂量约20 g·kg-1, 相对高于临床常用量, 但是不能排除患者的特异质性和蓄积中毒等原因, 从而导致黄药子剂量相对较低的临床用药量就造成肝毒性。半枝莲临床用量一般为15~30 g, 本实验中SE剂量200 mg·kg-1相当于半枝莲生药剂量为1.8 g·kg-1, 与临床用量比较接近。
综上所述, 本研究结果表明SE对EF连续给药诱导的肝毒性具有明显的保护作用, 其机制可能是通过抑制炎症的发生发展和提升机体抗氧化能力而抵御EF连续给药诱导的肝损伤。在本实验中, SE和EF是同时给药, 无法排除EF与SE在肠道中是否存在相互作用, 以及SE是否影响EF的吸收等方面的因素, 这有待今后进一步的探讨。本文的研究结果为半枝莲和黄药子的临床合用治疗肿瘤提供了一定的科学基础。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China:Volume I (中华人民共和国药典)[S]. 2010 ed. Part I. Beijing:China Medical Science Press, 2010:124-125. |
| [2] | Tan XQ, Yuan JL, Chen HS, et al. Studies on liver toxicity in Rhigoma of Dioscorea bulbifera[J]. Chin J Chin Mater Med (中国中药杂志), 2003, 28:661-663. |
| [3] | Liu JR. Two cases of toxic hepatitis induced by Dioscorea bulbifera[J]. Adverse Drug React J (药物不良反应杂志), 2002, 2:129-130. |
| [4] | Suh SJ, Yoon JW, Lee TK, et al. Chemoprevention of Scutellaria bardata on human cancer cells and tumorigenesis in skin cancer[J]. Phytother Res, 2007, 21:135-141. |
| [5] | Sato Y, Suzaki S, Nishikawa T, et al. Phytochemical flavones isolated from Scutellaria barbata and antibacterial activity against methicillin-resistant Staphylococcus aureus[J]. J Ethnopharmacol, 2000, 72:483-488. |
| [6] | Yu HC, Yang XL, Liu FE, et al. Protective effect of Herba Scutellaria barbata on CCl4-induced liver injury[J]. J Fourth Mil Med Univ (第四军医大学学报), 2005, 26:892-893. |
| [7] | Li ZH, Zhao XF, Yu SM, et al. Effect of barbata alcohol extract on transforming growth factor-β1 and tumor necrosis factor-α expression in rats with CCl4-induced liver fibrosis[J]. J Clin Hepatol (实用肝脏病杂志), 2010, 13:193-195. |
| [8] | Ma YB, Ji LL, Wang SC, et al. Protection of Grateloupia filicina polysaccharide against hepatotoxicity induced by Dioscorea bulbifera L[J]. Acta Pharm Sin (药学学报), 2013, 48:1253-1258. |
| [9] | Panda V, Ashar H, Srinath S. Antioxidant and hepatoprotective effect of Garcinia indica fruit rind in ethanol-induced hepatic damage in rodents[J]. Interdiscip Toxicol, 2012, 5:207-213. |
| [10] | Cui B, Liu S, Wang Q, et al. Effect of β-carotene on immunity function and tumour growth in hepatocellular carcinoma rats[J]. Molecules, 2012, 17:8595-8603. |
| [11] | Haqqani AS, Sandhu JK, Birnboim HC. A myeloperoxidasespecific assay based upon bromide-dependent chemiluminescence of luminol[J]. Anal Biochem, 1999, 273:126-132. |
| [12] | Yin M, Wheeler MD, Kono H, et al. Essential role of tumor necrosis factor alpha in alcohol-induced liver injury in mice[J]. Gastroenterology, 1999, 117:942-952. |
| [13] | Tagawa Y, Sekikawa K, Iwakura Y. Suppression of concanavalin A-induced hepatitis in IFN-gamma(-/-) mice, but not in TNF-alpha(-/-) mice:role for IFN-gamma in activating apoptosis of hepatocytes[J]. J Immunol, 1997, 159:1418-1428. |
| [14] | Choi JH, Kang JW, Kim DW, et al. Protective effects of Mg-CUD against D-galactosamine-induced hepatotoxicity in rats[J]. Eur J Pharmacol, 2011, 657:138-143. |
| [15] | Baeuerle PA, Baltimore D. NF-κB:ten years after[J]. Cell, 1996, 87:13-20. |
| [16] | Baeuerle PA, Henkel T. Function and activation of NF-kappa B in the immune system[J]. Annu Rev Immunol, 1994, 12:141-179. |
| [17] | Ferreiro DU, Komives EA. Molecular mechanisms of system control of NF-κB signaling by IκBα[J]. Biochemistry, 2010, 49:1560-1567. |
| [18] | Dyson HJ, Komives EA. Role of disorder in IκB-NFκB interaction[J]. IUBMB Life, 2012, 64:499-505. |
| [19] | Thanos D, Maniatis T. NF-κB:a lesson in family values[J]. Cell, 1995, 80:529-532. |
| [20] | Xu MQ, Shuai XR, Yan ML, et al. Nuclear factor-κB decoy oligodeoxynucleotides attenuates ischemia/reperfusion injury in rat liver graft[J]. World J Gastroenterol, 2005, 11:6960-6967. |
| [21] | Moselhy SS, Ali HK. Hepatoprotective effect of cinnamon extracts against carbon tetrachloride induced oxidative stress and liver injury in rats[J]. Biol Res, 2009, 42:93-98. |
| [22] | Chen YH, Lin FY, Liu PL, et al. Antioxidative and hepatoprotective effects of magnolol on acetaminophen-induced liver damage in rats[J]. Arch Pharm Res, 2009, 32:221-228. |
| [23] | dos Santos NA, Martins NM, Curti C, et al. Dimethylthiourea protects against mitochondrial oxidative damage induced by cisplatin in liver of rats[J]. Chem Biol Interact, 2007, 170:177-186. |
| [24] | Lu SC. Regulation of hepatic glutathione synthesis:current concepts and controversies[J]. FASEB J, 1999, 13:1169-1183. |
| [25] | Zuckerbraun BS, Billiar TR. Heme oxygenase-1:a cellular Hercules[J]. Hepatology, 2003, 37:742-744. |
 2016, Vol. 51
2016, Vol. 51


