Survivin基因编码产生的Survivin蛋白以二聚 体的形式存在, 是凋亡抑制蛋白家族 (inhibitor of apoptosis proteins, IAPs) 的一种新颖的抗细胞凋亡蛋白因子, 也是迄今人们所发现的最强的凋亡抑制因子。Survivin蛋白是染色体过客复合物(chromosomal passenger complex, CPC) 不可或缺的部分, 具有抑制细胞凋亡和调节细胞有丝分裂的双重功能, 在调控细胞周期和参与血管形成等方面发挥重要生物学功能。Survivin蛋白在多种肿瘤组织中过量表达, 其过量表达与肿瘤发生、发展和诱发抗癌药物耐药性相关, 在肿瘤细胞生存和扩散通路中扮演着重要的角色, 而在正常未分化成人组织中几乎不表达, 与肿瘤不良预后和耐药性密切相关[1, 2]。因此, Survivin抑制剂的研究成为治疗癌症和克服肿瘤细胞耐药性的新策略。
1 Survivin的结构特点1997年, 人类Survivin基因由美国耶鲁大学的Ambrosini等[3, 4]利用效应细胞蛋白酶受体-1 (effector cell protease receptor-1, EPR-1) cDNA在人类基因组的杂交筛选中分离并克隆得到, 其与EPR-1同位于染色体17q25, 全长14.7 kb, 由3个内含子和4个外显子组成。Survivin基因编码产生的Survivin蛋白由142个氨基酸组成, 相对分子质量为16 500, 其N末端区域包含一个单独的BIR(baculovirus inhibitior of apoptosis protein repeat) 结构域, 该结构域是IAPs家族的标志, 由第15~87位氨基酸残基组成, 形成3个反平行β折叠和4个α螺旋的空间结构。
Survivin蛋白具有以下特点: ① Survivin的单体N末端只含有一个较为保守的BIR序列, 与Zn2+离子通过配位键形成锌指结构, 直接作用于细胞凋亡的效应分子caspases, C末端连接着一个长度为6.5 nm、由40个氨基酸组成的亲酯性的α-螺旋, 激活后的Survivin通过α-螺旋结构与纺锤体微管上的蛋白结合, 产生抑制凋亡作用[5]。② BIR序列和α-螺旋结构间的连接区域具有核输出信号功能。该信号的突变可引起Survivin抗凋亡与有丝分裂调控作用的分离[6]。③ 目前已经发现人类Survivin蛋白除野生型外, 还有4种通过Survivin的前体mRNA经不同的选择性剪接所得到的不同异构体亚型: Survivin-ΔEx3、Survivin-2B、Survivin-3B和Survivin-2α。Survivin-ΔEx3几乎完整保留了野生型Survivin的抗凋亡活性, 而Survivin-2B具有部分内含子2, 抗凋亡活性明显降低, Survivin-3B包含一个BIR结构功能区, 对产生抗凋亡作用至关重要, 但缺乏C末端α-螺旋结构域, 保留了抗凋亡 活性并可作为染色体乘客复合体, 可能与细胞周期G2/M期进程无关, 与野生型Survivin有着不同的功能[7, 8]。
2 Survivin的作用机制Survivin的表达与一些关键的细胞信号通路和致癌因子密切相关, 例如PI3K/AKT/mTOR、HIF-1α、HSP90、Smac/DIABLO、Beclin-1和Ras等[9, 10, 11, 12, 13, 14, 15]。
PI3K/AKT/mTOR通路是细胞内重要的信号转 导途径, 该通路的紊乱会引起包括癌症在内的多种疾病。PI3K的效应蛋白和mTOR蛋白, 可以通过调控Survivin的表达促进细胞生存、增殖和血管生成。PI3K/mTOR途径抑制可以导致Survivin的下调和后期在G0/G1期的细胞周期捕获。而PI3K/AKT信号通路参与肿瘤细胞的形成, 抑制该通路激活会降低Survivin和PI3K/AKT的蛋白水平[9, 10]。
在大多数肿瘤细胞株中, HIF-1α和Survivin的表达呈正相关。以HIF-1α为靶点的反义寡核苷酸可以引起肿瘤细胞中Survivin显著的下调, 导致肿瘤血管生成抑制[11]。Survivin和HSP90在肿瘤细胞中过量表达, 在细胞有丝分裂控制和细胞凋亡抑制中扮演着重要角色, 它们能够使辅酶因子 (AKT、Erb-2和HIF-1α) 更加稳定, 导致肿瘤增长, 破坏Survivin和HSP90的复合物可以使Survivin不稳定, 引起线粒体凋亡, 最终使细胞生长抑制[12]。
Smac/DIABLO (second mitochondria-derived activator of caspases/direct IAP-binding protein) 通 路, Smac是一种重要的凋亡调节因子, 能与现已发现的所有IAP结合, 在肿瘤细胞中高表达能够促进肿瘤细胞凋亡, 延缓肿瘤的发展。当凋亡因素刺激时, Survivin与Smac/DIABLO结合, Smac释放到细胞质中, 与XIAP、cIAP1和cIAP2的BIR结构域竞争结合, 从而消除IAPs对casapse活性的抑制作用, 促进细胞凋亡[13]。
Beclin-1和Ras是两个重要的致癌基因。Survivin在自我吞噬细胞凋亡中是一个重要的媒介物。Beclin-1 (自我吞噬基因) 减少能够导致Survivin下调和由TRAIL (肿瘤坏死因子相关凋亡诱导配体) 引起的 敏感神经胶质瘤细胞凋亡[14]。Survivin的表达也与Ras相关核蛋白 (Ran) 有关, Ran的下调可以导致Survivin在G1到S期的细胞周期捕获, 导致Survivin表达的降低, 并引起细胞凋亡[15]。
3 Survivin抑制剂目前, 已报道了100多个Survivin抑制剂, 包括基因工程药物、天然产物药物以及化学合成或半合 成的药物。按照药物的作用机制, 可将Survivin抑制剂分为4大类: ① 直接作用于Survivin的抑制剂: 反义寡核苷酸抑制剂和小分子化合物抑制剂; ② 对Survivin表达具有抑制作用的化合物: 五环三萜类等天然产物、其他化学合成或半合成化合物; ③ 阻断Survivin和其他蛋白质关联的化合物; ④ 其他类。
3.1 直接作用于Survivin的抑制剂 3.1.1 反义寡核苷酸抑制剂EZN3042 (1) 是一个由16个核苷酸组成的反义锁核酸 (locked nucleic acid antisense oligonucleotide, LNAON), 相对原来的反义核苷酸LNA的形式保证了核酸酶稳定性, 1是 一种完全磷酸化的形式, 结构上易与RNA结合, 以Survivin开放阅读框的终止密码子为作用靶点, 使其更好地抑制Survivin的mRNA, 最终导致细胞周期停滞, 细胞凋亡增强。目前, 在一项儿童急性成淋巴细胞性白血病的研究中, 1已进入I期临床试验[16]。
LY2181308 (2) 是化学合成的二代产物, 含有18个碱基, 结合在Survivin的翻译起始密码子上激活RNA酶H, 引起mRNA的降解, 所以不影响IAP家族的其他成员, 2作用于肿瘤细胞可活化caspase-3, 阻滞细胞分裂, 在移植瘤模型中抑制肿瘤的生长。在一项随机公开的NSCLC患者Ⅱ期临床试验中, 给予2治疗, 可以增强多烯紫杉醇引起的癌细胞凋亡的能力, 且安全性良好[17, 18]。然而在另一项雄激素抵抗的前列腺癌患者Ⅱ期临床试验中, 并没有发现2联合多烯紫杉醇用药与多烯紫杉醇单独用药有明显差异[19]。
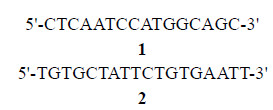
化合物YM155 (3) 是通过高通量筛选得到的新颖的Survivin小分子抑制剂, 一种合成的萘醌咪唑衍生物, 主要通过抑制启动子活性而抑制Survivin基因的转录。目前化合物3有6项研究已进入Ⅰ/Ⅱ期临床试验[20, 21]。Cheng等[22]研究发现, 3可以强烈抑制Survinin表达因子的活性 和内源性蛋白的表达, 由3导致的Survinin基因表 达下调具有细胞周期依赖性, 而与G1期细胞捕获无关。该研究同时也发现, 3介导调制DNA-蛋白质在SCPO-4和SCPO-5 DNA元素中的相互作用很大程度上归因于Sp1转录因子而不是Ap2。3联合紫杉醇用药治疗黑色素瘤患者, 已经进入了Ⅲ~Ⅳ期临床研究, 作用增强且安全有效[23]。与苯达莫司汀联合用药, 显示出很强的细胞增长抑制, 而且可以抑制由苯达莫司汀引起的ATM路径激活和Survivin在G2-M期的累积, 强烈引起DNA破坏和细胞凋亡。同样和美罗华联合用药也起到协同作用[24]。可以明显看出, 与其他化疗药物联合使用达到协同抗肿瘤效果为一些顽固性或是对化疗药物耐受的恶性肿瘤治疗带来了希望。
NSC80467 (4) 也是一种合成的萘醌咪唑衍生物, 可选择性地抑制Survivin基因启动子的活性及下调体外Survivin的表达, 引起细胞凋亡。Glaros等[25]通过免疫细胞化学发现, 随着肿瘤细胞中诱导DNA损伤的标志物γH2AX和pKAP1的增多, 这种作用呈剂量依赖趋势, 提示4可能通过直接与DNA作用来抑制DNA合成, 诱导DNA损伤。
FL118(5) 是喜树碱类似物, 与依利替康 (irinotecan) 和拓扑替康 (topotecan) 有着相似的结构。临床前研究表明, 5能够有效地抑制其他3个来自于IAP和Bcl-2家族的细胞凋亡蛋白 (Survivin、Mcl-1、XIAP、cIAP2) 的表达。对Survinin表达的抑制作用显著高于伊立替康和拓扑替康, 进一步研究揭示了5优越的抗癌活性是因为高度依赖的主要结构和空间配置, 这表明基于其核心结构而生成新颖的衍生物来说是一种很有前景的药物平台[26, 27]。目前, 5已经被用于和FDA批准抗肿瘤药物 (伊立替康、拓扑替康、5-FU、阿霉素、吉西他滨等) 进行临床前比较。
GDP366(6) 通过免疫印迹分析研究表明, 在1~4 μmol·L-1水平下可以有效抑制Survinin和肿瘤蛋白18 (Op18/微管不稳定蛋白主要调控微管序列) 的表达。6还可增加染色体不稳定性, 诱导有丝分裂危象, 抑制端粒酶活性, 诱导细胞衰老。体外研究显示, 其可抑制荷瘤裸鼠模型的肿瘤生长, 并诱导细胞凋亡。体内研究也证实6可抑制肿瘤生长和集落形成[28]。
UC112(7) 在NCI-60细胞株筛选和以A375黑色素瘤模型的临床前体内活性研究中显示出了广谱的抗增殖活性。临床前研究表明, 7可以选择性下调Survinin表达水平, 而对其他IAP家族成员仅有微小的影响[29]。

五环三萜类化合物是自然界广泛存在的一大类化合物, 包括熊果酸、齐墩果酸、积雪草酸和甘草次酸等。
熊果酸 (ursolic acid, 8) 对一系列人类肿瘤细胞显示出较好的抗肿瘤活性。8可以通过直接抑制Survivin对不同的结肠癌细胞株产生增殖抑制作用, 还可以通过促进c-Jun N-terminal kinase (JNK) 激活, 导致AMPK的激活, 从而抑制信号mTOR复合物1传递, 导致Survivin下调。8也能够抑制EGFR和诱 导p53、p21表达, 与Survinin上调p53一致[30, 31]。

齐墩果酸 (oleanolic acid, 9) 同样以其显著的抗肿瘤作用和药理安全引起了人们的广泛关注。9和5-FU联合用药, 通过影响Survivin的表达, 从而使人胰腺细胞 (Panc-28) 凋亡作用显著提高, 而且相关凋亡蛋白 (caspases-3、Bcl-2/Bax、Survivin和NF-κB) 的表达也受到影响[32]。9可以提高促凋亡蛋白Bax, 改变Bcl-2/Bax的平衡, 明显降低抗肿瘤凋亡蛋白Survinin的表达[33]。
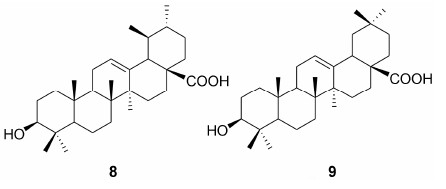
羽扇豆醇 (lupeol, 10) 可以抑制雄激素敏感性人前列腺癌 (CaP) 细胞的生长, 减少血清PSA的水平, 主要是通过引起G2/M细胞周期捕获, 对正常人前列腺上皮细胞 (PrEC) 没有任何毒性。在治疗LNCaP和DU145细胞时, 发现其能够降低Survivin和cFLIP基因在CaP细胞中的转录活性, 导致微管组装的破裂[34]。
甘草次酸 (glycyrrhetinic acid, 11) 能够引起大多数肿瘤细胞凋亡和细胞增长抑制。通过增强HSP90蛋白抑制剂凋亡影响, 提高caspase-8和线粒体介导细胞死亡途径的活性, 最终引起人卵巢上皮癌细胞株中caspase-9和-3的激活, 引起细胞凋亡[35]。11能够诱导人骨髓瘤细胞株U266细胞周期阻滞于G0/G1期, 表现为G0/G1期细胞比例升高, G2/M及S期细胞比例下降, 下调细胞中Survivin基因的表达, 抑制U266细胞增殖[36]。
积雪草酸 (asiatic acid, 12) 对多种肿瘤细胞有效。研究[37]发现, 12能够激活caspases-3和-9, 调控细胞凋亡调节器Bad、Survivin和pAKT-Ser473的表达, 达到抑制人脐静脉内皮细胞 (human umbilical vein endothelial cells, HUVEC) 的增长, 引起细胞凋亡。
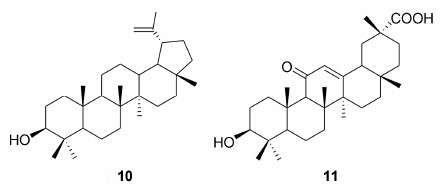
七叶树皂苷 (escin, 13) 在体内外均被证实有抗肿瘤作用。其作用机制可能是核因子B (NF-κB) 的失活。13可以下调STAT3调控的VEGF、cyclin D1、Bcl-2、COX-2、Bcl-xL和Survivin的表达, 抑制肿瘤细胞增殖。13与阿霉素或紫杉醇联合用药治疗肝细胞癌时, 耐受性良好, 起到协同作用[38, 39]。
老虎皮酸B (retigeric acid B, 14) 可以抑制体内外前列腺癌细胞NF-κB信号, 抑制雄激素非依赖性前列腺癌细胞的增殖, 引起细胞凋亡。研究[40]发现, 用PC3和DU145细胞作为模型, 14可以抑制IκBα的磷酸化水平和N降解, 阻断P65细胞核的转移和DNA链接活性, 抑制NF-κB-调节蛋白 (Bcl-2、Bcl-xL、cyclin D1和Survivin) 表达。
桦木酸 (betulinic acid, 15) 对治疗多种肿瘤有潜在作用。最近研究[41]表明, 15通过抑制拓扑异构酶1 (Top1), 发挥显著的抗肿瘤活性。15表现出在早期诱导Survivin的表达, 而后期通过转录控制达到抑制的作用。
除了五环三萜类化合物, 还有部分天然产物也显示出了较好的抑制Survivin作用。
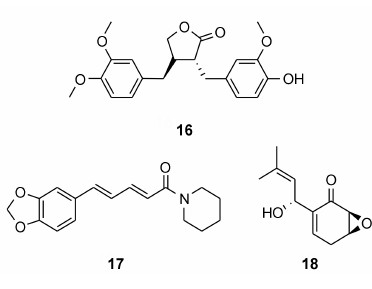
牛蒡苷元 (arctigenin, 16) 是一种从牛蒡的种子中分离出的配体, 表现出了对一系列肿瘤细胞的抗增殖活性。主要是通过抑制STAT3磷酸化和Survivin的表达执行其抗肿瘤活性。给予卵巢癌细胞16治疗, Survivin的水平被显著降低。16也可以通过抑制PI3K/ AKT途径, 减弱Survivin的表达, 引起肝癌细胞凋亡, 同时也能够提高顺铂治疗肿瘤的敏感性[42, 43]。

胡椒碱 (piperine, 17) 是从黑胡椒中提出的生物碱, 可以抑制多种结肠癌细胞株的生长[44]。在给予17的HT-29结肠癌细胞中, Survivin蛋白水平与未给予治疗的细胞比较显著降低。由于17对Survivin表达的抑制作用也能使癌细胞对其他化疗药物更敏感[45]。
Panepoxydone (18) 是食用蘑菇的次级代谢产物, 能够影响NF-κB的表达, 尤其对MCF-7、TNBC、MDA-MB-231、MDA-MB-468和MDA-MB-453细胞株具有显著的增长抑制。在给予18治疗后, Survivin水平显著降低, 引起细胞凋亡[46]。
夫拉平度 (flavopiridol, 19) 是细胞周期依赖性激酶 (CDK) 抑制剂。可以通过抑制Survivin发挥作用的关键点Thr34的磷酸化, 引起Survivin的表达逐步丧失[47]。最近一项研究表明, 在体外和异种移植模型中, 19可以抑制人类子宫平滑肌瘤增长。19联合顺铂治疗抵抗性和敏感性的卵巢或原发性腹膜癌的Ⅱ期临床试验也显示出了很好的临床治疗效果[48, 49]。
Purvalanol A (20) 是p34Cdc2特异性CDK抑制剂, 不仅可以抑制Cdc2活性, 也能够通过抑制Thr34的磷酸化从而抑制Survivin的表达[50]。20联合紫杉醇治疗, 可以抑制由紫杉醇引起的Survivin的过度表达, 帮助克服紫杉醇的耐药性[51]。
拉帕替尼 (lapatinib, 21) 是一潜在的ErbB1和ErbB2酪氨酸激酶小分子抑制剂, 当治疗ErbB2过量表达的乳腺癌细胞株 (如BT 474) 时, 可显著抑制Survivin的表达, 引起细胞凋亡[52]。其作用机制主要是通过促进Survivin蛋白的泛素蛋白酶体的降解来翻译后调控。当使用其他的细胞毒性试剂如索菲替 尼, 21会产生协同效应, 目前已进入Ⅲ期临床, 将是众多Survivin小分子抑制剂中最有潜力的一个[53, 54]。

头孢色菌素 (cephalochromin, 22) 是从发酵的液体培养基中分离得到的一种抗菌剂, 在人类小肺癌细胞中可抑制细胞增殖并引起细胞凋亡, IC50值 达2.8 μmol·L-1。在A549肺癌细胞中, 其能显著降 低Survivin的表达水平。结果表明, 22可以通过下调Survivin的蛋白表达产生抗肿瘤作用[55]。

此外, 奥沙利铂 (oxaliplatin)、托芬那酸 (tolfenamic acid)、黄芩素 (baicalein)、多韦替尼 (dovitinib)、NU6140、MK-2206、ICG-001和KPT-185等也有报道对Survivin有直接或间接的作用[56, 57]。
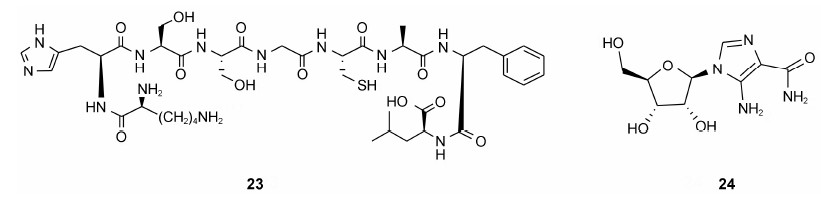
3.3 阻断Survivin和其他蛋白质的关系Shepherdin (KHSSGCAFL, Survivin K79-L87, 23) 是一个可以穿透细胞的拟肽类物质, 是绑定HSP-90和Survivin的模型接口, 能够通过ATP绑定HSP-90的口袋来扰乱HSP90和Survivin的相互关系。而且23可以破坏Survivin和其他影响细胞凋亡的HSP-90蛋白 (AKT、CDK6和telomerase)。其作用机制是通过凋亡和非凋亡来导致细胞死亡, 具有良好的抗肿瘤选择性, 而不影响正常的细胞[58]。在最近的一项关于对伊马替尼耐药的慢性髓细胞白血病细胞研究中发现[59], 23能够增加其对羟基脲或阿霉素的敏感性。随后, 基于23的特点和HSP90受体的灵活性, 通过计算机辅助设计得到了一个非肽类小分子化合物AICAR(24)。24在大多数肿瘤细胞中显示出极好的抗增殖活性, 包括DU145、JR8和HeLa细胞, 且不影响正常的纤维母细胞增殖[60]。
目前, 还存在一些对Survivin表达的影响存在争议的化合物。例如, 亚砷酸盐和三氧化二砷可以通过抑制多种信号途径 (NF-κB、PI3K/AKT、JNK/Erk) 抑制Survivin的表达, 但是在低浓度情况下, 亚砷酸盐也可以通过激活这些路径来促进Survivin表达[61]。吉非替尼 (gefitinib) 是一种选择性酪氨酸酶抑制剂抗肿瘤药物, 其对Survivin的表达既可以产生上调作用又可以产生下调作用[62, 63]。雷帕霉素 (rapamycin) 是一种mTOR抑制剂, 可以通过多种作用机制抑制Survivin在多种肿瘤细胞中的表达[64], 但是在神经母细胞瘤细胞中雷帕霉素会诱发Survivin的表达[65]。
4 小结与展望Survivin具有抑制细胞凋亡、调节细胞有丝分裂、调控细胞周期和参与血管形成等多种生物功能, 并且可以影响HSP90、borealin和INCENP等多种小分子。Survivin在多种肿瘤组织中过度表达, 而在正常终末分化的成人组织中几乎不表达, 与肿瘤不良预后和耐药性密切相关。目前, Survivin小分子抑制剂YM155、LY2181308和EZN-3042已进入到临床研究阶段, 研究表明, Survivin抑制剂没有引起不良反应, 但由于其参与调控正常细胞功能, 因此, 能否长期使用将是接下来的主要研究方向之一。Survivin抑制剂也可与其他传统的抗肿瘤化学治疗药物联合应用, 显示出较强的临床疗效, 并且通过克服肿瘤细胞耐药性, 使其对肿瘤治疗更加敏感。
随着对Survivin作用机制和Survivin抑制剂构效关系的深入研究, 开发具有选择性的新型Survivin抑制剂在肿瘤治疗领域具有良好的应用前景。Survivin作为一种节点蛋白, 有别于传统的例如酶或者受体小分子的传统靶标, 因此, 如何进行候选药物的筛选也将成为Survivin抑制剂的研究方向之一。
| [1] | Waligórska-Stachura J, Jankowska A, Wásko R, et al. Survivin-prognostic tumor biomarker in human neoplasms-review[J]. Ginekol Pol, 2012, 83:537-540. |
| [2] | Farnebo L, Tiefenboeck K, Ansell A, et al. Strong expression of survivin is associated with positive response to radiotherapy and improved overall survival in head and neck squamous cell carcinoma patients[J]. Int J Cancer, 2013, 133:1994-2003. |
| [3] | Ambrosini G, Adida C, Altieri DC. A novel anti-apoptosis gene, survivin, expressed in cancer and lymphoma[J]. Nat Med, 1997, 3:917-921. |
| [4] | de Almagro MC, Vucic D. The inhibitor of apoptosis (IAP) proteins are critical regulators of signaling pathways and targets for anti-cancer therapy[J]. Exp Oncol, 2012, 34:200-211. |
| [5] | Chantalat L, Skoufias DA, Kleman JP, et al. Crystal structure of human survivin reveals a bow tie-shaped dimer with two unusual α-helical extensions[J]. Mol Cell, 2000, 6:183-189. |
| [6] | Colnaghi R, Connell CM, Barrett RMA, et al. Separating the anti-apoptotic and mitotic roles of survivin[J]. J Biol Chem, 2006, 281:33450-33456. |
| [7] | Knauer SK, Bier C, Schlag P, et al. The survivin isoform survivin-3B is cytoprotective and can function as a chromosomal passenger complex protein[J]. Cell Cycle, 2007, 6:1502-1509. |
| [8] | Atlasi Y, Mowla SJ, Ziaee SAM. Differential expression of survivin and its splice variants, survivin-deltaEx3 and survivin-2B, in bladder cancer[J]. Cancer Detect Prev, 2009, 32:308-313. |
| [9] | Gu YJ, Jin SD, Wang F, et al. Clinicopathological significance of PI3K, Akt and survivin expression in gastric cancer[J]. Biomed Pharmacother, 2014, 68:471-475. |
| [10] | Moon DG, Lee SE, Oh MM, et al. NVP-BEZ235, a dual PI3K/mTOR inhibitor synergistically potentiates the antitumor effects of cisplatin in bladder cancer cells[J]. Int J Oncol, 2014, 45:1027-1035. |
| [11] | Fan LF, Dong WG, Jiang CQ, et al. Role of hypoxia-inducible factor-1α and survivin in colorectal carcinoma progression[J].Int J Colorectal Dis, 2008, 23:1057-1064. |
| [12] | Fortugno P, Beltrami E, Plescia J, et al. Regulation of survivin function by Hsp90[J]. Proc Natl Acad Sci USA, 2003, 100:13791-13796. |
| [13] | Song ZY, Yao XB, Wu M. Direct interaction between Smac/DIABLO is essential for anti-apoptotic activity of survivin during taxol-induced apoptosis[J]. J Biol Chem, 2003, 25:23130-23140. |
| [14] | Niu TK, Cheng Y, Ren XC, et al. Interaction of beclin 1 with survivin regulates sensitivity of human glioma cells to TRAILinduced apoptosis[J]. FEBS Lett, 2010, 584:3519-3524. |
| [15] | Deng L, Lu YY, Zhao XD, et al. Ran GTPase protein promotes human pancreatic cancer proliferation by deregulating the expression of survivin and cell cycle proteins[J]. Biochem Biophys Res Commun, 2013, 440:322-329. |
| [16] | Raetz EA, Morrison D, Romanos-Sirakis E, et al. A phase I study of EZN-3042, a novel survivin messenger ribonucleic acid (mRNA) antagonist, administered in combination with chemotherapy in children with relapsed acute lymphoblastic leukemia (ALL):a report from the therapeutic advances in childhood leukemia and lymphoma (TACL) consortium[J]. J Pediatr Hematol Oncol, 2014, 36:458-463. |
| [17] | Callies S, Andre V, Patel B, et al. Integrated analysis of preclinical data to support the design of the first in man study of LY2181308, a second generation antisense oligonucleotide[J]. Br J Clin Pharmacol, 2011, 71:416-428. |
| [18] | Ronald N, Fiona B, Dariusz K, et al. Evaluation of antitumor activity using change in tumor size of the survivin antisense oligonucleotide LY2181308 in combination with docetaxel for second-line treatment of patients with non-small-cell lung cancer[J]. J Thorac Oncol, 2014, 9:1704-1708. |
| [19] | Pawe W, Bradley GS, Begona M, et al. A randomised phase 2 study combining LY2181308 sodium (survivin antisense oligonucleotide) with first-line docetaxel/prednisone in patients with castration-resistant prostate cancer[J]. Eur Urol, 2014, 65:516-520. |
| [20] | Tolcher AW, Quinn DI, Ferrari A, et al. A phase Ⅱ study of YM155, a novel small-molecule suppressor of survivin, in castration-resistant taxane-pretreated prostate cancer[J]. Ann Oncol, 2012, 23:968-973. |
| [21] | Cheson BD, Bartlett NL, Vose JM, et al. A phase Ⅱ study of the survivin suppressant YM155 in patients with refractory diffuse large B-cell lymphoma[J]. Cancer, 2012, 118:3128-3134. |
| [22] | Cheng QY, Ling X, Haller A, et al. Suppression of survivin promoter activity by YM155 involves disruption of Sp1-DNA interaction in the survivin core promoter[J]. Int J Biochem Mol Biol, 2012, 3:179-197. |
| [23] | Ragini K, Scott E, Bartosz C, et al. A phase 2, multicenter, open-label study of sepantronium bromide (YM155) plus docetaxel in patients with stage Ⅲ (unresectable) or stage IV melanoma[J]. Cancer Med, 2015, 4:643-650. |
| [24] | Kaneko N, Mitsuoka K, Amino N, et al. Combination of YM155, a survivin suppressant, with bendamustine and rituximab:a new combination therapy to treat relapsed/refractory diffuse large B-cell lymphoma[J]. Clin Cancer Res, 2014, 20:1814-1822. |
| [25] | Glaros TG, Stockwin LH, Mullendore ME, et al. The "survivin suppressants" NSC 80467 and YM155 induce a DNA damage response[J]. Cancer Chemother Pharmacol, 2012, 70:207-212. |
| [26] | Li FZ. Anticancer drug FL118 is more than a survivin inhibitor:where is the Achilles' heel of cancer?[J]. Am J Cancer Res, 2014, 4:304-311. |
| [27] | Zhao JY, Ling X, Cao SS, et al. Antitumor activity of FL118, a survivin, Mcl-1, XIAP, and cIAP2 selective inhibitor, is highly dependent on its primary structure and steric configuration[J]. Mol Pharm, 2014, 11:457-467. |
| [28] | Shi XP, Wang DP, Ding K, et al. GDP366, a novel small molecule dual inhibitor of survivin and Op18, induces cell growth inhibition, cellular senescence and mitotic catastrophe in human cancer cells[J]. Cancer Biol Ther, 2010, 9:640-650. |
| [29] | Wang J, Li W. Discovery of novel second mitochondriaderived activator of caspase mimetics as selective inhibitor of apoptosis protein inhibitors[J]. J Pharmacol Exp Ther, 2014, 349:319-329. |
| [30] | Zheng QY, Jin FS, Yao C, et al. Ursolic acid-induced AMPactivated protein kinase (AMPK) activation contributes to growth inhibition and apoptosis in human bladder cancer T24 cells[J]. Biochem Biophys Res Commun, 2012, 419:741-747. |
| [31] | Prasad S, Yadav VR, Sung B, et al. Ursolic acid inhibits growth and metastasis of human colorectal cancer in an orthotopic nude mouse model by targeting multiple cell signaling pathways:chemosensitization with capecitabine[J]. Clin Cancer Res, 2012, 18:4942-4953. |
| [32] | Wei JT, Liu HZ, Liu M, et al. Oleanolic acid potentiates the antitumor activity of 5-fluorouracil in pancreatic cancer cells[J]. Oncol Rep, 2012, 28:1339-1345. |
| [33] | Lucio KA, Rocha GG, Moncao-Ribeiro LC, et al. Oleanolic acid initiates apoptosis in non-small cell lung cancer cell lines and reduces metastasis of a B16F10 melanoma model in vivo[J]. PLoS One, 2011, 6:e28596. |
| [34] | Saleem M, Murtaza I, Witkowsky O, et al. Lupeol triterpene, a novel diet-based microtubule targeting agent:disrupts survivin/cFLIP activation in prostate cancer cells[J]. Biochem Biophys Res Commun, 2009, 388:576-582. |
| [35] | Lee CS, Kim YJ, Lee MS, et al. 18β-Glycyrrhetinic acid induces apoptotic cell death in SiHa cells and exhibits a synergistic effect against antibiotic anti-cancer drug toxicity[J]. Life Sci, 2008, 41:481-489. |
| [36] | Yang JC, Myung SC, Kim WY, et al. 18β-Glycyrrhetinic acid potentiates Hsp90 inhibition-induced apoptosis in human epithelial ovarian carcinoma cells via activation of death receptor and mitochondrial pathway[J]. Mol Cell Biochem, 2012, 370:209-219. |
| [37] | Kavitha CV, Jain AK, Agarwal C, et al. Asiatic acid induces endoplasmic reticulum stress and apoptotic death in glioblastoma multiforme cells both in vitro and in vivo[J]. Mol Carcinog, 2015, 54:1417-1429. |
| [38] | Rimmon A, Vexler A, Berkovich L, et al. Escin chemosensitizes human pancreatic cancer cells and inhibits the nuclear factor-κB signaling pathway[J]. Biochem Res Int, 2013, 2013:251752. |
| [39] | Tan ML, Li F, Rajendran P, et al. Identification of β-escin as a novel inhibitor of signal transducer and activator of transcription 3/Janus-activated kinase 2 signaling pathway that suppresses proliferation and induces apoptosis in human hepatocellular carcinoma cells[J]. J Pharmacol Exp Ther, 2010, 334:285-293. |
| [40] | Liu YQ, Hu XY, Lu T, et al. Retigeric acid B exhibits antitumor activity through suppression of nuclear factor-κB signaling in prostate cancer cells in vitro and in vivo[J]. PLoS One, 2012, 7:e38000. |
| [41] | Bache M, Bernhardt S, Passin S, et al. Betulinic acid derivatives NVX-207 and B10 for treatment of glioblastoma-an in vitro study of cytotoxicity and radiosensitization[J]. Int J Mol Sci, 2014, 15:19777-19790. |
| [42] | Wang HQ, Jin JJ, Wang J. Arctigenin enhances chemosensitivity to cisplatin in human non small lung cancer H460 cells through downregulation of survivin expression[J]. J Biochem Mol Toxicol, 2014, 28:39-45. |
| [43] | Jiang XX, Zeng LP, Huang JF, et al. Arctigenin, a natural lignan compound, induces apoptotic death of hepatocellular carcinoma cells via suppression of PI3-K/Akt signaling[J]. J Biochem Mol Toxicol, 2015. DOI:10.1002/jbt.21712. |
| [44] | Yaffe PB, Power Coombs MR, Doucette CD, et al. Piperine, an alkaloid from black pepper, inhibits growth of human colon cancer cells via G1 arrest and apoptosis triggered by endoplasmic reticulum stress[J]. Mol Carcinog, 2015, 54:1070-1085. |
| [45] | Abdelhamed S, Yokoyama S, Refaat A, et al. Piperine enhances the efficacy of TRAIL-based therapy for triplenegative breast cancer cells[J]. Anticancer Res, 2014, 34:1893-1899. |
| [46] | Arora R, Gary BD, McClellan S, et al. Panepoxydone targets NF-κB and FOXM1 to inhibit proliferation, induce apoptosis and reverse epithelial to mesenchymal transition in breast cancer[J]. PLoS One, 2014, 9:e98370. |
| [47] | Hayashi T, Adachi K, Ohba S, et al. The Cdk inhibitor flavopiridol enhances temozolomide-induced cytotoxicity in human glioma cells[J]. J Neuro-Oncol, 2013, 115:169-178. |
| [48] | Karp JE, Garrett-Mayer E, Estey EH, et al. Randomized phase Ⅱ study of two schedules of flavopiridol given as timed sequential therapy with cytosine arabinoside and mitoxantrone for adults with newly diagnosed, poor-risk acute myelogenous leukemia[J]. Haematologica, 2012, 97:1736-1742. |
| [49] | Bible KC, Peethambaram PP, Oberg AL, et al. A phase 2 trial of flavopiridol (Alvocidib) and cisplatin in platin-resistant ovarian and primary peritoneal carcinoma:MC0261[J]. Gynecol Oncol, 2012, 127:55-62. |
| [50] | Iizuka D, Ogura A, Kuwabara M, et al. Purvalanol A induces apoptosis and downregulation of antiapoptotic proteins through abrogation of phosphorylation of JAK2/STAT3 and RNA polymerase Ⅱ[J]. Anticancer Drugs, 2008, 19:565-572. |
| [51] | O'Connor DS, Wall NR, Porter ACG, et al. A p34cdc2 survival checkpoint in cancer[J]. Cancer Cell, 2002, 2:43-54. |
| [52] | Singla S, Pippin JA, Drebin JA. Dual ErbB1 and ErbB2 receptor tyrosine kinase inhibition exerts synergistic effect with conventional chemotherapy in pancreatic cancer[J]. Oncol Rep, 2012, 28:2211-2216. |
| [53] | Kacan T, Altun A, Altun GG, et al. Investigation of antitumor effects of sorafenib and lapatinib alone and in combination on MCF-7 breast cancer cells[J]. Asian Pac J Cancer Prev, 2014, 15:3185-3189. |
| [54] | de Azambuja E, Holmes A, Piccart-Gebhart M, et al. Lapatinib with trastuzumab for HER2-positive early breast cancer (NeoALTTO):survival outcomes of a randomised, open-label, multicentre, phase 3 trial and their association with pathological complete response[J]. Lancet Oncol, 2014, 15:1137-1146. |
| [55] | Hsiao CJ, Hsiao G, Chen WL, et al. Cephalochromin induces G0/G1 cell cycle arrest and apoptosis in A549 human non-small-cell lung cancer cells by inflicting mitochondrial disruption[J]. J Nat Prod, 2014, 77:758-765. |
| [56] | Xiao M, Li W. Recent advances on small-molecule survivin inhibitors[J]. Curr Med Chem, 2015, 22:1136-1146. |
| [57] | Li FZ. Discovery of survivin inhibitors and beyond:FL118 as a proof of concept[J]. Int Rev Cell Mol Biol, 2013, 305:217-252. |
| [58] | Plescia J, Salz W, Xia F, et al. Rational design of shepherdin, a novel anticancer agent[J]. Cancer Cell, 2005, 7:457-468. |
| [59] | Stella S, Tirro E, Conte E, et al. Suppression of survivin induced by a BCRABL/JAK2/STAT3 pathway sensitizes imatinibresistant CML cells to different cytotoxic drugs[J]. Mol Cancer Ther, 2013, 12:1085-1098. |
| [60] | Meli M, Pennati M, Curto M, et al. Small-molecule targeting of heat shock protein 90 chaperone function:rational identification of a new anticancer lead[J]. J Med Chem, 2006, 49:7721-7730. |
| [61] | Li Y, Jiang RR, Zhao Y, et al. Opposed arsenite-mediated regulation of p53-survivin is involved in neoplastic transformation, DNA damage, or apoptosis in human keratinocytes[J]. Toxicology, 2012, 300:121-131. |
| [62] | Cristina OF, Alejandro VM, Silvia C, et al. Inhibitor of apoptosis (IAP) survivin is indispensable for survival of HER2 gene-amplified breast cancer cells with primary resistance to HER1/2 targeted therapies[J]. Biochem Biophys Res Commun, 2011, 407:412-419. |
| [63] | Okamoto K, Okamoto I, Okamoto W, et al. Role of survivin in EGFR inhibitor-induced apoptosis in non-small cell lung cancers positive for EGFR mutations[J]. Cancer Res, 2010, 70:10402-10410. |
| [64] | Morikawa Y, Koike H, Sekine Y, et al. Rapamycin enhances docetaxel-induced cytotoxicity in a androgen-independent prostate cancer xenograft model by survivin downregulation[J]. Biochem Biophys Res Commun, 2012, 419:584-589. |
| [65] | Samkari A, Cooper ZA, Holloway MP, et al. Rapamycin induces the anti-apoptotic protein survivin in neuroblastoma[J]. Int J Biochem Mol Biol, 2012, 3:28-35. |
 2016, Vol. 51
2016, Vol. 51


