量效关系 (dose-response relationship) 描述了在一定时间内某一刺激因素作用于机体时其暴露剂量与效应之间的关系。刺激因素主要包括物理刺激 (如: 温度、压力、辐射等) 和化学刺激 (如: 药物作用)[1]。药物的量效关系, 是指药物作用一定时间后, 其剂量或浓度与效应之间的关系。药物量效曲线 (dose-response curve) 用于定量分析药物量效关系, 是由实验数据和数学模型拟合而得。根据数学模型 的复杂度和分析适用范围, 可分为: 数据拟合模型 (data fitting)、启发式模型 (heuristic)、漫画模型 (caricature) 和仿真模型 (simulation), 其中最常用的是数据拟合模型, 复杂程度低且具有一定分析能力。数据拟合模型可根据实验数据拟合出含2~4个参 数的数学方程式和相应的量效曲线, 且曲线形状与朗缪尔吸附等温式曲线形状相符, 可定量反映药物剂量与效应之间的关系, 并能从中获得具有药理学意义的参数, 如: 阈剂量 (threshold dose)、半数有效量 (median effective dose)、效能 (efficacy)、效价 (potency) 等[2, 3]。绘制量效曲线对药物的药效强度评价、安全剂量的确定、作用机制的研究以及指导临床用药均具有重要意义。
经典的量效曲线模型包括阈值模型 (threshold model) (图 1A) 和直线模型 (linear non-threshold model) (图 1B)。其中, 阈值模型更为常用; 而直线模型最初只限于对少数极端环境和高剂量药物作用的研究, 后来被广泛应用于离子辐射引发的突变危害分析和化学致癌物质的风险评估[4, 5]。毒物、药物、辐射、热等刺激因素低剂量时发挥激动作用, 高剂量时发挥抑制作用的毒物兴奋效应 (hormesis) 近年在药理学、毒理学以及生物医学等领域越来越得到人们的关注。Calabrese等[6, 7]认为毒物兴奋效应是一种基本量效曲线模型, 普遍存在于各类生物 (动物、植物、微生物) 和化学物质 (毒物、药物、致癌物等) 以及生命现象 (生长、代谢、寿命、肿瘤形成等) 中。包括抗生素在内的一些治疗感染性疾病药物也具有毒物兴奋效应现象: 在一剂量区间发挥药物拟定效应, 而在另一剂量区间则发挥相反效应。在感染性疾病治疗过程中, 药物相反效应的出现不但会加重病情而且易导致耐药和二重感染的发生[8]。因此, 明确抗感染药物的毒物兴奋效应将有助于临床合理用药 (药物种类、剂量、疗程以及联合用药方案的确定), 降低耐药和二重感染的发生几率, 同时对抗感染病药物的研发、药物作用机制及耐药机制的药理学研究有重要意义。
1 毒物兴奋效应毒物兴奋效应是指刺激因素在低剂量时发挥激动作用, 在高剂量时发挥抑制作用的效应。毒物兴奋效应的量效曲线形状由检测终点 (endpoint measured) 决定, 表现为J型、倒U型 (或β型) 曲线。检测终点主要包括生长、细胞增殖、记忆、寿命、肿瘤形成、死亡等。通常检测终点为有害效应 (机体功能的改变、疾病发生率和死亡等) 时, 毒物兴奋效应的量效曲线形状表现为J型, 而当检测终点为生长、增殖和存活率等时, 曲线形状为倒U型 (或β型)[9]。在不同细胞模型、组织模型中, 毒物兴奋效应具有相似定量特征: ① 刺激因素在低剂量时发挥激动效应, 在高剂量时发挥抑制效应; ② 低剂量激动效应的幅度小, 一般最大激动效应比对照组效应 (又称零等效点zero equivalent point, ZEP) 高30%~60%; ③ 刺激因素发挥激动效应的剂量范围窄, 通常未观察到毒副作用的剂量 (no observable adverse effect level, NOAEL) 是发挥激动效应最小剂量的10~20倍 (图 2A)[10, 11, 12]。
Lushchak[13]将毒物兴奋效应曲线分为3个区域: 延迟区、兴奋区和抑制区。延迟区 (图 2B Ⅰ) 为所有类型量效曲线所共有, 是无可检测效应的剂量区间, 该区间范围由检测器灵敏度决定; 兴奋区 (图 2B Ⅱ) 是刺激因素发挥激动效应的剂量区间, 激动效应在低剂量时随剂量增加而增加, 在较高剂量时激动效应随剂量增加而降低; 抑制区 (图 2B Ⅲ) 是刺激因素发挥抑制效应的剂量区间, 曲线表现为一阶指数衰减。同时, 基于作用靶点或调节分子在刺激因素 作用过程中可能会发生改变的理论, Lushchak认为“理想毒物兴奋效应”(idealized hermetic curves) 由以下几部分组成: 激动效应与抑制效应的净效应曲线 (图 2B ①); 抑制效应曲线 (图 2B ②); 在具备保护能力的生命体 (如有免疫系统的生物体) 中存在的抑制效应与机体保护效应的加和效应曲线 (图 2B ③)。
 | 图 2 A: 毒物兴奋效应量效曲线及其特征[11]; B: 毒物兴奋效应曲线的分区和组成: Ⅰ延迟区、Ⅱ兴奋区、Ⅲ抑制区; ① 激动效应和抑制效应的净效应曲线、② 抑制效应曲线、③ 抑制效应与机体保护效应的加和效应曲线[13] |
关于毒物兴奋效应的发生机制, 目前主要有3种假说[12, 14]: ① 机体存在可同时与刺激因素作用的两种亲和力不同且分别发挥激动和抑制作用的受体; ② 由破坏机体初期稳态后的过度补偿反应导致; ③ 由机体的适应性反应导致, 即机体在低剂量刺激因素处理后对一定剂量的该刺激因素产生耐受。Calabrese[14]在其基础上对毒物兴奋效应的可能分子机制进行了较全面的总结, 他提出了受体介导的毒物兴奋效应机制、细胞信号介导的毒物兴奋效应机制和剂量依赖的分子开关机制等。
毒物兴奋效应对毒理学、药理学、流行病学等研究和临床治疗均具有重要价值: 可用于非致癌物和致癌物的危险度评估[15]; 可用于临床药物剂量的优化[16]; 可作为治疗方法——利用低剂量激动效应诱导细胞产生修复、耐受和保护功能, 应用于临床治疗阿尔兹海默病、骨质疏松、肿瘤、血管再生、系统性红斑狼疮、病毒和细菌感染等疾病[17]。本文以抗感染药物的毒物兴奋效应为例, 阐述了通过在实验中设立一定数量的低剂量组对药物毒物兴奋效应进行观察、分析, 全面掌握药物量效关系, 此项研究对药物开发、药物作用机制研究和临床合理用药均有重要意义。
2 抗感染药物的毒物兴奋效应感染性疾病包括一切由病原微生物和寄生虫感染后引起的疾病, 此类疾病具有病因明确且外因起主导作用等特点。病原体短期内人际间快速传播, 对人类健康和社会经济造成严重危害[8]。病原微生物可分为朊毒体 (prion)、病毒 (virus)、立克次体 (rickettsia)、衣原体 (chlamydia)、支原体 (mycoplasma)、细菌 (bacteria)、真菌 (fungus)、螺旋体 (spirochete) 等。人体寄生虫主要包括原虫 (protozoa) 和蠕虫 (helminth)。感染性疾病的发生与宿主的免疫力以及病原体的侵袭力、毒力、变异性等密切相关。因此, 治疗感染性疾病的药物主要有抑制或杀灭病原微生物或寄生虫的抗感染药物 (包括抗生素、抗病毒药物和抗寄生虫药)、免疫调节药物和疫苗等。感染性疾病治疗中的两个严重问题是耐药和二重感染, 它们的产生与不合理用药有直接关系[8]。而全面掌握药物量效关系是科学合理地确定药物种类、剂量、疗程以及联合用药方案的前提。因此, 研究、细化药物量效曲线, 设立一定数量低剂量组用以观察药物毒物兴奋效应, 对治疗感染性疾病药物的研发和临床应用具有重要意义。
2.1 刚果红与朊毒体病 (prion diseases)朊毒体病又称传染性海绵状脑病, 是由变异朊蛋白感染引起的具有传染性和遗传性的致死性疾病, 至今尚无特效药物。阿糖胞苷、阿糖腺苷和干扰素虽被临床试用, 但疗效均不理想[8]。Rudyk等[18]应用羊痒病因子感染的非神经元小鼠细胞系模型 (SMB) 考察刚果红 (图 3A) 及其结构类似物对生物标志物PrP-res (PrP5C, 蛋白酶抵抗的可致病朊病毒蛋白) 生成的抑制作用, 发现刚果红在高剂量时显著抑制PrP5C的生成, 在低剂量时却促进PrP5C的生成 (图 3B)。Rudyk等[19, 20]认为此双向量效关系的可能机制是: 低剂量刚果红以单体形式与PrPC (存在于正常组织, 对蛋白酶敏感的不致病糖蛋白) 一个位点结合, 促进其向PrP5C转变; 高剂量刚果红可形成与PrP5C和(或) PrPC结合的液晶超分子配体, 抑制两者之间转变。刚果红-PrP-res的量效曲线 (图 3B) 形状与毒物兴奋效应倒U型(或β型) 量效曲线相似, 且与毒物兴奋效应特征相符, 表明低剂量刚果红可能会促进朊毒体病的发生, 此发现在药物研发和疾病发生中应得到足够重视。
 | 图 3 A: 刚果红结构式; B: 刚果红与致病性朊病毒蛋白PrP-res产量的量效曲线[18]。 |
RNA肿瘤病毒属逆转录病毒科, 其逆转录酶 (RNA依赖的DNA聚合酶) 是病毒诱导细胞转化的重要因素, 抑制该酶的活性可有效减缓细胞癌变。胶霉毒素类似物是真菌代谢产物, de Clercq等[21]研究了4种胶霉毒素类似物 (图 4) 对鼠肉瘤病毒逆转录酶RNA依赖DNA聚合酶作用, 结果发现: 4种胶霉毒素类似物高剂量时对DNA聚合酶活性均显示抑制效应; 而低剂量时对酶活性显示激动效应 (10%~18%, 图 4), 其中类似物1和3表现为时间依赖性, 即在药物作用60 min后才出现激动效应, 且随化合物作用时间的延长, 激动效应越明显 (图 4)。该现象适用于毒物兴奋效应过度补偿效应理论[22]。此研究结果提示, 药物毒物兴奋效应现象的出现不仅与药物剂量有关, 还与药物作用时间有关, 因此在设计实验时, 研究者应考虑药物作用时间对药物量效曲线及毒物兴奋效应的影响。
 | 图 4 胶霉毒素类似物结构式以及4种胶霉毒素类似物与小鼠白血病病毒DNA聚合酶活性之间在3个时间点 (30、 60和120 min) 的量效曲线[21] |
疟疾(malaria) 是由疟原虫感染引起的寄生虫病。现有抗疟药物有氯喹、奎宁、青蒿素等。氯喹用于治疗疟疾的急性发作, 可迅速稳定症状, 但易导致疟原虫产生耐药。目前临床发现有较大比例的恶性疟原虫对氯喹产生了抗性, 且由单一耐药向多药耐药发展[8]。
2.3.1 肽类抗生素对疟原虫的作用Efrapeptins、zervamicins和antiamoebin是由真菌次级代谢产物中获得的抗疟活性肽, 其恶性疟原虫体外半数抑制浓度分别为1.37、0.48和6.16 μmol·L-1。虽然文章未提及药物低剂量的相反效应, 但从实验数据和量效曲线图可发现3种活性肽在低剂量时促进疟原虫增殖 (5%~20%), 且3种活性肽对恶性疟原虫的体外半数抑制浓度与引起相反效应的低剂量相近[22, 23]。因此, 这3种活性肽可能不适合开发成临床抗疟药物。所以, 尽早地发现化合物的低剂量相反效应对药物研发有重要意义。
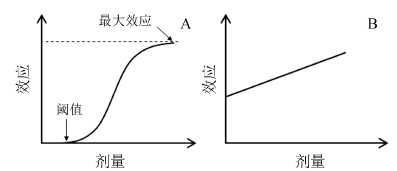
2.3.2 疟原虫对氯喹、甲氟喹、罗丹明的多药耐药与毒物兴奋效应在研究抗疟药物的多药耐药机制时, Abrahem等[24]发现氯喹、甲氟喹、罗丹明 (图 5) 对野生疟原虫有单一抑制作用, 但对放线菌素D耐药恶性疟原虫表现为双相量效关系: 即低剂量的激动效应和高剂量的抑制效应, 该结果在大鼠体内实验得到证实[22]。此研究结果首先提示, 确定抗感染药物治疗剂量时要考虑毒物兴奋效应, 其次表明抗疟药物多药耐药机制与毒物兴奋效应存在联系, 应得到基础研究的关注。
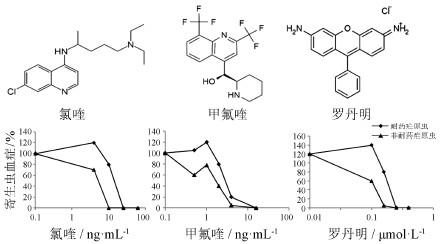 | 图 5 氯喹、甲氟喹、罗丹明结构式及其作用于放线菌素耐药的恶性疟原虫和非耐药疟原虫的量效曲线[24] |
多糖硫酸酯 (sulfated polysaccharide) 又称硫酸酯多糖, 是一种新型药物, 在自然界中广泛存在, 其结构特征为多糖链中单糖分子的一个或多个羟基被硫酸基取代, 具有抗氧化抗炎、抗凝血、抗病毒、抗肿瘤、增强免疫等生物活性[25, 26, 27]。Witvrouw等[28]发现硫酸酯化多糖可通过影响包膜病毒 (如HSV-1、HIV-1) 的融合过程阻断病毒进入宿主细胞。细胞融合实验显示, 鼠李糖聚糖硫酸酯 (rhamnan sulfate, RS) 和葡聚糖硫酸酯 (dextran sulfate, DS) 高剂量时抑制HIV-1膜融合形成合胞体, 而在低剂量时却促进HIV-1合胞体的形成, 最大激动效应约为20%[22, 29]。因此, 不同类型的化学物质均有可能存在毒物兴奋效应现象。
2.5 青霉素与伤寒青霉素是第一个抗生素, 可用于伤寒的治疗。Randall等[30]发现低剂量青霉素会增加感染伤寒沙门菌小鼠的死亡率 (表 1)。该研究应用了药用青霉素、青霉素K晶体和青霉素G晶体进行实验, 因而排除了药物杂质引发相反效应的可能, 明确了特定剂量青霉素作用于伤寒沙门菌感染小鼠时会出现毒物兴奋效应现象。
|
|
表 1 药用青霉素、青霉素K晶体、青霉素G晶体不同剂量时感染伤寒沙门菌小鼠的死亡率[30] |
该研究认为青霉素仍可用于伤寒的临床治疗的原因, 是由于青霉素的治疗指数高, 血药浓度可保持在较高浓度, 一般不会出现引起毒物兴奋效应的低血药浓度。但该研究也提示, 当用青霉素治疗伤寒时, 一定要关注血药浓度, 若浓度过低, 则非但不能抑制伤寒沙门菌, 反而有可能会加重病情。因此, 在感染性疾病治疗过程中, 临床应重视抗感染药物的毒物兴奋效应, 全面掌握药物量效曲线, 制定合理的用药方案, 密切监视药物的血浆浓度, 以避免因药物毒物兴奋效应造成的用药安全问题。
2.6 免疫调节药物免疫调节剂是一类发展迅速的药物, 分为免疫增强药物和免疫抑制药物, 主要用于感染性疾病、肿瘤、自身免疫性疾病。免疫调节药物应用于感染性疾病时, 需对其种类、剂量和疗程严格控制[8]。
Clerici等[31, 32]发现妥卡雷琐 (tucaresol, 图 6) 低剂量时可刺激T细胞产生IL-2 (促进细胞介导的免疫反应) 和IFN-γ (通过LTR抑制tat介导的HIV反式激活作用) , 而高剂量时则抑制IL-2和IFN-γ的产生, 其中低剂量妥卡雷琐作用于免疫功能相对较好的艾滋病患者 (CD4+细胞>500个/μL) 时表现的相反效应强于健康对照, 而作用于免疫功能较低的艾滋病患者 (CD4+细胞<500个/μL) 时的激动效应弱于健康对照 (图 6)。因此, 作者提出妥卡雷琐可应用于治疗免疫功能较好的艾滋病患者。此研究结果表明, 在严格控制药物种类、剂量和疗程, 密切监视药物血浆浓度和药物相互作用的情况下, 可应用低剂量药物的相反效应, 诱导细胞发挥修复、耐受和保护功能, 从而达到治疗疾病的效果。
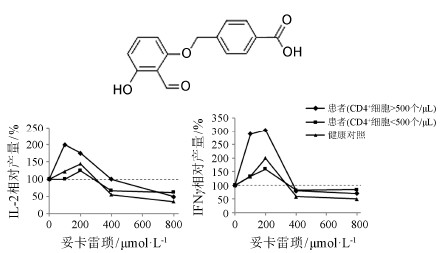 | 图 6 妥卡雷琐结构式和分别以IL-2和IFN-γ产量为效应指标, 妥卡雷琐作用于艾滋病患者(CD4+细胞 >500个/μL)、艾滋病患者 (CD4+ 细胞 < 500个/μL) 和健康对照的外周单个核细胞时的量效曲线[31] |
一个多世纪前, Schulz记录了一些化合物低剂量时促进酵母生长, 高剂量时抑制酵母生长的现象[33]。20世纪40年代, 此双相量效关系特征在细菌生长、昆虫反应、植物生物学、免疫刺激等方面的研究中均被发现, 这种现象由Southam和Ehrlich正式命名为“Hormesis”——毒物兴奋效应, 但此效应在以后的半个世纪中未被重视[34]。最近十年, Calabrese等[35]对毒物兴奋效应进行了详细的研究、分析和总结, 提出了符合毒物兴奋效应的评价标准, 并建立了毒物兴奋效应数据库和毒物兴奋效应频率数据库。
研究毒物兴奋效应有两个难点: 一、毒物兴奋效应的重现性差和可预测性低; 二、有机体的生理状态对毒物兴奋效应有较大影响。为了解决以上两个问题, 首先需要采用更高灵敏度的检测器, 提高观察结果的可信度, 并采用更精确的数学模型处理实验数据; 其次应独立观察和分析相同药物在不同组织和有机体中产生的毒物兴奋效应[13]。
毒物兴奋效应是阈值量效曲线模型和直线量效曲线模型的重要补充, 对该效应的系统研究可完善并深刻理解药物低剂量时的量效关系。因此, 对药物毒物兴奋效应的观察分析不仅有助于临床用药方案的制定, 同时在药物研发过程中也是判断其成药性的重要指标, 应该得到药物研发和医务工作者的更多关注。
| [1] | Wikipedia contributors. Dose-response relationship. Wikipedia, The Free Encyclopedia[EB/OL]. 2014. http://en.wikipedia.org/w/index.php?title=Dose%E2%80%93response_relationship&oldid=609853916 |
| [2] | Kenakin T, Williams M. Defining and characterizing drug/compound function[J]. Biochem Pharmacol, 2014, 87:40-63. |
| [3] | Kenakin TP. A Pharmacology Primer:Theory, Application and Methods[M]. Burlington, USA:Elsevier Academic Press, 2009:15-19. |
| [4] | Calabrese EJ. How the US National Academy of Sciences misled the world community on cancer risk assessment:new findings challenge historical foundations of the linear dose response[J]. Arch Toxicol, 2013, 87:2063-2081. |
| [5] | Calabrese EJ. Origin of the linearity no threshold (LNT) dose-response concept[J]. Arch Toxicol, 2013, 87:1621-1633. |
| [6] | Calabrese EJ. Hormesis:a revolution in toxicology, risk assessment and medicine[J]. EMBO Rep, 2004, 5:37-40. |
| [7] | Calabrese EJ. The maturing of hormesis as a credible doseresponse model[J]. Nonlinearity Bio Toxicol Med, 2003, 1:319-343. |
| [8] | Peng WW. Modern Infectious Diseases and Lemology (现代感染性疾病与传染病学)[M]. Beijing:Science Press, 2000, 3-181. |
| [9] | Calabrese EJ. Getting the dose-response wrong:why hormesis became marginalized and the threshold model accepted[J]. Arch Toxicol, 2009, 83:227-247. |
| [10] | Calabrese EJ, Baldwin LA. Hormesis:the dose-response revolution[J]. Annu Rev Pharmacol Toxicol, 2003, 43:175-197. |
| [11] | Calabrese EJ. Hormesis:from marginalization to mainstream:a case for hormesis as the default dose-response model in risk assessment[J]. Toxicol Appl Pharmacol, 2004, 197:125-136. |
| [12] | Calabrese EJ. Hormesis and medicine[J]. Br J Clin Pharmacol, 2008, 66:594-617. |
| [13] | Lushchak VI. Dissection of the hormetic curve:analysis of components and mechanisms[J]. Dose Response, 2014, 1:1-14. |
| [14] | Calabrese EJ. Hormetic mechanisms[J]. Crit Rev Toxicol, 2013, 43:580-606. |
| [15] | Chapman PM. Ecological risk assessment (ERA) and hormesis[J]. Sci Total Environ, 2002, 288:131-140. |
| [16] | Calabrese EJ, Baldwin LA. Applications of hormesis in toxicology, risk assessment and chemotherapeutics[J]. Trends Pharmacol Sci, 2002, 23:331-337. |
| [17] | Jonas WB, Ives JA. Should we explore the clinical utility of hormesis?[J]. Hum Exp Toxicol, 2008, 27:123-127. |
| [18] | Rudyk H, Vasiljevic S, Hennion RM, et al. Screening Congo red and its analogues for their ability to prevent the formation of PrP-res in scrapie-infected cells[J]. J Gen Virol, 2000, 81:1155-1164. |
| [19] | Skowronek M, Stopa B, Konieczny L, et al. Self-assembly of Congo Red-A theoretical and experimental approach to identify its supramolecular organization in water and salt solutions[J]. Biopolymers, 1998, 46:267-281. |
| [20] | Stopa B, Górny M, Konieczny L, et al. Supramolecular ligands:monomer structure and protein ligation capability[J]. Biochimie, 1998, 80:963-968. |
| [21] | de Clercq E, Billiau A, Ottenheijm HCJ, et al. Antireverse transcriptase activity of gliotoxin analogs[J]. Biochem Pharmacol, 1978, 27:635-639. |
| [22] | Calabrese EJ, Baldwin LA. Chemotherapeutics and hormesis[J]. Crit Rev Toxicol, 2003, 33:305-353. |
| [23] | Nagaraj G, Uma MV, Shivayogi MS, et al. Antimalarial activities of peptide antibiotics isolated from fungi[J]. Antimicrob Agents Chemother, 2001, 45:145-149. |
| [24] | Abrahem A, Certad G, Pan XQ, et al. Pleiotropic resistance to diverse antimalarials in actinomycin D-resistant plasmodium falciparum[J]. Biochem Pharmacol, 2000, 59:1123-1132. |
| [25] | Guo L, Yang YL, Yang T, et al. Sulfated modification and anticoagulant activity in vitro of sulfated glucan isolated from the aqueous extract of Hedysarum polybotry[J]. Acta Pharm Sin (药学学报), 2013, 48:1665-1670. |
| [26] | Cui YQ, Luo DZ, Wang XM. Fucoidan:advances in the study of it's anti-inflammatory and anti-oxidative effects[J]. Acta Pharm Sin (药学学报), 2008, 43:1186-1189. |
| [27] | Peng ZG, Chen HS, Guo ZM, et al. Anti-HIV activities of Achyranthes bidentata polysaccharide sulfate in vitro and in vivo[J]. Acta Pharm Sin (药学学报), 2008, 43:702-706. |
| [28] | Witvrouw M, de Clercq E. Sulfated polysaccharides extracted from sea algae as potential antiviral drugs[J]. Gen Pharmacol, 1997, 29:497-511. |
| [29] | Lee JB, Hayashi K, Hayashi T, et al. Antiviral activities against HSV-1, HCMV, and HIV-1 of rhamnan sulfate from Monostroma latissimum[J]. Planta Med, 1999, 65:439-441. |
| [30] | Randall WA, Price CW, Welch H. Demonstration of hormesis (increase in fatality rate) by penicillin[J]. Am J Public Health Nations Health, 1947, 37:421-425. |
| [31] | Clerici M, Cogliati M, Rizzardini G, et al. In vitro immunomodulatory properties of tucaresol in HIV infection[J]. Clin Immunol, 2000, 97:211-220. |
| [32] | Calabrese EJ. Hormetic dose-response relationships in immunology:occurrence, quantitative features of the dose response, mechanistic foundations, and clinical implications[J]. Crit Rev Toxicol, 2005, 35:89-295. |
| [33] | Calabrese EJ, Baldwin LA. Hormesis as a biological hypothesis[J]. Environ Health Perspect, 1998, 106:357-362. |
| [34] | Calabrese EJ. Hormesis:changing view of the dose-response, a personal account of the history and current status[J]. Mutat Res, 2002, 511:181-189. |
| [35] | Calabrese EJ, Blain RB. The hormesis database:the occurrence of hormetic dose responses in the toxicological literature[J]. Regul Toxicol Pharmacol, 2011, 61:73-81. |
 2016, Vol. 51
2016, Vol. 51