2. 苏州科伦药物研究有限公司, 江苏苏州 215000
2. Suzhou Kelun Pharmaceutical Research Co., Ltd., Suzhou 215000, China
近年来,大量文献[1, 2]报道,浸润于肿瘤组织内的巨噬细胞,又称肿瘤相关巨噬细胞 (tumor-associated macrophage,TAM),含量高达实体瘤组织50% 以 上[3, 4],是导致肿瘤组织低氧环境的产生、相关血管与淋巴管的形成、免疫抑制的出现、化疗耐药和放疗 抵抗的发生及肿瘤干细胞的活化等多种现象的重要原因,参与了肿瘤发展、侵袭和转移的整个过程[5, 6, 7, 8, 9]。同其他组织的巨噬细胞一样,TAM几乎不能在肿瘤部位原位增殖,需要从外部环境中源源不断地招募[10],即在肿瘤释放的多种趋化因子 (如CCL2、GPC3、VEGF、TSP-1和GM-CSF等) 诱导下,血液循环中的单核细胞迁移至酸性、缺氧的肿瘤组织,并在IL-10的作用下分化成TAM[11]。值得注意的是,单核细胞表面过表达siglec受体,该受体为特异性结合唾液酸 (sialic acid,SA) 的免疫球蛋白样凝集素[12, 13],目前尚未发现可与其他配体结合。鉴于肿瘤生长过程中所释放的趋化因子诱导单核细胞进入肿瘤并转化为TAM,如果将SA修饰于制剂表面,其与siglec受体高度特 异性作用可使制剂随单核细胞到达肿瘤部位,间接实现TAM靶向目的。
为了验证此设想,本课题组前期采用SA与十 八胺 (octadecylamine,ODA) 偶联制备了衍生物SA- ODA,将其修饰于装载马来酸匹杉琼 (pixantrone maleate,Pix) 的普通脂质体表面,进行体外细胞实验和体内药效学的综合评价。首先选择具有SA受体的小鼠单核巨噬细胞白血病细胞RAW 246.7作为TAM靶向细胞模型,以小鼠肉瘤细胞S180、小鼠成纤维细 胞L929和血管内皮细胞EA.hy926为对照,进行细 胞毒实验。结果显示,与其他细胞相比,SA修饰的Pix脂质体对RAW 246.7的细胞毒性最强,说明SA具有单核细胞靶向性,为间接实现TAM靶向提供了物质基础[14]。进一步的药效学实验结果显示,与未经SA修饰的Pix普通脂质体和Pix长循环脂质体相比,SA修饰的Pix普通脂质体取得了最好的肿瘤抑制效果、毒性最低。并且该制剂组荷瘤小鼠在给药4~6次后,肿瘤组织从生长部位“脱落”并伴随着伤口逐渐愈合[15]。
理论上,SA脂肪胺衍生物的碳链长度是影响其与载体结合能力的关键因素,直接关系到载体借助单核细胞的转运和后续的TAM靶向性。如果选择不当,不仅会影响靶向效率,还可能对免疫系统造成损伤,因此非常有必要对衍生物链长进行系统考察。本文作者合成了4种不同链长的SA脂肪胺衍生物,以毒性和药效学为评价指标,分析了衍生物链长与TAM靶向性之间的关系,确定最优靶向材料,为后续进一步的机制研究奠定基础。
材料与方法 仪器Bruker IFS 55红外光谱仪 (美国Bruker公司); Bruker micrOTOF_Q电喷雾四级杆飞行时间质谱 (美国Bruker公司); DRC-1000 REC冷冻干燥机 (日本Rikakikai公司); JY92-2D超声波细胞粉碎机 (宁波新芝科器研究所); Nicomp-380激光粒度测定仪 (美国PSS公司); UV1801紫外-可见分光光度计 (北京瑞利分析仪器有限公司)。
试药SA (长兴药业有限公司); 十八胺,1-(3- 二甲氨基丙基)-3-乙基碳二亚胺盐酸盐[1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC·HCl],N-羟基琥珀酰亚胺 (N-hydroxysuccinimide,NHS),N,N-二甲基甲酰胺 (dimethylformamide,DMF),ZB-1型Na+型阳离子交换纤维 (国药集团化学试剂有限公司); 十六胺、十四胺、十二胺 (百灵威科技有限公司); 马来酸匹杉琼 (pixantrone maleate,Pix,南京科优医药科技有限公司); 注射级蛋黄卵磷脂E80 (德国Lipoid公司); 胆固醇 (cholesterol,CH,南京新百药业有限公司); 聚乙二醇单甲醚2000-二硬脂酰磷脂酰乙醇胺 [(polyethylene glycol) 2000-1,2-distearoyl-sn- glycero-3-phosphoethanolamine,mPEG2000-DSPE,美国Genzyme公司]; 氢化大豆磷脂 (hydrogenated soybean phosphatidylcholine,HSPC,德国Lucas Meyer公司); 5% 葡萄糖注射液 (四川科伦药业有限公司); 灭菌注射用水 (石家庄石药集团有限公司); 其他试剂均为分析纯。
细胞与动物小鼠肉瘤S180细胞株 (中国医科大学); 昆明种小鼠 (体质量18~22 g,雄性,沈阳药科大学实验动物中心)。
SA脂肪胺衍生物的合成依据本课题组前期建立的唾液酸-十八胺偶联物 (sialic acid-octadecylamine,SA-18) 合成方法进行不同链长SA脂肪胺衍生物的合成[15],即采用EDC/NHS为催化剂,将SA的羧基 与脂肪胺的氨基偶联 (合成路线1),其中唾液酸-十六胺偶联物 (sialic acid-hexadecylamine,SA-16)、唾液酸-十四胺偶联物 (sialic acid-tetradecylamine,SA-14) 和唾液酸-十二胺偶联物 (sialic acid-dodecylamine,SA-12) 的合成工艺与SA-18完全相同,脂肪胺均按与SA 1∶3的摩尔比投料,所得纯化后的产物采用傅立叶变换红外及质谱两种方法进行结构确证。
SA衍生物溶液的制备取SA衍生物适量,加入50.0 mg蛋黄卵磷脂E80后,用无水乙醇500 μL溶解,加入灭菌注射用水稀释至5 mL,过0.22 μm微孔滤膜即得。
SA衍生物修饰的空白脂质体的制备按摩尔比54.8∶40∶5∶0.2称取脂质体膜材HSPC、CH、SA-n (n = 18,16,14,12) 及mPEG2000-DSPE置于10 mL西林瓶中,加入无水乙醇400 μL并于65 ℃水浴中搅拌溶解后,以4 mL·min-1速度将4 mL预热至相同温度的柠檬酸-柠檬酸钠溶液 (200 mmol·L-1,pH 4.0) 注入膜材中,65 ℃水浴搅拌20 min,得到脂质体初品。将初品超声分散处理 (200 W × 2 min + 400 W × 4 min; 工作1 s,间歇1 s) 后,依次通过0.80、0.45、0.22 µm微孔滤膜,即得空白脂质体 (blank liposomes modified with SA derivatives,BLK-SnL),SA修饰密度为膜材的5%。
该空白脂质体主要用于后续载药脂质体的制备,“空白脂质体的药效学研究”中所用制剂的制备方法与其相同,仅将水化介质替换为5%葡萄糖溶液。
SA衍生物修饰的载药脂质体的制备[15]取水化介质为柠檬酸-柠檬酸钠的空白脂质体混悬液1.0 mL,加入500 mmol·L-1磷酸钠溶液400 μL,调节外水相pH至7.0,再加入适量灭菌注射用水,混合均匀,得pH梯度脂质体。将上述梯度脂质体与5.0 g·L-1 Pix溶液按照药脂比1∶10 (w/w) 混合,于60 ℃水浴搅拌孵育,15 min后取出,置于冰水浴终止载药,即得Pix脂质体 (Pix liposomes modified with SA derivatives,Pix-SnL,Pix质量浓度为1 g·L-1,此时SA浓度为1.25×10-3 mol·L-1)。
Pix脂质体包封率的测定采用阳离子交换纤维微柱法测定Pix脂质体的包封率,具体操作为: 取湿视体积1.5 mL、常规酸碱处理后的钠型732强酸性阳离子交换纤维,装于2.5 mL注射器中,以去离子水平衡,2 000 r·min-1离心4 min,弃去滤液,制成阳离子交换纤维微柱,柱高约为1 cm,待用。取两份Pix脂质体混悬液,每份100 μL,一份直接置于量瓶中,加蒸馏水1.2 mL,用破乳剂异丙醇-水 (90∶10,v/v,含1 mol·L-1 HCl) 破乳并稀释至5.0 mL,摇匀,于641 nm处测定吸光度 (Abefore); 另一份上样于阳离子交换纤维柱顶端,2 000 r·min-1离心4 min,继续加400 μL去离子水于柱的顶端,2 000 r·min-1离心4 min洗脱,连续操作3次,合并洗脱液并转移至量瓶中,加入破乳剂破乳并稀释至5.0 mL,摇匀,于641 nm波长处测定吸光度 (Aafter)。包封率 (entrapment efficiency,EE) 以公式EE (%) = Aafter/Abefore × 100% 计算,每份Pix-SnL样品平行测定3次。
|
Scheme 1 Synthesis schematic of the sialic acid and linear chain alkylamine conjugates (n = 8,7,6,5) |
采用Nicomp-380粒径测定仪对Pix-SnL的粒径和zeta电位进行测定,每份样品平行测定3次。
SA衍生物急性毒性实验72只小鼠随机分为12组,每组6只,即SA-18、SA-16、SA-14和SA-12 4个溶液组。每个溶液组又分为低、中、高3个剂量组,分别为药效学实验中SA衍生物给药剂量的1、5和10倍,即1.25×10-2、6.25×10-2和0.125 mmol·kg-1。各组小鼠以不同剂量尾静脉注射相应的SA衍生物溶液,1 h内及时记录小鼠的死亡时间,随后每隔1 h记录1次,至12 h结束实验,计算各组小鼠的平均存活时间。
SA衍生物修饰的空白脂质体药效学实验液氮中取出保种的S180细胞冻存管,迅速置于37 ℃温水中复苏。将复苏的S180细胞悬液接种于小鼠腹腔内 (每只0.5 mL),7天后,在无菌条件下抽取乳白色黏稠腹水,于倒置显微镜下计数,肿瘤细胞活度大于95%,加生理盐水稀释成细胞混悬液,调整稀释倍数,使细胞混悬液的瘤细胞数为每毫升1.8×107个。将稀释后的细胞混悬液接种于正常小鼠右前腋下的皮下组织,每只小鼠接种0.2 mL,共接种60只。其中30只荷 瘤小鼠随机分为5组,即对照组 (5% 葡萄糖注射液,10 mL·kg-1) 和不同链长SA衍生物修饰的空白脂质体组 (BLK-S18L组、BLK-S16L组、BLK-S14L组和BLK-S12L组),每组6只。各组小鼠均于肿瘤体积长至100 mm3后 (接种后第6天) 开始尾静脉注射给药,每3天1次,共给药5次 (接种后第6、9、12、15和18天)。各BLK-SnL组的SA衍生物剂量与相应组别后续药效学实验中的剂量相等,即以相应SA衍生物计,给药剂量均为1.25×10-2 mmol·kg-1。治疗期间每天记录小鼠死亡事件,隔天称量小鼠体质量并测量肿瘤长径 (a) 和短径 (b),按公式V = 0.5 x a x b2计算肿瘤体积。
以体积抑瘤率、体质量变化和生存分析为指标评价各SA衍生物修饰空白脂质体的抑瘤作用和毒性,其中体积抑瘤率 (tumor inhibition rate,TIR) 的计算公式为: TIR (%) = (Vcontrol - Vtreated) / Vcontrol x 100%。
SA衍生物修饰的Pix脂质体药效学实验将余下30只荷瘤小鼠随机分为5组,即对照组 (control,5%葡萄糖注射液,10 mL·kg-1)、不同链长SA衍生物修饰的载药脂质体组 (Pix-S18L组、Pix-S16L组、Pix-S14L组和Pix-S12L组),每组6只。各组小鼠均于肿瘤体积长至100 mm3后,开始尾静脉注射给药,每3天1次,共给药5次 (接种后第6、9、12、15和18天),各载药脂质体组的单次给药剂量均为10 mg·kg-1 (以Pix计量,此时SA的给药剂量为1.25×10-2 mmol·kg-1)。治疗期间每天记录小鼠死亡事件,隔天称量小鼠体质量并测量肿瘤长径 (a) 和短径 (b)。按“SA衍生物修饰的空白脂质体药效学研究”中的指标进行制剂的药效学评价。
为了排除肿瘤进展程度对脾脏和胸腺的影响,客观评价制剂对免疫系统的损伤,本研究使用健康小鼠进行脾指数和胸腺指数测定。具体方案为: 将30只健康小鼠随机分为5组,每组6只,自饲养第6天开始尾静脉注射给予上述载药制剂,每3天1次,共给药5次 (第6、9、12、15和18天),各组的单次给药剂量均为10 mg·kg-1 (以Pix计量)。末次给药后第2天将小鼠颈锥脱臼处死,称量脾脏、胸腺及体质量,按公式脾/胸腺指数 (mg·g-1) = (脾/胸腺质量) /体质量,计算脾指数和胸腺指数。
统计学分析实验数据以均数 ± 标准差 (x± s) 表示,应用SPSS 19.0软件对小鼠体重变化进行统计学分析,P < 0.05具有显著性差异,P < 0.01具有极显著性差异。
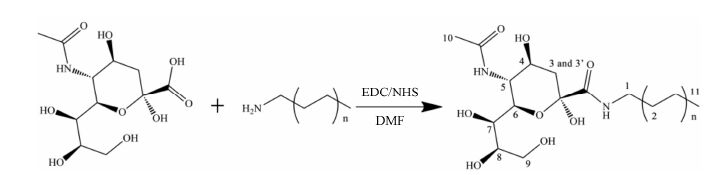
结果 1 SA衍生物的合成使用红外和质谱对所得产物进行结构确证,结果见图 1和图 2。图 1 (A~D) 中,1 730 cm-1的SA羧酸C=O伸缩振动峰均消失,并伴随约2 850 cm-1与2 910 cm-1处的烷基C-H伸缩振动峰相对强度显著增加,说明SA以1位羧酸衍生物的形式与脂肪胺偶合。图 2 (A~D) 中,m/z 583.4、555.4、527.5和499.3分别为[SA-18+Na]+、[SA-16+Na]+、[SA-14+Na]+和[SA-12+Na]+峰,与目标产物分子质量相吻合,由此确定所得产物即为目标产物。

|
Fig. 1 FT-IR spectrums of sialic acid-octadecylamine (A),sialicacid-hexadecylamine (B),sialic acid-tetradecylamine (C),sialic acid-dodecylamine (D) and sialic acid (E) |
|
Fig. 2 MS spectrums of sialic acid-octadecylamine (A),sialic acid-hexadecylamine (B),sialic acid-tetradecylamine (C) and sialic acid-dodecylamine (D) |
粒径及zeta电位是影响制剂体内行为的重要因素[16],不同SA衍生物修饰载药脂质体的粒径、zeta电位及包封率见表 1。结果表明,各制剂粒径均在 125 nm左右,zeta电位均于 -20~-15 mV之间,各制剂的包封率均能达到90% 以上,符合《中国药典 (2015版) 》中“微粒制剂指导原则”相关要求。
|
|
Table 1 Mean particle diameter,zeta potential and entrapment efficiency of sialic acid derivative-modified preparations. n = 3,x± s. Pix-SnL (n= 18,16,14,12) represents pixantrone maleate liposomes modified with different chain length (18,16,14,12) of sialic acid derivatives |
由SA衍生物的急性毒性结果可知 (表 2),低剂量的SA衍生物均不导致小鼠死亡; 高剂量的SA衍生物,除SA-12外,均对小鼠产生急性毒性,且毒性强度随链长的缩短逐渐降低。值得注意的是,中剂量的SA-18仍导致小鼠在12 h内死亡,表明SA-18自身毒性相对于其他材料较高,一方面可能是潜在的风险,另一方面可能协同药物发挥抗肿瘤作用。
|
|
Table 2 Survival times of mice administrated with different doses (1.25×10-2,6.25×10-2,0.125 mmol·kg-1) of SA derivative solutions. n = 6,x± s. SA-n (n = 18,16,14,12) represents different chain length (18,16,14,12) of sialic acid derivatives;A.S. represents all mice survived over 12 h |
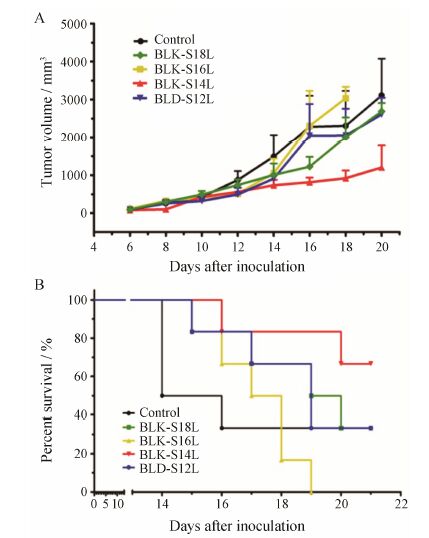
由体积抑瘤率 (表 3) 和肿瘤生长曲线 (图 3A)可知,BLK-S14L能够有效抑制小鼠体内肿瘤的增长 (61.4% ± 18.8%)。在整个实验期内,该组小鼠肿瘤增长非常缓慢。然而,BLK-S12L和BLK-S18L的抑瘤效果不佳,其中BLK-S12L组小鼠自第16天起,肿瘤增长与对照组相当,并保持与对照组平行的增长趋 势; BLK-S18L组小鼠的肿瘤虽在实验中期增长略缓,但后期增长速度加快,实验终点时也与对照组相当。BLK-S16L甚至促进了肿瘤的增长 (-31.7% ± 13.1%),自第16天起,该组小鼠平均肿瘤体积已超过对照组,18天后,该组小鼠全部死亡。
|
|
Table 3 Tumor inhibition rates (TIR) of S180-bearing mice treated with different SA derivative-modified blank liposomes. n = 2-6,x± s. BLK-SnL (n= 18,16,14,12) represents blank liposomes modified with different chain length (18,16,14,12) of sialic acid derivatives. aData was caculated on the 18th day |
由各制剂组小鼠的生存曲线可知 (图 3B),BLK- S16L组小鼠的存活率最低,18天已全部死亡。采用Kaplan-Meier方法进行生存分析,结果显示,对照组、BLK-S18L组、BLK-S16L组和BLK-S12L组小鼠的中位生存时间分别为15、19.5、17.5和19天。BLK-S14L组的生存率为66.7%,无法计算中位生存时间。
|
Fig. 3 Tumor volumes (A) and survival curves (B) of S180-bearing mice treated with different chain length of sialic acid derivative-modified blank liposomes. n = 2-6,x± s |
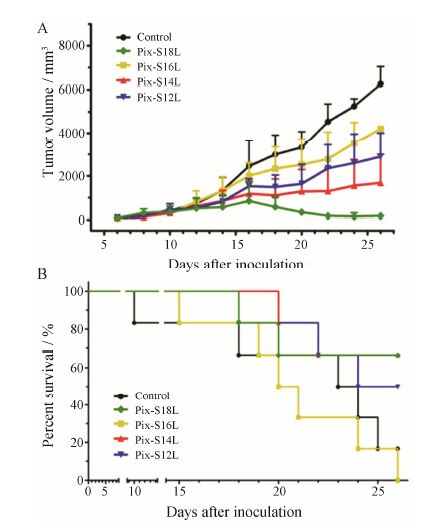
由肿瘤生长曲线 (图 4A) 可知,不同链长SA衍生物修饰的Pix脂质体对小鼠肿瘤抑制作用各不相同,由强到弱依次为Pix-S18L (97.4% ± 2.1%) > Pix-S14L (73.1% ± 21.1%) > Pix-S12L (53.9% ± 17.8%) > Pix-S16L (32.9%)。
|
Fig. 4 Tumor volumes (A) and survival curves (B) of S180-bearing mice treated with different lipophilic chain length of sialic acid derivative-modified Pix liposomes. n = 1-6,x± s |
由各制剂组小鼠的生存曲线 (图 4B) 可知,Pix- S16L组小鼠的存活率最低,实验期内小鼠全部死亡。采用Kaplan-Meier方法进行生存分析,结果显示,对照组、Pix-S16L组和Pix-S12L组小鼠的中位生存 时间分别为23.5、20.5和24.5天。虽然实验结束时,Pix-S12L组仍有50% 小鼠存活,但中位生存时间并未显著延长。Pix-S18L和Pix-S14L组小鼠的生存时间较长,实验结束时,两组小鼠的生存率仍可达66.7%,无法计算中位生存时间。
体质量变化也可在一定程度上反映出制剂的毒性,由各组小鼠体质量变化结果 (图 5) 可知,各制剂组小鼠体质量均呈持续上升趋势,其中对照组小鼠体质量在实验后期 (17天后) 增长最快,主要归因于肿瘤对体质量的贡献。抗肿瘤作用相当的Pix-S14L组和Pix-S12L组小鼠体质量无显著性差异 (P > 0.05),均略高于Pix-S18L组(P > 0.05),显著低于对照组 (P < 0.01)。抗肿瘤作用最差的Pix-S16L组小鼠体质量均低于其他各组,但未见显著性差异 (P > 0.05)。
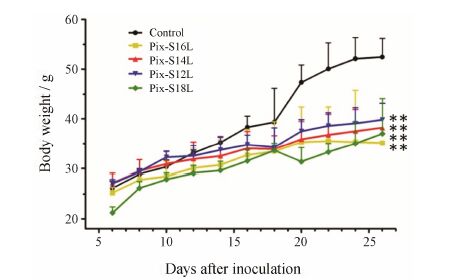
|
Fig. 5 Body weight curves of S180-bearing mice treated with different SA derivative-modified Pix liposomes. n = 1-6,x± s. **P < 0.01,compared with control group |
采用正常小鼠对制剂进行的免疫损伤评价结果见图 6。整体上看,各Pix-SnL组小鼠的脾指数和胸
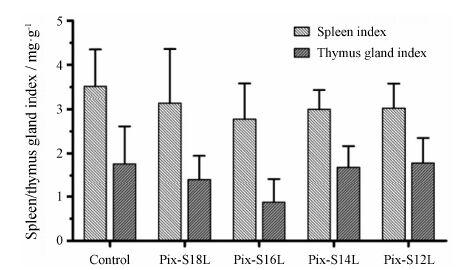
|
Fig. 6 Spleen/thymus gland indexes of normal mice treated with different sialic acid derivative-modified Pix liposomes. n = 6,x± s |
腺指数与对照组相比均有所降低,但无显著性差异 (P > 0.05)。各组小鼠脾指数大小顺序为: Pix-S18L > Pix-S12L ≈ Pix-S14L > Pix-S16L; 胸腺指数大小顺序则为: Pix-S12L > Pix-S14L > Pix-S18L > Pix-S16L。综合两种指数,相比于其他链长SA衍生物修饰的Pix脂质体,Pix-S16L显示出相对严重的免疫损伤,但损伤程度无显著性差异 (P > 0.05)。实验中部分小鼠出现了肿瘤脱落及伤口愈合现象,愈合后的小鼠能够存活60天以上,肿瘤未见复发。并且,出现此现象的小鼠均来自Pix-S18L组(6只中有3只,即肿瘤脱落率为50%)。
讨论越来越多的证据表明,肿瘤的发生和发展与机体免疫功能密切相关,健全、健康的免疫系统对于肿瘤的控制至关重要[17]。然而,目前在抗肿瘤药物/制剂开发的基础研究方面存在一种趋势,即研究者更关注使用免疫缺陷动物建立的人体肿瘤异种移植模型,忽视了借助免疫功能正常动物建立移植性肿瘤模型的价值[18]。这种趋势的流行可能导致实验者难以客观评价药物对免疫系统的影响以及免疫系统在肿瘤发生和治疗中的作用。Pix是一种具有免疫抑制作用的抗肿瘤药物[19],它可以导致脾脏和循环B细胞的计数降低,还可抑制特异性和非特异性抗体的产生[20]。本课题组前期的实验结果显示,与生理盐水相比,经Pix溶液治疗的小鼠S180肿瘤增长更快,且脾和胸腺受损严重[15]。因此,免疫功能健全的小鼠 肿瘤模型能够更为客观地反映出制剂的疗效和毒性。基于以上分析,最终确定以免疫功能健全的昆明小鼠建立S180肿瘤模型,进行制剂的TAM靶向性研究。
SA衍生物中脂肪链的亲脂性较强,水溶性差,需选择适宜的体系将其分散制备成可供静脉注射的制剂。常用可供静脉注射的分散剂有泊洛沙姆F68、聚山梨酯80、聚氧乙烯蓖麻油、聚氧乙烯氢化蓖麻油40和卵磷脂等。除卵磷脂外,上述分散剂均含有亲水的聚合链,该聚合链会降低细胞对材料的摄取,从而不能客观地反映材料毒性。此外,静脉注射聚山梨酯80、聚氧乙烯蓖麻油还易引起过敏反应等[21, 22]。因此,作者最终选用注射级蛋黄卵磷脂E80来分散SA衍生物。
SA为内源性物质,存在于生物体内几乎所有类型细胞的外层多糖链中,无毒[23],而SA脂肪胺衍生物具有一定毒性,且随链长的增加而增大,故推测其毒性是由脂肪胺所引起的。链长对毒性的影响主要归因于两个方面: 一方面,其可通过改变C-N键的诱导效应来影响氨基毒性,碳链越长,诱导效应越大,氨基毒性越强[24]; 另一方面,其可改变与细胞的相互作用,碳链越长,疏水性越强,与细胞亲和性越好,毒性越大[25]。但并非含有相同链长的脂肪胺衍生物毒性都相近,还与所偶联的物质密切相关。如Kim等[26]将十八胺与肝素 (4 500 Da) 偶联,在0~200 μg·mL-1内对MCF-6和MDAMB231两种细胞均无明显毒性。推测原因可能是肝素的高分子量和空间位阻妨碍了脂肪链与细胞的相互作用或影响了材料的入胞。作者使用的SA分子质量较低 (309 Da),不会阻碍脂肪链与细胞的相互作用,故仍然具有一定的毒性。这种毒性对于某些SA受体过表达的细胞来说,可能比相同链长的脂肪胺更强。需要注意的是,毒性具有两面性,如果适当利用,可发挥协同抗肿瘤作用。
对于不同链长SA衍生物修饰的制剂,无论是BLK-SnL还是Pix-SnL,药效学优劣均不随链长的改变呈规律性变化。由于本研究的设计思想是利用单核细胞对SA修饰制剂的吞噬及向肿瘤组织的迁移,间接靶向TAM,因此,作者考虑从SA衍生物与载体的结合能力及自身毒性两个方面进行分析,综合探讨脂肪链长对TAM靶向性的影响。
理想状态下,经SA修饰的脂质体进入血液循环后,首先被血液中的单核细胞吞噬,在肿瘤分泌的趋化因子作用下向肿瘤部位转运,最终到达肿瘤组织中发挥药效。此过程划分为3相,即吞噬相 (phagocytosis phase)、转运相 (transporting phase) 和效应相 (effectuation phase)。在吞噬相和转运相中“脱落”的SA衍生物会因其自身毒性大小对机体产生不同程度的损伤,而在效应相中“脱落”的SA衍生物则会因其毒性产生一定的协同抗肿瘤作用。
本实验所用膜材为含有C18双链的HSPC,SA-18与脂质体的结合能力最强,不易“脱落”,使得其所修饰制剂 (Pix-S18L) 能较好地通过上述3个时相到达肿瘤部位,产生最佳药效。然而,也正是因为这种强的结合能力,不易“脱落”的特性,导致BLK-S18L的肿瘤抑制作用较弱。
SA-14与载体的结合能力和自身毒性均不及SA-18,因此,其修饰的脂质体从吞噬相开始,就存在“脱落”的风险,靶向TAM的机会相对较小。但BLK-S14L在各空白制剂组中却显示出最佳药效,推测可能是因为进入吞噬相和转运相的BLK-S14L会部分“脱落”SA-14,但毒性不足以使转运过程停滞,仍有大量SA-14随载体进入效应相,并在效应相中“脱落”,发挥了肿瘤抑制作用。
SA-16与载体的结合能力和自身毒性均介于SA-18和SA-14之间,但从胸腺指数、体质量变化和死亡率来看,BLK-S16L和Pix-S16L的毒性最强。推测可能是因为其所修饰脂质体能够进入吞噬相,但在转运相中,“脱落”的SA-16对单核细胞产生较强毒性,使得其修饰脂质体的TAM靶向过程终止于转运相,造成荷瘤小鼠免疫损伤。
SA-12与载体的结合能力及自身毒性均为最弱,其所修饰的BLK-S12L和Pix-S12L都表现出较弱的抗肿瘤作用和较低的毒性。可能是SA-12极易从脂质体表面脱落。对于空白脂质体来说,其较弱的毒性既不能对转运相造成阻断,也不能在效应相中发挥抗肿瘤作用; 对于载药脂质体来说,SA-12的脱落会导致载体靶向性降低,并伴随药物的泄漏,到达肿瘤部位的药物量较少,抗肿瘤作用较差。
综上所述,本文通过考察不同链长SA脂肪胺衍生物的毒性及其修饰脂质体的药效,相对系统地建立了链长与TAM靶向性之间的关系,筛选出较好的靶向材料SA-18,为后续TAM靶向机制的研究奠定了基础。
| [1] | Gacche RN, Meshram RJ. Targeting tumor mi-cro-environment for design and development of novel anti-angiogenic agents arresting tumor growth[J]. Prog Biophys Mol Biol, 2013, 113:333-354. |
| [2] | Quail DF, Joyce JA. Microenvironmental regulation of tumor progression and metastasis[J]. Nat Med, 2013, 19:1423-1437. |
| [3] | Solinas G, Germano G, Mantovani A, et al. Tumor-associated macrophages (TAM) as major players of the cancer-related inflammation[J]. J Leukocyte Biol, 2009, 86:1065-1073. |
| [4] | Mantovani A, Sozzani S, Locati M, et al. Macrophage polarization:tumor-associated macrophages as a paradigm for polarized M2 mononuclear phagocytes[J]. Trends Immunol, 2002, 23:549-555. |
| [5] | Chen FH, Chiang CS, Wang CC, et al. Radiotherapy de-creases vascular density and causes hypoxia with macrophage aggre-gation in TRAMP-C1 prostate tumors[J]. Clin Cancer Res, 2009, 15:1721-1729. |
| [6] | Jinushi M, Baghdadi M, Chiba S, et al. Regulation of cancer stem cell activities by tumor-associated macrophages[J]. Am J Cancer Res, 2012, 2:529-539. |
| [7] | Riabov V, Gudima A, Wang N, et al. Role of tumor associ-ated macrophages in tumor angiogenesis and lymphangiogenesis[J]. Front Physiol, 2014, 5:75. |
| [8] | Kitamura T, Qian BZ, Pollard JW. Immune cell promotion of metastasis[J]. Nat Rev Immunol, 2015, 15:73-86. |
| [9] | Burke B, Tang N, Corke KP, et al. Expression of HIF-1α by human macrophages:implications for the use of macro-phages in hypoxia-regulated cancer gene therapy[J]. J Pathol, 2002, 196:204-212. |
| [10] | Allavena P, Germano G, Marchesi F, et al. Chemokines in cancer related inflammation[J]. Exp Cell Res, 2011, 317:664-673. |
| [11] | Allavena P, Sica A, Solinas G, et al. The inflammatory micro-environment in tumor progression:the role of tumor-associated macrophages[J]. Crit Rev Oncol Hematol, 2008, 66:1-9. |
| [12] | Crocker PR, Paulson JC, Varki A. Siglecs and their roles in the immune system[J]. Nat Rev Immunol, 2007, 7:255-266. |
| [13] | Crocker PR, Clark EA, Filbin M, et al. Siglecs:a family of sialic-acid binding lectins[J]. Glycobiology, 1998, 8:v-vi. |
| [14] | She ZN. Study on Sialic Acid Decorated Pixantrone-Loaded Liposome Based on the "MPS Pathway" Targeting Strategy (基于"MPS通路"靶向策略的唾液酸修饰马来酸匹杉琼脂质体的研究)[D]. Shenyang:Shenyang Pharmaceutical University, 2014. |
| [15] | She ZN, Zhang T, Wang XL, et al. The anticancer efficacy of pixantrone-loaded liposomes decorated with sialic acid-octadecylamine conjugate[J]. Biomaterials, 2014, 35:5216-5225. |
| [16] | Yang YF, Xie XY, Yang Y, et al. A review on the influences of size and surface charge of liposome on its targeted drug delivery in vivo[J]. Acta Pharm Sin (药学学报), 2013, 48:1644-1650. |
| [17] | Whiteside TL. Immune suppression in cancer:effects on immune cells, mechanisms and future therapeutic intervention[J]. Semin Cancer Biol, 2006, 16:3-15. |
| [18] | Sausville EA, Burger AM. Contributions of human tumor xenografts to anticancer drug development[J]. Cancer Res, 2006, 66:3351-3354. |
| [19] | Mazzanti B, Biagioli T, Aldinucci A, et al. Effects of pixantrone on immune-cell function in the course of acute rat experimental allergic encephalomyelitis[J]. J Neuroimmunol, 2005, 168:111-117. |
| [20] | Gonsette RE. Pixantrone (BBR2778):a new immunosup-pressant in multiple sclerosis with a low cardiotoxicity[J]. J Neurol Sci, 2004, 223:81-86. |
| [21] | Nannan Panday VR, Huizing MT, ter Bokkel Huinink WW, et al. Hypersensitivity reactions to the taxanes paclitaxel and docetaxel[J]. Clin Drug Invest, 1997, 14:418-427. |
| [22] | Weiss RB, Donehower RC, Wiernik PH, et al. Hypersensitivity reactions from taxol[J]. J Clin Oncol, 1990, 8:1263-1268. |
| [23] | Schauer R. Achievements and challenges of sialic acid research[J]. Glycoconjug J, 2000, 17:485-499. |
| [24] | He YY. The relationship between toxicity and molecular structure of saturated aliphatic amines[J]. J Tongji Med Univ (同济医科大学学报), 1985, 5:328-331. |
| [25] | Lewis MA. Chronic and sublethal toxicities of surfactants to aquatic animals:a review and risk assessment[J]. Water Res, 1991, 25:101-113. |
| [26] | Kim DH, Termsarasab U, Cho HJ, et al. Preparation and characterization of self-assembled nanoparticles based on low-molecular weight heparin and stearylamine conjugates for controlled delivery of docetaxel[J]. Int J Nanomedicine, 2014, 9:5711-5727. |
 2016, Vol. 51
2016, Vol. 51


