2. 中国药科大学江苏省新药筛选中心, 江苏南京 210009;
3. 南京圣和药业有限公司, 江苏南京 210038
2. Jiangsu Center for Drug Screening, China Pharmaceutical University, Nanjing 210009, China;
3. Nanjing Sanhome Pharmaceutical Co., Ltd., Nanjing 210038, China
血管生成是指从已有微血管发展形成新的血管,是一个复杂、多步骤的过程,受多种促 (和抑) 血管生成因子共同调控以维持平衡,该平衡一旦打破可引起包括肿瘤在内的诸多疾病。肿瘤血管生成为肿瘤生长提供氧气和必需营养物质[1],对肿瘤的生长和转移尤为重要,是肿瘤的重要病理特征之一。肿瘤血管生成的诸多调控因素中,血管内皮生长因子 (VEGF) 及其同源受体血管内皮生长因子受体2 (VEGFR2) 研究最为广泛。研究显示,VEGF可与VEGFR2结合,后者作为肿瘤血管生成的主要信号传导者,可介导下游PI3K/AKT/mTOR信号通路激活促进内皮细胞募集和增殖[2]。
肿瘤血管生成在实体肿瘤起始、进展阶段均发挥重要作用,因此抗血管生成单独、或作为辅助治疗手段与放化疗等联合成为治疗恶性肿瘤的重要策略。随着对肿瘤血管生成机制的研究不断深入,许多抗血管生成药物也随之研发,其中对于天然药物及其组分的研究占据了相当大的比例。这部分天然药物因毒性小、不良反应少以及抗血管生成作用明确,克服了临床现有一些抗血管生成药物毒性较大以及使用初期有效、后期耐受等缺点[3]。
消癌平注射液是由中药通关藤 (Marsdenia tenacissima) 的干燥藤茎经水提醇沉后制成的中药注射剂。本课题组在前期已报道过消癌平注射液的质 量分析,HPLC-ELSD图谱的结果表明,消癌平注射液主要含9个甾体化合物,这可能是其药理作用的物质基础[4]。已有研究显示,消癌平注射液毒副作用轻微[5],具有多方面抗肿瘤效应[6, 7, 8, 9],目前已广泛应用于食管癌、胃癌、肝癌以及胃癌等治疗[10],但消癌平注射液对于血管生成的直接抑制作用尚缺乏研究。抗肿瘤血管生成是肿瘤治疗的重要策略之一[11, 12],而抑制VEGF/VEGFR是目前抗血管生成的关键靶标[13]。本研究着眼于消癌平注射液体外和离体水平对血管生成的直接影响,考察消癌平注射液的直接抗血管生成作用,并研究其作用机制与VEGF/VEGFR信号通路的关系。
材料与方法 试剂消癌平注射液为南京圣和药业有限公司生产 (批号201205141,国药准字Z20025868); 索拉菲尼 (德国拜耳公司,批号FS10807); CCK8试剂盒 (日本同仁公司); 纤维蛋白原、凝血酶、氨基己酸、鼠抗人β-actin抗体(美国Sigma公司); DMEM培养基、胎牛血清 (美国Gibco公司); Transwell小室 (美国Millipore公司),Matrigel (美国BD公司); 兔抗人p-VEGFR2、VEGFR2、p-AKT (Ser473)、AKT (美国Cell Signal Technology公司); Human VEGF ELISA kit (上海Excell公司)。
细胞与动物HUVECs购自中国科学院上海细胞库; 六日龄受精鸡胚购自南京盘城养鸡厂; 清洁 级雄性SD大鼠,170 g左右,合格证号: SCXK (苏) 2009-0002,由江苏大学实验动物中心提供。
仪器设备32lD型CO2培养箱 (美国Thermo公司); 酶标仪 (美国Bio-Rad公司); IX71荧光倒置显微镜 (日本Olympus公司); 照蛋器 (北京方通孵化机厂); 小型孵蛋机 (北京方通孵化机厂); 电泳槽、转印系统、凝胶成像仪 (美国Bio-Rad公司)。
CCK8实验取对数生长期HUVECs接种于96孔板 (每孔2×103~8×103个细胞),置37 ℃、5% CO2孵箱中培养24 h。加入不同生药质量浓度的消癌平 注射液 (终质量浓度为5~100 mg·mL-1),阴性对照组加入等体积消癌平注射液的溶剂对照。同时,设空白对照组 (不接种细胞,操作与其他孔一致)。每组设3个复孔。药物分别作用24、48和72 h后,换含10% CCK8的无血清培养基,每孔100 μL,孵箱中反应 2 h。酶标仪检测450 nm波长处吸光度,计算细胞增殖抑制率: 抑制率 (%) = (阴性对照组吸光度 - 药敏组吸光度) / (阴性对照组吸光度 - 空白对照组吸光度) × 100%。
BrdU掺入细胞免疫荧光实验常规培养HUVECs接种于24孔板 (每孔1×105个细胞)。待细胞生长融合至60%~70% 密度,消癌平注射液 (终质量浓度为5、10和20 mg·mL-1) 处理24 h,设置阴性对照组。药物作用结束前2 h加入BrdU (10 μmol·L-1)。孵育结束后弃去培养液,PBS洗1次; 4% 多聚甲醛固定30 min,PBST洗3次; 2 mol·L-1 HCl 37 ℃变性30 min,PBST洗3次; 0.3 % Triton通透打孔10 min,PBST洗3次; 5 % BSA封闭1 h; BrdU (稀释比例1∶200) 一抗室温孵育2 h,PBST洗3次; Cy3标记的羊抗小鼠荧光二抗及Hoechst 33342 (稀释比例1∶1 000) 避光孵育1 h,避光条件下PBST洗2次,三蒸水洗1次; 利用IX71荧光倒置显微镜 (Olympus) 于激发波长550 nm、发射波长600 nm处观察橙红色荧光并拍照。
细胞划痕愈合实验常规培养HUVECs接种于24孔板 (每孔2×105个细胞),培养至单层细胞铺满板底,用20 μL枪头垂直于板底划痕,PBS洗去细胞碎片,换含0.1% 血清的新鲜培养基,消癌平注射液 (终质量浓度为5、10和20 mg·mL-1) 处理24 h,设置阴性对照组。分别于0、4、8、12和24 h拍照。
小室迁移实验常规培养HUVECs重悬于含1%血清的新鲜培养基中,接种于小室内室 (每孔1×104个细胞,180 μL),加入消癌平注射液 (终质量浓度为5、10和20 mg·mL-1) 各20 μL给予处理,设置阴性对照组。外室加入含10% 血清的新鲜培养基600 μL。药物作用6 h后,弃去小室内室液体,4% 多聚甲醛固定细胞30 min。棉签轻轻擦去内室上层未穿过的细胞,0.1% 结晶紫常温染色10 min,PBS漂洗3次,100倍镜下随机选取5个视野拍照,采用IPP6.0软件计数结晶紫染色细胞数目,求均值。
HUVECs管腔形成实验预先冷却的96孔板中加入Matrigel (每孔50 μL),置37 ℃、5% CO2孵箱1 h使凝固。HUVECs重悬于含20% 血清的新鲜培养基中,接种于96孔板 (每孔1.5×104个细胞),消癌平注射液 (终质量浓度为5、10和20 mg·mL-1) 处理6 h,设置阴性对照组。40倍镜下观察管腔形成情况,随机选取3个视野拍照。
大鼠动脉环出芽实验取体重约170 g雄性SD大鼠1只,脱臼法处死,取胸主动脉,去除外围结缔组织和脂肪组织,在超净台中用无血清培养基漂洗,剪成长约1 mm的动脉环。48孔板每孔加入纤维蛋白胶 (DMEM培养基 + 0.3% 纤维蛋白原 + 0.5% 氨基己酸) 400 μL,将动脉环放入胶中,加入凝血酶 (0.01 U·μL-1),待纤维蛋白胶凝固后,消癌平注射液 (终质量浓度为10、20和40 mg·mL-1) 各600 μL给予处理,设置阴性对照组和阳性对照组 (索拉菲尼10 μmol·L-1)。隔天换液,第7天100倍镜下拍照。
鸡胚尿囊膜 (CAM) 实验购买孵育6天的受精鸡胚,酒精擦拭后静置15 min (气室端向上),于气室处划一个2 cm × 2 cm的区域,用剪刀磨切开窗,小心撬开开窗处蛋壳,用虹膜刀切破壳膜,暴露出尿囊膜。将消癌平注射液 (10、20和40 mg·mL-1) 分别加在经高压灭菌的0.5 cm × 0.5 cm大小的Whatman滤纸上,每个鸡胚10 μL,设置阴性对照组和阳性对照组 (索拉菲尼10 μmol·L-1)。将滤纸放在血管较少部位,透明胶带封窗后放入孵化箱中继续孵化。隔天给药一次,给药方式剂量同前。孵育6~8天,撕开透明胶带,用镊子轻轻夹去Whatman滤纸,暴露给药部位,观察并拍照。
ELISA酶联免疫吸附实验HUVECs生长融合至70%~80% 密度后,换液,消癌平注射液 (终质量浓度为5、10和20 mg·mL-1) 处理24 h,设置阴性对照组。收集细胞培养上清,离心后取上清,分装后保存于 -70 ℃备用。按ELISA试剂盒的说明,每孔加入100 μL样品,37 ℃孵育90 min; 弃去孔内液体,洗板5次; 加入生物素化抗体工作液,每孔100 μL,37 ℃孵育60 min; 洗板5次; 加入酶结合物工作液,每孔100 μL,37 ℃避光孵育30 min; 洗板5次; 加入显 色底物,每孔100 μL,37 ℃避光孵育15 min; 加入终止液,每孔100 μL,混匀后以酶标仪检测450 nm波长处吸光度值。按说明书做标准曲线(15.625~1 000 pg·mL-1),以标准曲线计算样品浓度值。
Western blot常规培养HUVECs接种于6孔 板 (每孔5×105个细胞),消癌平注射液 (终质量浓度为5、10和20 mg·mL-1) 处理24 h,设置阴性对照组。收集并裂解细胞,BCA法进行蛋白定量。取30 μg蛋白,经SDS-PAGE凝胶电泳分离后,湿转法将蛋白转印至硝酸纤维素膜上。封闭后,分别用p-VEGFR2、VEGFR2、p-AKT、AKT以及内参β-actin一抗4 ℃孵育过夜,二抗室温孵育1 h,用ECL增强型发光液检测蛋白表达量。
统计学分析各组计量数据采用均数 ± 标准差 (x± s) 表示,用GraphPad Prism5进行单因素方差分析,检验水准α = 0.05,P < 0.05有统计学意义。
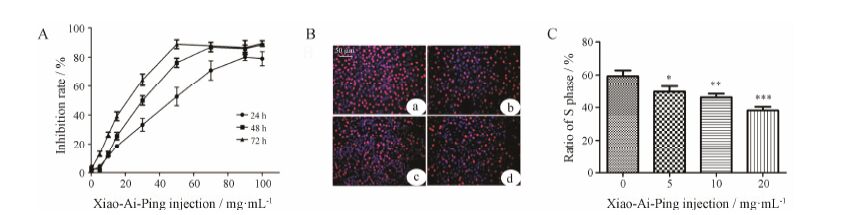
结果 1 消癌平注射液抑制HUVECs增殖CCK8实验检测结果显示,消癌平注射液24、48和72 h对HUVECs的IC50 (mg·mL-1) 值分别为: 48.7 ± 7.14,29.1± 2.25和22.0 ± 4.53 (图 1A)。提示消癌平注射液可剂量和时间依赖性地抑制HUVECs增殖。
|
Figure 1 Effect of Xiao-Ai-Ping injection on HUVECs proliferation. (A) Cells were treated for 24,48 or 72 h with different concentrations of Xiao-Ai-Ping injection,and the viability of HUVECs was measured by CCK8 assay. (B) Cells were treated for 48 h with different concentrations of Xiao-Ai-Ping injection,and DNA synthesis was measured via BrdU incorporation immunofluorescence assay. a: Control; b: Xiao-Ai-Ping injection (5 mg·mL-1); c: Xiao-Ai-Ping injection (10 mg·mL-1); d: Xiao-Ai-Ping injection (20 mg·mL-1). (C) The analysis of the BrdU immunofluorescence assay. The fraction of cells which incorporated BrdU into their DNA (red),out of the total cells whose nuclei were stained with Hoechst 33342 (blue),was quantified. n = 3,x± s. P < 0.05,**P < 0.01,***P < 0.001 vs control |
以2 h内掺入细胞DNA的BrdU比例变化,评价消癌平注射液处理HUVECs后对细胞DNA合成的影响,以反映增殖情况。结果显示,消癌平注射液处理细胞后掺入BrdU的细胞比例下降 (图 1B)。阴性对照组BrdU掺入率为 (59.29 ± 3.51) %,消癌平注射液 (5、10和20 mg·mL-1) 组分别为 (49.62 ± 3.38) %、(46.18 ± 2.20) % 和 (38.19 ± 2.19) %。与阴性对照组相比,消癌平注射液可显著抑制HUVECs的DNA合成和细胞增殖,呈一定的剂量依赖性 (图 1C)。
2 消癌平注射液抑制HUVECs迁移各组细胞在划痕后动态观察24 h,通过比较相同时间内给药组与阴性对照组细胞划痕愈合程度,评价消癌平注射液对HUVECs划痕愈合影响,从而反映其迁移能力变化。结果显示,各组细胞0 h无明显差异; 消癌平注射液各处理组作用细胞24 h后,较阴性对照组划痕愈合变慢。表明消癌平注射液可抑制HUVECs的划痕愈合,并且抑制程度呈现一定的剂量依赖性 (图 2A)。

|
Figure 2 Effect of Xiao-Ai-Ping injection on HUVECs migration. (A) Xiao-Ai-Ping injection inhibited HUVECs migration in wound healing assay. a,b: Control; c,d: Xiao-Ai-Ping injection (5 mg·mL-1); e,f: Xiao-Ai-Ping injection (10 mg·mL-1); g,h: Xiao-Ai-Ping injection (20 mg·mL-1). (B) Xiao-Ai-Ping injecttion suppressed HUVECs migration in transwell assay. The migrated cells were visualized by crystal violet and quantified using Image-Pro Plus 6.0 software. a: Control; b: Xiao-Ai-Ping injection (5 mg·mL-1); c: Xiao-Ai-Ping injection (10 mg·mL-1); d: Xiao-Ai-Ping injection (20 mg·mL-1). (C) The cell migration was quantified by counting migrated cells in five randomly selected fields. n = 3,x± s. **P < 0.01,***P < 0.001 vs control |
药物处理HUVECs,通过计数穿过transwell小室细胞数目,评价消癌平注射液对血清诱导HUVECs迁移的影响。结果显示,消癌平注射液各处理组细胞迁移减少 (图 2B),统计如下: 阴性对照组一个视野内平均细胞数为377 ± 36,消癌平注射液 (5、10和20 mg·mL-1) 组分别为364 ± 25、150 ± 31和120 ± 28。与阴性对照组相比,消癌平注射液 (10和20 mg·mL-1) 组可显著抑制HUVECs迁移 (P < 0.01,P < 0.001) (图 2C)。
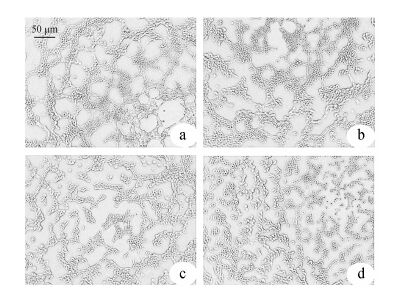
3 消癌平注射液抑制体外HUVECs管腔形成HUVECs在Matrigel基质中生长6 h后,细胞变长呈梭形,向凝胶基质中延伸,呈现线性排列并形成管腔样结构。与阴性对照组相比,消癌平注射液各处理组管腔样结构明显减少,提示消癌平注射液可抑制HUVECs的管腔形成,肉眼观察对管腔形成的抑制作用呈剂量依赖性 (图 3)。
|
Figure 3 Effect of Xiao-Ai-Ping injection on HUVECs tube formation in vitro. HUVECs were placed in the Matrigel coated 96-well plate. After 6 h,the tubular structures were photograghed. a: Control; b: Xiao-Ai-Ping injection (5 mg·mL-1); c: Xiao-Ai-Ping injection (10 mg·mL-1); d: Xiao-Ai-Ping injection (20 mg·mL-1) |
用纤维蛋白胶包埋的动脉环,其内皮细胞能够从动脉段切口处向外生长,形成具有分支结构的微血管结构。观察各组动脉环切口延伸出的微血管样 结构,发现与阴性对照组相比,消癌平注射液 (20和40 mg·mL-1) 组能抑制动脉环切口处微血管样结构生长,其中消癌平注射液40 mg·mL-1组抑制血管生成作用强于阳性药索拉菲尼 (图 4A)。

|
Figure 4 Effect of Xiao-Ai-Ping injection on angiogenesis ex vivo. (A) Representative photograghs of Xiao-Ai-Ping injection on microvessel sprouting. (B) Representative photograghs of Xiao-Ai-Ping injection on new blood vessel formation in chicken chorioallantoic membrane. a: Xiao-Ai-Ping injection (10 mg·mL-1); b: Xiao-Ai-Ping injecttion (20 mg·mL-1); c: Xiao-Ai-Ping injection (40 mg·mL-1); d: Control; e: Sorafenib (10 μmol·L-1). Photographed with a digital camera at 5× magnification |
鸡胚尿囊膜实验是一种离体研究血管生成的实验模型[14],胚胎发育期血管萌发最为活跃。作者通过检测消癌平注射液对鸡胚新生血管生长的抑制作用,研究消癌平注射液的抗肿瘤血管生成作用。结果表明,消癌平注射液 (20和40 mg·mL-1) 组处理后,鸡胚尿囊膜血管生长受到抑制,分支明显减少,血管出现萎缩甚至坏死 (图 4B)。提示消癌平注射液可抑制鸡胚尿囊膜血管生成。
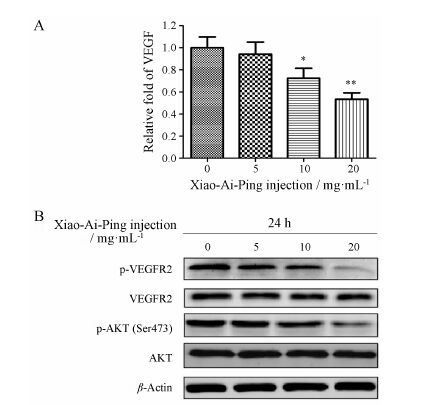
5 消癌平注射液抑制HUVECs中VEGF分泌以及VEGFR2等蛋白表达ELISA统计结果显示,消癌平注射液 (10和20 mg·mL-1) 组处理HUVECs后,VEGF分泌量分别是阴性对照组的 (72.33 ± 9.07) % (P < 0.05) 和 (53.33 ± 5.86) % (P < 0.01),提示消癌平注射液能够抑制HUVECs中VEGF的分泌 (图 5A)。
|
Figure 5 Effect of Xiao-Ai-Ping injection on the secretion of VEGF and the expression of VEGFR2 in HUVECs. (A) Cells were pretreated with different concentrations of Xiao-Ai-Ping injection for 24 h,and supernatant was collected and assayed by ELISA kit. n = 3,x± s. P < 0.05,**P < 0.01 vs control. (B) Cells were treated with different concentrations of Xiao-Ai-Ping injection (0,5,10 and 20 mg·mL-1) for 24 h,and the activation of VEGFR2 and its downstream signaling pathways were analyzed by Western blot |
与阴性对照组相比,消癌平注射液 (5、10和20 mg·mL-1) 各组处理HUVECs后,VEGFR2和AKT表达未见明显变化,但p-VEGFR2和p-AKT表达明显降低,并呈一定的剂量依赖性 (图 5B)。提示消癌平注射液可能通过抑制VEGFR2以及AKT磷酸化,发挥一定的抗血管生成作用。
讨论肿瘤血管生成为肿瘤生长提供氧气和营养物质,同时为癌细胞的浸润与转移提供通道,是肿瘤发生、发展与转移的重要条件[15, 16]。因此,抗肿瘤血管生成作为潜在预防和治疗肿瘤的靶标受到了广泛的关注。研究中发现,许多天然药物及其组分具有预防血管生成作用,同时还可抑制肿瘤生长与转移,可有效预防、控制和治疗肿瘤[3]。
消癌平注射液是中药通关藤干燥藤茎的提取物。现代药理学已证实,其发挥活性的主要成分为酚酸和C-21甾体苷,后者至少包含9种甾体苷单体化合物。其中,通光藤苷C较其他可显著抑制人血液肿瘤细胞Raji、NB4以及K562的增殖[17]。已有研究表明,消癌平注射液可在体外抑制肿瘤细胞增殖、诱导肿瘤细胞分化和凋亡以及引起细胞周期阻滞、逆转常规化疗药物耐药性[6, 7, 8, 9]等,并且在体内可抑制多种动物移植瘤增殖[18]。但消癌平注射液对于血管生成的直接抑制作用尚缺乏研究,因此,本文考察了消癌平注射液对血管生成的直接抑制作用,并对相关机制进行探索。
血管生成是一个复杂、多步骤的过程,主要包括内皮细胞激活、增殖、迁移以及新生血管和脉管网 络重构,是一个涉及多种细胞和多种分子的复杂过程[19]。本实验首先以HUVECs作为体外模型,采用CCK8实验检测了消癌平注射液对HUVECs的增殖抑制作用,发现消癌平注射液可剂量和时间依赖性地抑制HUVECs增殖。根据以上实验结果,选取无毒剂量 (5~20 mg·mL-1) 检测消癌平注射液对HUVECs迁移能力和DNA合成影响,发现消癌平注射液作用后HUVECs迁移和DNA合成均减少。随后采用HUVEC管腔形成实验、大鼠动脉环出芽实验以及鸡胚尿囊膜实验 (10~40 mg·mL-1) 分别从体外和离体水平验证了消癌平注射液对血管生成的抑制作用,此处药物浓度 (10~40 mg·mL-1) 较细胞水平所用浓度并不十分一致,考虑到药物在器官水平和细胞水平的作用不一致。
肿瘤血管生成受多种促 (和抑) 血管生成因子共同调控,其中,VEGF家族在肿瘤血管生成过程中起着关键调控作用[20],可由多种细胞包括成纤维细胞、内皮细胞、炎性细胞以及多种肿瘤细胞等分泌产生,该家族主要包括VEGF (VEGF-A)、胎盘生长因子 (PIGF)、VEGFB、VEGFC和VEGFD,其中VEGF在促进血管生成中发挥主要作用,研究也最为广泛[21, 22, 23]。其有3种受体分别为VEGFR1、VEGFR2和VEGFR3,VEGF与VEGFR2结合可诱导血管生成,VEGFR1可负性调控二者结合,VEGFR3究竟发挥何种作用尚不明确[24]。因此,在抗血管生成机制研究中对于靶向VEGF/ VEGFR2更为关注。已有研究显示,VEGF与其受体VEGFR2结合后,可介导下游PI3K/AKT/mTOR[2]以及MAPK信号通路[25]激活促进内皮细胞募集和增殖。为了考察消癌平注射液抗血管生成可能的分子机制,本文采用ELISA酶联免疫吸附实验和Western blot检测了HUVECs中VEGF的分泌情况以及VEGFR2及其下游信号通路的激活情况,提示消癌平注射液抗血管生成作用可能与抑制HUVECs中VEGF分泌、阻断VEGFR2以及下游信号分子AKT活化相关。
综上所述,消癌平注射液可在体外和离体水平抑制血管生成,其发挥抑制血管生成作用可能与抑制VEGF/VEGFR2及其下游AKT信号通路的磷酸化有关。该研究为中药消癌平注射液发挥抗肿瘤血管生成作用,提供了一定的理论依据,后期研究应加强药物对动物移植瘤以及移植瘤血管形成的相关研究,进一步为消癌平注射液抗血管生成、从而发挥预防和治疗肿瘤提供更为直接的依据。
| [1] | Gupta MK, Qin RY. Mechanism and its regulation of tu-mor-induced angiogenesis[J]. World J Gastroenterol, 2003, 9:1144-1155. |
| [2] | Park SH, Kim BR, Lee JH, et al. GABARBP down-regulates HIF-1α expression through the VEGFR-2 and PI3K/mTOR/4E-BP1 pathways[J]. Cell Signal, 2014, 26:1506-1513. |
| [3] | Wang Z, Dabrosin C, Yin X, et al. Broad targeting of angio-genesis for cancer prevention and therapy[J]. Semin Cancer Biol, 2015, 35 Suppl:S224-S243. |
| [4] | Fan W, Sun L, Zhou JQ, et al. Marsdenia tenacissima ex-tract induces G0/G1 cell cycle arrest in human esophageal carcinoma cells by inhibiting mitogen-activated protein kinase (MAPK) signaling pathway[J]. Chin J Nat Med, 2015, 13:428-437. |
| [5] | Lin Q, Rong JY. Clinical observation of Xiaoaiping injec-tion combined with mFOLFOX6 regimen on the treatment of advanced esophageal cancer[J]. Guangxi Med J (广西医学), 2013, 35:912-913, 916. |
| [6] | Zhang MZ, He Z, Wu GY, et al. Effect of Xiaoaiping injection on Ec-9706 cell line[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2008, 19:1182-1184. |
| [7] | Li D, Ouyang J, Li CP, et al. Preliminary study on effects of Xiaoaiping injection on NB4 cells[J]. Chin J Biochem Pharm (中国生化药物杂志), 2007, 28:247-250. |
| [8] | Koumtebaye E, Su N, Hu WF, et al. Antitumor activity of Xiaoaiping injection on human gastric cancer SGC-7901 cells[J]. Chin J Nat Med, 2012, 10:339-346. |
| [9] | Han SY, Zhao MB, Zhuang GB, et al. Marsdenia tenacis-sima extract restored gefitinib sensitivity in resistant non-small cell lung cancer cells[J]. Lung Cancer, 2012, 75:30-37. |
| [10] | Wang ZL, Fan QX, Fan KS. Clinical study of Xiaoaiping in the treatment of cancer[J]. J Henan Med Univ (河南医科大学学报), 1994, 29:79-80. |
| [11] | Hanahan D, Weinberg RA. Hallmarks of cancer:the next generation[J]. Cell, 2011, 144:646-674. |
| [12] | Potente M, Gerhardt H, Carmeliet P. Basic and therapeutic aspects of angiogenesis[J]. Cell, 2011, 146:873-887. |
| [13] | Risau W. Mechanisms of angiogenesis[J]. Nature, 1997, 386:671-674. |
| [14] | Ribatti D. Chicken chorioallantoic membrane angiogenesis model[J]. Methods Mol Biol, 2012, 843:47-57. |
| [15] | Folkman J. Seminars in medicine of the Beth Israel Hospi-tal, Boston. Clinical applications of research on angiogenesis[J]. N Eng J Med, 1995, 333:1757-1763. |
| [16] | Folkman J, Shing Y. Angiogenesis[J]. J Biol Chem, 1992, 267:10931-10934. |
| [17] | Xue HL, Huang XD, He D, et al. Effects of Marsdenia tenacissima extract on proliferation and apoptosis of hema-tologic neoplasm cell line cells[J]. J Sichuan Univ (四川大学学报), 2012, 43:174-179. |
| [18] | Li D, Li C, Song Y, et al. Marsdenia tenacssima extract and its functional components inhibits proliferation and induces apoptosis of human Burkitt leukemia/lymphoma cells in vitro and in vivo[J]. Leuk Lymphoma, 2015, 18:1-10. |
| [19] | Weis S, Cheresh DA. Tumor angiogenesis:molecular pathways and therapeutic targets[J]. Nat Med, 2011, 17:1359-1370. |
| [20] | Hicklin DJ, Ellis LM. Role of the vascular endothelial growth factor pathway in tumor growth and angiogenesis[J]. J Clin Oncol, 2005, 23:1011-1027. |
| [21] | Ferrara N. Role of vascular endothelial growth factor in physiologic and pathologic angiogenesis:therapeutic implica-tions[J]. Semin Oncol, 2002, 29:10-14. |
| [22] | Ferrara N, Gerber HP, LeCouter J. The biology of VEGF and its receptors[J]. Nat Med, 2003, 9:669-676. |
| [23] | Shibuya M, Claesson-Welsh L. Signal transduction by VEGF receptors in regulation of angiogenesis and lymphan-giogenesis[J]. Exp Cell Res, 2006, 312:549-560. |
| [24] | Sia D, Alsinet C, Newell P, et al. VEGF signaling in cancer treatment[J]. Curr Pharm Des, 2014, 20:2834-2842. |
| [25] | Matsumoto T, Mugishima H. Signal transduction via vas-cular endothelial growth factor (VEGF) receptors and their roles in atherogenesis[J]. J Atheroscler Thromb, 2006, 13:130-135. |
 2016, Vol. 51
2016, Vol. 51


