虽然分子靶向药物能够清除部分肿瘤细胞,为癌症患者带来益处,但并不能达到终身治愈,这是因为肿瘤诱导的免疫抑制能够促进肿瘤生长、侵袭及 远端转移,是限制机体抗肿瘤免疫应答的关键因 素[1, 2, 3]。肿瘤免疫抑制机制包括抑制性受体-配体的作用 [programmed death-1 (PD-1) 和programmed death ligand-1 (PD-L1) 等]、免疫抑制细胞因子 [interleukin 10 (IL-10) 和transforming growth factor-β (TGF-β) 等] 以及肿瘤免疫抑制细胞 [骨髓来源的抑制性细胞 (myeloid derived suppressor cell,MDSC)、调节性T细胞 (regulatory T cells,Treg) 和肿瘤相关巨噬细胞 (tumor associated macrophage,TAM) 等][4, 5, 6, 7]。MDSC是来源于髓系、未成熟的多种细胞群体的统称,包括髓系前体细胞、未成熟的粒细胞、单核巨噬细胞和树突状细胞等,对T细胞具有强烈的抑制作用[8]。MDSC约占髓系细胞的1%~5%,其中约1/3可在细胞因子的刺激下分化为成熟的髓系细胞,对免疫系统发挥正常功能具有重要的调节作用。但在癌症等疾病中,未成熟的髓系细胞的正常分化途径被扰乱,导致病理状态MDSC的大量产生。MDSC可通过多种机制影响机体固有免疫应答和适应性免疫应答,包括抑制NK细胞的细胞毒活性[9],抑制树突状细胞 (dendritic cell,DC) 和巨噬细胞的分化[10],诱导Treg细胞的产生和扩增等[11]。MDSC还可通过上调精氨酸酶、一氧化氮合酶和活性氧物质的表达来抑制CD8+ T淋巴细胞的功能。因此,阻断MDSC的形成,减少由MDSC参与的肿瘤免疫抑制有可能成为增强机体抗肿瘤免疫应答的有效手段。
小鼠外周血中的MDSC按照表面标志物可分为两类不同的细胞亚群,一类为CD11b+Ly6G-Ly6Chi,其具有单核细胞的形态,被称为M-MDSC,另一类为CD11b+Ly6G+Ly6CLow的细胞亚群,其具有粒细胞的形态,被称为G-MDSC[12]。而脾脏中主要是单核细胞来源的MDSC。MDSC还带有与其他髓系来源的细胞相同的表面标志物,这些标志物缺乏特异性,因此很难用单一的标志物将MDSC与其他髓系来源的免疫细胞如巨噬细胞和DC等进行区分,这些标志物也不适合作为肿瘤治疗的靶标[13]。2014年,Qin等[14]设计了一个peptibody,可完全清除荷瘤小鼠体内两种亚群的MDSC细胞,他们的研究发现该peptibody可作用于MDSC细胞表面的S100A8蛋白,该研究提示了S100A8可作为MDSC治疗的候选靶点。
S100A8属于钙结合蛋白S100蛋白家族,其表 达于粒细胞和单核细胞等髓系来源的细胞[15/a>, 16]。在 炎症相关的病理条件及胃癌、食道癌等多种癌症中,S100A8均呈现显著的上调表达[17, 18]。最近的研究[19]也表明S100A8在肿瘤部位MDSC的产生和招募过 程中扮演着非常重要的角色。在正常情况下,S100A8以及其他S100蛋白家族蛋白为胞内蛋白。但是在炎症和肿瘤的刺激下,MDSC能够将S100A8释放到胞外作为炎症信号。因而S100A8可以作为肿瘤诱导的MDSC细胞表面标志物而用于靶向药物设计。
霍乱毒素 (cholera toxin,CT) 由A亚基(CTA) 及一个五聚化的B亚基 (CTB) 组成,CTB能够与大多数哺乳动物细胞表面的神经节苷脂GM1特异性结合,可促进与其连接抗原蛋白通过黏膜屏障,同时增强抗原被DC等抗原提呈细胞的提呈作用[20, 21],因此CTB是一个良好的载体蛋白。
本文以CTB为载体蛋白构建了一个五聚化的CTB-S100A8多肽疫苗。该疫苗在4T1小鼠乳腺癌肿瘤模型中显示出显著的抗肿瘤保护效果,它产生的抗体能够消除肿瘤诱导的MDSC,同时对机体固有的髓系来源细胞 (如DC和巨噬细胞) 无显著影响,本研究提示消除MDSC是抗肿瘤的一个有效途径。
材料与方法 质粒、菌株及试剂大肠杆菌分泌表达载体pCTB2 (将CTB基因装载至pSJF2载体形成pCTB2质粒) 及表达菌株TG1由江苏省中医药研究院细胞与分子生物学实验室曹鹏博士惠赠; 质粒pET28a- S100A8 (上海捷瑞生物工程有限公司)。E coli TG1感受态细胞由本实验室制备及保存,E coli Top10感受态细胞、E coli BL21 (DE3) 感受态细胞及DNA分子量标准 (天根生化公司); 蛋白分子量标准 (Thermo公司)。ClonExpress II One Step Cloning Kit (Vazyme公司); BspEI及BamHI内切酶 (NEB公司)。酪蛋白水解物 (casin hydrolyate) (Fluka公司); 凝胶回收及质粒小提试剂盒 (Axygen公司)。流式抗体CD11b- FITC、Gr-1-APC、F4/80、CD11c-PE、CD86-FITC及Fcγ R III/II (BD公司),其他试剂均为国产或进口分析纯试剂。
实验动物及细胞株SPF级6周龄雌性BALB/c小鼠购自上海实验动物中心,体重 (20 ± 1) g,许可证号: SCXK (沪) 2012-0002。小鼠均采用标准的啮齿类动物饲料进行喂养,所有相关动物实验的操作严格按照《实验动物管理条例》进行。小鼠乳腺癌4T1细胞株购自中科院上海细胞库,接种于含10% 胎牛血清的RPMI 1640培养基中,37 ℃、5% CO2培养箱中培养。
引物设计与基因合成S100A8 (基因序列号P27005) 序列由上海捷瑞生物工程有限公司合成并装载至pET28a载体中,引物由南京金斯瑞生物科技有限公司合成。引物序列如表 1。
|
|
Table 1 Primers used for the construction of CTB-S100A8. The underlined nucleotides are BspEI and BamHI restriction sites |
以pET28a-S100A8为模板,S100A8-F/R为引物扩增S100A8 (267 bp) 片段,反应体系为50 μL,条件为95 ℃预变性3 min,95 ℃变性30 s、60 ℃退火30 s、68 ℃延伸25 s,共进行35次循环,最后68 ℃延伸5 min。PCR产物进行1% 琼脂糖凝胶电泳检测 (120 V、25 min),按照Axygen凝胶回收试剂盒标准操作回收。将pCTB2质粒,用BamHI及BspEI内切酶进行线性化,酶切产物进行1% 琼脂糖凝胶电泳检测 (120 V、25 min),按照Axygen凝胶回收试剂盒标准操作回收。PCR获得的S100A8片 段,通过同源重组法将其整合至线性化质粒pCTB2的BamHI及BspEI酶切位点之间 (反应体系20 μL,含ExnaseTmII 2 μL、5×CE II buffer 4 μL、线性化质粒50~200 ng和插入片段扩增产物20~200 ng,反应 体系不足20 μL以ddH2O补足; 所有组分轻柔混匀,37 ℃孵育30 min,然后立即置于冰上5 min备用)。取反应液2 μL加入到E coli Top10感受态细胞50 μL中,冰浴30 min、42 ℃热激90 s,立即置于冰上5 min,然后加入LB无抗性培养基600 μL,37 ℃、180 r·min-1振摇复苏1 h,取300 μL涂布LB固体平板 (Amp 100 μg·mL-1),37 ℃倒置培养过夜并挑取单克隆培养。PCR鉴定为阳性 (PCR条件和电泳检测方法如前) 的单克隆送南京金斯瑞生物科技有限公司测序。
以测序正确的CTB-S100A8质粒为模板,Mutation-F/R为引物进行PCR扩增,将CTB与S100A8之间的Linker进行突变。PCR反应体系50 μL,条件为95 ℃预变性5 min,95 ℃变性1 min、55 ℃退火 1 min、68 ℃延伸5 min,共进行35次循环,最后68 ℃延伸10 min。PCR产物进行1% 琼脂糖凝胶电泳检 测 (120 V、25 min),按照Axygen凝胶回收试剂盒标准操作回收。DPN I酶消化胶回收产物 (反应体系 50 μL: DPN I酶1 μL、10×NEB buffer 4 5 μL,总体积不足50 μL以ddH2O补足; 37 ℃孵育120 min,80 ℃ 变性20 min备用)。取消化液2 μL转化E coli Top10感受态细胞,反应体系及条件如前,挑取转化后平板上长出的单克隆于3 mL LB(Amp 100 μg·mL-1) 培养基中,37 ℃、180 r·min-1振摇培养过夜。将过夜菌送南京金斯瑞生物科技有限公司测序,重组质粒命名为pCTB2-S100A8。
重组蛋白的诱导表达取pCTB2及测序正确的pCTB2-S100A8质粒各1 μL,加入到E coli TG1感受态细胞50 μL中,冰浴30 min、42 ℃热激90 s,立即置于冰上5 min,然后加入LB无抗性培养基600 μL,37 ℃、180 r·min-1振摇复苏1 h,取300 μL涂布LB固体平板,37 ℃倒置培养过夜至单克隆长出。挑取单克隆于25 mL LB培养基 (Amp 100 μg·mL-1) 中,37 ℃、180 r·min-1振摇培养过夜。将过夜菌按1∶500转接至1 LM9培养基 (Amp 100 μg·mL-1),28 ℃、200 r·min-1振摇培养30 h,然后加入1 mol·L-1 IPTG 100 μL和10×TB培养基100 mL,28 ℃、200 r·min-1振摇培养65~70 h,8 000 r·min-1室温离心5 min收集菌体并称重。
重组蛋白的纯化每1 g菌体充分重悬于上样 缓冲液10 mL中 (500 mmol·L-1 NaCl,20 mmol·L-1 Tris,20 mmol·L-1 imidazole,pH 8.0),超声破碎仪 破碎重悬液 (功率 8%~10%,30 min)。4 ℃、12 000 r·min-1离心30 min后取上清液备用。Ni柱平衡 (500 mmol·L-1 NaCl,20 mmol·L-1 Tris,20 mmol·L-1 imidazole,pH 8.0) 后以2 mL·min-1流速上样,杂蛋白洗脱液 (500 mmol·L-1 NaCl,20 mmol·L-1 Tris,50 mmol·L-1 imidazole,pH 8.0) 冲洗20个柱体积,靶蛋白洗脱液 (500 mmol·L-1 NaCl,20 mmol·L-1 Tris,500 mmol·L-1 imidazole,pH 8.0) 洗脱,收集洗脱峰。G25分子筛采用10 mmol·L-1 PBS (pH 7.4) 平衡后,将洗脱峰过G25分子筛,收集流穿峰。流穿峰采用 3 kDa超滤管超滤后,加入还原/非还原上样缓冲液 进行SDS-PAGE电泳 (分离胶浓度12%、电压120 V、电泳时间约80 min、蛋白胶的制备及Running buffer配制参考Bio-Rad标准配方),BCA定量检测蛋白纯度及浓度。
单结构域蛋白的表达与纯化取pET28a-S100A8质粒1 μL加入E coli BL21 (DE3) 感受态细胞50 μL中,热激法转化,操作步骤如前,取转化液300 μL 涂布Amp平板(Amp 100 μg·mL-1),37 ℃倒置过夜 培养至单克隆长出。挑取单克隆于3 mL LB (Amp 100 μg·mL-1) 培养基中,37 ℃,200 r·min-1振摇过 夜。将过夜菌按1∶500转接至LB培养基 (Amp 100 μg·mL-1) 1 L中,37 ℃、200 r·min-1振摇培养至OD600介于0.6到0.8之间,加入1 mol·L-1 IPTG 1 mL,20 ℃、180 r·min-1振摇培养20 h。8 000 r·min-1、室温离心5 min收集菌体,称重。
每1 g菌体充分重悬于上样缓冲液20 mL中,超声破碎仪破碎重悬液 (功率1%,20 min)。4 ℃,12 000 r·min-1离心30 min后取上清液备用。Ni柱纯化后洗脱峰用G25分子筛进行脱盐,脱盐后流穿峰用3 kDa超滤管超滤,SDS-PAGE电泳及BCA定量检测蛋白浓度及纯度,操作方法如前。
免疫BALB/c小鼠及肿瘤接种30只BALB/c小鼠随机分成5组,分别为PBS组、alumiunm hydroxide (alum) 佐剂组、CTB组、S100A8组及CTB-S100A8组。第0、12天进行皮下免疫,注射剂量为50 μg (400 μL) 抗原/只/次,5组均辅以alumiunm hydroxide 325 μg·(20 g)-1。第17天进行眼眶静脉采血,将血样室温静置2 h至血浆沉淀、血清完全析出,4 ℃,4 000 r·min-1离心20 min,取血清储存于 -70 ℃。第20天接种4T1肿瘤细胞,接种剂量为1×105个 (100 μL,10 mmol·L-1 pH 7.0的PBS稀释)。第25天进行第3次皮下免疫,剂量方法如前,计算肿瘤抑制率 = [1 - (治疗组当天肿瘤体积 - 治疗组出瘤第1天体积) / (alum佐剂对照组当天肿瘤体积 - alum佐剂对照组出瘤第 1天体积)] × 100%。接瘤第7天后,小鼠出瘤后每隔两天测量一次瘤体大小,第49天采集小鼠肿瘤及血液样本,称量小鼠瘤重和体重。所有统计数据均采用Graphpad Prism5.0软件进行统计分析,并制图。本实验采用t检验对数据差异显著性进行分析,P < 0.05表示有显著性差异。
ELISA法检测血清抗体浓度用50 mmol·L-1碳酸盐缓冲液 (pH 9.6) 稀释S100A8单结构域蛋白至10 μg·mL-1,包被96孔培养皿,每孔100 μL,4 ℃孵育过夜。0.1% PBST洗涤6次,3% BSA 37 ℃封闭 2 h,0.1% PBST洗涤6次,封闭液1∶100稀释血清,每孔包被100 μL,4 ℃孵育过夜。0.1% PBST洗涤6次,HRP-rabbit-anti-mouse IgG用封闭液1∶5 000稀释,每孔包被100 μL,37 ℃孵育1 h,0.1% PBST洗涤12次后TMB/H2O2室温显色20 min,2 mol·L-1硫酸100 μL终止反应。采用双波长法于酶标仪上读取数据OD450和OD630,实验组血清OD450-OD630大于正常组2.1倍确认为抗体阳性。
ELISA法检测血清抗体滴度各组取OD450- OD630读数介于中间值的样本检测抗体滴度。S100A8包被、洗涤和封闭如上操作。血清用封闭液倍比稀释如下倍数: 100×20、100×21、100×22、……、100×210,每孔包被100 μL,4 ℃孵育过夜。二抗孵育、洗涤及显色反应如上操作,采用双波长法于酶标仪上读取数据OD450和OD630,根据OD450-OD630读数计算各组抗体滴度。
流式细胞术检测细胞含量第17及49天,在超净台中分离小鼠脾脏,将脾脏放入盛有10 mmol·L-1 PBS (pH 7.4) 2 mL的小皿中,无菌镊子夹碎,细胞 悬液采用细胞筛进行过滤,过滤后的脾脏细胞悬浊液1 500 r·min-1离心5 min,并加入上述PBS重悬洗涤2次,外周血则直接离心。在脾脏细胞悬液和外周血细胞加入3~5倍细胞体积的红细胞裂解液,轻轻吹打混匀,室温裂解1~2 min。4 ℃、2 000 r·min-1离心5 min,弃上清液。离心后的细胞沉淀加入适量上述PBS重悬并洗涤2次。
将上述制备好的细胞用流式缓冲液重悬,稀释细胞为每毫升5×106个细胞,分成2组进行流式染 色,每支流式检测管中加入细胞悬液100 μL,分组如下: ① CD11b-FITC,Gr-1-APC,F4/80; ② CD11c-PE,CD86-FITC。每管均加入Fcγ R III/II抗体1 μL,轻柔混匀并在冰上孵育10 min,然后每管加入上述PBS 2 mL洗涤2次。流式缓冲液重悬细胞,在每个流式检测管中加入对应的荧光标记抗体,然后各管避光孵育30 min,如上重复洗涤2次,最后加入500 μL流式缓冲液,充分重悬细胞,上机检测。本实验采用One-way ANOVA (and nonparametric) and Tukey test统计,P < 0.05表示有显著性差异。
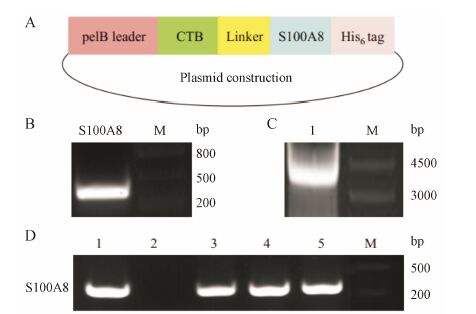
结果 1 CTB-S100A8表达载体的构建重组CTB-S100A8表达质粒的构建如图 1A所 示,Linker的序列为GGGGS,长度为20个氨基酸残基。pelB leader序列可引导重组蛋白分泌至大肠杆菌周质腔,His6-tag序列为蛋白纯化标签。如图 1B所示,S100A8的PCR片段大小为267 bp。进一步利用重组的pCTB2-S100A8质粒为模板设计linker突变引物 进行PCR扩环后得到的重组质粒大小为4 000 bp左右 (图 1C)。利用扩增S100A8的PCR引物对pCTB2- S100A8重组子进行菌落PCR鉴定发现,所挑取的4个克隆中,1、3、4号克隆扩增出了S100A8片段为阳性克隆 (图 1D)。经测序验证,3个阳性克隆的序列均与预期一致。
|
Figure 1 Expression plasmid construction of CTB-S100A8. A: Construction of His6-tagged CTB-S100A8 expression vector,pCTB2-S100A8. pelB leader is the leader sequence of the secretory expression vector. B: PCR of S100A8. C: Linker mutation PCR. D: Monoclonal colony PCR of recombinant vector pCTB2-S100A8,lane 1- 4: Monoclonal colony; lane 5: Positive control. The molecular mass (bp) on the right of the gel |
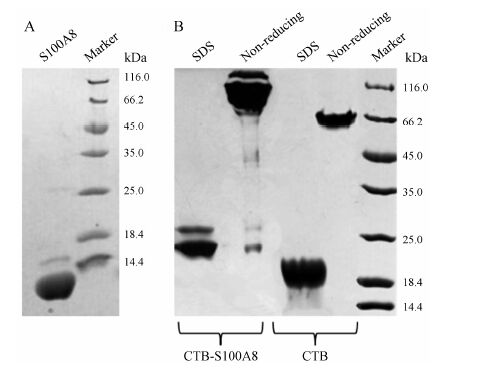
表达载体转化至BL21菌株进行表达,Ni柱亲和纯化,得到大小约为12 kDa的S100A8单结构域蛋白,SDS-PAGE电泳检测蛋白纯度大于90% (图 2A)。CTB及CTB-S100A8在TG1宿主菌进行培养表达,采用Ni柱进行亲和纯化,获得纯度大于90% 的重组蛋白 (图 2B)。使用变性还原及变性非还原两种上样缓冲液进行SDS-PAGE检测重组蛋白是否具有多聚体形态。结果显示,亲和纯化得到CTB蛋白能形成五聚体,将CTB融合S100A8表达时,重组蛋白仍能保持形成五聚体的特性 (图 2B)。
|
Figure 2 Purification and identification of CTB,S100A8 and CTB-S100A8. A: SDS-PAGE analysis of the expression of S100A8 under reducing condition. B: SDS-PAGE analysis of the production of recombinant CTB and CTB-S100A8 pentamer. To detect the pentameric CTB and CTB-S100A8,the purified proteins were mixed with 4× non-reducing sample buffer and directly loaded onto the gel without heating |
以S100A8单结构域蛋白包被,将第二次免疫后的血清作为一抗,进行ELISA测定。ELISA结果显示S100A8及CTB-S100A8组都能产生均一的针对S100A8的阳性抗体 (图 3A)。测定各组抗体滴度,结果显示,CTB-S100A8的抗体滴度高达25 600,是 CTB免疫组的8倍,是S100A8单结构域组的16倍。说明五聚化的CTB能够增加抗原尺寸,增强免疫反应,是良好的多肽疫苗载体蛋白。

|
Figure 3 Antibody specificity analysis by ELISA. A: Results shown recombinant peptide responses from pooled mouse sera obtained 5 days after the second immunization,as assessed by ELISA. n = 6,x± s. ***P < 0.001. B: Anti-S100A8 titers after the second immunization,the mouse with average OD450- OD630 readings in each group were detected. n = 5 mice,repeat 3 times |
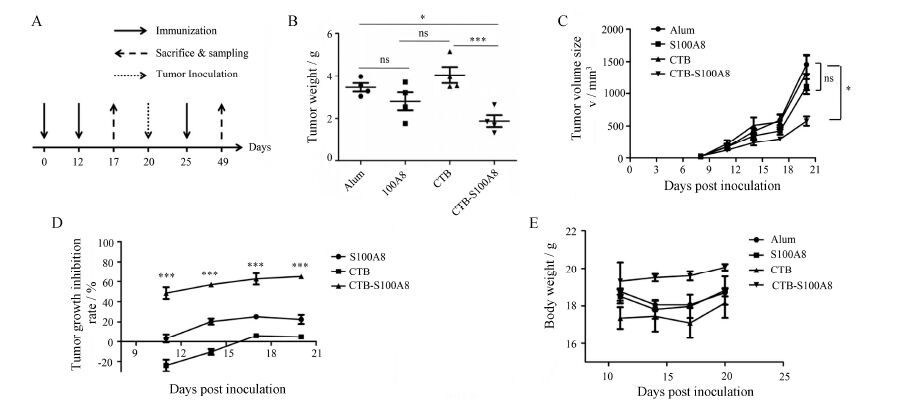
按图 4A所示对小鼠进行免疫、样本采集及肿 瘤接种。CTB-S100A8免疫后小鼠肿瘤平均重量为1.88 g,显著低于CTB组 (P < 0.001) 及alum佐剂组 (P < 0.05) (图 4B),显示CTB-S100A8具有显著的肿瘤保护效果。图 4C的结果提示,在接种肿瘤21天时各组肿瘤大小有显著性差异。其中相对于佐剂对照组CTB-S100A8的肿瘤抑制率在接种肿瘤15天后就达到了50%。第21天CTB-S100A8免疫组的肿瘤抑制率接近60% (图 4D)。
|
Figure 4 Tumor protective efficacy of CTB-S100A8 on 4T1 tumor-bearing mice. A: Vaccination schedule,mice got 3 immunizations on day 0,12 and 25. Mice after 2 immunization were given inoculations with 4T1 cells on day 20. B: Weight statistics of separated tumors after sacrifice. n = 4,x± s. P < 0.05,***P < 0.001. C: Inhibition of 4T1 tumor growth in BALB/c mice following tumor inoculation every 3 days. D: Inhibition rate statistics of 4T1 tumor growth in BALB/c mice following tumor inoculation every 3 days. ***P < 0.001 vs alum group. E: The body weight change for each group was determined every 3 days during the delivery period. n = 5,repeat 3 times |
获取第二次免疫后第5天小鼠外周血及脾脏白细胞,用流式细胞术分析其中主要髓系来源的免疫细胞的变化,结果发现,各免疫组对小鼠脾脏及外周血中的DC、巨噬细胞及MDSC的两种亚群均没有显著的影响 (P > 0.05),见图 5。

|
Figure 5 Effect of CTB-S100A8 on dendritic cell (DC),macrophage and MDSCs in splenocyte and periphera blood leucocyte after the second vaccination. A: Percentage of macrophage among splenocytes in each group. B: Percentage of macrophage among periphera blood leucocytes. Frequencies of DC among splenocytes and periphera blood leucocytes are shown as percentage of C and D. E: Percentage of G-MDSC (CD11b+Gr-1high) among periphera blood leucocytes. F: Percentage of M-MDSC (CD11b+Gr-1int) among periphera blood leucocytes. G: Percentage of MDSC among splenocyte |
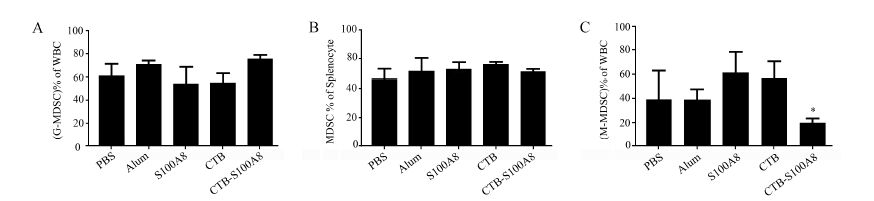
小鼠外周血中存在两种MDSC,而脾脏中则只有一种MDSC。流式分析4T1荷瘤小鼠的脾脏及外周血细胞中MDSC的数量,结果如图 6所示,经CTB- S100A8免疫后的小鼠外周血中,经肿瘤诱导的M- MDSC的数量显著降低 (P < 0.05),而G-MDSC无显著性变化。脾脏中的MDSC数量也无显著变化。
|
Figure 6 Effect of CTB-S100A8 on MDSCs in splenocyte and periphera blood leucocyte of tumor-bearing mice. A: Percentage of G-MDSC in periphera blood leucocyte in each group. B: Percentage of total MDSC in splenocyte in each group. C: Statistics on the percentage of M-MDSC among periphera blood leucocytes. Periphera blood and spleen were removed from tumor-bearing mice in different groups after sacrifice. n = 3,x± s,repeat 3 times. P < 0.05 vs PBS and alum group |
MDSC是最重要的肿瘤诱导的免疫抑制细胞之一,MDSC表面同时高表达精氨酸酶和一氧化氮合 酶,从多个方面影响T细胞的活化,包括: 降低TCR CD3ζ链的表达[22]; 阻止细胞周期素D3及细胞周期素依赖激酶4 (CDK4) 的上调等[23]。在MDSC与T细胞的直接接触中,由MDSC产生的过氧亚硝基能够导致TCR和CD8分子的硝化,改变分子结构,使T细胞对特异性抗原的刺激无应答[24, 25]。因此,MDSC的存在正是抗肿瘤疫苗等治疗方法无法引起免疫应答的重要原因[26]。虽然吉西他滨等化疗药物在动物模型上显示出对脾脏中MDSC具有一定的抑制作用[27],但由于MDSC缺乏特异性的细胞表面标志物,目前还没有出现特异性靶向MDSC的药物或单抗[28]。
CTB能够形成一个非共价五聚体。该五聚体能够与黏膜层的GM1受体结合,从而激发强烈的免疫应答。因而是一个良好的疫苗载体蛋白或佐剂。本文利用融合表达技术率先设计了一种靶向S100A8的多肽疫苗CTB-S100A8,该重组多肽疫苗保留了CTB可形成五聚体的特性,在BALB/c小鼠中能有效打破自身免疫耐受,产生高滴度的抗S100A8的抗体。这表明与CTB融合后能显著增强S100A9的免疫原性。
该多肽疫苗在4T1乳腺癌荷瘤小鼠模型中具有显著的肿瘤保护效果,同时,其免疫正常小鼠后对机体几种髓系来源的免疫细胞,如M-MDSC、G-MDSC、DC及巨噬细胞等的数量无显著影响。而在荷瘤小鼠体内,CTB-S100A8免疫组中的M-MDSC含量显著 低于其他组。这可能是由于在髓系前体细胞向DC或巨噬细胞正常分化的过程中,S100A8的表达是下调的,而肿瘤分泌的细胞因子能够促进髓系前体细胞中STAT-3途径依赖的S100A8表达上调,从而导致大量MDSC的募集[16]。此外,在炎症和肿瘤的刺激下,MDSC能够将S100A8/S100A9这些胞内蛋白释放到胞外,成为细胞表面标志物而被抗体识别。
本研究表明通过重组疫苗技术消除荷瘤小鼠体内肿瘤诱导的MDSC将是一个有效的抗肿瘤途径。本研究可为靶向肿瘤免疫环境的疫苗设计提供借鉴。
| [1] | Hu HX, Wang XQ, Zhang H, et al. Mechanism and clinical progress of molecular targeted cancer therapy[J]. Acta Pharm Sin (药学学报), 2015, 50:1232-1239. |
| [2] | Duraiswamy J, Kaluza KM, Freeman GJ, et al. Dual block-ade of PD-1 and CTLA-4 combined with tumor vaccine effectively restores T-Cell rejection function in tumors[J]. Cancer Res, 2013, 73:3591-3603. |
| [3] | Mittal D, Gubin MM, Schreiber RD, et al. New insights into cancer immunoediting and its three component phases-elimination, equilibrium and escape[J]. Curr Opin Immunol, 2014, 27:16-25. |
| [4] | Motz GT, Coukos G. Deciphering and reversing tumor immune suppression[J]. Immunity, 2013, 39:61-73. |
| [5] | Reynolds J, Sando GS, Marsh OB, et al. Stimulation of the PD-1/PDL-1 T-cell co-inhibitory pathway is effective in treatment of experimental autoimmune glomerulonephritis[J]. Nephrol Dial Transplant, 2012, 27:1343-1350. |
| [6] | Liston A, Gray DH. Homeostatic control of regulatory T cell diversity[J]. Nat Rev Immunol, 2014, 14:154-165. |
| [7] | Görgün GT, Whitehill G, Anderson JL, et al. Tumor-promoting immune-suppressive myeloid-derived suppressor cells in the multiple myeloma microenvironment in humans[J]. Blood, 2013, 121:2975-2987. |
| [8] | Gabrilovich DI, Nagaraj S. Myeloid-derived suppressor cells as regulators of the immune system[J]. Nat Rev Immunol, 2009, 9:162-174. |
| [9] | Liu C, Yu S, Kappes J, et al. Expansion of spleen myeloid suppressor cells represses NK cell cytotoxicity in tumor-bearing host[J]. Blood, 2007, 109:4336-4342. |
| [10] | Kusmartsev S, Gabrilovich DI. STAT1 signaling regulates tumor-associated macrophage-mediated T cell deletion[J]. J immunol, 2005, 174:4880-4891. |
| [11] | Serafini P, Mgebroff S, Noonan K, et al. Myeloid-derived suppressor cells promote cross-tolerance in B-cell lymphoma by expanding regulatory T cells[J]. Cancer Res, 2008, 68:5439-5449. |
| [12] | Hestdal K, Ruscetti FW, Ihle JN, et al. Characterization and regulation of RB6-8C5 antigen expression on murine bone marrow cells[J]. J Immunol, 1991, 147:22-28. |
| [13] | Gabrilovich DI, Ostrand-Rosenberg S, Bronte V. Coor-dinated regulation of myeloid cells by tumours[J]. Nat Rev Immunol, 2012, 12:253-268. |
| [14] | Qin H, Lerman B, Sakamaki I, et al. Generation of a new therapeutic peptide that depletes myeloid-derived suppressor cells in tumor-bearing mice[J]. Nat Med, 2014, 20:676-681. |
| [15] | Roth J, Vogl T, Sorg C, et al. Phagocyte-specific S100 proteins:a novel group of proinflammatory molecules[J]. Trends Immunol, 2003, 24:155-158. |
| [16] | Sinha P, Okoro C, Foell D, et al. Proinflammatory S100 pro-teins regulate the accumulation of myeloid-derived sup-pressor cells[J]. J Immunol, 2008, 181:4666-4675. |
| [17] | Gebhardt C, Németh J, Angel P, et al. S100A8 and S100A9 in inflammation and cancer[J]. Biochem Pharmacol, 2006, 72:1622-1631. |
| [18] | Salama I, Malone PS, Mihaimeed F, et al. A review of the S100 proteins in cancer[J]. Eur J Surg Oncol, 2008, 34:357-364. |
| [19] | Cheng P, Corzo CA, Luetteke N, et al. Inhibition of dendritic cell differentiation and accumulation of myeloid-derived suppressor cells in cancer is regulated by S100A9 protein[J]. J Exp Med, 2008, 205:2235-2249. |
| [20] | McKenzie SJ, Halsey JF. Cholera toxin B subunit as a carrier protein to stimulate a mucosal immune response[J]. J Immunol, 1984, 133:1818-1824. |
| [21] | Pinkhasov J, Alvarez ML, Pathangey LB, et al. Analysis of a cholera toxin B subunit (CTB) and human mucin 1(MUC1) conjugate protein in a MUC1-tolerant mouse model[J]. Cancer Immunol Immunother, 2010, 59:1801-1811. |
| [22] | Rodriguez PC, Quiceno DG, Ochoa AC. L-Arginine availability regulates T-lymphocyte cell-cycle progression[J]. Blood, 2007, 109:1568-1573. |
| [23] | Rodriguez PC, Zea AH, Culotta KS, et al. Regulation of T cell receptor CD3zeta chain expression by L-arginine[J]. J Biol Chem, 2002, 277:21123-21129. |
| [24] | Vickers SM, MacMillan-Crow LA, Green M, et al. Associa-tion of increased immunostaining for inducible nitric oxide synthase and nitrotyrosine with fibroblast growth factor trans-formation in pancreatic cancer[J]. Arch Surg, 1999, 134:245-251. |
| [25] | Cobbs CS, Whisenhunt TR, Wesemann DR, et al. Inactiva-tion of wild-type p53 protein function by reactive oxygen and nitrogen species in malignant glioma cells[J]. Cancer Res, 2003, 63:8670-8673. |
| [26] | Ugel S, Delpozzo F, Desantis G, et al. Therapeutic targeting of myeloid-derived suppressor cells[J]. Curr Opin Pharma-col, 2009, 9:470-481. |
| [27] | Suzuki E, Kapoor V, Jassar AS, et al. Gemcitabine selec-tively eliminates splenic Gr-1+/CD11b+ myeloid suppressor cells in tumor-bearing animals and enhances antitumor im-mune activity[J]. Clin Cancer Res, 2005, 11:6713-6721 |
| [28] | Marigo I, Dolcetti L, Serafini P, et al. Tumor-induced tole-rance and immune suppression by myeloid derived suppressor cells[J]. Immunol Rev, 2008, 222:162-179. |
 2016, Vol. 51
2016, Vol. 51


