前列腺癌 (prostate cancer) 是威胁男性健康的常见肿瘤之一,为欧美等发达国家男性中发病率最高的恶性肿瘤[1]。而在我国,虽然发病率相对较低,但由于人口老龄化、饮食习惯改变等因素的影响,其发病率增长很快,年均增长率超过10%,故对于前列腺癌诊断和治疗的研究日趋迫切。雄激素受体 (androgen receptor,AR) 在维持前列腺的功能、促进前列腺癌的增长、抑制前列腺癌细胞的凋亡方面起着非常重要的作用,是前列腺癌治疗中最重要的靶点[2]。尽管已经成功开发数个治疗前列腺癌的雄激素拮抗剂如氟他胺 (flutamide)、比卡鲁胺(bicalutamide)、尼鲁卡胺 (nilutamide),以及新近被美国FDA批准的阿比特龙 (abiraterone) 和恩杂鲁胺 (enzalutamide),但在治疗中产生的耐药性问题严重影响了这些药物的疗效[3, 4, 5],甚至会促进前列腺癌细胞的生长。因而,寻找治疗前列腺癌的新策略迫在眉睫。
双荧光素酶基因报告系统的原理就是在一个信号系统内同时表达,但独立测量两个荧光素酶的报告基因。其中一个荧光素酶报告基因活性的改变,与目的基因表达相关,而另一个荧光素酶报告基因则作为内参,使实验值更准确。与单荧光素酶基因报告系统相比,双荧光素酶基因报告系统更具有优势。首先单荧光素酶基因报告系统不适用于基因下调的体系,因为在该体系中不能排除细胞死亡造成的干扰; 其次双荧光素酶基因报告系统中,作为内参的荧光素酶基因表达可以对转染效率、细胞反应的非特异性进行校准。
本研究通过将AR的靶基因前列腺特异性抗原 (prostate specific antigen,PSA) 的启动子和萤火虫荧光素酶基因偶联,以校准后的萤火虫荧光素酶活性来反映AR的转录活性,建立了以AR为靶标的抗前列腺癌药物筛选模型。并应用该模型,研究了红景天根、野生猕猴桃根和雷公藤根提取物的抗前列腺癌活性,为前列腺癌的治疗提供新思路。
材料与方法 仪器超净工作台: Thermo SCIENTIFIC,SERIES A2; 3111型CO2细胞孵箱; 96孔细胞培养板购自Costar公司; EnSpire 2300多功能酶标仪购自美国PerkinElmer; Centro XS3 LB 960酶标仪购自德国Berthold公司; 实时荧光定量PCR仪Stratagene MX3000P购自美 国Agilent公司; 蛋白电泳仪PowerPacTMHC Power Supply和蛋白转膜仪Mini Trans-Blot Electrophoretic Transfer Cell购自美国Bio-Rad公司。
药品与试剂 药品二氢睾酮 (dihydrotestosterone,DHT) 由加拿大麦吉尔大学惠赠; 恩杂鲁胺 (enzalutamide,ENZ) 由上海药物所惠赠; 比卡鲁胺 (bicalutamide,BIC) 购自Sigma公司。红景天根购于甘肃兰州陇萃堂;野生猕猴桃根、雷公藤根购自浙江金华天德堂中药连锁店。中药提取如下: 称取适量的中药,加无水乙醇将其浸没,室温下浸泡过夜,加热回流2 h后倒出溶液到另一干净的容器里,再往残渣里加无水乙醇加热回流2 h,如此重复加热回流3次。将回流后得到的溶液进行过滤,再进行旋转蒸发、浓缩、蒸干,得到提取物。实验中用二甲基亚砜 (DMSO) 溶解提取物。
试剂RPMI 1640培养基、F-12K培养基、胎 牛血清 (FBS) 均购自美国Gibco公司; 含EDTA的0.25% 胰酶购自美国Hyclone公司; DMSO购自美国Amresco公司; 四甲基噻唑蓝 (MTT) 和RNA提取试剂Trizol购自美国Invitrogen公司; 报告基因检测系统试剂盒购自Promega公司; One Step SYBR PrimeScript RT-PCR kit购自日本TaKaRa公司; PSA抗体购自Abcam公司; β-actin抗体购自Santa Cruz公司; 辣根过氧化酶标记的山羊抗兔、山羊抗小鼠的抗体购自中杉金桥公司。
细胞系LNCaP细胞购于ATCC (CRL-1740),用含有10% 胎牛血清的RPMI 1640培养基进行培养,按1∶2传代,3~4天传一次。PC-3细胞由加拿大麦吉尔大学惠赠,用含有10% FBS的F-12K培养基进行培养,按1∶6 传代,3~4天传一次。
质粒PSA-luc是由日本癌症化疗中心Hiroyuki教授惠赠,共表达前列腺特异性抗原和萤火虫荧光素酶; AR-F876L质粒来自加拿大麦吉尔大学,表达876位F→L突变的AR蛋白; pCMV-Renilla质粒是本科室所有,表达海肾荧光素酶。
MTT法检测细胞存活率分别取生长良好的LNCaP和PC-3细胞,制成每毫升2×104个的细胞悬液,接种于96孔板中,每孔接种200 μL。培养24 h后,每孔加入相应的药物1 μL,每组药物做三组平行,同时设置空白组和对照组。接着培养72 h,每孔加入用PBS配制的5 g·L-1 MTT溶液20 μL,继续培养2~4 h后,小心地弃掉上清液,每孔用异丙醇100 μL溶解沉淀物,96孔板振荡器上混匀30 min,最后用多功能酶标仪在570 nm波长下测定其吸光度值。
双荧光素酶报告基因检测系统实验在24孔板中,接种每毫升1.6×105个LNCaP细胞悬液,每孔接种500 μL。待细胞长至80% 时,每孔共转染100 ng PSA-luc和1 ng pCMV-Renilla质粒,转染6 h后将 培养基换成含10% charcoal-stripped FBS的无酚红RPMI 1640培养基; 转染24 h后,每孔按照1 nmol·L-1 DHT和相应药物各加入1 μL,继续培养24 h。最后将培养基吸掉,每孔加入1×PLB 100 μL裂解20 min,收集细胞裂解物到干净的EP管中,离心,取上清液20 μL到干净的白色96孔板中,按照Dual-luciferase检测方法,用960酶标仪测定荧光值。
在24孔板中,接种每毫升1.4×105个PC-3细胞悬液,每孔接种500 μL。待细胞长至80% 时,每孔共转染100 ng PSA-luc、20 ng AR-F876L和1 ng pCMV- Renilla质粒。后续操作同上。
实时荧光定量PCR实验 提取细胞总RNA六孔板中的LNCaP细胞在药物作用24 h后,弃细胞培养基,加入Trizol溶液1 mL,室温裂解细胞5 min,收集到1.5 mL无RNase的EP管中。加入氯仿200 μL,震荡30 s,使其充分混匀,室温静置5 min。4 ℃,12 000 ×g离心10 min。取上清液至新的无RNase的EP管中,加入异丙醇0.5 mL,混匀后室温放置10 min。4 ℃,10 000 ×g离心10 min。弃上清液,加入75% 乙醇1 mL洗RNA。4 ℃,7 000 ×g离心5 min。弃上清液,干燥RNA 5~10 min,至乙醇完全挥发。加入无RNase水30 μL溶解RNA。-80 ℃保存RNA,或者立即进行后续PCR实验。合成qRT- PCR所需要的引物,如表 1所示。接着按照One Step SYBR PrimeScript RT-PCR kit配制扩增体系,如表 2所示。
|
|
Table 1 Primer sequences for real-time RT-PCR |
|
|
Table 2 Components for qRT-PCR amplification |
42 ℃逆转录5 min后95 ℃,10 s; 然后是40次循环,每次循环条件为95 ℃,5 s; 60 ℃,34 s; 熔解曲线为65~95 ℃。以管家基因GAPDH为对照,用2-ΔΔCt法分析PSA基因mRNA转录水平的变化。
免疫印迹 (Western blot) 实验 细胞蛋白样品收取六孔板的LNCaP细胞在药物作用24 h后,弃旧培养基,加RIPA强裂解液80 µL,刮取6孔板中细胞,收集到1.5 mL EP管中。冰浴裂解30 min,每隔10 min涡旋振荡。再加入5×蛋白上样缓冲液20 µL裂解细胞。金属浴100 ℃加热20 min。蛋白样品储存于-20 ℃或者-80 ℃。
Western blot流程10% SDS-PAGE分离蛋白样品。使用PVDF膜70 V恒压湿法转膜1 h后,5% 脱脂牛奶室温封闭1 h。先后孵育一抗和二抗,最后ECL显色。抗体使用浓度为PSA (1∶10 000)、β-actin (1∶5 000)、山羊抗兔 (1∶5 000) 和山羊抗小鼠 (1∶5 000)。
统计学方法实验数据以x± s表示,并采用GraphPad Prism5.0软件对数据进行统计学分析。两组数据间的差异性分析采用t检验,P < 0.05认为有显著性差异。采用复孔处理,每组实验重复3次。
结果 1 双荧光素酶基因报告系统体系的确认LNCaP细胞是AR阳性的前列腺癌细胞系,而PC-3细胞是AR阴性的前列腺癌细胞系。利用这两种细胞系的差异,采用已经上市的新一代AR拮抗剂药物恩杂鲁胺对实验体系进行了验证,从图 1A增殖实验可以看出,恩杂鲁胺对PC-3细胞不具抑制增殖的作用,却可以抑制LNCaP细胞的增殖。恩杂鲁胺在5 μmol·L-1时对LNCaP细胞增殖的抑制率可达50%。此外,双荧光素酶基因报告系统实验结果如图 1B所示,恩杂鲁胺对AR转录活性具有很好的抑制作用,在5 μmol·L-1浓度下对AR的转录抑制作用几乎达100%。以上结果与文献[6]报道相符合,初步验证了该实验体系的有效性。
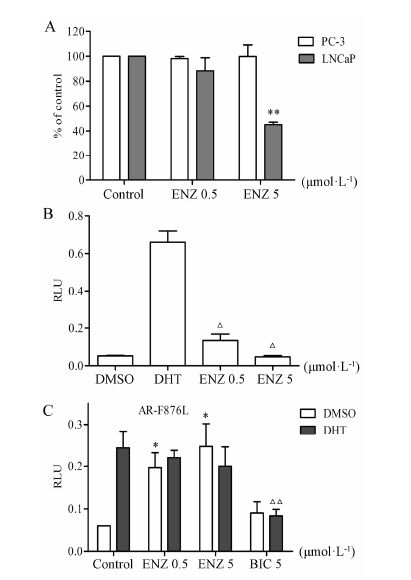
|
Figure 1 The anti-prostate cancer activity of androgen receptor antagonist. A: MTT assay in LNCaP and PC-3 cells; B: Dual- luciferase assay in LNCaP cells,the ENZ was co-treated with DHT; C: Dual-luciferase assay in PC-3 cells with AR-F876L. n = 3,x± s. P < 0.05,**P < 0.01 vs DMSO group; △P < 0.05,△△P < 0.01 vs DHT group. BIC: bicalutamide; DHT: dihydrotestosterone; ENZ: enzalutamide |
综合MTT和双荧光素酶基因报告系统实验结果可知,500 nmol·L-1恩杂鲁胺对AR转录活性的抑制率接近80%,而对LNCaP细胞抑制增殖的效果不明显。这是因为AR转录活性的增加会促进LNCaP细胞增殖,但反过来AR转录活性的降低,并不能显 著抑制LNCaP细胞增殖,它只是一定程度的抑制。LNCaP细胞本身可以通过AR依赖方式增殖,还可以通过AR非依赖途径增殖,比如NF-κB和PI3K/AKT等途径[7, 8]。因而恩杂鲁胺的浓度为500 nmol·L-1,对LNCaP细胞作用72 h时,其抑制增殖效果弱是正常的。此结果和恩杂鲁胺的主要发明者Dr Sawyers的细胞水平实验结果一致[6],表明该体系是有效的。
目前,已有研究发现了一系列AR关键位点的突变,包括741位色氨酸 (W)→亮氨酸 (L) 或者半胱氨酸 (C),877位苏氨酸 (T)→丙氨酸 (A)[9],876位苯丙氨酸 (F)→亮氨酸 (L)[10]。其中F876L突变是恩杂鲁胺产生耐药性的原因之一[4],因而本研究建立了关于AR-F876L的双荧光素酶基因报告系统。从图 1C的结果可知,无论有无DHT的作用,恩杂鲁胺在0.5和5 μmol·L-1时对AR-F876L的转录活性均不具有 抑制作用,而表现为激动剂的效应; 而比卡鲁胺对AR-F876L的转录活性具有很好的抑制作用,依然是拮抗剂的效应,与报道一致[3, 11]。因而这组实验进一步证实了该实验体系的可行性。
2 三种中药提取物的抗前列腺癌活性红景天、野生猕猴桃和雷公藤是三种很常见的中药,国内对其研究的报道也很多。它们的应用非常广泛,可用于消炎、抗氧化、增强免疫和抗肿瘤等[12, 13],但是在治疗前列腺癌方面的研究,目前几乎没有报道。因而在本研究中,采用生化方法评价这三种中药的抗前列腺癌潜力,为治疗前列腺癌提供新思路。
本研究通过采用乙醇加热回流的方法[14],提取了红景天根、野生猕猴桃根和雷公藤根的成分。分别称取这3种中药提取物配制成一定浓度的贮存溶液,按一定的浓度梯度进行稀释,通过MTT实验来检测3种中药提取物对前列腺癌细胞的抑制情况。图 2的结果表明3种中药提取物均对前列腺癌细胞具有一定程度的抑制作用。从图 2A可以看出,红景天根提取物在10 μg·mL-1质量浓度时就表现出很强的抑制LNCaP细胞增殖作用,抑制率能达到50%; 在100和200 μg·mL-1时细胞形态明显发生改变,表现出细胞毒性作用。而对PC-3细胞只在200 μg·mL-1质量浓度时表现出抑制作用。
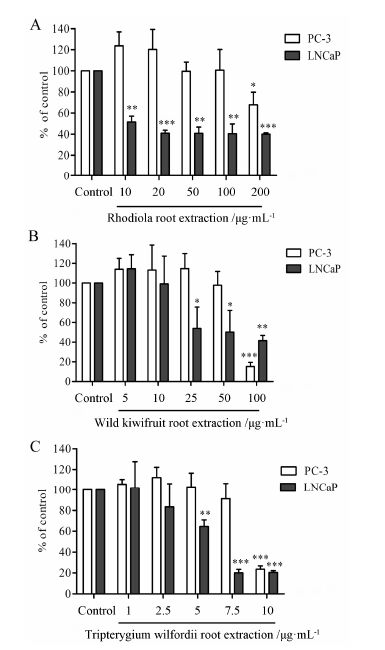
|
Figure 2 The inhibition effects of the Chinese herb extracts on PC-3 and LNCaP cells. A: Rhodiola root extraction; B: Wild kiwifruit root extraction; C: Tripterygium wilfordii root extraction. n = 3,x± s. P < 0.05,**P < 0.01,***P < 0.001 vs DMSO group |
从图 2B中可知,野生猕猴桃根提取物对前列腺癌细胞的作用情况和红景天根提取物相似。提取物在100 μg·mL-1质量浓度下对PC-3和LNCaP细胞具有明显的细胞毒性,可以观察到细胞的形态发生了改变。因而排除细胞毒性因素外,野生猕猴桃根提取物对PC-3细胞是没有抑制作用,对LNCaP细胞在10~100 μg·mL-1的质量浓度范围内,随着浓度增加,提取物的抑制强度增加。
雷公藤的毒性较大,因而将其质量浓度范围设置在1~10 μg·mL-1。在实验过程中,观察到10 μg·mL-1质量浓度下PC-3细胞形态明显发生改变。从图 2C中可知,在1~7.5 μg·mL-1质量浓度范围内,雷公藤根提取物对LNCaP细胞具有抑制增殖作用,并呈现剂量依赖关系; 而对PC-3细胞没有抑制增殖作用。
3 中药提取物的抗前列腺癌活性与雄激素受体的关系3种中药提取物在一定浓度范围内均表现出对LNCaP细胞抑制增殖作用,而对PC-3细胞不具抑制作用。由于LNCaP细胞是AR阳性的前列腺癌细胞系,而PC-3细胞是AR阴性的前列腺癌细胞系,这种细胞本身的差异提示,3种中药提取物可能会影响AR相关的信号通路,因而作者利用双荧光素酶报告基因系统测定3种中药提取物对AR活性的影响。结果如图 3所示,由于红景天根提取物和野生猕猴桃根提取物分别在100 μg·mL-1浓度可明显改变LNCaP细胞形态,表现出很强的细胞毒性,因而调整其作用质量浓度为1~50 μg·mL-1。从图 3A和3B可知,与阳性对照组的恩杂鲁胺相比,红景天根提取物和猕猴桃根提取物在1~50 μg·mL-1质量浓度范围内,对AR的转录活性不具有抑制作用。这意味着红景天根和猕猴桃根提取物抗前列腺癌的作用机制,与AR拮抗剂恩杂鲁胺的作用机制明显不同,它们不是通过直接抑制AR活性来产生抗前列腺癌活性的,具体的作用机制,还需进一步研究。图 3C的结果显示,雷公藤根提取物在5、7.5和10 μg·mL-1质量浓度时,对AR的转录活性具有很好的抑制作用,呈现出剂量依赖关系,因而雷公藤根提取物对AR活性具有一定的抑制作用,可进一步进行研究。
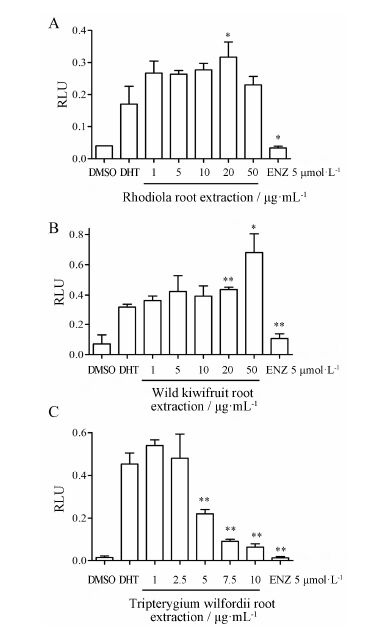
|
Figure 3 The relevance between the Chinese herb extracts and androgen receptor activity in LNCaP cells. A: Rhodiola root extraction; B: Wild kiwifruit root extraction; C: Tripterygium wilfordii root extraction. n = 3,x± s. P < 0.05,**P < 0.01 vs DHT group |
氨基酸突变是前列腺癌对AR拮抗剂产生耐药的重要机制,其中F876L突变是恩杂鲁胺产生耐药性的原因之一。由于上述实验表明雷公藤根提取物对内源性AR转录活性具有抑制作用,因而本课题进一步研究了雷公藤根提取物对AR-F876L的转录活性影响。结果如图 4所示,雷公藤根提取物对AR-F876L转录活性不具有抑制作用。在没有DHT激活的作用下,雷公藤根提取物1~5 μg·mL-1对AR-F876L转 录活性值呈逐渐增加的趋势; 在7.5和10 μg·mL-1时 呈现下降趋势,但整体值仍比对照组高。在有DHT激活的情况下,虽然在10 μg·mL-1时的相对荧光值略大于7.5 μg·mL-1时的值,但其标准偏差值大于7.5 μg·mL-1时的值,因而雷公藤根提取物1~10 μg·mL-1对AR-F876L转录活性值整体呈现下降趋势。结果表明,雷公藤根提取物对AR-F876L转录活性不具有抑制作用,反而具有一定的激动效应。
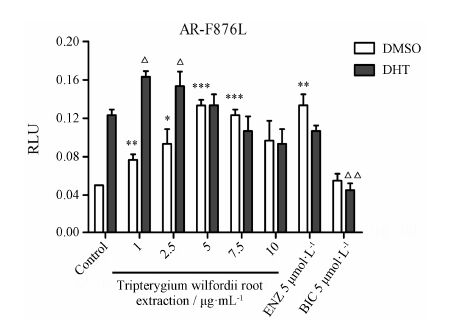
|
Figure 4 The relevance between the tripterygium wilfordii root extraction and mutant androgen receptor (F876L) activity in PC-3 cells. n = 3,x± s. P < 0.05,**P < 0.01,***P < 0.001 vs DMSO group; △P < 0.05,△△P < 0.01 vs DHT group |
PSA是雄激素受体的正调控靶基因之一,也是前列腺癌临床诊断和治疗监测的敏感指标之一[15]。PSA的表达受雄激素受体调控,因而本研究通过检测雷公藤根提取物对PSA的mRNA和蛋白表达的作用,从而间接反映其受雄激素受体表达的影响。
图 5A的Western blot结果显示,雷公藤根提取物对LNCaP细胞的AR和PSA蛋白表达,均具有显著的抑制作用。在1~10 μg·mL-1质量浓度范围内,其对AR和PSA蛋白表达的抑制呈剂量依赖性关系。图 5B的qRT-PCR结果也表明,雷公藤根提取物对PSA的mRNA表达水平呈现剂量依赖性抑制,与其蛋白表达情况一致。其中图 5B的雷公藤根提取物在10 μg·mL-1质量浓度下的t-test值为0.053 89,略大于0.05。可能是标准偏差 (SD值为10.26) 较大,从而导致其显著性不明显。这部分结果表明,雷公藤根提取物对内源性AR的靶基因PSA,在mRNA和蛋白表达水平均具有抑制作用,也反映了其对内源性AR在mRNA和蛋白表达水平的抑制作用,这可能也是其抑制LNCaP细胞增殖的机制之一。
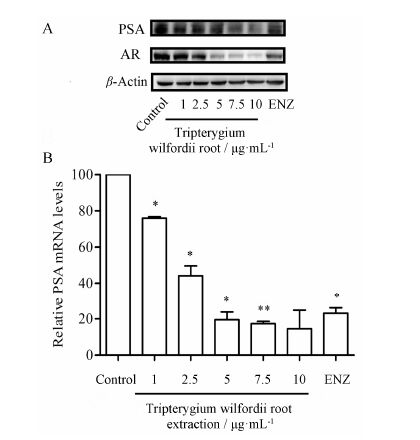
|
Figure 5 The expression of PSA with tripterygium wilfordii root extraction (μg·mL-1) treated in LNCaP cells. A: Western blot assay; B: qRT-PCR assay. The concentration of ENZ in these assays was 5 μmol·L-1. n = 3,x± s. P < 0.05,**P < 0.01 vs DHT group |
前列腺癌的发展,包括侵袭前病变、恶性腺瘤、雄激素去势抵抗性和转移性前列腺癌四个阶段。在其发展的过程中,AR均起到了重要作用。因而本研究首先建立了以AR为靶标的双荧光素酶基因报告系统,用已被FDA批准的药物恩杂鲁胺对该报告系统进行了验证,结果表明该体系有效可行。
本研究应用该报告系统重点研究了红景天根、野生猕猴桃根和雷公藤根3种中药提取物的抗前列腺癌活性。MTT结果表明,3种中药提取物对雄激素依赖性的LNCaP细胞系具有抑制增殖活性,对雄激素非依赖性的PC-3细胞系则几乎没有抑制增殖的作用。而双荧光素酶基因报告系统实验结果表明,红景天根和野生猕猴桃根提取物对AR转录活性不具有抑制作用,而雷公藤根提取物则能剂量依赖地抑制AR转录活性。这表明红景天根和野生猕猴桃根提取物不
是通过直接抑制AR转录活性而产生抗前列腺癌活性的,而雷公藤根提取物则可以直接抑制内源性AR的转录活性。于是进一步研究了雷公藤根提取物对AR-F876L的转录活性影响,结果表明,雷公藤根提取物不具有抑制AR-F876L活性的作用,反而具有激动效应。在mRNA和蛋白表达水平检测了雷公藤根提取物对AR的靶基因PSA的影响,结果显示,其对PSA的mRNA和蛋白表达均具有剂量依赖性抑制作用。因而综上所述,可得出结论: 3种中药提取物均可抑制雄激素依赖性的LNCaP细胞增殖,其中雷公藤根提取物对内源性AR转录活性具有抑制作用,同时对内源性AR的mRNA和蛋白表达均具有抑制作用; 但是其对AR-F876L却具有激活作用,具体机制还需深入研究。
此外,从实验结果来看,红景天根、野生猕猴桃根和雷公藤根提取物均不能抑制PC-3 (AR阴性) 细胞的增殖,而对LNCaP (AR阳性) 细胞抑制效果明显,这提示受试物可能通过影响AR活性从而发挥抗肿瘤活性。然而,AR活性依赖的双荧光素酶基因报告系统中,3种受试物的表型并不一致,其中前两者不能抑制AR的活性。这就造成了AR依赖的前列腺癌细胞增殖与AR转录活性之间的相关性不明显的现象,分析原因主要有两点: ① 细胞复杂性。正如前面所提及的,LNCaP细胞还可以通过AR非依赖的方式增殖,比如NF-κB和PI3K/AKT等途径。红景天及野生猕猴桃根提取物可能是通过其他途径,而不是AR信号通路来抑制LNCaP细胞增殖的; ② 提取物成分的复杂性。提取物成分多种多样,活性不一,作用机制也不尽相同。在AR活性依赖的双荧光素酶基因报告系统实验中,红景天及野生猕猴桃根提取物不能抑制AR的转录活性; 可能是其提取物中存在一些成分能下调AR信号通路上的其他相关蛋白,因而在细胞毒性实验中可以选择性抑制LNCaP增殖,却不能抑制AR的转录活性。进一步工作可以考虑基因芯片分析实验,尝试检测提取物对其他信号通路以及AR下游靶基因的影响。因而综上所述,AR活性依赖的双荧光素酶基因报告系统作为以AR为靶标的抗前列腺药物筛选模型有效,能够抑制AR活性的化合物或提取物是可作为潜在的抗前列腺癌 (AR依赖的前列腺癌) 药物。
在我国,常见中药在癌症治疗中的应用很广泛,但在抗前列腺癌方面的研究总体不多。已报道的研究主要是针对雄激素非依赖的PC-3细胞系的研究[16],具体机制尚不明确; 这些中药对于前列腺癌重要靶点雄激素受体活性的影响未见报道。本实验研究了红景天根、野生猕猴桃根和雷公藤根提取物对AR转录活性的影响,并研究发现雷公藤根提取物对内源性AR转录活性、mRNA和蛋白表达均具有较好的抑制作用,对AR-F876L具有激活作用,因而雷公藤根提取物可作为非AR-F876L的前列腺癌的潜在治疗药物。与此同时,作者充分挖掘了传统中药雷公藤提取物的潜能,拓展了其药效,并为前列腺癌的治疗提供了新方法。
| [1] | Siegel R, Ma JM, Zou ZH, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64:9-29. |
| [2] | Dong Y, Zhang H, Gao AC, et al. Androgen receptor signaling intensity is a key factor in determining the sensitivity of prostate cancer cells to selenium inhibition of growth and cancer-specific biomarkers[J]. Mol Cancer Ther, 2005, 4:1047-1055. |
| [3] | Korpal M, Korn JM, Gao X, et al. An F876L mutation in androgen receptor confers genetic and phenotypic resistance to MDV3100(enzalutamide)[J]. Cancer Discov, 2013, 3:1030-1043. |
| [4] | Claessens F, Helsen C, Prekovic S, et al. Emerging mecha-nisms of enzalutamide resistance in prostate cancer[J]. Nat Rev Urol, 2014, 11:712-716. |
| [5] | He Y, Liu YG, Cen S, et al. The mechanisms of drug resis-tance in prostate cancer[J]. Acta Pharm Sin (药学学报), 2015, 50:797-801. |
| [6] | Tran C, Ouk S, Clegg NJ, et al. Development of a second-generation antiandrogen for treatment of advanced prostate cancer[J]. Science, 2009, 324:787-790. |
| [7] | Semenas J, Hedblom A, Miftakhova RR, et al. The role of PI3K/AKT-related PIP5K1α and the discovery of its selec-tive inhibitor for treatment of advanced prostate cancer[J]. Proc Natl Acad Sci U S A, 2014, 111:E3689-E3698. |
| [8] | Nadiminty N, Lou W, Sun M, et al. Aberrant activation of the androgen receptor by NF-κB2/p52 in prostate cancer cells[J]. Cancer Res, 2010, 70:3309-3319. |
| [9] | Otsuka T, Iguchi K, Fukami K, et al. Androgen receptor W741C and T877A mutations in AIDL cells, an androgen-independent subline of prostate cancer LNCaP cells[J]. Tumour Biol, 2011, 32:1097-1102. |
| [10] | Balbas MD, Evans MJ, Hosfield DJ, et al. Overcoming mutation-based resistance to antiandrogens with rational drug design[J]. Elife, 2013, 2:e00499. |
| [11] | Joseph JD, Lu N, Qian J, et al. A clinically relevant androgen receptor mutation confers resistance to second-generation antiandrogens enzalutamide and ARN-509[J]. Cancer Discov, 2013, 3:1020-1029. |
| [12] | Liu ZB, Li XS, Simoneau AR, et al. Rhodiola rosea extracts and salidroside decrease the growth of bladder cancer cell lines via inhibition of the mTOR pathway and induction of auto-phagy[J]. Mol Carcinog, 2012, 51:257-267. |
| [13] | Hu XL, Zhang X, Qiu SF, et al. Salidroside induces cell-cycle arrest and apoptosis in human breast cancer cells[J]. Biochem Biophys Res Commun, 2010, 398:62-67. |
| [14] | Liu WG, Zhou JM, Geng GY, et al. Antiandrogenic, maspin induction, and antiprostate cancer activities of tashinone ⅡA and its novel derivatives with modification in ring A[J]. J Med Chem, 2012, 55:971-975. |
| [15] | Yang L, Zhang LY, Chen WW, et al. Inhibition of the expres-sion of prostate specific antigen by curcumin[J]. Acta Pharm Sin (药学学报), 2005, 40:800-803. |
| [16] | Su MC, Cheng HH. New progress of traditional Chinese medicine and pharmacy in the treatment of prostate cancer[J]. Glob Tradit Chin Med (环球中医药), 2012, 5:152-156. |
 2016, Vol. 51
2016, Vol. 51


