2. 复旦大学药学院, 教育部智能化递药重点实验室, 上海 201203
2. Key Laboratory of Smart Drug Delivery, Ministry of Education, School of Pharmacy, Fudan University, Shanghai 201203, China
肿瘤为目前危害人类健康和生命的第二大疾病,且因治疗困难,总体生存率偏低,治疗费用昂贵,已经成为患者和社会的重大负担。据国家癌症中心2015年发布的最新统计数据显示,2011年我国总体癌症发病率每10万人250例,其中每10万人中有157人因癌症而死亡[1]。基于此,各制药公司研发了多种抗肿瘤药物,2014年全球抗肿瘤药物的市场已突破1 000亿美元。尽管如此,癌症的治疗效果仍然差强人意。其中,抗肿瘤药物在肿瘤部位蓄积浓度较低,毒副作用较大是这些药物面临的主要问题之一。随着材料学、药剂学的发展,采用纳米技术递送抗肿瘤药物已经成为研究热点,纳米药物也成为制药公司关注的重要领域,并有多种纳米药物上市,如阿霉素脂质体 (Doxil)[2]、紫杉醇白蛋白纳米粒 (Abraxane)[3]、紫杉醇胶束和亮丙瑞林纳米粒等[4]。
相较正常组织,肿瘤具有独特的微环境[5]: 一方面,由于肿瘤细胞的快速增殖,使得肿瘤组织内血管和淋巴管不完整,从而导致物质容易从血管内渗漏进入肿瘤组织,且难以从淋巴管回流,导致肿瘤具有增强的渗透和滞留效应 (enhanced permeability and retention effect,EPR效应)[6]; 另一方面,肿瘤淋巴管缺陷也导致肿瘤间质液回流困难,从而使得肿瘤间质压较高,影响药物在肿瘤内的扩散。同时肿瘤的快速增殖使得氧供不足,从而在肿瘤内部,尤其是血管缺乏的核心区,存在缺氧区域。该区域不仅化疗药物难以到达,而且肿瘤细胞更易耐受化疗药物,从而产生化疗盲区,导致肿瘤更易复发和转移。
前期的肿瘤靶向研究主要集中于组织器官水平靶向,即以提高在肿瘤部位的药物浓度为目的,而较少考虑肿瘤的异质性和特殊的微环境,导致其靶向治疗效果不明显。随着对肿瘤微环境及其肿瘤发生、发展、耐药和转移等过程的深入了解,以及纳米材料的迅速发展,研究者设计了多种新型的肿瘤靶向递药策略,以期更好地靶向浓集于肿瘤组织,进一步克服肿瘤内的屏障,将抗肿瘤药物更有效地递送至肿瘤内部,从而提高抗肿瘤效果。本文将对这些策略进行综述,并对存在的问题进行讨论。
肿瘤靶向药物递送策略通常分为两类: 被动靶向和主动靶向。被动靶向系指依靠肿瘤部位的生理、病理特点以及纳米递药系统本身的性质,使纳米递药系统能够有效蓄积在肿瘤部位; 而主动靶向则是指依靠纳米系统表面的特定分子与肿瘤部位的特定分子间、蛋白间的主动识别而结合,达到肿瘤组织、细胞中药物选择性浓集的目的。
1 被动靶向策略被动靶向尽管不具有主动识别特定位点的功能,但可以通过设计功能化的纳米材料响应肿瘤的微环境或直接调节肿瘤微环境,从而达到较好的靶向递送效果,因此近几年得到较多的关注。被动靶向的主要策略如下。
1.1 利用EPR效应的被动靶向递药策略由于肿瘤存在的EPR效应,普通纳米递药系统即可被动地蓄积于肿瘤部位,达到抗肿瘤药物靶向递送的目的,同时普通纳米递药系统的构建较为简单,制备方法易于扩大生产,因此得到医药企业的青睐。目前已上市的抗肿瘤纳米药物均为此类: 如Doxil,由聚乙二醇-磷脂酰乙醇胺 (PEG-DSPE)、磷脂与胆固醇制备得到的长循环脂质体包载阿霉素而成; 其制备材料均为注射用辅料,安全性较好。白蛋白纳米粒由于其辅料为注射用白蛋白,且依靠抗肿瘤药物与白蛋白的高亲和性而制成,不含其他表面活性剂和有机溶剂,具有良好的生物相容性和安全性,因此也得到广泛关注[3]。目前已有Abraxane上市,此外,其他多种药物的白蛋白纳米粒也处在各阶段的研发中,包括多西紫杉醇[7]、拉帕替尼[8]和吡柔比星[9]等,在动物水平均取得了较原有注射液或片剂更好的抗肿瘤效果。也有研究表明,肿瘤部位高表达的富含半胱氨酸的酸性分泌蛋白 (secreted protein,acidic and rich in cysteine) 为白蛋白的特异性受体,因此能够一定程度依靠该受体主动靶向至肿瘤部位[10]。表 1为目前已在临床应用的抗肿瘤靶向递药系统,表 2为目前处于各期临床研究的肿瘤靶向递药系统[11]。
|
|
表 1 目前临床应用的抗肿瘤靶向递药系统[4] |
|
|
表 2 各期临床研究的肿瘤靶向递药系统[11] |
纳米系统的粒径对实体瘤的穿透能力和滞留能力存在显著影响。在一定范围内,纳米系统的粒径越小,对实体瘤的穿透 (渗透) 能力越强,如有研究比较12~125 nm胶束或纳米粒对实体肿瘤的渗透性发现,小粒径纳米系统的渗透能力显著强于较大粒径的纳米系统[12, 13]。与此相反,纳米系统在肿瘤组织的滞留能力却与粒径成正相关,即小粒径纳米系统在肿瘤部位的滞留能力显著逊于大粒径纳米系统[14]。鉴于穿透能力和滞留能力对粒径的需求正好相反,研究者设计了一种粒径可智能化调节的纳米系统,以期同时具有良好的肿瘤滞留性和渗透性。主要思路有两种: ① 以大粒径纳米系统应用,利用EPR效应和纳米系统较大的粒径,使其更易滞留于肿瘤部位,然后通过环境响应性使粒径降低,提高其在肿瘤内部的穿透性; ② 以小粒径纳米系统应用,将穿透进入肿瘤组织的小粒径纳米递药系统在肿瘤内部聚集成大粒径,可以提高其在肿瘤部位的滞留性。由于该策略能够有效提高纳米系统在肿瘤部位的浓集和穿透,从而达到药物肿瘤靶向递送的效果。
1.2.1 粒径智能化降低策略粒径智能化降低策略可以通过酶敏感、pH敏感和热敏感等多种方式实现。肿瘤部位高表达多种酶,如基质金属蛋白酶-2 (matrix metalloproteinase-2,MMP-2)。而明胶是MMP-2的底物,能够被MMP-2降解为碎片,据此,有研究者[15]设计了一种载四氧化三铁磁球的明胶纳米粒。明胶纳米粒的粒径为150 nm左右,赋予其在肿瘤部位良好的滞留能力; 其中的明胶结构具有酶敏感性,在肿瘤
高表达的MMP-2作用下,明胶降解而形成小粒径的四氧化三铁磁球 (约10 nm),从而赋予其更好的肿瘤细胞渗透性。本课题组利用此原理,将小粒径的载阿霉素金纳米粒 (粒径为30 nm左右) 修饰于明胶纳米粒表面,用于阿霉素的肿瘤靶向递送 (图 1)[16]。在体外,与MMP-2孵育24 h,该纳米系统的粒径能够从186.5 nm降低至59.3 nm,表现出良好的粒径调控能力; 同时MMP-2的孵育能够有效提高纳米系统在凝胶和三维肿瘤球中的穿透。在体内,该纳米系统的肿瘤蓄积浓度显著高于明胶纳米粒和金纳米粒,且在多个肿瘤模型 (包括乳腺癌、结肠癌和脑肿瘤) 中均体现出良好的靶向药物递送和治疗效果[16, 17]。
pH敏感的粒径降低主要是通过调节嵌段纳米材料的等电点,使纳米材料的部分片段在不同pH值中具有不同的电荷,从而使其在中性pH中能够聚合或自组装成为一定粒径的纳米递药系统; 当进入酸性环境时,由于电荷变化使得材料间相互排斥而解聚,从而降低其粒径。Yu等[18]采用两亲性的pH敏感材料甲氧基聚乙二醇-聚丙交酯-聚二氨基酯 (MPEG-PLA- PAE) 共聚物成功制备了一种粒径/电荷可调节的胶束,该MPEG-PLA-PAE胶束在pH 7.4环境中较为稳定,对化疗药物姜黄素具有较高的包封率。当环境pH值下降到5.5时,该胶束的粒径从171.0 nm降至22.6 nm,表面电荷由轻微正电荷 (4.0 mV) 升至高正电荷 (18.3 mV); 较小的粒径将降低其扩散障碍,有利于纳米粒穿透肿瘤间质抵达肿瘤深部,而正电荷可以显著提高MCF-7细胞对其的摄取,从而增加化疗药物对肿瘤细胞的毒性作用,其肿瘤抑制率达到65.6%,而粒径不可调节纳米粒组的肿瘤抑制率仅为47.1%。
在纳米材料上修饰一些具有光敏感变构性质的基团,可以赋予纳米材料在光照前后不同的亲和性,从而改变其粒径。Tong等[19]利用疏水性螺吡喃 (spiropyran) 在紫外线照射下能够变构为亲水性部花青 (merocyanine) 的特点,将螺吡喃修饰上9个碳的烃链得到疏水性纳米材料,该材料在水相中可以乳化为纳米粒,粒径为143.2 nm,经紫外线照射后粒径降至47.1 nm。利用此原理使其肿瘤渗透性大为增加,且能将更多的阿霉素递送入肿瘤深部,有效延长荷HT-1080肿瘤小鼠的中位生存期[20]。但由于该异构化是由紫外线触发,而紫外线的组织穿透能力很差,因此只能应用于体外或浅表肿瘤。
1.2.2 粒径智能化聚集增大策略纳米系统的聚集同样可以受pH、酶、热等触发而实现[21]。Nam等[22]在金纳米粒表面修饰甲基马来酰胺的类似物,所得粒径仅为10 nm,表面为负电荷。进入肿瘤后,在弱酸环境下甲基马来酰胺水解而暴露出氨基,进一步质子化而使金纳米粒表面带正电荷。水解的和未水解的纳米粒由于电荷相吸而聚集,90 min后粒径已达443 nm,有效增强了滞留性。同时由于聚集,金纳米粒的吸收峰由524 nm红移至650 nm,从而更加有利于肿瘤的光热治疗。
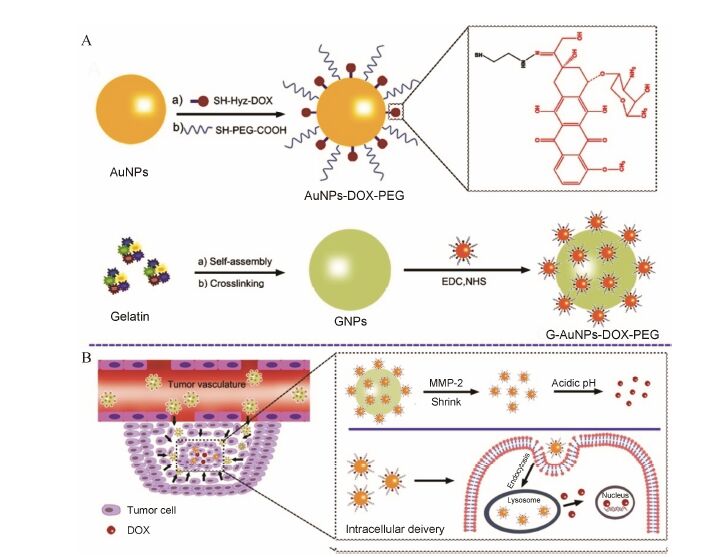
|
图 1 粒径智能化降低纳米系统示意图。将阿霉素 (DOX) 修饰于小粒径的金纳米粒 (AuNPs) 表面,并进一步修饰到明胶纳米粒 (GNPs) 表面而得到较大粒径的G-AuNPs-DOX-PEG。该系统通过EPR效应进入肿瘤,在肿瘤内部高表达的基质金属蛋白酶2 (MMP-2) 作用下降解而降低粒径,从而有利于穿透至肿瘤内部,并在酸性环境下释放DOX[16] |
纳米递药系统的表面电荷与其长循环效果及细胞摄取具有一定的相关性。一般而言,正电荷吸附血浆蛋白能力更强,从而容易被单核巨噬系统清除; 反之,荷负电的纳米递药系统吸附血浆蛋白能力较弱,血浆半衰期也更长; 因此大多数纳米递药系统均将表面修饰为负电荷。另外细胞膜通常呈负电荷,荷正电的纳米递药系统更容易被细胞摄取。基于此,研究者设计了表面性质智能化调节的递药系统,利用pH或酶的触发,使得纳米系统表面的电荷、基团发生变化,从而既有良好的血浆半衰期,又有较好的肿瘤细胞穿透性。Lee等[23]以脱氧胆酸和二甲基马来酸修饰的聚赖氨酸为材料制备纳米递药系统: 亲水性的聚二甲基马来酰胺在中性pH中呈负电性,从而使纳米系统具有较长的血浆半衰期; 进入肿瘤组织后因pH降低,其嵌段中的酰胺质子化而呈正电性,从而更容易被肿瘤细胞摄取。结果表明,pH 6.8时肿瘤细胞对纳米系统的摄取是pH 7.4时的近40倍。
1.4 通过降低肿瘤间质压的被动靶向策略正常组织的间质压 (interstitial fluidpressure,IFP) 一般为 -1~-3 mmHg,而由于肿瘤新生血管较高的渗漏性和淋巴回流缺陷,肿瘤内部的间质压高达10~20 mmHg[24]。肿瘤的高间质压极大限制了药物和纳米载体从血管周围向肿瘤内部的渗透,从而使纳米递药系统难以进入肿瘤组织内部而影响抗肿瘤效果。因此降低肿瘤间质压有望提高纳米系统的递药效果和疗效。多种药物,包括胶原蛋白酶、VEGF受体抑制剂和PDGF受体抑制剂等均可以降低肿瘤间质压。伊马替尼 (imatinib) 可以抑制PDGF受体,张强课题组[25]将伊马替尼脂质体与阿霉素脂质体联用以提高药物的肿瘤内递送。20 mg·kg-1伊马替尼脂质体可使肿瘤间质压降低约40%,从而使阿霉素脂质体在肿瘤内的分布显著增加,肿瘤重量相比单用阿霉素脂质体降低30% 以上。
细胞外基质中的胶原、透明质酸等含量较高,降低这些物质的含量也有助于降低肿瘤间质压。氯沙坦 (losartan) 作为抗高血压药,能够降低I型胶原的合成,从而降低肿瘤间质压。Zhang等[26]将氯沙坦与脂质体联用以提高紫杉醇的抗肿瘤效果。结果表明,多次给予氯沙坦后脂质体在肿瘤的蓄积显著提高,肿瘤重量进一步下降约20%,有效提高了紫杉醇脂质体的抗肿瘤效果。甲基-羟基香豆素能抑制透明质酸的合成,因此Kohli等[27]将水溶性前药磷酸化的甲基-羟基香豆素与阿霉素脂质体联合应用,显著改善阿霉素脂质体在乳腺癌内的分布,并显著提高了荷瘤小鼠的生存期。
肿瘤需要新生血管供应养分和能量,但是肿瘤新生血管往往杂乱无章且具有高渗漏性。功能和结构上的异常性导致肿瘤间质压升高,从而降低纳米药物渗透进入肿瘤组织的能力。因此,使肿瘤血管正常化有望降低肿瘤间质压,提高药物的肿瘤内递送效果。造成肿瘤血管异常的原因包括促血管生成因子与抗血管生成因子间的不一致性,应用抑制血管生成的药物可以使肿瘤新生血管正常化。Chauhan等[28]应用此策略发现,通过阻断血管内皮生长因子受体-2使血管正常化后其血管壁上的孔径减小,肿瘤间质压降低,从而增加小粒径纳米粒 (12 nm) 的穿透性和抗肿瘤效果。但是血管正常化后血管壁孔隙减小,不利于较大粒子 (120 nm) 的渗漏,所以该方法只是对小粒径的纳米粒较为适用。此外,研究发现经典的自噬抑制剂氯喹可以通过增加内皮Notch1信号通路促使血管结构和功能正常化。而血管正常化,一方面增加了屏障功能,由此阻止了癌细胞的播散和转移; 另一方面增加了肿瘤的灌注,从而提高肿瘤对化疗的反应[29]。
1.5 药物响应性释放策略普通纳米递药系统虽然可以通过EPR效应被动靶向至肿瘤部位,但仍然有大量的纳米递药系统可能分布于肝、脾和肾等器官,抗肿瘤药物在这些部位的释放会导致严重的毒副作用。因此如何使药物能够特异性地在肿瘤内部释放,而尽可能减少在正常组织器官的释放成为研究者关注的问题之一。药物特异性释放主要通过环境响应性,而非特定分子间相互作用,因此将其归为被动靶向策略。目前,研究者已设计了多种响应性释放策略,包括pH值响应性、氧化还原响应性、酶响应性和紫外线响应性等[21]。pH值响应性主要是将药物通过一些pH敏感化学键 (如腙键) 修饰于纳米递药系统内部或表面。到达肿瘤部位后,由于肿瘤微环境pH值 (约6.5~6.8) 较正常组织更低,pH敏感化学键水解而释放药物[30]。通过调节敏感键周围的基团,可以使其最佳响应pH位于不同的区间,从而调节药物释放在肿瘤间质 (pH值6.5~6.8) 或肿瘤细胞内部的溶酶体 (pH值5.0~5.5)[31]。本课题组将阿霉素采用腙键修饰于金纳米粒表面,结果表明,阿霉素在pH 5.0时48 h累积释放达到88.3%,显著快于pH 7.4 (仅为21.9%),从而使得该系统在具有良好抗肿瘤效果的同时具有较低的心脏毒性[30]。
2 主动靶向策略为了使递药系统能够被特定的细胞所识别和摄取,递药系统表面可以修饰特定的靶向分子,如蛋白、抗体、多肽、核酸和化学小分子等。这些靶向分子能够与细胞表面的特定受体、抗原或转运体等特异性结合,进而触发细胞内吞,从而达到将递药系统靶向递送至特定细胞的目的。根据靶向细胞的不同,可将主动靶向策略分为以下几类。
2.1 靶向肿瘤细胞肿瘤细胞是肿瘤的主要组成部分,选择性杀伤肿瘤细胞成为肿瘤治疗的首要选择。肿瘤细胞由于 生长迅速,其细胞表面的多种受体表达显著高于正常细胞,如转铁蛋白受体、叶酸受体、低密度脂蛋白受体和葡萄糖转运体等,因此相应的配体经常用作肿瘤细胞递药的靶向分子。如白介素13受体亚型2 (IL-13Rα2) 在脑肿瘤细胞高表达[32],本课题组将IL-13Rα2的特异性配体IL-13p修饰在纳米粒表面,用于多西紫杉醇的靶向递送[33]。结果表明,IL-13p修饰纳米粒对脑肿瘤细胞的选择性显著优于未修饰纳米粒 (图 2); 其在脑肿瘤的蓄积浓度是未修饰纳米粒的3.96倍; 经过4次治疗后,其肿瘤体积是生理盐水组的31.4%,显著低于未修饰纳米粒组[33]。用于肿瘤细胞的靶向分子较多,相对有效的如pH (low) insertion peptide[34]、angiopep-2[30]、AS1411核酸适配体[35]和叶酸[36]等。
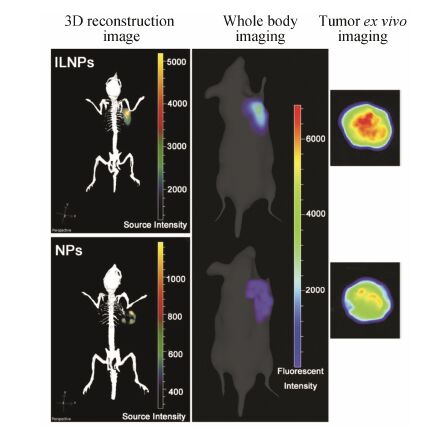
|
图 2 IL-13p修饰纳米粒 (ILNPs) 与未修饰纳米粒 (NPs) 尾静脉给药2 h后采用活体成像仪观察纳米粒的肿瘤分布[33] |
目前,越来越多的研究表明肿瘤细胞包含不同的分化阶段,其中某些未分化的肿瘤细胞具有很强的成瘤潜力,并具有很强的分化和增殖能力,这与其他器官组织中干细胞的作用类似,因此称为肿瘤干细胞 (cancer stem cells)。一般认为,肿瘤细胞内仅有0.01%~1% 的肿瘤干细胞,但肿瘤干细胞对化疗、放疗等抗肿瘤治疗的耐受性更大,且抗肿瘤治疗反而导致肿瘤干细胞的富集,使其快速增殖或转移,从而使抗肿瘤治疗失败。因此,将抗肿瘤药物靶向递送至肿瘤干细胞将有助于提高抗肿瘤效果,改善预后效果,减少肿瘤复发和转移。相比普通肿瘤细胞,肿瘤干细胞存在多种高表达的标记物,如CD44、CD133和EPCAM等,以这些标记物为靶点,能够将纳米递药系统靶向输送至肿瘤干细胞,提高对肿瘤干细胞的杀伤效果[37, 38]。
Wang等[39]将anti-CD133抗体作为靶向分子修饰于碳纳米管表面 (anti-CD133-SWNT),以靶向脑肿瘤干细胞。结果表明,该递药系统能被CD133+的脑肿瘤干细胞选择性摄取,浓度显著高于CD133-的肿瘤细胞。经光热治疗后,脑肿瘤几乎消失,治疗效果远远优于普通未修饰碳纳米管。透明质酸 (HA) 能特异性结合CD44,因此也被广泛应用于肿瘤干细胞的靶向递送。多种HA修饰的脂质体、固体脂质纳米粒等递药系统均能有效靶向至肿瘤干细胞,从而提高抗肿瘤效果[40, 41]。
2.3 靶向肿瘤新生血管肿瘤组织含有大量新生血管,其是维系肿瘤生长的重要基础和特征。通过药物阻止新生血管的增生能阻断肿瘤的营养供应,从而达到“饿死”肿瘤的目的。与成熟的血管内皮细胞相比,肿瘤新生血管内皮细胞高表达多种蛋白,包括整合素、跨膜糖蛋白和氨肽酶N等,能够识别这些高表达蛋白的分子即可用于新生血管靶向药物递送[42]。如RGD环肽能够选择性结合整合素αvβ3,从而被广泛应用于靶向肿瘤新生血管[43, 44]。本课题组将RGD修饰于荧光碳量子点表面,结果表明其对乳腺癌的诊断效果显著优于未修饰荧光碳量子点[45]。
2.4 靶向肿瘤相关巨噬细胞普通活化的巨噬细胞 (M1型) 能够产生促凋亡因子,并有效清除外来的病原体和肿瘤细胞。与此不同的是,肿瘤相关巨噬细胞 (tumor associated macrophages,TAM) 更接近于M2型,对肿瘤细胞毒性低,具有抗炎症和组织修复功能,且会促进肿瘤的生长、血管新生乃至转移[46]。因此靶向TAM并选择性杀伤TAM有助于提高抗肿瘤效果,其中多种靶向分子被证明具有靶向TAM的效果,如CD163抗体[42]、Ly6C抗体[47]和甘露糖[48]等。Zhu等[48]研究表明,甘露糖修饰纳米粒在肿瘤部位与TAM共定位程度显著高于未修饰纳米粒,即甘露糖修饰能够提高递药系统对TAM的靶向性。
2.5 靶向其他基质细胞除了前述几种细胞外,肿瘤部位还存在肿瘤相关成纤维细胞 (tumor-associated fibroblasts)、肿瘤相关周细胞 (tumor-associated pericytes)、肿瘤相关细胞外基质 (tumor-associated extracellular matrix) 和肿瘤相关淋巴细胞 (tumor-associated lymphocytes) 等。这些细胞或基质均在维持肿瘤微环境、促进肿瘤生长和转移方面发挥着重要作用,因此针对这些基质细胞的靶向递药同样能够发挥抗肿瘤效果[42]。
2.6 靶向多种细胞靶向单一细胞尽管可以选择性杀死肿瘤相应细胞,但是由于肿瘤微环境的复杂性,往往会产生意想不到的不良反应。如抗新生血管治疗能够阻断肿瘤 的营养供应,但是同时也会阻断抗肿瘤药物的进入。不仅如此,肿瘤细胞在由此导致的氧、营养成分匮乏环境下,使得肿瘤内部的缺氧诱导因子1α (hypoxia- inducible factor-1α,HIF-1α) 蓄积,而高表达的HIF-1α能够提高肿瘤细胞的侵袭性和耐药性[49, 50]。因此同 时靶向肿瘤的多种细胞,可以更好地治疗肿瘤。如前所述,IL-13p能靶向脑肿瘤细胞,而RGD能靶向肿瘤新生血管内皮细胞,因此本课题组将IL-13p和RGD同时修饰在纳米粒表面,构建得到双重靶向递药系统 (IRNP)[51]。体外新生内皮细胞和脑肿瘤细胞共培养模型中,IRNP在两种细胞的摄取浓度均较高,而单一靶向分子修饰的纳米系统仅能选择性提高相应靶细胞的摄取。体内切片共定位结果同样发现IRNP既与肿瘤细胞共定位,又与新生血管细胞共定位。与对照生理盐水组相比,载多西紫杉醇IRNP治疗的荷脑肿瘤小鼠的中位生存期延长106%,显著优于单一靶向分子修饰的纳米递药系统[51]。
3 存在的问题及展望如前所述,目前的肿瘤靶向策略主要是通过纳米材料结构的设计赋予载药系统以环境响应性调节能力,或通过表面靶向分子的修饰赋予其主动靶向性。尽管这些研究均取得一定的成果,一定程度提高了药物递送和抗肿瘤效果,但是这些策略仍然存在一些问题。
对于具有环境响应性的纳米载体而言,响应的特异性、敏感性是需要关注的重要问题。内源性的环境,如pH、酶的差异,能够使得纳米系统及时且持续响应,对于系统给药而言较为有利。但是这类刺激的特异性往往不够专属。尽管肿瘤内部的pH值较正常组织低,但是正常组织细胞内的溶酶体仍然具有较低pH值,从而使得这些纳米系统被正常细胞摄取进入溶酶体后同样会发生响应性,导致药物在正常细胞内的释放和蓄积。酶的特异性尽管较好,但一方面某些酶的底物容易被血液和其他组织中的酶在不同位点降解,从而影响整个体系响应的特异性; 另一方面内源性的刺激往往存在浓度不够高,使得响应速度较慢。如基质金属蛋白酶响应性的载体需要24 h才能被充分降解[16]。外源性的环境刺激,如紫外线、超声等强度较大,且局部刺激,从而使得纳米载体的响应速度较快、特异性较好,但是这种刺激只能选择特定的时间间断性刺激,持续时间短,从而使得纳米载体在非刺激时段无法具有响应性。
对于主动靶向策略而言,靶向分子的特异性、有效性是关注的热点: 一方面,尽管靶向受体在肿瘤部位高表达,但是其仍然在正常组织中有一定程度的表达,使得靶向递药系统也可能分布于其他组织,因此寻找特异性更好的受体及相关配体成为本领域的研究目标; 另一方面,靶向分子修饰于纳米递药系统表面的有效性仍然有待探索。纳米系统进入血液循 环后,由于血浆蛋白的吸附而在表面形成一层蛋白冠 (protein corona),而这层蛋白冠会阻断靶向分子与受体的特异性结合从而使得靶向特异性减弱甚至消失[52]。除此之外,靶向分子的间距也会影响其与受体的结合。张强课题组[53]证明,当在脂质体表面同一个PEG分子上修饰两个RGD,且两个RGD具有特定间距时,其促进细胞内吞的作用更强。
尽管存在上述问题,但是环境响应性和主动靶向性仍然是肿瘤靶向领域的热点。随着材料学的发展,研究更为灵敏和特异的响应性材料将显著改善现有纳米材料面临的问题。通过新技术,包括噬菌体展示技术、指数富集的配基系统进化技术 (systematic evolution of ligands by exponential enrichment,SELEX) 和计算机辅助设计等[54, 55, 56, 57],有助于筛选得到特异性和亲和性更好的靶向分子,从而进一步提高肿瘤靶向效果。
| [1] | Chen W, Zheng R, Zeng H, et al. Annual report on status of cancer in China, 2011[J]. Chin J Cancer Res, 2015, 27:2-12. |
| [2] | Barenholz YC. Doxil-the first FDA-approved nano-drug:lessons learned[J]. J Control Release, 2012, 160:117-134. |
| [3] | Fu Q, Sun J, Zhang WP, et al. Nanoparticle albumin-bound (NAB) technology is a promising method for anti-cancer drug delivery[J]. Recent Pat Anticancer Drug Discov, 2009, 4:262-272. |
| [4] | Weissig V, Pettinger TK, Murdock N. Nanopharmaceuti-cals (part 1):products on the market[J]. Int J Nanomedicine, 2014, 9:4357-4373. |
| [5] | Jain RK. Delivery of molecular and cellular medicine to solid tumors[J]. Adv Drug Deliv Rev, 2001, 46:149-168. |
| [6] | Fang J, Nakamura H, Maeda H. The EPR effect:unique features of tumor blood vessels for drug delivery, factors involved, and limitations and augmentation of the effect[J]. Adv Drug Deliv Rev, 2011, 63:136-151. |
| [7] | Gao HL, Cao SJ, Yang Z, et al. Preparation, characterization and anti-glioma effects of docetaxel-incorporated albumin-lipid nanoparticles[J]. J Biomed Nanotechnol, 2015, 11:2137-2147. |
| [8] | Gao HL, Cao SL, Chen C, et al. Incorporation of lapatinib into lipoprotein-like nanoparticles with enhanced water solubility and anti-tumor effect in breast cancer[J]. Nanomedicine, 2013, 8:1429-1442. |
| [9] | Zhou J, Zhang XM, Li M, et al. Novel lipid hybrid albumin nanoparticle greatly lowered toxicity of pirarubicin[J]. Mol Pharm, 2013, 10:3832-3841. |
| [10] | Desai NP, Trieu V, Hwang LY, et al. Improved effectiveness of nanoparticle albumin-bound (nab) paclitaxel versus polysorbate-based docetaxel in multiple xenografts as a function of HER2 and SPARC status[J]. Anticancer Drugs, 2008, 19:899-909. |
| [11] | Pérez-Herrero E, Fernández-Medarde A. Advanced targeted therapies in cancer:drug nanocarriers, the future of chemo-therapy[J]. Eur J Pharm Biopharm, 2015, 93:52-79. |
| [12] | Cabral H, Matsumoto Y, Mizuno K, et al. Accumulation of sub-100 nm polymeric micelles in poorly permeable tumours depends on size[J]. Nat Nanotechnol, 2011, 6:815-823. |
| [13] | Popović Z, Liu WH, Chauhan VP, et al. A nanoparticle size series for in vivo fluorescence imaging[J]. Angew Chem Int Ed Engl, 2010, 49:8649-8652. |
| [14] | Perrault SD, Walkey C, Jennings T, et al. Mediating tumor targeting efficiency of nanoparticles through design[J]. Nano Lett, 2009, 9:1909-1915. |
| [15] | Wong C, Stylianopoulos T, Cui J, et al. Multistage nanoparticle delivery system for deep penetration into tumor tissue[J]. Proc Natl Acad Sci U S A, 2011, 108:2426-2431. |
| [16] | Ruan SB, Cao X, Cun XL, et al. Matrix metalloproteinase-sensitive size-shrinkable nanoparticles for deep tumor penetra-tion and pH triggered doxorubicin release[J]. Biomaterials, 2015, 60:100-110. |
| [17] | Ruan SB, He Q, Gao HL. Matrix metalloproteinase triggered size-shrinkable gelatin-gold fabricated nanoparticles for tumor microenvironment sensitive penetration and diagnosis of glioma[J]. Nanoscale, 2015, 7:9487-9496. |
| [18] | Yu Y, Zhang XL, Qiu LY. The anti-tumor efficacy of curcumin when delivered by size/charge-changing multistage polymeric micelles based on amphiphilic poly(β-amino ester) derivates[J]. Biomaterials, 2014, 35:3467-3479. |
| [19] | Tong R, Hemmati HD, Langer R, et al. Photoswitchable nanoparticles for triggered tissue penetration and drug delivery[J]. J Am Chem Soc, 2012, 134:8848-8855. |
| [20] | Tong R, Chiang HH, Kohane DS. Photoswitchable nanopar-ticles for in vivo cancer chemotherapy[J]. Proc Natl Acad Sci U S A, 2013, 110:19048-19053. |
| [21] | Blum AP, Kammeyer JK, Rush AM, et al. Stim-uli-responsive nanomaterials for biomedical applications[J]. J Am Chem Soc, 2015, 137:2140-2154. |
| [22] | Nam J, Won N, Jin H, et al. pH-Induced aggregation of gold nanoparticles for photothermal cancer therapy[J]. J Am Chem Soc, 2009, 131:13639-13645. |
| [23] | Lee DJ, Oh YT, Lee ES. Surface charge switching nanopar-ticles for magnetic resonance imaging[J]. Int J Pharm, 2014, 471:127-134. |
| [24] | Heldin CH, Rubin K, Pietras K, et al. High interstitial fluid pressure-an obstacle in cancer therapy[J]. Nat Rev Cancer, 2004, 4:806-813. |
| [25] | Fan YC, Du WW, He B, et al. The reduction of tumor interstitial fluid pressure by liposomal imatinib and its effect on combination therapy with liposomal doxorubicin[J]. Biomaterials, 2013, 34:2277-2288. |
| [26] | Zhang L, Wang Y, Yang YT, et al. High tumor penetration of paclitaxel loaded pH sensitive cleavable liposomes by depletion of tumor collagen I in breast cancer[J]. ACS Appl Mater Interfaces, 2015, 7:9691-9701. |
| [27] | Kohli AG, Kivimäe S, Tiffany MR, et al. Improving the distribution of Doxil in the tumor matrix by depletion of tumor hyaluronan[J]. J Control Release, 2014, 191:105-114. |
| [28] | Chauhan VP, Stylianopoulos T, Martin JD, et al. Normalization of tumour blood vessels improves the delivery of nanomedicines in a size-dependent manner[J]. Nat Nanotechnol, 2012, 7:383-388. |
| [29] | Maes H, Kuchnio A, Peric A, et al. Tumor vessel normalize-tion by chloroquine independent of autophagy[J]. Cancer Cell, 2014, 26:190-206. |
| [30] | Ruan SB, Yuan MQ, Zhang L, et al. Tumor microenviron-ment sensitive doxorubicin delivery and release to glioma using angiopep-2 decorated gold nanoparticles[J]. Biomaterials, 2015, 37:425-435. |
| [31] | Li L, Sun W, Zhong JJ, et al. Multistage nanovehicle deliv-ery system based on stepwise size reduction and charge reversal for programmed nuclear targeting of systemically administered anticancer drugs[J]. Adv Funct Mater, 2015, 25:4101-4113. |
| [32] | Mintz A, Gibo DM, Slagle-Webb B, et al. IL-13Rα2 is a glioma-restricted receptor for interleukin-13[J]. Neoplasia, 2002, 4:388-399. |
| [33] | Gao HL, Yang Z, Zhang S, et al. Glioma-homing peptide with a cell-penetrating effect for targeting delivery with enhanced glioma localization, penetration and suppression of glioma growth[J]. J Control Release, 2013, 172:921-928. |
| [34] | Weerakkody D, Moshnikova A, Thakur MS, et al. Family of pH (low) insertion peptides for tumor targeting[J]. Proc Natl Acad Sci U S A, 2013, 110:5834-5839. |
| [35] | Guo JW, Gao XL, Su LN, et al. Aptamer-functionalized PEG-PLGA nanoparticles for enhanced anti-glioma drug delivery[J]. Biomaterials, 2011, 32:8010-8020. |
| [36] | Li JJ, Guo MM, Han SP, et al. Preparation and in vitro evaluation of borneol and folic acid co-modified doxorubicin loaded PAMAM drug delivery system[J]. Acta Pharm Sin (药学学报), 2015, 50:899-905. |
| [37] | Krishnamurthy S, Ke XY, Yang YY. Delivery of therapeutics using nanocarriers for targeting cancer cells and cancer stem cells[J]. Nanomedicine, 2015, 10:143-160. |
| [38] | Qiao MX, Zhang XJ, Shuang BA, et al. Progress in the study of targeted drug delivery systems for cancer stem cells[J]. Acta Pharm Sin (药学学报), 2013, 48:477-483. |
| [39] | Wang CH, Chiou SH, Chou CP, et al. Photothermolysis of glioblastoma stem-like cells targeted by carbon nanotubes conjugated with CD133 monoclonal antibody[J]. Nanomedi-cine, 2011, 7:69-79. |
| [40] | Yao HJ, Zhang YG, Sun L, et al. The effect of hyaluronic acid functionalized carbon nanotubes loaded with salinomycin on gastric cancer stem cells[J]. Biomaterials, 2014, 35:9208-9223. |
| [41] | Shen HX, Shi SJ, Zhang ZR, et al. Coating solid lipid nanoparticles with hyaluronic acid enhances antitumor activity against melanoma stem-like cells[J]. Theranostics, 2015, 5:755-771. |
| [42] | Zhao G, Rodriguez BL. Molecular targeting of liposomal nanoparticles to tumor microenvironment[J]. Int J Nanome-dicine, 2013, 8:61-71. |
| [43] | Zhao B, Fan YC, Wang XQ, et al. Cellular toxicity and anti-tumor efficacy of iRGD modified doxorubixin loaded sterically stabilized liposomes[J]. Acta Pharm Sin (药学学报), 2013, 48:417-422. |
| [44] | Tu LX, Xu YH, Tang CY, et al. In vivo imaging in tumor-bearing animals and pharmacokinetics of PEGylated li-posomes modified with RGD cyclopeptide[J]. Acta Pharm Sin (药学学报), 2012, 47:646-651. |
| [45] | Ruan SB, Qian JB, Shen S, et al. Non-invasive imaging of breast cancer using RGDyK functionalized fluorescent carbo-naceous nanospheres[J]. RSC Adv, 2015, 5:25428-25436. |
| [46] | Raggi C, Mousa HS, Correnti M, et al. Cancer stem cells and tumor-associated macrophages:a roadmap for multitargeting strategies[J]. Oncogene, 2015. DOI:10.1038/onc.2015.132. |
| [47] | Yokoi K, Godin B, Oborn CJ, et al. Porous silicon nanocarriers for dual targeting tumor associated endothelial cells and macrophages in stroma of orthotopic human pancreatic cancers[J]. Cancer Lett, 2013, 334:319-327. |
| [48] | Zhu SJ, Niu MM, O'Mary H, et al. Targeting of tumor-associated macrophages made possible by PEG-sheddable, mannose-modified nanoparticles[J]. Mol Pharm, 2013, 10:3525-3530. |
| [49] | Blagosklonny MV. Antiangiogenic therapy and tumor progression[J]. Cancer Cell, 2004, 5:13-17. |
| [50] | Yu JL, Rak JW, Coomber BL, et al. Effect of p53 status on tumor response to antiangiogenic therapy[J]. Science, 2002, 295:1526-1528. |
| [51] | Gao HL, Yang Z, Cao SJ, et al. Tumor cells and neovascula-ture dual targeting delivery for glioblastoma treatment[J]. Biomaterials, 2014, 35:2374-2382. |
| [52] | Gao HL, He Q. The interaction of nanoparticles with plasma proteins and the consequent influence on nanoparticles behavior[J]. Expert Opin Drug Deliv, 2014, 11:409-420. |
| [53] | Guo Z, He B, Jin H, et al. Targeting efficiency of RGD-modified nanocarriers with different ligand intervals in response to integrin αvβ3 clustering[J]. Biomaterials, 2014, 35:6106-6117. |
| [54] | Yang Y, Yang DL, Schluesener HJ, et al. Advances in SELEX and application of aptamers in the central nervous system[J]. Biomol Eng, 2007, 24:583-592. |
| [55] | Zhan CY, Li B, Hu LJ, et al. Micelle-based brain-targeted drug delivery enabled by a nicotine acetylcholine receptor ligand[J]. Angew Chem Int Ed Engl, 2011, 50:5482-5485. |
| [56] | Li JW, Feng L, Fan L, et al. Targeting the brain with PEG-PLGA nanoparticles modified with phage-displayed peptides[J]. Biomaterials, 2011, 32:4943-4950. |
| [57] | Wang XL, Wang QQ, Song HF. Advance in the study of targeting delivery system for siRNA mediated by aptamers[J]. Acta Pharm Sin (药学学报), 2012, 47:850-855. |
 2016, Vol. 51
2016, Vol. 51


