酪氨酸激酶的过度激活与肿瘤发生、发展和预后密切相关[1]。从酪氨酸激酶抑制剂 (TKIs) 来研究新的抗肿瘤药物,已取得巨大的突破,如针对断裂点簇-艾贝尔逊融合基因 (BCR-ABL) 的伊马替尼[2]、尼洛替尼[3],针对EGFR受体酪氨酸激酶的吉非替尼[4]等。2010~2015年,CFDA批准临床试验的1.1类小分子靶向抗癌药约70个,其中酪氨酸激酶抑制剂占一半左右 (咸达数据V3.2)。截至2015年初,CFDA批准在国内上市的小分子TKIs有9个,其中由我国自主研发的埃克替尼和阿帕替尼,分别于2011年8月和2014年12月上市,其余7个为国外研制的TKIs抗肿瘤药物,在人体的药动学情况已有综述[5]。本文综述了我国自主研发的几个TKIs抗肿瘤新药的代谢研究,包括埃克替尼、阿帕替尼、法米替尼、氟马替尼、艾力替尼、呋喹替尼和塞拉替尼。
药物代谢研究利用多种方法研究药物在机体内的吸收、分布、代谢和排泄 (ADME)。通过对药物代谢的研究,可以从定性、定量及药动学方面了解 药物在体内的活化、去活化及产生毒性的过程; 不仅可以阐明药物在机体内的代谢过程,还对新药设计与开发起到重要的指导作用。随着科学技术的发展 和各专业之间的相互渗透,药物代谢研究方法日渐多元化和成熟。在已有的TKIs人体临床试验数据综述的基础上[5],本文系统地总结了我国自主研发的几种TKIs在患者或健康受试者体内的代谢、生物转化和处置情况; 并从目前抗癌药物的代谢研究方法上阐述我国药物代谢研究水平的不足。
1 埃克替尼 1.1 药理作用埃克替尼 (icotinib) 是选择性EGFR抑制剂 (IC50 = 5 nmol·L-1),是浙江贝达药业合成的侧链为冠醚的喹唑啉类药物[6],为已上市抗癌药厄洛替尼的结构类似物。埃克替尼是我国第一个具有自主知识产权的小分子靶向抗肿瘤新药,2011年8月在中国上市,用于治疗既往接受过至少一个化疗方案 (主要为铂类) 失败后的局部晚期或转移性非小细胞肺癌 (NSCLC)。在临床研究中发现,埃克替尼对于NSCLC引起的软脑膜癌病也有很好的治疗效果[7, 8]。
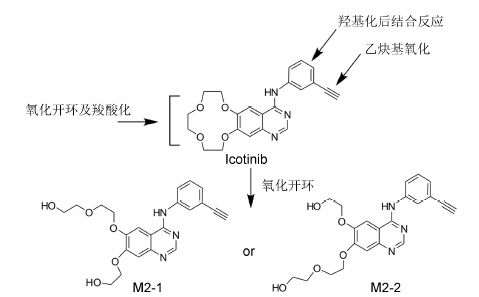
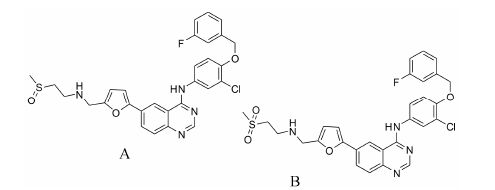
1.2 体内代谢物鉴定Guan等[9]利用Thermo- Finnigan LCD 离子阱质谱仪检测到了大鼠体内的6种代谢物,包括4种I相代谢物和2种II相代谢物,推测的主要代谢途径是冠醚环的氧化开环和苯环羟基化。从大鼠尿中分离纯化出2个代谢物对照品,分别为仲胺对位羟基化产物和冠醚氧化开环产物 (标记为M2-1,图 1),以质谱和NMR手段确证了结构。由于代谢物中含有羧基或醇羟基,推测氧化过程中有反应性代谢物醛的产生,因此以氨基脲为捕获试剂,通过加成产物的质谱裂解信息推测了反应性代谢物的结构,确证了冠醚氧化开环过程中产生含醛基的反应性中间体。
Liu等[10]研究了埃克替尼在人体内的代谢物,共检测到人体内的29种代谢物 (21种同分异构体),主要代谢物与Guan等[9]推测的相同。从人粪中分离纯化出5种主要的代谢物对照品,其中仲胺对位羟基化代谢物对照品与Guan等获得的相同,标记为M2-2的代谢物对照品 (图 1) 与Guan等获得的对照品M2-1为同分异构体,且人体内代谢物鉴定过程中未发现M2-1,显示出埃克替尼在大鼠和人体内代谢位点的差异。
1.3 人体内ADME特征原形和代谢物在血浆中生成和消除迅速,健康受试者服药3 h后,血浆中检测不到代谢物。埃克替尼在人体内的主要代谢途径有3个: 12-冠-4-醚部分的氧化开环及进一步氧化、苯环羟基化及硫酸或葡糖醛酸结合、乙炔基氧化 (图 1)。服药后0~3 h血浆中共检测到5种代谢物 (M1-M5),为冠醚环氧化开环和苯环羟基化生成,是体循环中主要代谢物。每日两次口服埃克替尼150 mg,达稳态之后,血浆中M1-M5的Cmax和AUC0-∞分别占原形的20.9% 和22.5%,其中仲胺对位羟基化代谢物M3含量最高,暴露量占原形的8.6%。人体尿、粪中回收到总的药物相关物质占剂量的80% 左右[11]。
1.4 埃克替尼代谢酶及药物相互作用Chen等[12]研究显示,CYP3A4、CYP2C19和CYP1A2是埃克替尼的主要代谢酶。CYP3A4贡献率为53.48%,CYP2C19和CYP1A2贡献率超过30%。研究还建立了PBPK模型预测埃克替尼与酮康唑或利福平合用时对其药动学的影响。与酮康唑或利福平合用时,AUC为单独使用埃克替尼的3.22倍和0.55倍。埃克替尼的推荐剂量为125 mg TID,远低于最大耐受剂量625 mg TID,根据此预测的结果,与酮康唑或利福平合用时对临床治疗不会产生较大的安全问题。
1.5 基因多态性对药动学影响CYP2C19在埃克替尼的代谢中起到了一定作用,不同基因型对埃克替尼药动学有明显影响。弱代谢基因型 (CYP2C19*2和CYP2C19*3) 与野生纯合子基因型相比,人体血浆中埃克替尼的系统暴露量高,Cmax和AUC0-∞分别为后者的1.41和1.56倍[13]。
埃克替尼虽已上市,但是尚未进行人体药物-药物相互作用研究,对临床合并用药安全性无数据支持。
2 阿帕替尼 2.1 药理作用甲磺酸阿帕替尼 (apatinib,YN968D1) 由江苏恒瑞医药公司研发,于2014年12月上市,治疗晚期胃癌,是全球首个被证实在晚期胃癌标准化疗失败后,安全有效的小分子抗血管生成靶向药物。阿帕替尼高选择性地抑制血管内皮生长因子受体-2 (VEGFR-2,IC50 = 1.9 nmol·L-1),阻断VEGF与其受体结合后的下游信号转导,抑制肿瘤血管生成,从而控制肿瘤[14, 15]。阿帕替尼作用于SP细胞和P-gp过表达的白血病细胞,在K562/ADR细胞中减弱对阿霉素、柔红霉素和长春碱的耐药作用[16]。阿帕替尼还可以抑制P-gp和乳腺癌耐药蛋白 (BCRP),减弱多药耐药 (MDR),使细胞内其他化疗药物浓度升高[17]。
2.2 人体内ADME特征阿帕替尼的口服生物利用度低 (大鼠9.24%,犬15.4%),肿瘤患者口服后达峰时间为2.9~4.7 h,吸收入体循环的药物经历了广泛代谢[18]。患者口服阿帕替尼后共检测到49种代谢物,其中血浆、尿和粪中分别检测到23、35和14种代谢物。合成和分离纯化了9个代谢物对照品,从而确证了9个主要代谢物的结构。血浆中主要代谢物有5种,分别通过E-和Z-羟基化 (M1-1、M1-2)、25-N-氧化(M1-6)、N-去烷基和E-3-羟基化和O-葡糖醛酸结合 (M9-2) 产生。血浆中这4种途径产生的主要代谢物为M1-1、M1-2、M1-6和M9-2 (图 2),晚期结直肠癌患者每日一次口服750 mg阿帕替尼28天后,这4种代谢物的暴露量 (摩尔量) 分别占原形药物的56%、22%、32% 和125%[19],尿中几乎检测不到原形,几种代谢物的排泄量都小于给药剂量的2%。粪中主要以原形药物为主,约59.0% 的原形药物从粪中排泄。粪中主要代谢物M1-1、M1-2和总的双氧化物排泄量分别占给药剂量的2.76%、1.20% 和6.8%。服药后96 h内排泄总回收率为76.8%,粪中回收69.8%,尿中回收7.02%[18]。阿帕替尼在人体内的主要代谢途径见图 2。

|
图 2 阿帕替尼人体内主要代谢物及代谢途径[18] |
Ding等[18]研究 表明,约95% 的阿帕替尼在体外重组酶CYP3A4/5 和CYP2D6孵化体系中被代谢,表明CYP3A4/5和CYP2D6为主要代谢酶。通过重组酶的酶促动力学实验,表明CYP2D6是催化M1-1和M1-6生成的主要代谢酶,M1-2主要由 CYP3A4代谢生成。通过分别将M1-1和M1-2在人肝、肠、肺和肾微粒体中孵化,M9-2主要在肝和肾微粒体中生成,表明体循环中主要药物相关物质M9-2的生成部位主要是肝脏和肾脏,且是由M1-1通过O-葡糖醛酸结合得到。分别将M1-1和M1-2与12种UGT重组酶共孵,结果显示UGT2B7是催化M9-2生成的主要UGT酶。
2.4 大鼠体内药物相互作用Zhou等[20]研究了阿帕替尼在大鼠体内对主要CYP450酶的抑制作用,给予大鼠4种CYP酶特异性底物: 非那西汀、氯沙坦、美托洛尔和咪达唑仑分别作为CYP1A2、2C11、2D4和3A1的底物。结果显示,服用阿帕替尼之后,使大鼠体内非那西汀、氯沙坦、美托洛尔和咪达唑仑的AUC0-t分别增加至对照组的3.71、1.84、10.8和7.26倍。由于大鼠的CYP1A2、CYP2C11、CYP2D4和CYP3A1分别与人的CYP1A2、CYP2C9、CYP2D6和CYP3A4同源,由此可以推测,阿帕替尼抑制人体CYP1A2、CYP2D6和CYP3A4的作用较强,建议临床用药时避免该酶的敏感底物与阿帕替尼同服。
3 法米替尼 3.1 研究现状法米替尼 (famitinib,SHR1020) 是恒瑞医药自主研发的抗肿瘤新药,是一个口服多靶点受体酪氨酸激酶抑制剂,目前处于临床Ⅲ期阶段。体外实验报道法米替尼抑制c-kitproto原癌基因、VEGFR-2和血小板衍生生长因子受体 (PDGFR) 的IC50值分别为2.3、4.7和6.6 nmol·L-1,体内表现出广泛的肿瘤抑制活性。法米替尼体内、外抗肿瘤作用均优于其结构类似物舒尼替尼,临床试验中延长了晚期转移性结直肠癌患者的无进展生存期,具有良好的安全性和耐受性[21]。
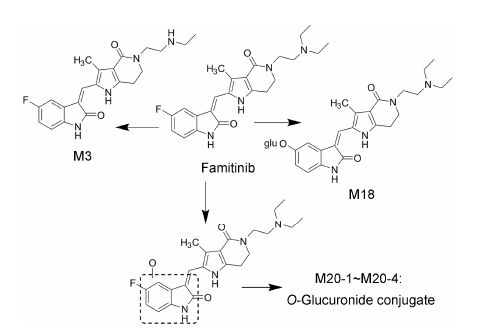
3.2 人体内ADME特征Xie等[22]研究了法米替尼在肿瘤患者体内的代谢及生物转化过程。法米替尼在人体内吸收缓慢,达峰时间为4.4~6.8 h。法米替尼的主要代谢位点有3个: 三乙胺部分、氟原子及二氢亚吲哚环。合成获得6个代谢物对照品,确证了体循环中6个主要代谢物结构。血浆中检测到23种代谢物,主要代谢物为活性的N-去乙基法米替尼 (M3)、氧化脱氟后葡糖醛酸结合物M18及二氢亚吲哚环氧化后的葡糖醛酸结合物M20-2。体循环中主要以原形药物为主,主要代谢物N-去乙基法米替尼 (M3) 在稳态时暴露量占原形的7.2%~7.5%。尿、粪中分别共检测到40、27种代谢物,尿中主要代谢物是经N-脱乙基、氧化脱氟及进一步与葡糖醛酸结合、二氢亚吲哚环氧化进一步葡糖醛酸结合形成的。粪中主要代谢物通过氧化脱氟、氧化脱氨及进一步半胱氨酸结合途径产生,原形及主要代谢物排泄量占剂量的56.3%。尿、粪回收的药物相关物质分别占每日剂量的14.2% 和56.3%,粪排泄是主要的排泄途径。法米替尼在人体的主要代谢途径见图 3。
|
图 3 推测的法米替尼在人体内代谢途径[22] |
Xie等[22]的研究表明,多种酶在法米替尼的氧化代谢中起重要作用,包括CYP3A4/5、CYP1A1/2、醛氧化酶及黄 素单氧化酶 (FMO3)。法米替尼在人原代肝细胞中 也显示出了生物转化及由此引起的毒性,IC50值为13.7 μmol·L-1。检测结果说明GSH结合在法米替尼的二氢亚吲哚环上,为氧化脱氟后的产物。因此,首先考察细胞毒性是否由法米替尼氧化脱氟后的代谢物产生,但该代谢物产生GSH结合产物远远少于原形产生的,因此推测是由原形直接活化产生反应性代谢物,经CYP1A1/2代谢在二氢亚吲哚环上生成环氧化物同时脱氟重排形成醌亚胺结构,从而产生肝细胞毒性。
法米替尼的人体代谢及物料平衡试验中,通过合成主要代谢物的对照品得出其回收率为70%,并且推测了含氟二氢亚吲哚环可能的生物活化过程,推测法米替尼的结构类似物舒尼替尼也可能发生类似的生物活化,可能是舒尼替尼产生肝毒性的原因。
4 氟马替尼 4.1 研究现状甲磺酸氟马替尼 (flumatinib) 是江苏豪森药业股份有限公司研发的新一代靶向创新药物,用于治疗白血病及其他肿瘤疾病,目前我国未上市。与现有的同类产品相比,体内、外活性更强,毒性更低,是比目前白血病首选治疗药物伊马替尼更为优越、不良反应更小的替代品种。氟马替尼是选择性的BCR-ABL/PDGFR/KIT抑制剂,体外实验结果显示氟马替尼能有效地克服某些KIT突变导致的耐药性,体内实验也显示,与伊马替尼和舒尼替尼相比,氟马替尼对有Y823D突变的32D细胞有更强的作用活性[23, 24]。氟马替尼作为伊马替尼的替代治疗药物,对中国慢性粒细胞白血病 (CML) 患者的临床治疗意义重大,可降低治疗费用。
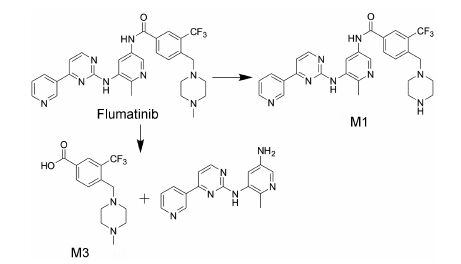
4.2 人体内代谢情况Gong等[25]研究并表征了口服氟马替尼后,在CML患者体内的代谢情况。利用UPLC/Q-TOF MS检测到了氟马替尼在人体内的34种代谢物,其中7种代谢物通过合成对照品确证了结构。在患者血浆和粪中以原形药物为主,人体主要的代谢途径是酰胺水解。
血浆中检测到13种代谢物,主要代谢物为酰胺水解产物M3和活性代谢物N-去甲基氟马替尼M1,M1活性与原形相当,酰胺水解产物M3在血浆中含量为原形药物的30%。尿中检测到30种代谢物,主要代谢物为M3,其在尿中含量为原形的3倍。粪中主要是未代谢的原形药物。粪中除原形外,共检测到15种代谢物,主要代谢物是N-去甲基代谢物M1、N-去甲基后氧化产物等。人体最主要代谢途径为酰胺 水解,其他途径包括N-去甲基 (M1)、N-氧化、羟基化和葡糖醛酸化。氟马替尼在人体的主要代谢途径 见图 4。
|
图 4 氟马替尼在人体的主要代谢途径[25] |
抗肿瘤新药甲苯磺酸艾力替尼 (allitinib) 为上海艾力斯医药科技有限公司自主研发的口服制剂,选择性作用于EGFR/ErbB2受体,为不可逆抑制剂。临床前显示该药在分子水平、细胞水 平和动物实验中,具有很强的抗肿瘤生长作用,可减弱由BCRP引起的多重耐药性,对第一代替尼耐药的T790M细胞具有抑制其生长的作用[26-28]。目前处于临床II期试验阶段。
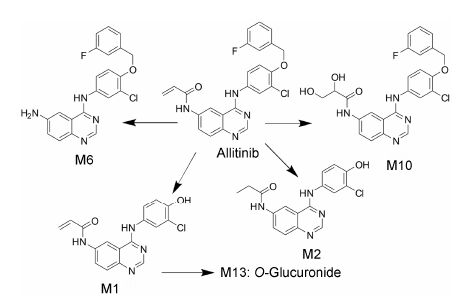
5.2 人体内ADME特征艾力替尼是拉帕替尼的 结构类似物,但是含有一个有药理活性的α,β-不饱和羰基侧链,该基团是亲电性的,能够通过Michael加成共价结合于EGFR的Cys797残基和ErbB2的Cys805残基上的半胱氨酸[26]。在体内,α,β-不饱和羰基是主要代谢位点。
艾力替尼口服生物利用度低 (大鼠5.7%),吸收入血后代谢广泛[29]。通过合成获得6个艾力替尼的代谢物对照品,肿瘤患者口服艾力替尼后,血浆中检测到11种代谢物,主要代谢物有酰胺水解产物M6和双键氧化开环形成的二醇代谢物M10 (图 5)。每日3次口服1 g甲苯磺酸艾力替尼21天后,两个主要代谢物的AUC0-24 h分别占原形药物的11% 和70% (摩尔浓度)。尿中检测到12种代谢物,主要代谢物为O-去烷基代谢物M1及其葡糖醛酸结合物M13,尿中 排泄总量占剂量的0.042%。粪中检测到10种代谢物,主要为未代谢的原形药物。在稳态期,原形和主要代谢物排泄量占剂量的32.5%。艾力替尼在人体的主要代谢途径见图 5。
|
图 5 推测的艾力替尼在患者体内的代谢途径图[29] |
Lin等[29]研究表明,艾力替尼的主要代谢酶是CYP3A4,其次是CYP3A5和CYP2C8。CYP3A4/5也是催化活性代谢物M1和M10生成的主要代谢酶。酰胺水解产物M6可以在不含NADPH的人肝微粒体中生成,说明M6的生物转化是由酰胺水解酶催化的。在研究M10生成途径时,在HLM孵化体系中加入丙戊酰胺 (环氧化物水解酶抑制剂) 后,M10的生成量减少,且可以检测到环氧化物,该化合物含量随着丙戊酰胺浓度的增加而增加。以此证实M10的生成先由CYP3A4/5催化形成环氧化物中间体,然后在环氧化物水解酶的作用下开环形成二醇结构的M10。在高浓度下,可以检测到GSH结合物,但是低浓度下检测不到,仅检测到M10,说明环氧中间体更倾向于水解开环。
艾力替尼的代谢研究显示,尿粪中回收率为32.5%,其余约68% 的药物清除途径不详,由此更显示出14C标记药物的人体物质平衡试验的重要性。艾力替尼在药物设计时,避开了拉帕替尼的结构警示基团,即不会产生拉帕替尼类似的代谢引起的酶失活[30]。艾力替尼结构中α,β-不饱和羰基是与EGFR/ErbB2结合的部位,也是代谢活性位点。
6 呋喹替尼 6.1 研究现状呋喹替尼 (fruquintinib HMPL-013) 是由和记黄埔医药研发的高选择性VEGFR1、2、3抑制剂,IC50值分别为33、35和0.5 nmol·L-1[31]。用于治疗前列腺癌、黑色素瘤,目前处于临床III期阶段。
6.2 临床前ADME临床前的吸收、分布、代谢和排泄是成药性的重要指标。呋喹替尼的临床前试验显示出良好的药效、PK性质,组织中分布广且产生临床DDI (drug-drug interactions) 可能性小。Gu等[32]研究表明: 呋喹替尼溶解度差,在pH 7.4缓冲液中的溶 解度为0.55 µg·mL-1,对Caco-2细胞的膜渗透性强,Papp(A-B)值为30×10-6 cm·s-1,非P-gp或BCRP底物,口服生物利用度为40%~50%。游离药物在大鼠体内分布约4%,犬体内约12%; 在大鼠胃肠道、肝、脂肪、肾上腺和肾中的浓度高于血浆中浓度,在组织中无蓄积,14 h后组织中药物浓度低于Cmax的3%。在各种属肝微粒体中检测到3个代谢物,通过合成对照品鉴定了M1 (O-去甲基) 和M2 (羟基化) 的结构 (图 6),M3的结构不明确。体外呋喹替尼对所有测定的CYP亚型都没有可逆性抑制作用; 仅考察了对CYP1A2和3A4的诱导作用,结果显示呋喹替尼对两者的诱导作用不明显。从大鼠粪中回收22.1%,尿中回收11.1%。呋喹替尼在大鼠体内的主要代谢途径见图 6。

|
图 6 呋喹替尼在大鼠体内的主要代谢途径[32] |
从呋喹替尼的临床前试验结果来看,其在组织中消除快,且脑、骨髓和睾丸中几乎没有分布,原因不明。在物质平衡试验中,仅回收33%,其余67% 的药物清除途径不明确。代谢方面,仅检测到3个代谢物,通过合成对照品确证2个,可能遗漏主要代谢物而导致药物回收率低。因此,需要进行放射性标记药物在动物和人体的代谢研究来解答这些问题。
7 塞拉替尼的人体放射性标记药物研究放射性标记药物在人体的ADME试验可以提供更为详尽的代谢数据[33]。进行放射性标记 (3H或14C) 试验可以定量地提供药物相关物质在体内的清除途径信息、总的有关物质在循环系统中的药动学及每个主要代谢途径中代谢产物占总清除率的比例[34]。14C产生的非离子化β-射线能量低,安全性较好,国际上主要将药物进行14C标记进行人体放射性药物代谢试验[35],该类研究在国外已开展40多年,上市药物中90% 以上都做过放射性标记的人体试验。但在中国,由于法律法规、伦理和人们的心理障碍等因素的限制,并没有做此类试验,而塞拉替尼的14C-AME研究开启了中国人体放射性研究的先河。
塞拉替尼 (GLNC-120,图 7) 由山东齐鲁制药研发,是拉帕替尼的结构类似物,将拉帕替尼侧链的砜替换为亚砜[36],其抑制EGFR/HER2的IC50分别为13.0和8.5 nmol·L-1[36],目前处于临床I期研究阶段。体外EGFR/HER2酪氨酸激酶的抑制活性与拉帕替 尼相似; 体内每天给予200 mg·kg-1可抑制NCI-N87肿瘤生长率达94.8%,抑制SK-OV-3肿瘤生长率达85.7%[36]; 给予SD大鼠等剂量的塞拉替尼和拉帕替尼,塞拉替尼的口服生物利用度更高,且血浆Cmax和AUC0-t都接近于拉帕替尼的两倍[36]。塞拉替尼的水溶性好 (404.6 mg·L-1)[36],口服生物利用度高,显示出“Me better”的特征。
|
图 7 塞拉替尼 (A) 和拉帕替尼 (B) 的化学结构式 |
[14C]GLNC-120给予6个健康男性志愿者,给药剂量为每人100 μCi,收集全血、血浆、尿和粪样 (资料见http://www.xbl-china.com/index.asp)。结果显示,尿和粪总回收率约为94%,粪排泄的回收率为92%,利用LC-RAM/MS鉴定主要代谢物结构的研究结果尚未发表。尽管如此,从这个例子也可说明我国药物代谢研究已迈上一个新的台阶。
8 讨论在代谢物鉴定方面,LC-MS和NMR是常用手 段[37]。在UPLC/Q-TOF MS平台上,IDA、MSE和SWATH方法都可以提供代谢物MS2图谱,对结构鉴定非常有利[38, 39]。对于一些特殊或不稳定代谢物,需要将样品制备方法与MS相结合,将样品进行化学衍生化、酶水解和H/D交换等[40]。例如,在鉴定阿帕替尼25-N-氧化物时不仅需要合成该代谢物的对照品来确证该结构,还需要将血浆和尿样品用TiCl3还原 (TiCl3能选择性地将N-氧化物还原为胺) 观察原形药物是否增加、25-N-氧化物是否减少,从两方面验证推测的代谢物结构是否正确。本文介绍的几种TKIs进行代谢物鉴定时主要以UPLC/Q-TOF MS为手段,以MSE和MDF进行数据采集和挖掘,从而得到这 几种TKIs的活性代谢位点主要在结构改造部分,埃克替尼在人体内主要代谢途径为冠醚环氧化开环和进一步氧化为羧酸; 阿帕替尼主要是氧化代谢后与葡糖醛酸结合; 法米替尼主要是N-去乙基和氧化脱氨途径; 氟马替尼主要为酰胺水解; 艾力替尼主要为酰胺水解和双键氧化形成二醇代谢物; 呋喹替尼主要是O-去甲基和羟基化; 塞拉替尼代谢研究尚未报道。从本文介绍的几种TKIs代谢研究来看,以高分辨质谱 (HRMS)、NMR并结合对照品合成来表征和鉴定人体内主要代谢物是常规方法,我国的代谢物鉴定研究手段与国际相同,研究水平已达到国际水准。
药物的代谢酶表型鉴定主要是研究参与药物清除的代谢酶的类型、数量和相对贡献率。目前主要有4种表型鉴定方法,即相关性分析法、化学抑制法、抗体抑制法和重组酶法[41]。国内主要以化学抑制法和重组酶法相结合来考察药物的主要代谢酶。这几种TKI药物都以CYP3A4为主要代谢酶,但是都有其他CYP450酶的参与 (氟马替尼未报道)。
研究药物代谢时,不仅要定性地了解药物在体内的代谢转化过程,还要定量地阐述药物在体内的动态分布和清除规律,这就依赖于合成或分离出代谢物的对照品。对于代谢广泛和给药剂量低的药物,没有合成的对照品时,代谢物的准确定量不易实现。而放射性检测在代谢物定量和复杂基质中检测药物相关物质方面显示出良好的优势。物质平衡研究是新药评价中很重要的数据,国外上市的药物中90% 以上都进行过放射性标记药物人体试验,回收到的药物相关物质都在剂量的70% 以上。与国际上研究代谢的方法相比,我国研发的这几种TKIs药物 (塞拉替尼除外) 都没有进行过人体14C-AME试验。目前,我国开展放射性人体研究在技术上完全可以实现,需要克服的主要是人们的心理障碍。根据FDA 有关放射性标记药物临床研究的法规[42],成年人单次口服最大放射性剂量为3 Rems (30 mSv),而一般进行放射性标记药物研究时口服剂量为每人100 μCi (吸收约1 mSv),远低于FDA规定的最大剂量,对人体没有危害。
塞拉替尼的14C-AME试验开创了我国放射性标记药物人体研究的先例,目前已经有其他几例药物也进行了人体放射性试验,显示出我国药物代谢研究正迈上新的台阶。这几种TKIs中,除氟马替尼未报道外,埃克替尼、阿帕替尼和法米替尼通过获得尽可能多的代谢物对照品,测得的药物回收率分别为80%、76.8% 和70%,艾力替尼和呋喹替尼的药物回收率低,约33% 左右,大部分原形药物的代谢及清除途径不明确,需进一步研究。
临床不良反应的发生除与药物作用靶点相关外,还与代谢过程产生的反应活性中间体密不可分。药物进入体内,在CYP450酶的作用下,形成多种多样的反应活性中间体与细胞内大分子结合产生毒性,如环氧化物、α,β-不饱和羰基、醌、醌亚胺、亚甲基醌、亚硝基等。体外研究方法主要是用捕获试剂与亲电 性中间体形成加成产物,以LC-MS/MS和NMR方法来确证加成产物结构从而可推断出生物活化的位点,捕获试剂有GSH、N-乙酰半胱氨酸、氰化物、氨基脲或DNA碱基等,以13C2-15N-GSH为捕获试剂可以检测到丢失78 Da的同位素标记的甘氨酸,从而提高检测的专属性[43]。在本文介绍的反应性代谢物鉴定时,以氨基脲为捕获试剂捕获到了埃克替尼冠醚环氧化开环的醛中间体; 以GSH为捕获试剂推测了法米替尼的吲哚环氧化脱氟重排为醌亚胺中间体的活化过程; 艾力替尼在代谢物研究时也提示,在高浓度下双键氧化形成的环氧化物易结合体内大分子物质产生毒性。
与药物代谢密切相关的DDI主要是对CYP450酶或转运体的抑制和诱导引起的。当药物主要经多 态性表达的酶或易被抑制和诱导的酶代谢时,DDI对于临床用药至关重要。许多上市的小分子TKIs是外排转运体P-gp和BCRP的底物或抑制剂,或对摄取转运体OCT1、OCT3有抑制作用 (如伊马替尼、厄洛替尼)[44],都会导致临床的DDI作用。以上几种我国研发的TKIs药物都没有人体DDI的报道,未来还需要进行相关研究来填补该空白以指导临床安全用药。在DDI预测方面,以PBPK模型预测埃克替尼与CYP3A4抑制剂合用时产生DDI的作用不明显; 阿帕替尼对大鼠体内与人同源的CYP1A2、2D6和3A4有抑制作用,临床需要密切关注阿帕替尼与该酶底物合用时的相互作用。
总之,由我国自主研发的几种TKIs抗癌药物,药理活性均强于第一代抗肿瘤药,在安全性和耐受性方面也显示出优势。随着我国药物代谢研究的不断发展和深入,不仅能完善这些TKIs药物的代谢数据,更能促进我国创新药物研究的发展。
| [1] | Roskoski R Jr. A historical overview of protein kinases and their targeted small molecule inhibitors[J]. Pharmacol Res, 2015, 100:1-23. |
| [2] | Druker BJ, Talpaz M, Resta DJ, et al. Efficacy and safety of a specific inhibitor of the BCR-ABL tyrosine kinase in chronic myeloid leukemia[J]. N Engl J Med, 2001, 344:1031-1037. |
| [3] | DeRemer DL, Ustun C, Natarajan K. Nilotinib:a second-generation tyrosine kinase inhibitor for the treatment of chronic myelogenous leukemia[J]. Clin Ther, 2008, 30:1956-1975. |
| [4] | Kris MG, Natale RB, Herbst RS, et al. Efficacy of gefitinib, an inhibitor of the epidermal growth factor receptor tyrosine kinase, in symptomatic patients with non-small cell lung cancer:a randomized trial[J]. J Am Med Assoc, 2003, 290:2149-2158. |
| [5] | Ding JF, Zhong DF. Clinical pharmacokinetics of small molecule tyrosine kinase inhibitors[J]. Acta Pharm Sin (药学学报), 2013, 48:1080-1090. |
| [6] | Hu SJ, Xie GJ, Zhang DX, et al. Synthesis and biological evaluation of crown ether fused quinazoline analogues as potent EGFR inhibitors[J]. Bioorg Med Chem Lett, 2012, 22:6301-6305. |
| [7] | Zhao X, Zhu GQ, Chen HM, et al. Efficacy of icotinib versus traditional chemotherapy as first-line treatment for preventing brain metastasis from advanced lung adenocarcinoma in patients with epidermal growth factor receptor-sensitive mutation[J]. J Cancer Res Ther, 2014, 10:C155-C159. |
| [8] | Gong L, Xiong M, Huang ZY, et al. Icotinib might be effective for the treatment of leptomeningeal carcinomatosis in non-small cell lung cancer with sensitive EGFR mutations[J]. Lung Cancer, 2015, 89:268-273. |
| [9] | Guan ZM, Chen XY, Wang YX, et al. Metabolite identifica-tion of a new antitumor agent icotinib in rats using liquid chromatography/tandem mass spectrometry[J]. Rapid Com-mun Mass Spectrom, 2008, 22:2176-2184. |
| [10] | Liu D, Jiang J, Zhang L, et al. Metabolite characterization of a novel anti-cancer agent, icotinib, in humans through liquid chromatography/quadrupole time-of-flight tandem mass spec-trometry[J]. Rapid Commun Mass Spectrom, 2011, 25:2131-2140. |
| [11] | Liu D, Jiang J, Zhang L, et al. Clinical pharmacokinetics, safety, and preliminary efficacy evaluation of icotinib in patients with advanced non-small cell lung cancer[J]. Lung Cancer, 2015, 89:262-267. |
| [12] | Chen J, Liu DY, Zheng X, et al. Relative contributions of the major human CYP450 to the metabolism of icotinib and its implication in prediction of drug-drug interaction between icotinib and CYP3A4 inhibitors/inducers using physiologically based pharmacokinetic modeling[J]. Expert Opin Drug Metab Toxicol, 2015, 11:857-868. |
| [13] | Ruan CJ, Liu DY, Jiang J, et al. Effect of the CYP2C19 genotype on the pharmacokinetics of icotinib in healthy male volunteers[J]. Eur J Clin Pharmacol, 2012, 68:1677-1680. |
| [14] | Li J, Zhao XM, Chen L, et al. Safety and pharmacokinet-ics of novel selective vascular endothelial growth factor receptor-2 inhibitor YN968D1 in patients with advanced malignancies[J]. BMC Cancer, 2010, 10:529. |
| [15] | Tian S, Quan HT, Xie CY, et al. YN968D1 is a novel and selective inhibitor of vascular endothelial growth factor receptor-2 tyrosine kinase with potent activity in vitro and in vivo[J]. Cancer Sci, 2011, 102:1374-1380. |
| [16] | Tong XZ, Wang F, Liang S, et al. Apatinib (YN968D1) enhances the efficacy of conventional chemotherapeutical drugs in side population cells and ABCB1-overexpressing leukemia cells[J]. Biochem Pharmacol, 2012, 83:586-597. |
| [17] | Mi YJ, Liang YJ, Huang HB, et al. Apatinib (YN968D1) reverses multidrug resistance by inhibiting the efflux function of multiple ATP-binding cassette transporters[J]. Cancer Res, 2010, 70:7981-7991. |
| [18] | Ding JF, Chen XY, Gao ZW, et al. Metabolism and pharma-cokinetics of novel selective vascular endothelial growth factor receptor-2 inhibitor apatinib in humans[J]. Drug Metab Dispos, 2013, 41:1195-1210. |
| [19] | Ding JF, Chen XY, Dai XJ, et al. Simultaneous determina-tion of apatinib and its four major metabolites in human plasma using liquid chromatography-tandem mass spectrometry and its application to a pharmacokinetic study[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2012, 895-896:108-115. |
| [20] | Zhou YF, Wang SH, Ding T, et al. Evaluation of the effect of apatinib (YN968D1) on cytochrome P450 enzymes with cocktail probe drugs in rats by UPLC-MS/MS[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2014, 973C:68-75. |
| [21] | Zhou AP, Zhang W, Chang CX, et al. Phase I study of the safety, pharmacokinetics and antitumor activity of famitinib[J]. Cancer Chemother Pharmacol, 2013, 72:1043-1053. |
| [22] | Xie C, Zhou JL, Guo ZT, et al. Metabolism and bioactiva-tion of famitinib, a novel inhibitor of receptor tyrosine kinase, in cancer patients[J]. Br J Pharmacol, 2013, 168:1687-1706. |
| [23] | Luo H, Quan H, Xie C, et al. HH-GV-678, a novel selec-tive inhibitor of BCR-ABL, outperforms imatinib and effectively overrides imatinib resistance[J]. Leukemia, 2010, 24:1807-1809. |
| [24] | Zhao J, Quan HT, Xu YP, et al. Flumatinib, a selective inhibitor of BCR-ABL/PDGFR/KIT, effectively overcomes drug resistance of certain KIT mutants[J]. Cancer Sci, 2014, 105:117-125. |
| [25] | Gong AS, Chen XY, Deng P, et al. Metabolism of flu-matinib, a novel antineoplastic tyrosine kinase inhibitor, in chronic myelogenous leukemia patients[J]. Drug Metab Dispos, 2010, 38:1328-1340. |
| [26] | Xie H, Lin LP, Tong LJ, et al. AST1306, a novel irreversi-ble inhibitor of the epidermal growth factor receptor 1 and 2, exhibits antitumor activity both in vitro and in vivo[J]. PLoS One, 2011, 6:e21487. |
| [27] | Zhang H, Wang YJ, Zhang YK, et al. AST1306, a potent EGFR inhibitor, antagonizes ATP-binding cassette subfamily G member 2-mediated multidrug resistance[J]. Cancer Lett, 2014, 350:61-68. |
| [28] | Zhang J, Cao JN, Li J, et al. A phase I study of AST1306, a novel irreversible EGFR and HER2 kinase inhibitor, in patients with advanced solid tumors[J]. J Hematol Oncol, 2014, 7:22. |
| [29] | Lin LS, Xie C, Gao ZW, et al. Metabolism and pharmacoki-netics of allitinib in cancer patients:the roles of cytochrome P450s and epoxide hydrolase in its biotransformation[J]. Drug Metab Dispos, 2014, 42:872-884. |
| [30] | Barbara JE, Kazmi F, Parkinson A, et al. Metabolism-dependent inhibition of CYP3A4 by lapatinib:evidence for formation of a metabolic intermediate complex with a ni-troso/oxime metabolite formed via a nitrone intermediate[J]. Drug Metab Dispos, 2013, 41:1012-1022. |
| [31] | Sun QL, Zhou JH, Zhang Z, et al. Discovery of fru-quintinib, a potent and highly selective small molecule inhibitor of VEGFR 1, 2, 3 tyrosine kinases for cancer therapy[J]. Cancer Biol Ther, 2014, 15:1635-1645. |
| [32] | Gu Y, Wang J, Li K, et al. Preclinical pharmacokinetics and disposition of a novel selective VEGFR inhibitor fru-quintinib (HMPL-013) and the prediction of its human pharmacokinetics[J]. Cancer Chemother Pharmacol, 2014, 74:95-115. |
| [33] | Penner N, Klunk LJ, Prakash C. Human radiolabeled mass balance studies:objectives, utilities and limitations[J]. Bio-pharm Drug Dispos, 2009, 30:185-203. |
| [34] | Penner N, Xu L, Prakash C. Radiolabeled absorption, distri-bution, metabolism, and excretion studies in drug development:why, when, and how?[J]. Chem Res Toxicol, 2012, 25:513-531. |
| [35] | Prakash C, Li Z, Orlandi C, et al. Assessment of exposure of metabolites in preclinical species and humans at steady state from the single-dose radiolabeled absorption, distribution, metabolism, and excretion studies:a case study[J]. Drug Metab Dispos, 2012, 40:1308-1320. |
| [36] | Zhang L, Fan CW, Guo ZR, et al. Discovery of a potent dual EGFR/HER-2 inhibitor L-2(selatinib) for the treatment of cancer[J]. Eur J Med Chem, 2013, 69:833-841. |
| [37] | Prakash C, Shaffer CL, Nedderman A. Analytical strate-gies for identifying drug metabolites[J]. Mass Spectrom Rev, 2007, 26:340-369. |
| [38] | Hopfgartner G, Tonoli D, Varesio E. High-resolution mass spectrometry for integrated qualitative and quantitative analysis of pharmaceuticals in biological matrices[J]. Anal Bioanal Chem, 2012, 402:2587-2596. |
| [39] | Zhu XC, Chen YP, Subramanian R. Comparison of informa-tion-dependent acquisition, SWATH, and MS(All) techniques in metabolite identification study employing ultrahigh-performance liquid chromatography-quadrupole time-of-flight mass spectrometry[J]. Anal Chem, 2014, 86:1202-1209. |
| [40] | Li WK, Zhang J, Tse FL. Strategies in quantitative LC-MS/MS analysis of unstable small molecules in biological matrices[J]. Biomed Chromatogr, 2011, 25:258-277. |
| [41] | Liu HY. Qualitative and quantitative methods for liver cytochrome P450's reaction phenotyping in drug discovery and development[J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2013, 27:760-765. |
| [42] | Food and Drug Administration, Department of Health and Human Services. 21 CFR 361.1-Radioactive drugs for cer-tain research uses[EB/OL]. 2015-10-29[2015-04-01]. http://www.access-data.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?fr=361.1. |
| [43] | Yan ZY, Caldwell GW. Stable-isotope trapping and high-throughput screenings of reactive metabolites using the isotope MS signature[J]. Anal Chem, 2004, 76:6835-6847. |
| [44] | Minematsu T, Giacomini KM. Interactions of tyrosine kinase inhibitors with organic cation transporters and multidrug and toxic compound extrusion proteins[J]. Mol Cancer Ther, 2011, 10:531-539. |
 2016, Vol. 51
2016, Vol. 51