2. 滨州医学院药学院, 山东烟台 264003
2. College of Pharmacy, Binzhou Medical University, Yantai 264003, China
前列腺癌 (prostate cancer,PCa) 是男性最常见的恶性肿瘤之一,其发病率随年龄的增长而增加,已成为严重威胁人类健康的恶性疾病。美国癌症学会公布的统计报告显示,前列腺癌的发病率在男性肿瘤中排名第一,死亡率排名第二,仅次于肺癌。早期前列腺癌细胞多为雄激素依赖性,但经过一段时间 (约14~30月) 内分泌治疗后,多转为非激素依赖性前列腺癌 (androgen independent prostate cancer,AIPC),最终转化为激素抵抗前列腺癌 (hormone refractory prostate cancer,HRPC)。HRPC分化度低、恶性度高,对去除雄激素无反应,癌细胞转移后,对常规肿瘤化疗药物治疗不敏感,死亡率高[1]。
对于早期前列腺癌的治疗,完整手术切除前列腺为首选治疗方案,然而手术治疗会伴有严重的并发症及医源性损伤,而且对已发生转移的前列腺癌无效。目前临床上中晚期前列腺癌的治疗主要采用化疗手段,常用的化疗药物主要有多西他赛、紫杉醇、米托蒽醌和雌二醇氮芥。但化疗存在组织选择性差、毒性反应大及耐药性等问题[2]。通过靶向给药可使药物选择性地作用于肿瘤细胞,增加肿瘤细胞对药物的摄取,减少对正常细胞毒性[3]。
前列腺特异性膜抗原 (prostate specific membrane antigen,PSMA) 是存在于前列腺上皮细胞膜的一种II型跨膜糖蛋白,氨基端位于细胞膜内,分子质量为100 kDa。PSMA在前列腺癌中高度表达,尤其是转移前列腺癌及激素抵抗前列腺癌。研究表明,PSMA是一种较前列腺特异性抗原 (prostate specific antigen,PSA) 和前列腺干细胞抗原 (prostate stem cell antigen,PSCA) 特异性和敏感性更高的肿瘤标志物,在前列腺癌的诊断和靶向治疗中显示出良好的应用前景[4, 5]。本文重点对以PSMA为靶标的配体-药物偶联物和PSMA激活前药的最新研究进展进行综述。
1 PSMA的基本结构及性质PSMA由750个氨基酸残基组成,分为3个部分: 胞内区域 (氨基酸序列1~18)、跨膜区域 (19~143) 和胞外区域 (44~750)。Davis等[6, 7]发现PSMA胞外区域具有3.5 Å的晶体结构,并证明它是一个与转铁蛋白受体结构相似的同型二聚体。胞外结构域包括: 蛋白酶区域、顶端区域和螺旋状区域。3个区域的交界面上有一个大约1 100 Å的腔室,含有双核Zn2+位点、催化残基以及底物结合的精氨酸片段。这个腔室就是底物与PSMA的结合部位,其结构如图 1所示[8]。
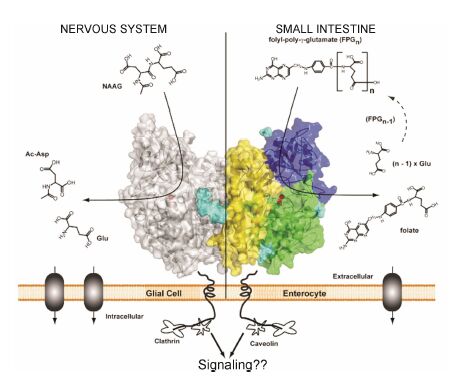
|
图 1 PSMA二聚体的晶体结构 |
PSMA主要具有4大功能: ① 参与信号的转导; ② 具有受体功能和内吞作用; ③ 具有促进细胞迁移的功能; ④ 具有叶酸水解酶以及羧肽酶的活性。鉴于其内吞功能及酶活性,以PSMA为靶标的纳米载体、配体-药物偶联物等靶向制剂及PSMA激活的前药的研究成为近年来研究的热点。PSMA通过受体介导的内吞 (receptor-mediated endocytosis,RME) 参与物质的转运,它通过网格蛋白 (clathrin) 和小窝蛋白-1 (calveolin-1) 包被的小窝介导内化作用,然后迅速回到细胞表面进行下一个循环内摄作用[8]。
此外,PSMA还具有叶酸水解酶I (FOLH I) 和N-乙酰基-α-连接二肽酶Ⅰ (NAALADase I) 活性[8],它在中枢神经系统中起作用,能将N-乙酰-天冬氨酰谷氨酸 (NAAG) 代谢成谷氨酸和N-乙酰天冬氨酸。PSMA在小肠中起作用,它能够从聚-γ-谷氨酸化的叶酸中去除γ键连接的谷氨酸以及从肽和小分子中去除α键连接的谷氨酸。研究发现,在正常组织中PSMA没有或者很少表达,而在前列腺癌和多种实体瘤新形成的血管中过度表达,尤其是转移性前列腺癌和激素抵抗前列腺癌。在前列腺癌中,PSMA的表达比正常前列腺上皮高1 000多倍。PSMA在肿瘤组织中表达的高度特异性使其成为前列腺癌靶向治疗最好的靶标之一[9, 10, 11]。将抗肿瘤药物制成前药,前药在血浆中没有活性,而在高度表达PSMA肿瘤组织中能够被激活,释放出活性形式的抗肿瘤药物。
2 配体-药物偶联物[8]选择对PSMA具有主动识别功能的配体,将其与抗肿瘤药物相连接,形成配体-药物偶联物,后者可通过受体介导的内吞作用选择性地被摄取到肿瘤细胞内,并可降低抗肿瘤药物对正常细胞的毒性,极大地减少药物的不良反应[10]。目前报道的PSMA配体包括单克隆抗体、核酸适配体和小分子配体。近年来,采用单克隆抗体及小分子配体制备的放射性核素及抗肿瘤药物偶联物,在前列腺癌的诊断和靶向治疗中已显示出良好的应用前景,上市及进入临床研究的诊断试剂与药物见表 1。
|
|
表 1 上市及进入临床研究的PSMA靶向药物及诊断试剂 |
单克隆抗体 (monoclonal antibody,mAb) 简称单抗,由激活的B淋巴细胞转化为浆细胞后分泌而来,每个B淋巴细胞株只能产生一种它专有的针对一种特异性抗原决定簇的抗体。按照抗原结合域的不同,PSMA抗体分为两种: 一种是胞内域抗体 (7E11、PM2J004.5等)。FDA于1997年批准放射性核素111In标记的单抗7E11 (111In-capromab pendetide) 上市,用于前列腺癌的检测,商品名为ProstaScint[11]。由于7E11的靶点是PSMA胞内部分的抗原决定簇,因此它们对活细胞不起结合作用,这在很大程度上限制了其在前列腺癌的诊断及治疗方面的应用。另一种是胞外域抗体 (J591、J415、J533、Hybritech PEQ226.5等)。J591是Bander等[12]研制出的第二代人源化单克隆抗体,它能够识别PSMA胞外两个明显的抗原决定基,因此可用于活性肿瘤细胞的靶向。以抗体作为靶头,通过化学键将其与细胞毒药物相连接所得到抗体偶联药物 (antibody drug conjugate,ADC) 是近年来肿瘤治疗领域的一大突破。偶联物特定的化学键的选择可以保证ADC在血液循环中的稳定性,主动识别并被摄取进入肿瘤组织后又能被相应的酶降解,释放出活性药物,发挥抗肿瘤作用。
MLN2704是单抗J591与美登醇1 (maytansinoid 1,大环内酯类化合物,微管聚合抑制剂) 相连所得到的ADC,结构见图 2。在23名转移型去势抵抗前列腺癌 (castration-resistant prostate cancer,CRPC) 患者中开展的I临床试验结果表明,有2名患者的PSA下降大于50%,有3名患者出现了三级药品相关毒性反应,8名患者出现了神经毒性。随后在62名转移型CRPC患者中开展了I/II期多中心实验。有2/3的患者PSA下降49%~88%,但是2、3度的外周神经毒性发生率高,其治疗效果受到其毒性的限制[13, 14]。
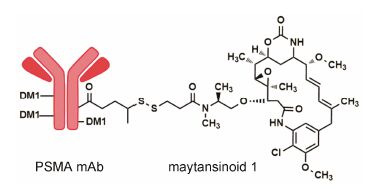
|
图 2 MLN2704的结构 |
Auristatin E是一种微管聚合抑制剂,Ma等[15, 16]合成了MAME-J591 (monomethylauristatin E-J591) 偶联物,该偶联物之间通过Val-Cit二肽键连接,结构见图 3。实验发现MAME-J591在血清中保持稳定,进入细胞后被人组织蛋白酶水解,MAME被释放并达到最大浓度。动物实验表明MAME-J591具有良好的选择性抗肿瘤作用,未发现明显的系统毒性作用。

|
图 3 MAME-J591的结构 |
核酸适配体 (aptamer),简称适体,是一段较短的单链DNA、RNA序列。通常 是利用体外筛选技术指数富集的配体系统进化(systematic evolution of ligands by exponential enrichment,SELEX) 技术,从核酸分子文库中筛选得到的寡核苷酸片段。适体因其构象灵活可折叠成独特的三维结构,暴露出活性位点与受体特异性地结合,其结合亲和力高。适体与抗体相比具有以下优点: 稳定性好,不易降解; 无免疫原性; 分子较小,组织渗透性强; 易于合成及化学修饰[17]。
A10适体是针对PSMA胞外区域的核酸适体,与PSMA具有较高的亲和力,其表观解离常数Kd为11.9 nmol·L-1。Bagalkot等[18]将阿霉素扁平的芳香环插入核酸适体A10三维构象中富含CG序列的短链结构中,得到了适体A10-阿霉素偶联物。药物与适体通过非共价作用结合,制备条件温和,不需要对适体或者药物进行化学修饰,避免药物或者适体失活并且通常会获得高的载药量。该偶联物对PSMA阳性表达的LNCaP细胞具有高度的特异靶向作用,而对PSMA阴性的PC-3细胞毒性较低。Chu等[19]将细胞毒蛋白gelonin与PSMA特异性适体连接,发现该偶联物能够选择性杀伤LNCaP细胞,半数抑制浓度为27 nmol·L-1,对LNCaP细胞的毒性比PC-3细胞大600多倍。
2.3 小分子配体偶联物虽然靶向PSMA的单克隆抗体在前列腺癌的分子影像学诊断及靶向治疗方面显示出一定的临床应用前景,但是单克隆抗体分子质量大,对前列腺癌肿瘤实质,尤其对淋巴结转移以及骨转移前列腺癌的渗透性差,体内循环半衰期长,易引起免疫应答反应,而且单克隆抗体生产成本高,不易保存,限制了其在前列腺癌诊断及治疗中的应用。近年来研究人员开发出一系列靶向PSMA的小分子配体,包括谷胺酰脲类和氨基磷酸酯类。这些小分子配体具有很多优势: 体外合成容易,易重现; 与受体结合力强; 与单抗相比易合成,无免疫原性,对于肿瘤实质以及肿瘤转移灶渗透性好[20, 21, 22, 23]。
典型的小分子配体-药物偶联物结构由4部分组成: 小分子配体 (targeting ligand)、连接臂 (spacer)、可断裂键 (cleavable bridge) 和药物 (therapeutic warhead),结构如图 4所示[24]。在小分子配体-药物偶联物的设计上,研究者主要注重以下几点: ① 配体与受体的亲和力 (binding affinity),亲和力越大,药物的选择性就越高,一般认为解离常数Kd小于10 nmol·L-1较好。② 药物与配体在细胞内分离的难易程度。已有的研究发现,偶联物分子中如含有二硫键、腙键等可断裂键,在细胞内比较容易释放出药物,有利于提高药物的效力。其中二硫键可以被细胞中的谷胱甘肽 (glutathione,GSH) 还原裂解,而腙键主要在细胞内吞腔较低pH的条件下水解断裂。③ 连接臂的性质。连接臂可选择一定长度的肽链、聚合物、烷基、多糖等,其作用主要是在药物与配体间形成一定的距离,保证配体与受体的结合,避免药物空间位阻的干扰。连接臂也可以连接一些官能团以改善偶联物的性质,如水溶性、透膜性等。④ 药物的选择。应选择药理作用强的药物,一般认为IC50小于1×10-8 mol·L-1较好。
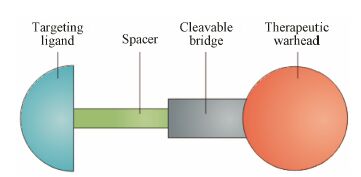
|
图 4 小分子配体-药物偶联物的典型结构[24] |
2-[3-(1,3-二羧基丙基) 脲基] 戊二酸 (2-[3-(1,3- dicarboxypropyl) ureido] pentanedioic acid,DUPA) 是谷胺酰脲类小分子配体,它是叶酸水解酶I活性抑制剂,同时能够竞争性抑制PSMA的N-乙酰基-α-连接二肽酶活性,因此能够高效与前列腺癌细胞表面的PSMA相结合,并且通过受体介导的内吞作用进入前列腺癌细胞。Kularatne等[21, 22]将DUPA与99mTc- Dap-Asp-Cys螯合物进行偶联得到可用于诊断前列腺癌的分子影像学探针; 而将DUPA与化疗药物TubH相结合所得到的偶联物在体外细胞实验中显示出了对PSMA阳性表达的LNCaP细胞的强烈活性,其结构见图 5。
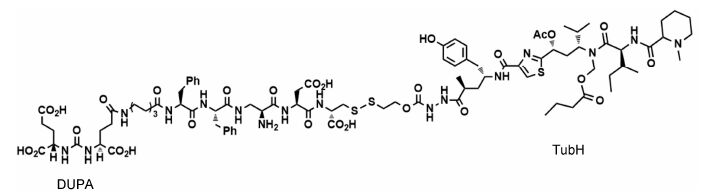
|
图 5 DUPA-TubH的结构 |
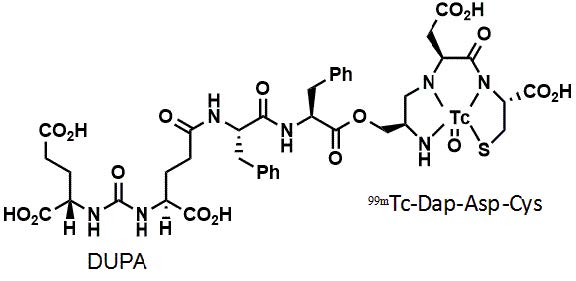
EC1169是将PSMA的小分子配体DUPA连接到天然抗癌产物TubBH制备的小分子药物偶联物,基于LNCaP细胞小鼠荷瘤模型的药效学实验结果表明,EC1169可产生完全的肿瘤抑制及治愈效果,目前该药已进入I期临床研究。EC0652是将DUPA与放射性核素99mTc连接制备的诊断试剂,用于表达PSMA的前列腺癌的诊断,筛选用于EC1169治疗的患者[25],0~II期临床研究正在开展,结构见图 6。
|
图 6 DUPA-99mTc的结构 |
PSMA具有叶酸水解酶和N-乙酰基-α-连接二肽酶I活性,能够催化α或γ键连接的谷氨酸从肽或小分子物质上水解出来。将抗肿瘤药物制成前药,前药在血浆中没有活性,而在高度表达PSMA肿瘤组织中能够被激活,释放出活性形式的抗肿瘤药物[26, 27, 28]。
由于聚-γ-谷氨酸甲氨蝶呤 (MTX) 是PSMA的底物,MTX被用于细胞毒药物以利于PSMA特异性底物的筛选。Mhaka等[26]合成一系列能被PSMA激活的MTX肽类前药,将MTX的4-[N-(2,4二氨基-6-蝶啶基-甲基)-N-甲基]氨基-苯甲酰 (简称APA) 的羧基与肽链的N端键合,评价其血浆稳定性及细胞毒性。PSMA发挥外肽酶活性,释放出MTX母药,产生抗肿瘤作用。实验结果表明,α-羧基键合的MTX二肽前药APA-Asp-Glu能被PSMA水解,且在血浆中稳定性良好。为了改善药物的水溶性,进一步将MTX和酸性多电荷五肽连接,制备MTX前药APA-
Glu-γGlu-γGlu-γGlu-γGlu和APA-Glu-γGlu-γGlu-γGlu- γAsp,二者均能被PSMA水解,但是血浆稳定性较差。制备的APA-Asp-Glu-γGlu-γAsp-Glu前药(图 7) 在48 h后,有77% 被PSMA水解,在血浆中18 h 后依然保持稳定。当质量浓度为10 μg·mL-1时,对PSMA阴性表达的TSU细胞的抑制率是25%,在加入PSMA后对细胞的抑制率提高到90%。因此为了保证前药的血浆稳定性及被PSMA水解激活的特性,PSMA底物的选择宜采用α-羧基和γ-羧基共同键合的氨基酸。

|
图 7 前药APA-Asp-Glu-γGlu-γAsp-Glu的结构 |
毒胡萝卜内酯 (thapsigargin) 是从天然植物毒胡萝卜中提取的一种细胞毒药物,它是SERCA泵抑制剂,通过干扰细胞内Ca2+ 浓度引起细胞程序性死亡。Denmeade等[27]将特定结构的肽连接到毒胡萝卜内酯衍生物上,制备成可被PSMA激活的前药G202 (12ADTβAsp-γGlu-γGlu-γGlu-Glu,见图 8),该前药 分子结构中Asp-γGlu-γGlu-γGlu-Glu是PSMA的底 物,12ADT为毒胡萝卜素内酯的衍生物。G202能够被PSMA的聚-γ-谷氨酸羧肽酶和N-乙酰基-α-连接 二肽酶激活,从而释放出细胞毒药物,肽序列Asp- γGlu-γGlu-γGlu-Glu的选择借鉴了MTX前药设计经验。研究结果证明,G202能够被PSMA酶解释放出细胞毒药物12ADTβAsp,其对LNCaP细胞和TSU细胞的IC50分别为40和72 nmol·L-1; 体内药效实验显示G202能使荷瘤小鼠的肿瘤体积减小一半 (30天内)。随后开展了I期临床试验,给予28例转移实体瘤患者静注G202,评估其安全性,给药剂量可从1.2增加到88 mg·m-2。但G202的药动学性质呈现了较大的个体差异性,患者出现了不同程度的不良反应[28]。II期临床试验于2012年开展以进一步评价其用于治疗激素抵抗前列腺癌的有效性和安全性。

|
图 8 前药G202 (12ADTβAsp-γGlu-γGlu-γGlu-Glu) 的结构 |
PSMA在前列腺癌中高度表达,尤其是转移性前列腺癌和激素抵抗前列腺癌,上市及处于临床研究的PSMA药物偶联物已在前列腺癌的诊断和靶向治疗中显示出了良好的应用前景。随着研究的深入,人们发现PSMA在多种非前列腺恶性实体瘤的新生血管中也有过度表达,因此其作为肿瘤脉管靶向治疗的靶标也逐步引起人们的重视[29]。
| [1] | Brawley OW. Prostate cancer epidemiology in the United States[J]. World J Urol, 2012, 30:195-200. |
| [2] | Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64:9-29. |
| [3] | Barve A, Jin W, Cheng K. Prostate cancer relevant antigens and enzymes for targeted drug delivery[J]. J Control Release, 2014, 187:118-132. |
| [4] | Elsässer-Beile U, Buhler P, Wolf P. Targeted therapies for prostate cancer against the prostate specific membrane antigen[J]. Curr Drug Targets, 2009, 10:118-125. |
| [5] | Kasten B, Liu T, Nedrow-Byers JR, et al. Targeting prostate cancer cells with PSMA inhibitor-guided gold nanoparticles[J]. Bioorg Med Chem Lett, 2013, 23:565-568. |
| [6] | Davis MI, Bennett MJ, Thomas LM, et al. Crystal structure of prostate-specific membrane antigen, a tumor marker and peptidase[J]. Proc Natl Acad Sci U S A, 2005, 102:5981-5986. |
| [7] | Mesters JR, Barinka C, Li W, et al. Structure of glutamate carboxypeptidase Ⅱ, a drug target in neuronal damage and prostate[J]. EMBO J, 2006, 25:1375-1384. |
| [8] | Barinka C, Rojas C, Slusher B, et al. Glutamate carboxy-peptidase Ⅱ in diagnosis and treatment of neurologic disorders and prostate cancer[J]. Curr Med Chem, 2012, 19:856-870. |
| [9] | Liu T, Nedrow-Byers JR, Hopkins MR, et al. Spacer length effects on in vitro imaging and surface accessibility of fluores-cent inhibitors of prostate specific membrane antigen[J]. Bioorg Med Chem Lett, 2011, 21:7013-7016. |
| [10] | Benjamin T, Ristau M, Denise S, et al. The pros-tate-specific membrane antigen:lessons and current clinical implications from 20 years of research[J]. Urol Oncol, 2014, 32:272-279. |
| [11] | Aloysius H, Hu L. Targeted prodrug approaches for hor-mone refractory prostate cancer[J]. Med Res Rev, 2014, 35:554-585. |
| [12] | Bander NH, Trabulsi EJ, Kostakoglu L, et al. Targeting metastatic prostate cancer with radiolabeled monoclonal antibody J591 to the extracellular domain of prostate specific membrane antigen[J]. J Urol, 2003, 170:1717-1721. |
| [13] | Galsky MD, Eisenberger M, Moore-Cooper S, et al. Phase I trial of the prostate-specific membrane antigen-directed immunoconjugate MLN2704 in patients with progressive metastatic castration-resistant prostate cancer[J]. J Clin Oncol, 2008, 26:2147-2154. |
| [14] | Akhtar NH, Pail O, Saran A, et al. Prostate-specific membrane antigen-based therapeutics[J]. Adv Urol, 2012, 2012:973820. |
| [15] | Wang X, Ma D, Olson WC, et al. In vitro and in vivo responses of advanced prostate tumors to PSMA ADC, an auristatin-conjugated antibody to prostate specific membrane antigen[J]. Mol Cancer Ther, 2011, 10:1728-1739. |
| [16] | Ma D, Hopf CE, Malewicz AD, et al. Potent antitumor activity of an auristatin-conjugated, fully human monoclonal antibody to prostate-specific membrane antigen[J]. Clin Cancer Res, 2006, 12:2591-2596. |
| [17] | Min K, Jo H, Song K, et al. Dual-aptamer-based delivery vehicle of doxorubicin to both PSMA (+) and PSMA (-) prostate cancers[J]. Biomaterials, 2011, 32:2124-2132. |
| [18] | Bagalkot V, Farokhzad OC, Langer R, et al. An aptamer-doxorubicin physical conjugate as a novel targeted drug-delivery platform[J]. Angew Chem Int Ed Engl, 2006, 45:8149-8152. |
| [19] | Chu T, Mark J, Lavery L, et al. Aptamer:toxin conjugates that specifically target prostate tumor cells[J]. Cancer Res, 2006, 66:5982-5999. |
| [20] | Peng ZH, Sima M, Salama ME, et al. Spacer length impacts the efficacy of targeted docetaxel conjugates in prostate-specific membrane antigen expressing prostate cancer[J]. J Drug Target, 2013, 21:968-980. |
| [21] | Kularatne SA, Wang K, Santhapuram HK, et al. Prostate specific membrane antigen targeted imaging and therapy of prostate cancer using a PSMA inhibitor as a homing ligand[J]. Mol Pharm, 2009, 6:780-789. |
| [22] | Kularatne SA, Venkatesh C, Santhapuram HK, et al. Synthesis and biological analysis of prostate-specific membrane antigen-targeted anticancer prodrugs[J]. J Med Chem, 2010, 53:7767-7777. |
| [23] | Kularatne S, Zhou Z, Yang J, et al. Design, synthesis, and preclinical evaluation of prostate-specific membrane antigen targeted 99mTc-radioimaging agents[J]. Mol Pharm, 2009, 6:790-800. |
| [24] | Srinivasarao M, Galliford CV, Low PS, et al. Principles in the design of ligand-targeted cancer therapeutics and imaging agents[J]. Nat Rev Drug Discov, 2015, 14:203-219. |
| [25] | Tolcher A, Ejadi S, Sartor AO, et al. P1.05*A ph 1 Study of 2 different schedules of the PSMA-tubulysin small-molecule drug conjugate EC1169 in pts with rec Met Cast-Resist PC (MCRPC)[J]. Ann Oncol, 2015, 26:ii16-ii19. |
| [26] | Mhaka A, Gady AM, Rosen DM, et al. Use of meth-otrexate-based peptide substrates to characterize the substrate specificity of prostate-specific membrane antigen (PSMA)[J]. Cancer Biol Ther, 2004, 3:551-558. |
| [27] | Denmeade SR, Mhaka AM, Rosen DM, et al. Engineering a prostate-specific membrane antigen-activated tumor endothelial cell prodrug for cancer therapy[J]. Sci Transl Med, 2012, 4:140-186. |
| [28] | Mahalingam D, Wilding G, Denmeade SR, et al. A first-in-human, phase 1 clinical study of the safety, tolerability and pharmacokinetics (PK) of G-202, a thapsigargin-based PSMA-activated prodrug, in patients with advanced solid tumors[J]. Eur J Cancer, 2012, 48:184-185. |
| [29] | Tang L, Tong R, Coyle V, et al. Targeting tumor vascula-ture with aptamer-functionalized doxorubicin-polylactide nanocon-jugates for enhanced cancer therapy[J]. ACS Nano, 2015, 9:5072-5081. |
 2016, Vol. 51
2016, Vol. 51


