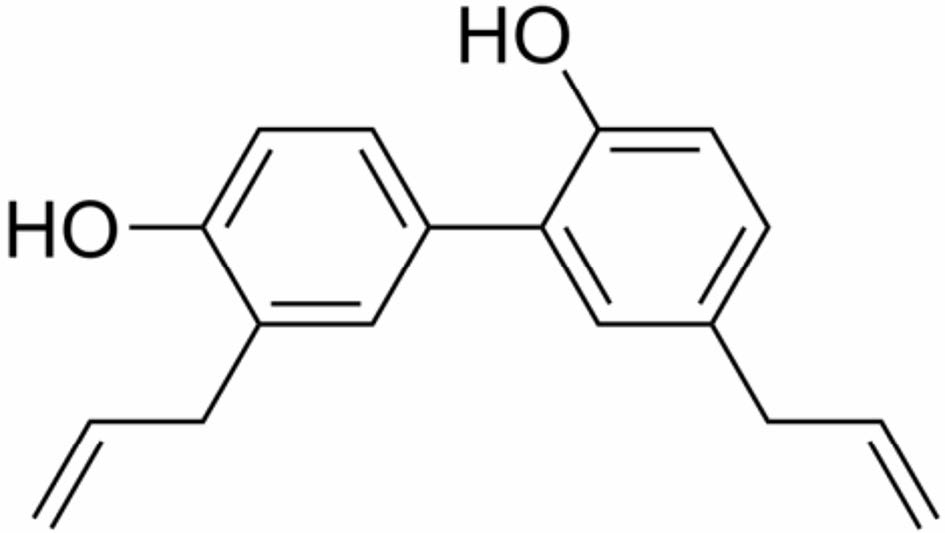
和厚朴酚 (honokiol,HNK) 来自于中药厚朴,是其最主要的两个活性组分之一,是带有烯丙基的联苯二酚类化合物,结构如图 1所示。和厚朴酚具有多种生物学活性,如抗菌、抗炎、中枢性肌肉松弛和神经抑制作用、抗血小板、降低胆固醇、抗肿瘤等药理作用,其抗肿瘤作用目前已经受到越来越多的关注。本课题组多年来对HNK的抗肿瘤作用进行了研究,发现HNK在体内外均具有抗肿瘤作用和抑制肿瘤侵袭和转移的作用[1, 2],因此,本文将对HNK抗肿瘤作用及其相关分子作用靶点进行综述。
|
Figure 1 The chemical structure of honokiol |
Figure 1
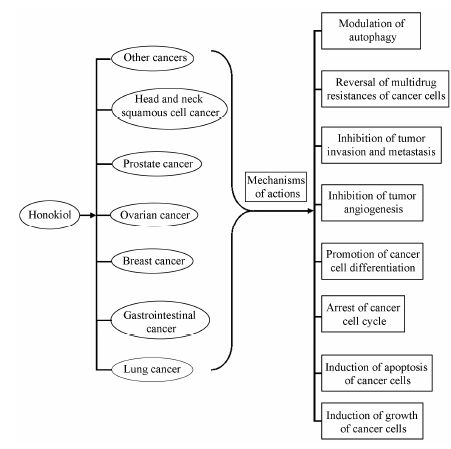
1 体内外抗肿瘤作用的实验研究肿瘤是世界上引起患者死亡的主要原因之一,由于侵袭转移和复发,至今还没有克服肿瘤的治疗方法面世,因此肿瘤至今仍是科学界面临的难题。事实上,从天然产物中寻找抗肿瘤药物或先导化合物一直是抗肿瘤药物研发的一个策略。HNK从传统中药厚朴中提取获得,研究发现,它在体内外均具有抑制多种肿瘤生长的作用,其可能的作用机制为: 诱导肿瘤细胞凋亡、引起肿瘤细胞周期阻滞、促进肿瘤细胞分化、抑制肿瘤血管形成、抑制肿瘤侵袭和转移、逆转肿瘤耐药性、通过调节自噬机制参与肿瘤生长的抑制作用等 (图 2)。
|
Figure 2 The antitumor activities of honokiol and its mechnisms |
实验研究表明,HNK能够在体外浓度依赖性地抑制非小细胞肺癌细胞的生长,并诱导其凋亡[2]; Singh等[3]研究表明,HNK也能通过靶向PGE2活化的β-catenin信号抑制非小细胞肺癌的侵袭; 另有研究[4]报道,HNK可以抑制肺鳞癌细胞的增殖,诱导细胞周期阻滞于G1-S期,并诱导细胞凋亡,同时能够明显抑制N-nitroso-trischloroethylurea诱发的小鼠支气管肺鳞癌的生成,这种抑制作用具有统计学意义(P = 0.004)。
1.2 对胃肠道肿瘤的抑制作用HNK能抑制结直肠癌细胞RKO、SW480和LS180的增殖,诱导RKO细胞出现DNA片段梯,流式细胞术检测可以发现HNK能够诱导RKO细胞出现凋亡,HNK诱导的这种结肠癌细胞凋亡不具有p53依赖特性[5]。HNK同时也可以抑制移植于裸鼠的RKO肿瘤生长,延长携带RKO移植瘤裸鼠的生存期[6]。因而,HNK在体内外均具有抑制结肠癌生长的作用。
1.3 对乳腺癌的抑制作用HNK在体外可以抑制MCF-7、SK-BR3和BT-474等多种乳腺癌细胞的增殖,其半数有效抑制浓度 (half effective inhibition concentration,IC50) 值在10~70 μmol∙L-1之间; 若将乳腺癌细胞SK-BR3接种于裸鼠,按100 mg&# 8729;kg-1剂量腹腔注射给予HNK,共给药4周,则HNK可基本抑制肿瘤的生长,其中给药2周时的肿瘤大小与对照组相比存在显著的差别 (P < 0.02)。HNK在体外诱导MCF-7细胞凋亡,导致PARP和caspase-8出现剪切条带,将细胞阻滞于G1-S期,抑制cyclin D1的表达,上调p27和p21的表达[7]。HNK通过抑制上皮-间质转化而抑制乳腺癌细胞MCF-7和MDA-MB-231的侵袭和转移,从而产生抗乳腺癌作用[8]。
1.4 对卵巢癌的抑制作用卵巢癌是最常见的女性生殖器肿瘤之一,其5年生存率为20%~30%,研究卵巢癌的治疗药物具有实际意义。HNK在体外能够抑制SKOV3、Coc1、Angelen和A2780等卵巢癌细胞的增殖,诱导SKOV3和Coc1细胞产生DNA片段梯和G0/G1期细胞周期阻滞。HNK按50 mg∙kg-1腹腔给药,可以明显抑制SKOV3裸鼠移植瘤的生长,同时减少肿瘤组织中血管内皮生长因子 (VEGF) 的表达以及微血管密度[9]。HNK可能通过诱导肿瘤细胞凋亡、细胞周期阻滞以及抑制肿瘤血管形成来产生抗卵巢癌作用。
1.5 对前列腺癌的抑制作用HNK能够抑制前列腺癌细胞PC-3和LNCaP的增殖,具有时间和剂量依赖性,而且引起LNCaP细胞周期阻滞于G0-G1期,降低细胞周期依赖性蛋白cyclin D1、周期蛋白依赖性激酶4 (cyclin-depedent kinase 4,CDK4)、CDK6和cyclin E的表达,并抑制cyclin D1和CDK4复合物的形成,能够降低Rb (retinoblastoma protein) 的蛋白水平及其磷酸化水平,因而引起细胞周期阻滞[10]。HNK也能诱导PC-3、LNCaP和Myc-CaP前列腺癌细胞发生自噬,自噬抑制剂3-甲基腺嘌呤 (3-methyladenine,3-MA) 能够促进HNK对前列腺癌细胞的增殖抑制作用和凋亡诱导作用,自噬在HNK对前列腺癌的抗肿瘤作用中可能起保护作用,因此抑制自噬可以促进HNK的抗肿瘤作用[11]。
1.6 对头颈部鳞癌的抑制作用头颈部鳞癌是世界上最常见的肿瘤之一。HNK在体外抑制SCC-1、SCC-5、OSC-19和FaDu等头颈部肿瘤细胞的增殖,这种增殖抑制作用具有时间和浓度依赖性; 同时,HNK也能诱导SCC-1和FaDu细胞凋亡,降低Bcl-2的表达和升高Bax的表达。将HNK按100 mg∙kg-1体重口服给予接种了SCC-1和FaDu的移植瘤裸鼠,则HNK显著抑制两株移植瘤的生长。HNK在体内外均具有对头颈部鳞癌的生长抑制作用[12]。
1.7 对其他肿瘤的抑制作用HNK也可以抑制脑部肿瘤、白血病和皮肤癌等细胞的生长和增殖,因而具有广泛的抗肿瘤作用。
2 抗肿瘤作用的可能分子靶点天然产物如白藜芦醇、小檗碱和姜黄素等单体成分均具有多种药理学作用,而且也都具有一定的抗肿瘤作用,作用靶点多样,但并没有单一的明确靶点。HNK能够抑制多种肿瘤的生长,作用多条信号通路产生抗肿瘤作用,如作用于凋亡相关信号通路蛋白、核因子κB (nuclear factor kappa B,NF-κB)、信号转导与转录激活因子3 (signal transducers and activator of transcription 3,STAT3)、表皮生长因子受体 (epidermal growth factor receptor,EGFR) 和哺乳动物雷帕霉素靶蛋白 (mammalian target of rapamycin,mTO R) 等 (图 3)。HNK产生抗肿瘤作用的可能分子靶点多样,至今并没有单一、明确的分子靶点被阐明。本部分将对HNK抗肿瘤作用的可能分子靶点进行综述。

|
Figure 3 The molecular targets of antitumor effects of honokiol |
抑制凋亡是肿瘤进展的主要原因之一。线粒体细胞色素C释放启动的细胞内凋亡途径受到Bcl-2 (B-cell lymphoma protein-2) 家族蛋白的调节,包括促凋亡蛋白Bcl-2-associated protein (Bax)、Bid、Bak以及抗凋亡蛋白Bcl-2和Bcl-xL。凋亡一般是通过caspase的级联活化产生的,调节凋亡一直是肿瘤治疗的策略。和厚朴酚的抗肿 瘤机制与PARP [poly (adenosine diphosphate-ribose) polymerase] 的剪接、cas pase的级联活化以及Bcl-2、Bax和BH-3家族相关联。HNK通过活化caspases-3、-8和-9以及PARP诱导B细胞慢性淋巴细胞白血病 (B-cell chronic lymphocytic leukemia,B-CLL) 细胞 凋亡,同时上调凋亡蛋白Bax的表达,下调关键存 活蛋白髓细胞白血病序列-1 (myeloid-cell leukemia sequence 1,Mcl-1) 的表达。HNK对凋亡通路的调节可能是该化合物产生抗肿瘤作用的主要机制之一[13]。
2.2 抑制NF-κB信号通路NF-κB通路是参与免疫、炎症、细胞增殖、拮抗凋亡的最重要的细胞信号通路。其中NF-κB具有转录因子活性,是一个大家族,主要包括p65 (RelA)、p105/p50、p100/p52、RelB和c-Rel。NF-κB的经典形式是p50和p65亚基组成的异二聚体,包含转录活化区,一般与抑制性蛋白IκBα结合,以非活性形式存在于细胞浆中,只有当IκBα降解后,NF-κB进入细胞核内,才能产生生物 学活性。许多肿瘤均存在NF-κB的活化状态。因此,抑制肿瘤中NF-κB信号通路,就能抑制肿瘤的生长。HNK能抑制TNF-α诱导的HeLa (宫颈癌细胞)、MCF-7 (乳腺癌细胞)、HL-60 (白血病细胞) 和U837 (白血病细胞) 细胞中NF-κB的活化,这种抑制作用没有细胞类型的特异性,HNK不能直接影响NF-κB与DNA的结合,Western blot实验结果表明,HNK能够抑制TNF-α刺激的胞浆内NF-κB抑制蛋白IκBα的磷酸化和降解,抑制内源性的和TNF-α刺激的上游IκB激酶 (IκB kinases,IKKs) 的活化[14],从而产生抑制NF-κB信号通路的作用,达到抑制肿瘤的效果。同时,HNK也能降低NF-κB下游靶向基因的表达,包括VEGF、MMP9、ICAM-1和COX-2等,HNK通过调节NF-κB的活性而调节肿瘤生存相关基因的表达,进而抑制肿瘤的生长[15]。
2.3 抑制STAT3信号通路STAT家族有7个不同的成员,主要调节与细胞存活、增殖、侵袭、血管形成和化疗耐药性相关基因产物的表达,其中STAT3是一种原癌基因,是与肿瘤形成关系最为密切的STATs,在许多肿瘤中存在组成性活化的现象。STAT3的活化是由于705位酪氨酸残基的磷酸化引起的,磷酸化的STAT3形成同源二聚体,进入细胞核,与DNA结合,调节基因表达。HNK能剂量和时间依赖性地降低肝癌细胞HepG2中组成性以及诱导性STAT3的活化,这种抑制作用是由抑制STAT3上游激酶c-Src、Janus- activated kinase 1 (JAK1)、Janus-activated kinase 2 (JAK2) 所介导的,研究进一步表明,HNK还通过诱导酪氨酸磷酸酶SHP-1 [Src homology 2 (SH2)-containing tyrosine phosphatase-1] 的表达来下调组成性的STAT3的活化,HNK也能抑制STAT3与DNA的结合,从而抑制与STAT3相关的肿瘤的生长[16]。STAT3调节参与肿瘤形成的相关基因表达,如血管形成诱导因子VEGF; STAT3也能与NF-κB相互作用调节IL-8等 靶基因的表达; 事实上,NF-κB能够调节IL-6的表达,而IL-6又能刺激STAT3活化; 因此,HNK既通过直接调节STAT3的活性而抑制肿瘤的生长,也可通过调节NF-κB的活性来调节STAT3的活化。
2.4 抑制EGFR信号通路EGFR是一种糖蛋白,具有酪氨酸激酶活性,能够调节细胞增殖和分化。哺乳动物体内存在4类EGFR家系,即erB1 (也叫EGFR)、erB2、erB3和erB4,有包括EGF和转化生长因子-α在内的6个配体存在。许多肿瘤内存在EGFR家系的过度表达,阻断EGFR信号传导通路就能抑制肿瘤的增殖,现在已有靶向EGFR的药物上市,EGFR是肿瘤治疗的一个靶点[17]。将头颈部鳞癌细胞Cal-33用HNK处理24小时,则EGFR的表达明显降低,其下游信号STAT3、Bcl-xL和cyclin D1的表达也明显降低。HNK还能减少EGFR下游信号AKT和MAPK的磷酸化水平[18]。EGFR也能调节STAT3的表达,HNK通过调节EGFR信号活性而产生抑制NF-κB/ STAT3信号途径的功能。因此,HNK通过抑制EGFR信号通路产生抗头颈部鳞癌的作用。
2.5 抑制mTOR信号通路mTOR是磷脂酰肌醇 激酶相关激酶 (phosphatidylinositol kinase-related kinases,PIKKs) 蛋白质家族成员,为一种非经典的丝氨酸/苏氨酸激酶,参与调节细胞增殖、细胞分化、细胞代谢、细胞凋亡和细胞自噬等,是一种进化上较为保守的蛋白质。据报道,mTOR是磷脂酰肌醇3激酶 (phosphatidylinositol-3 kinase,PI3K) 与AKT (RAC- alpha serine/threonine-protein kinase) 信号通路下游重要的效应分子,而S6K (S6 kinase) 和S6 (S6 proteins) 是mTOR的下游分子[19]。人第10号染色体缺失的 磷酸酶及张力蛋白同源基因 (phosphatase and tensin homolog deleted on chromosome ten,PTEN) 编码的蛋白质能促使PIP3脱磷酸转换为PIP2,抑制下游分子的活化,阻止细胞分裂,抑制细胞周期进展,诱导细胞凋亡。HNK能够抑制PTEN缺乏的神经胶质瘤细胞U87和U251中AKT、S6K和S6的磷酸化水平,也能抑制PTEN缺乏的乳腺癌细胞BT594和前列腺癌细胞PC-3中这些蛋白的磷酸化,表明HNK可以mTOR信号通路发挥抗肿瘤作用[20]。
2.6 抑制其他信号通路HNK可以抑制前列腺癌细胞LNCaP、C4-2和TRAMP-C1中雄激素受体的表 达,这种抑制作用不受p53的调节; 也可以调节肿瘤干细胞中Notch信号通路; 对HNK调节的相关信号通路可能还需进一步研究[21, 22]。
3 抗肿瘤增敏作用联合用药是肿瘤药物治疗的主要方式。一般情况下,抗肿瘤药物联合是为了增加疗效或减低不良反应。生化调节剂 (biochemical modulator) 作用于特定靶点或生化代谢的特定环节,增强抗肿瘤药物的作用效果或降低其毒性,而且能够逆转肿瘤细胞对抗肿瘤药物的耐药性,本身也具有一定的抗肿瘤活性,但作用不强[23]。药物联合应用在临床上已经使用多年,如叶酸和5-氟尿嘧啶 (5-fluorouracil,5-Fu) 联用、替加氟和尿嘧啶联用,叶酸和尿嘧啶的作用主要是增加疗效,其中叶酸就是一种生化调节剂。下面介绍HNK对化疗药物的增敏作用。
3.1 增加传统抗肿瘤药物的抗肿瘤作用传统抗肿瘤药物具有强烈的杀伤肿瘤细胞的作用,是肿瘤化疗必需的药物。抗代谢类抗肿瘤药物是与正常代谢物或辅酶结构相似的药物,通过干扰核酸的合成,抑制肿瘤细胞的生长。佛达拉滨、克拉屈滨以及吉西他滨都属于抗代谢类抗肿瘤药物,HNK能增加佛达拉滨、克拉屈滨对B细胞慢性淋巴细胞白血病细胞的细胞毒作用,也能增加吉西他滨对胰腺癌细胞MiaPaCa和Panc1的体外生长抑制作用,尚无有关体内实验的相关报道。HNK也能增加紫杉醇、顺铂和多柔比星的体外抗肿瘤作用,这些研究都只是初步的,还需进一步深入探索[18]。
3.2 增加小分子靶向药物的抗肿瘤作用靶向药物是抗肿瘤药物治疗的研发热点,包括小分子靶向药物和抗体药物。据报道,HNK能够抑制头颈部肿瘤细胞内EGFR的表达,因而在体外增加厄洛替尼对敏感型及耐药型头颈部肿瘤686LN细胞的增殖[18]。
3.3 增加蛋白类药物的抗肿瘤作用蛋白类药物包括肽类和抗体药物。肿瘤坏死因子相关的凋亡诱导 配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL) 是一种细胞因子,对肿瘤具有选择 性作用,而对正常组织没有杀伤作用。作者前期的研究[1]结果表明,HNK能够通过蛋白酶体途径降低非小细胞肺癌H226、H157和A549细胞中c-FLIP的表 达,促进肿瘤细胞对TRAIL的敏感性,增加TRAIL引起的肿瘤细胞增殖抑制和凋亡诱导作用。西妥昔单抗是靶向EGFR的单克隆抗体,HNK通过降低EGFR及相关通路因子p-STAT3和cyclin D1的表达,增加西妥昔单抗对移植于裸鼠的头颈部鳞癌1483的生长抑制作用,在体内实验中,HNK本身没有肿瘤生长抑制作用[18]。
4 逆转肿瘤耐药性肿瘤化疗失败的主要原因有肿瘤复发、肿瘤侵 袭转移以及肿瘤耐药性的产生,克服肿瘤耐药一直是抗肿瘤药物研究的一个方向。耐顺铂的卵巢癌细 胞A2780sp的耐药倍数为10倍以上,脂质体和厚朴酚 (liposomal honokiol,Lipo-HNK) 能够抑制卵巢癌细胞A2780s及耐药性细胞A2780sp的增殖,其IC50分别为36 μmol·L-1和34.6 μmol·L-1,同时Lipo-HNK对A2780s和A2780sp的凋亡诱导率分别为61.3% 和55.1%,100 μmol·L-1顺铂诱导A2780sp细胞的凋亡 率仅为20%,而10 μmol·L-1顺铂诱导A2780s细胞 的凋亡率为50.8%。将A2780s和A2780sp细胞接种于裸鼠的右胁皮下,每周两次尾静脉注射10 mg·kg-1 Lipo-HNK或每周1次腹腔注射5 mg·kg-1顺铂,共 给药3周。对A2780s肿瘤模型而言,Lipo-HNK组 和脂质体对照组平均肿瘤体积为 (222 ± 71) mm3和 (1 823 ± 606) mm3,而顺铂组和盐水对照组的平均肿瘤体积为 (112 ± 157) mm3和(3921 ± 235) mm3,Lipo-HNK组和顺铂组裸鼠的肿瘤大小没有显著差 别,Lipo-HNK和顺铂均能显著抑制A2780s裸鼠移植瘤的生长; 对A2780sp肿瘤模型而言,Lipo-HNK组和脂质体对照组裸鼠的平均肿瘤体积分别为 (408 ± 165) mm3和(2575 ± 701) mm3,而顺铂组和盐水对照组的平均肿瘤体积为 (1 607 ± 466) mm3和 (2 828 ± 796) mm3,顺铂对A2780sp裸鼠移植瘤的生长抑制作用较Lipo-HNK明显减弱[24]。从以上结果可以看出,HNK能够在体内外明显抑制敏感型及耐药型卵巢癌的生长,具有逆转肿瘤耐药性的作用。另有研究表明,HNK能够通过诱导肿瘤细胞凋亡来逆转耐多柔比星的急性淋巴细胞白血病或乳腺癌细胞的耐药性,也能逆转耐紫杉醇的口腔鳞癌细胞的多药耐药性。
5 小结综上,HNK在体内外均具有抑制肿瘤生长的作用,HNK调节细胞凋亡相关信号,抑制肿瘤细胞特异
受体酪氨酸激酶的活性及其下游信号通路的传导,阻断NF-κB信号通路,抑制STAT3及mTOR相关信号通路,降低雄激素受体的表达,阻断干细胞内Notch信号通路等,通过多靶点的综合作用达到抑制肿瘤生长、诱导肿瘤细胞凋亡、引起肿瘤细胞周期阻滞、抑制肿瘤血管形成、阻断肿瘤侵袭和转移的目 的。HNK产生抗肿瘤作用的靶点复杂多样,至今并没有明确、单一靶点被阐明,它作用的各个信号通路之间是否形成了信号网络也需进一步的研究。但是,诱导凋亡可能是HNK产生抗肿瘤作用的主要机制之一,NF-κB可能是HNK产生抗肿瘤作用的一个重 要靶点,HNK通过调节NF-κB的活性而进一步调节STAT3或VEGF信号的活性; 同时,EGFR可能也是HNK发挥抗肿瘤作用的重要靶点之一,因为通过调节EGFR也可以影响STAT3的活性。研究已经表明,HNK具有广泛的生物活性,在体内外均具增强抗肿瘤药物的疗效和逆转肿瘤多药耐药性的作用。不过,HNK与抗肿瘤药物联用的相互作用机制至今没有完全阐明,而且HNK单药抗肿瘤作用并不显著,与抗肿瘤药物联用为HNK应用于临床提供了新的思路。同时,如果能够将HNK进行结构改造,使其对抗肿瘤药物的增效及减毒作用进一步增强,得到具有选择性、能有效应用于临床的生化调节剂,将是研究HNK抗肿瘤作用的进一步目标。
| [1] | Lv X, Liu F, Shang Y, et al. Honokiol exhibits enhanced antitumor effects with chloroquine by inducing cell death and inhibiting autophagy in human non-small cell lung can-cer cells[J]. Oncol Rep, 2015, 34:1289-1300. |
| [2] | Raja SM, Chen S, Yue P, et al. The natural product honokiol preferentially inhibits cellular FLICE-inhibitory protein and augments death receptor-induced apoptosis[J]. Mol Cancer Ther, 2008, 7:2212-2223. |
| [3] | Singh T, Katiyar SK. Honokiol inhibits non-small cell lung cancer cell migration by targeting PGE2-mediated activation of β-catenin signaling[J]. PLoS One, 2013, 8:e60749. |
| [4] | Pan J, Zhang Q, Liu Q, et al. Honokiol inhibits lung tumori-genesis through inhibition of mitochondrial function[J]. Cancer Prev Res, 2014, 7:1149-1159. |
| [5] | Wang T, Chen F, Chen Z, et al. Honokiol induces apoptosis through p53-independent pathway in human colorectal cell line RKO[J]. World J Gastroenterol, 2004, 10:2205-2208. |
| [6] | Chen F, Wang T, Wu YF, et al. Honokiol:a potent chemo-therapy candidate for human colorectal carcinoma[J]. World J Gastroenterol, 2004, 10:3459-3463. |
| [7] | Wolf I, O'Kelly J, Wakimoto N, et al. Honokiol, a natural biphenyl, inhibits in vitro and in vivo growth of breast cancer through induction of apoptosis and cell cycle arrest[J]. Int J Oncol, 2007, 30:1529-1537. |
| [8] | Avtanski DB, Nagalingam A, Bonner MY, et al. Honokiol inhibits epithelial-mesenchymal transition in breast cancer cells by targeting signal transducer and activator of tran-scription 3/Zeb1/E-cadherin axis[J]. Mol Oncol, 2014, 8:565-580. |
| [9] | Li Z, Liu Y, Zhao X, et al. Honokiol, a natural therapeutic candidate, induces apoptosis and inhibits angiogenesis of ovarian tumor cells[J]. Eur J Obstet Gynecol Reprod Biol, 2008, 140:95-102. |
| [10] | Hahm ER, Singh SV. Honokiol causes G0-G1 phase cell cycle arrest in human prostate cancer cells in association with suppression of retinoblastoma protein level/phosphorylation and inhibition of E2F1 transcriptional activity[J]. Mol Cancer Ther, 2007, 6:2686-2695. |
| [11] | Hahm ER, Sakao K, Singh SV. Honokiol activates reactive oxygen species-mediated cytoprotective autophagy in human prostate cancer cells[J]. Prostate, 2014, 74:1209-1221. |
| [12] | Singh T, Gupta NA, Xu S, et al. Honokiol inhibits the growth of head and neck squamous cell carcinoma by tar-geting epidermal growth factor receptor[J]. Oncotarget, 2015, 6:21268-21282. |
| [13] | Battle TE, Arbiser J, Frank DA. The natural product honokiol induces caspase-dependent apoptosis in B-cell chronic lymphocytic leukemia (B-CLL) cells[J]. Blood, 2005, 106:690-697. |
| [14] | Tse AK, Wan CK, Shen XL, et al. Honokiol inhibits TNF-α-stimulated NF-κB activation and NF-κB-regulated gene expression through suppression of IKK activation[J]. Biochem Pharmacol, 2005, 70:1443-1457. |
| [15] | Kumar A, Kumar Singh U, Chaudhary A. Honokiol ana-logs:a novel class of anticancer agents targeting cell signaling pathways and other bioactivities[J]. Future Med Chem, 2013, 5:809-829. |
| [16] | Rajendran P, Li F, Shanmugam MK, et al. Honokiol inhibits signal transducer and activator of transcription-3 signaling, proliferation, and survival of hepatocellular carcinoma cells via the protein tyrosine phosphatase SHP-1[J]. J Cell Physiol, 2012, 227:2184-2195. |
| [17] | Chen SZ, Zhen YS. Molecular targets of tea polyphenols and its roles of anticancer drugs in experimental therapy[J]. Acta Pharm Sin (药学学报), 2013, 48:1-7. |
| [18] | Leeman-Neill RJ, Cai Q, Joyce SC, et al. Honokiol inhibits epidermal growth factor receptor signaling and enhances the antitumor effects of epidermal growth factor receptor inhibitors[J]. Clin Cancer Res, 2010, 16:2571-2579. |
| [19] | Chang L, Graham PH, Ni J, et al. Targeting PI3K/AKT/mTOR signaling pathway in the treatment of prostate cancer radioresistance[J]. Crit Rev Oncol Hematol, 2015, 96:507-517. |
| [20] | Crane C, Panner A, Pieper RO, et al. Honokiol-mediated inhibition of PI3K/mTOR pathway:a potential strategy to overcome immunoresistance in glioma, breast, and prostate carcinoma without impacting T cell function[J]. J Immuno-ther, 2009, 32:585-592. |
| [21] | Hahm ER, Karlsson AI, Bonner MY, et al. Honokiol in-hibits androgen receptor activity in prostate cancer cells[J]. Prostate, 2014, 74:408-420. |
| [22] | Kaushik G, Venugopal A, Ramamoorthy P, et al. Honokiol inhibits melanoma stem cells by targeting Notch signaling[J]. Mol Carcinog, 2015, 54:1710-1721. |
| [23] | Zhen YS, Chen ZM, Cheng SJ, et al. Tea, bioactivity and therapeutic potential[M]//Zhen YS. Antitumor Activity of Tea Product. London & New York:Taylor & Francis Inc, 2002:211-229. |
| [24] | Luo H, Zhong Q, Chen LJ, et al. Liposomal honokiol, a promising agent for treatment of cisplatin-resistant human ovarian cancer[J]. J Cancer Res Clin Oncol, 2008, 134:937-945. |
 2016, Vol. 51
2016, Vol. 51


