2. 广东药学院 医药化工学院, 广东 广州 510006
2. School of Chemistry and Chemical Engineering, Guangdong Pharmaceutical University, Guangzhou 510006, China
姜黄素 (curcumin) 是中药姜黄中主要有效成分之一,研究表明姜黄素具有多种药理活性,如抗氧化、抗肿瘤、抗炎、抗病毒和保肝等[1, 2]。但是姜黄素的水溶性和稳定性较差,口服生物利用度较低[3, 4],这在很大程度上限制了姜黄素的临床应用。
微球是应用相应的高分子材料,将药物包裹或分散于其中的新型给药系统。将药物包裹进入微球 后,由于载体材料的保护作用,可以提高药物的稳定性,同时也可以降低药物对器官的毒副作用。而对于半衰期较短的药物,微球的缓控释作用能使药物在体内连续释放,延长药物的作用时间[5, 6, 7]。随着微球研究的广泛开展,目前,多种不同材料作为骨架材料被应用于微球的制备中,如明胶[8]、海藻酸盐[9]、壳聚糖[10]和PLGA[11, 12]等。PLGA是一种生物可降解的高分子有机化合物,对人体无害,具有极高的安全性,已经被广泛应用于制药、医药工程材料和现代化工业等多个领域。目前已经上市的微球制剂中,大部分都是选择PLGA作为药物载体。但是PLGA微球同样存在许多亟待解决的问题,如药物突释严重、药物释放不完全、重复率和产率较低等。究其原因,是目前对微球中药物的存在状态以及微球内部结构缺乏更为深入的认识。本文期望通过对姜黄素微球中药物存在形式的研究,发现其与微球释药行为之间的关系,从而为解决目前PLGA微球所存在的问题提供更多的理论基础。
材料与方法 实验材料和仪器姜黄素对照品,姜黄素 (纯度98%) (上海麦克林试剂有限公司); 聚乳酸−羟基乙酸共聚物 (PLGA,LA/GA = 50∶50,标示黏度0.41 dl·g−1,济南岱罡生物工程有限公司); 聚乙烯醇1799 (PVA1799),十二烷基硫酸钠 (SDS) (上海阿拉丁试剂有限公司); 乙腈 (美国Merck公司,色谱纯); 冰醋酸 (天津市科密欧化学试剂有限公司,色谱纯); 乙酸乙酯,二氯甲烷,甲醇 (广州化学试剂厂,分析纯); 水为去离子水。
SPG膜乳化装置 (日本SPG Technology公司,膜孔径4 μm); Agilent1260系列高效液相色谱系统 (美国安捷伦科技有限公司,Agilent1260泵,型号为G1311C; Agilent1260自动进样器,型号为G1329B; Agilent 1260检测器,型号为G1314F; Agilent工作站); 752N型紫外分光光度计 (上海仪电分析仪器有限公司); S-4800冷场发射扫描电子显微镜 (日本Hitachi公司); BRUKER D8 ADVANCE X-射线粉末衍射仪 (德国Bruker公司); 差示扫描量热仪,傅立叶红外光谱仪 (美国PerkinElmer公司); 超高速低温冷冻离心机 (德国Sigma公司); 恒温振荡器 (上海匡贝实业有限公司)。
姜黄素-PLGA微球的制备采用快速膜乳化法制备包载姜黄素的PLGA微球。具体制备步骤如下: 将PLGA约150 mg与一定量的姜黄素溶于7 mL乙酸乙酯−二氯甲烷 (3∶4) 的混合溶剂中作为分散相,充分溶解后将其倒入膜乳化装置中,1% PVA水溶液200 mL作为连续相,用压力调节阀调节至13 MPa,氮气将分散相挤出使其分散于连续搅拌的PVA溶液中。直至完全挤出后,以350 r·min−1速度搅拌1 h,再稀释至400 mL继续搅拌3 h,使其中的有机溶剂充分挥发,微球固化成型。5 000 r·min−1、20 ℃下离心收集。并用去离子水多次离心洗涤收集所得的微球,直至上清液无色透明后,过滤、干燥。整个过程避光操作。
不同载药量微球的制备,分别加入约10、20和30 mg姜黄素,微球制备方法相同。空白微球的制备与载药微球制备方法相同,但不加入姜黄素。
含量测定标准曲线的绘制 精密称取姜黄素对照品5.0 mg,加适量二氯甲烷−甲醇(3∶1) 溶解,定溶于25 mL量瓶中,即得200.0 mg·L−1姜黄素对照品溶液。准确移取姜黄素对照品溶液,分别稀释成0.5、1.0、2.0、4.0、5.0、6.0和8.0 mg·L−1姜黄素溶液。在420 nm处,以二氯甲烷−甲醇 (3∶1) 为空白对照,测定各组溶液的吸光度 (A),以A对姜黄素溶液的质量浓度 (C) 进行线性回归,得到标准曲线方程A = 0.107 2 C + 0.018 6 (R2 = 0.999 7),结果表明,在0.5~8.0 mg·L−1内姜黄素的质量浓度与吸光度呈良好的线性关系。
载药量和包封率的测定 分别精密称取3种载药量的微球5.0 mg,加适量二氯甲烷−甲醇(3∶1) 溶解,定容于100 mL量瓶中。分别在420 nm处,以二氯甲烷−甲醇 (3∶1) 为空白对照测定吸光度,代入所得标准曲线方程中计算姜黄素的含量。根据以下公式计算微球载药量 (DL) 和包封率 (EE):
DL = 微球中姜黄素总量/微球总量×100%
EE = 实际载药量/理论载药量×100%
体外释放研究结合2010年版《中国药典》,并略作改进,确定色谱条件为色谱柱: PhenomenexGenimi C18柱(250 mm×4.6 mm,5 μm); 流动相: 4%冰醋酸溶液−乙腈 (52∶48); 流速: 1 mL·min−1; 检测波长: 430 nm; 进样量: 20 μL; 柱温: 40 ℃。方法学考察结果表明,空白释放液无干扰,姜黄素的峰面积与浓度呈良好的线性关系,y = 35.607 x − 2.657 9 (质量浓度范围为0.21~10.60 mg·L−1,R2 = 0.999 3),方法回收率为99.44%~99.98%,精密度和重复性实验考察RSD均小于2.0%。
药物体外累计释放度的测定 根据2010版《中国药典》附录ⅪⅩ D“缓释、控释和迟释制剂指导原则”中的相关内容,释放液选用pH 7.4磷酸盐缓冲液(PBS),由于姜黄素为难溶性药物,因此在释放液中加入0.5% SDS。分别精密称取3种载药量的微球各10.0 mg,放入具塞离心管中,分别加入上述含0.5% SDS的PBS溶液60 mL,摇匀,恒温 (37 ± 0.5) ℃气浴振荡 (100 r·min−1)。在预定的时间点离心,取适量上清液,经过滤后按上述色谱条件进样,测定样品中姜黄素的峰面积并代入标准曲线方程计算累计释放率。并同时加入等量的新鲜释放液,摇匀继续进行体外释放实验。
扫描电镜 (SEM) 观察分别取3种载药量的微球少量,将其放置在载物台上,均匀摊开,喷金,用扫描电子显微镜进行观察。
X-射线粉末衍射(XRD)分析使用X-射线粉末衍射仪分别对姜黄素原料药、空白微球、空白微球与姜黄素原料药的物理混合物 (按照对应微球的载药量进行物理混合)、3种不同载药量的微球进行分析。分析条件如下: Cu-Kα射线,衍射角度 (2θ) 扫描范围为5°~80°,扫描速率为8°·min−1,管压40 kV,管流40 mA。
差示扫描量热法 (DSC) 分析分别称取适量姜黄素原料药、空白微球、空白微球与姜黄素原料药的物理混合物 (按照对应微球的载药量进行物理混合)、3种不同载药量的微球,使用差示扫描量热仪对其进行分析。分析条件如下: 扫描范围为30~250 ℃,升温速率为10 ℃·min−1,气氛为高纯度氮气。
傅里叶红外光谱 (IR) 分析分别取适量的姜黄素原料药、空白微球、空白微球与姜黄素原料药的物理混合物 (按照对应微球的载药量进行物理混合)、3种不同载药量的微球,与KBr混合研磨均匀后压片,在4 000~400 cm−1内分别进行红外光谱分析。
结果 1 药物的含量投药量分别为10、20和30 mg的3批微球,测得其载药量分别为 (5.85 ± 0.21) %、(11.71 ± 0.39) % 和 (15.41 ± 0.40) %; 包封率分别为 (92.34 ± 1.36) %、(97.46 ± 3.52) % 和 (91.29 ± 3.07) %。
2 体外释放3种载药量微球的体外释放曲线见图 1。3种载药量的微球释放趋势较为接近,表现出较好的缓释效果。但值得注意的是,3种载药量的微球在相同的时间点,对应的累计释放百分率也呈现明显的梯度。120 h时,载药量为5.85% 的姜黄素微球中药物的累计释放百分数为65.06%; 载药量为11.71% 的姜黄素微球中药物的累计释放百分数为79.51%; 载药量为15.41% 的姜黄素微球中药物的累计释放百分数则达到了88.36%。经过多次实验,均表现出类似的结果。可以推测,载药量的变化使得微球内部的结构也产生了不同的变化,因此不同载药量的微球体外释放曲线会产生梯度式的区别。
 | Figure 1 Invitro release profiles of different microspheres. A: Drug loading of 5.85%; B: Drug loading of 11.71%; C: Drug loading of 15.41% |
进一步将3种载药量微球的体外释放数据分别按照零级动力学方程、一级动力学方程、Higuchi方程,以及双指数双相动力学方程进行拟合,结果如表 1所示。由拟合结果可以发现,3种载药量微球释放数据在用Higuchi方程进行拟合时,载药量最低的微球释放数据所得的拟合优度R2最大。由此可见,载药量最低的微球,其整体的缓释效果最佳。而3种载药量的微球释放数据在进行拟合时,双指数双相动力学方程的拟合优度都要明显好于其他方程。可见姜黄素微球的体外释放过程明显分为两个阶段,初期为药物突释过程,此过程中药物的释放非常快; 而后期则为药物缓释过程,此过程中药物释放速率较慢,体现出微球的缓释效果。
|
|
Table 1 Fitting results of different microspheres. A: Microspheres of 5.85% drug loading; B: Microspheres of 11.71% drug loading; C: Microspheres of 15.41% drug loading |
3种载药量微球的扫描电镜图见图 2。从图中可以发现,本文制备的微球,表面较为光滑圆整,没有过多的微球粘连,也没有在微球表面发现有析出的药物结晶。
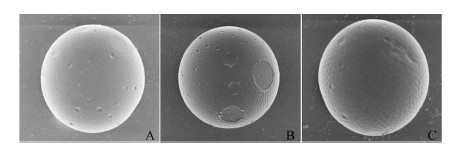 | Figure 2 SEM pictures of different microspheres. A: Drug loading of 5.85%; B: Drug loading of 11.71%; C: Drug loading of 15.41% |
如图 3所示,姜黄素原料药在3°~50°内出现很强的晶体衍射峰,可见姜黄素原料药是以结晶体的形式存在; 而空白微球则只出现一个离散型的隆峰,说明PLGA是以无定形的非晶体形式存在的。
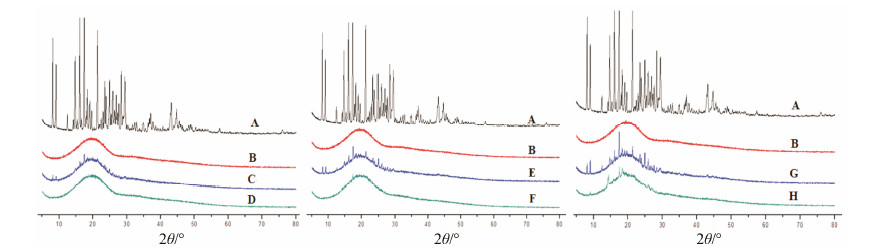 | Figure 3 XRD of different powders. A: Raw material of curcumin; B: Blank microspheres; C: Physical mixture of blank microspheres with curcumin (1∶15); D: Microspheres with the drug loading of 5.85%; E: Physical mixture of blank microspheres with curcumin (2∶15); F: Microspheres with the drug loading of 11.71%; G: Physical mixture of blank microspheres with curcumin (3∶15); H: Microspheres with the drug loading of 15.41% |
从载药量为5.85% 的载药微球与其对应的物理混合物的衍射图谱可以发现,姜黄素和空白微球的物理混合物在8.16°、9.10°、16.14° 和17.45° 等处出现了姜黄素的结晶衍射峰,而载药量为5.85% 的载药微球中并未出现任何姜黄素的晶体衍射峰。可见,在该载药量的情况下,被包载进入微球的姜黄素几乎全部转变为无定形的非晶体状态,分散在载体材料PLGA中。
而从载药量为11.71% 的载药微球与其对应的物理混合物的衍射图谱可以发现,载药微球在9.03°、14.23° 和17.43° 等处出现了姜黄素的特征晶体衍射峰。使用JADE6.0软件,对此时载药微球的衍射图谱进行拟合分析发现,载药量为11.71% 的微球中结晶度为 (2.12 ± 0.64) %,即此时载药微球中结晶药物含量约为2.12%,而相应的非晶体药物含量则约为9.59%。
从载药量为15.41%的载药微球与其对应的物理混合物的衍射图谱可以发现,此时载药微球中姜黄素的特征晶体衍射峰强度进一步增强,分别在9.10°、14.35°、17.50°、18.44° 和25.88° 等处出现了姜黄素的特征晶体衍射峰。使用JADE6.0软件,对此时载药微球的衍射图谱进行拟合分析发现,载药量为15.41% 的微球中结晶度为 (5.66 ± 0.07) %,即此时载药微球中结晶药物含量约为5.66%,而相应的非晶体药物含量则约为9.75%。
5 DSC分析如图 4所示,姜黄素原料药在188.8 ℃处出现了一个热吸收峰,这个温度与姜黄素的熔点接近; 空白微球在54.3 ℃处出现了一个热吸收峰,这个温度与PLGA的玻璃化转变温度相接近。在3组物理混合物的DSC曲线中,均出现了姜黄素和PLGA的热吸收峰,且吸收峰的位置并未发生太大改变,但是载药量为5.85% 和11.71% 的微球均只出现了PLGA的热吸收峰,这表示微球中的姜黄素大部分已转变为无定形的非晶体状态分散于PLGA中; 而载药量为15.41% 的微球,除了PLGA的热吸收峰之外,还在167.5 ℃处出现了一个峰形较宽的吸热峰,但这个温度与姜黄素的熔点温度相比明显降低,说明这不是单一姜黄素的熔点峰,而可能是姜黄素与PLGA的共融物。结合XRD的结果可以发现,载药量为15.41% 的微球中,有大约5.66% 姜黄素晶体存在,当PLGA熔融后,与这部分姜黄素晶体形成共融物,因而出现了这个较宽的热吸收峰。
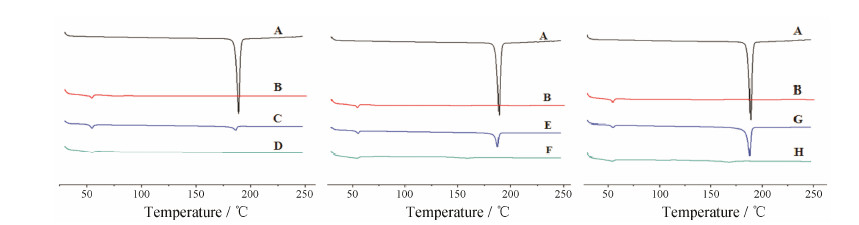 | Figure 4 DSC of different powders. A: Raw material of curcumin; B: Blank microspheres; C: Physical mixture of blank microspheres with curcumin (1∶15); D: Microspheres with the drug loading of 5.85%; E: Physical mixture of blank microspheres with curcumin (2∶15); F: Microspheres with the drug loading of11.71%; G: Physical mixture of blank microspheres with curcumin (3∶15); H: Microspheres with the drug loading of 15.41% |
如图 5所示,姜黄素在1 511、1 603和3 502 cm−1处有较强的特征吸收峰,区别于PLGA,其中: 1 511和1 603 cm−1两处的吸收峰为姜黄素中的芳环骨架 振动峰; 而3 502 cm−1处为姜黄素中酚羟基的伸缩振动峰。在各组物理混合物和载药微球的红外谱图中,均未发现新的吸收峰出现,可见微球制备过程中,姜黄素并未与PLGA发生化学反应。在各组载药微球的红外谱图中,位于1 511和1 603 cm−1两处的吸收峰仍然出现,峰位置也没有发生明显变化。但是由于PLGA的包埋作用,使得这两处的峰强度比对应的物理混合物明显减弱; 而姜黄素在3 502 cm−1处的酚 羟基的伸缩振动峰也由于PLGA的包埋作用,使得其在载药量为5.85% 和11.71% 微球的红外谱图中并未出现,而在载药量较高 (15.41%) 微球的红外谱图中再次出现。值得注意的是,该吸收峰由原来的尖峰变为离散型的宽峰,且峰位置也向低波数方向位移 (3 437 cm−1)。可以推测,在微球制备过程中,姜黄素的酚羟基形成了氢键缔合,电偶极矩增大,使得峰形和峰位置发生了改变。
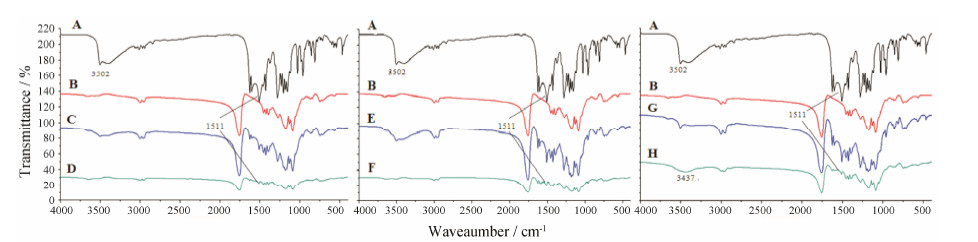 | Figure 5 IR spectra of different powders. A: Raw material of curcumin; B: Blank microspheres; C: Physical mixture of blank microspheres with curcumin (1∶15); D: Microspheres with the drug loading of 5.85%; E: Physical mixture of blank microspheres with curcumin (2∶15); F: Microspheres with the drug loading of11.71%; G: Physical mixture of blank microspheres with curcumin (3∶15); H: Microspheres with the drug loading of 15.41% |
由于姜黄素在水中的溶解度差,且稳定性较低,因此本文中使用SPG膜乳化装置,选择O/W单乳化法来制备以PLGA为载体材料的载药微球。使用这种方法,使得整个实验条件更为温和,尽量减小制备过程对姜黄素的影响。并通过改变投药量,制备出高、中、低3种载药量的姜黄素微球。由于姜黄素本身颜色较为明显,在对制备的微球进行洗涤时,未被包载进入微球的姜黄素可使上清液变为橘黄色,因此洗涤微球直至上清液变为无色透明,尽可能地洗去黏附于微球表面的姜黄素,减小游离药物对后续实验的影响。
通过扫描电镜的观察,3种载药量的微球表面都较为平整光滑,也未发现明显的药物结晶,相互之间也没有明显的粘连。通过对3种载药量微球中药物存在形式的研究,可以发现姜黄素与PLGA并没有发生化学连接; 但XRD和DSC的结果均显示,被包载进入微球后,姜黄素的存在状态发生了较大改变。根据XRD的结果分析,载药量最低的微球中,姜黄素几乎全部由结晶状态变为无定形的非晶体状态,与PLGA相融合。而在两个载药量较高的微球中,均发现姜黄素的结晶存在。可见,PLGA对姜黄素有一定的“溶解度”: 当微球中药物含量较低时,姜黄素能全部转变为无定形的分子状态“溶解”于载体材料PLGA中; 而当药物含量增大,超过PLGA对姜黄素的“溶解度”时,多余的姜黄素就会仍然以本体的结晶形式相对独立地存在于微球中。通过更精密的数据分析可以发现,载药量较高的两种微球中,药物结晶的含量分别为2.12% 和5.66%,用这两种载药微球总的药物含量减去这部分结晶药物的含量可以发现: 载药量为11.71% 和15.41% 的两种微球,其中的非晶体药物含量分别为9.59% 和9.75%,两者非常接近。可以推测,PLGA对姜黄素的“溶解度”在10% 左右,也就是说,采用本文的制备方法制备的姜黄素微球,当载药量低于10% 时,姜黄素基本上全部以非晶体状态与PLGA相融合; 而当载药量高于10% 时,多余的这部分姜黄素仍以晶体的形式存在于微球中。这一发现可以用来解释体外释放的结果: 载药量为5.85% 的微球中,姜黄素几乎全部以无定形的分子状态“溶解”于PLGA中,两者高度融合也使得整个微球形成一个结构更为致密的整体,因此微球内部药物从微球中释放的速率就会大大减慢。而在对3组微球的体外释放数据进行拟合时也发现,载药量最低的微球整体的缓释效果最好; 载药量为11.71% 和15.41% 的微球中,除了以无定形的分子状态与PLGA高度融合的这部分姜黄素外,还有相对独立的2.12% 和5.66% 的姜黄素晶体存在。这部分姜黄素晶体,由于结构较为独立,因此能够更快地被释放出来; 其次,由于这部分姜黄素晶体不能与载体材料PLGA充分融合,因此需要占据微球中部分独立的空间,这也就使微球内部的结构没有那么致密。而当微球中药物结晶含量越高,那么微球内部的结构就会变得越疏松,进而其中的药物就会更快地被释放出来。
本文研究了姜黄素微球中药物的存在形式,以及其对药物释放行为的影响,而不同类型的药物在微球中的存在形式可能有较大差别,不同制备方法对药物在微球中的存在形式可能也有不同的影响,因此还需要进一步更为全面地分析研究。
| [1] | Srivastava RM, Singh S, Dubey SK, et al. Immunomodulatory and therapeutic activity of curcumin [J]. Int Immunopharmacol, 2011, 11: 331-341. |
| [2] | Wang BH, Zhang WH, Zhang XF, et al. Research progress on pharmacology and dosage form of curcumin [J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2013, 31: 1102- 1105. |
| [3] | Tsai YM, Jan WC, Chien CF, et al. Optimised nano-formulation on the bioavailability of hydrophobic polyphenol, curcumin, in freely-moving rats [J]. Food Chem, 2011, 127: 918- 925. |
| [4] | Ravindranath V, Chandrasekhara N. Absorption and tissue distribution of curcumin in rats [J]. Toxicology, 1980, 16: 259-265. |
| [5] | Panusa A, Selmin F, Rossoni G, et al. Methyl prednisolone- loaded PLGA microspheres: a new formulation for sustained release via intra-articular administration. A comparison study with methyl prednisolone acetate in rats [J]. J Pharm Sci, 2011, 100: 4580-4586. |
| [6] | Ito F, Honnami H, Kawakami H, et al. Preparation and properties of PLGA microspheres containing hydrophilic drugs by the SPG (shirasu porous glass) membrane emulsification technique [J]. Colloid Surface B, 2008, 67: 20-25. |
| [7] | Zhang H, Wang X, Wang XQ, et al. Preparation and in vitro evaluation of risperidone loaded PLGA microspheres [J]. Chin New Drugs J (中国新药杂志), 2013, 22: 2423-2430. |
| [8] | Zhan GP, Huang KL, Xie EW. The preparation of streptomycin sulfate gelatin microspheres for lung targeting [J]. Chin J Hosp Pharm (中国医院药学杂志), 2005, 25: 625-628. |
| [9] | He QY, Wen LS, Li Q, et al. Fabrication of alginate microsphere for controlled release and investigation of its release characteristics in vitro [J]. J Biomed Eng (生物医学工程学杂志), 2007, 24: 1301-1304. |
| [10] | Harris R, Lecumberri E, Heras A. Chitosan-genipin microspheres for the controlled release of drugs: clarithromycin, tramadol and heparin [J]. Mar Drugs, 2010, 8: 1750- 1762. |
| [11] | Hamishehkar H, Emami J, Najafabadi AR, et al. The effect of formulation variables on the characteristics of insulin- loaded poly(lactic-co-glycolic acid) microspheres prepared by a single phase oil in oil solvent evaporation method [J]. Colloid Surface B, 2009, 74: 340-349. |
| [12] | Du LN, Cheng JP, Chi Q, et al. Biodegradable PLGA microspheres as a sustained release system for a new luteinizing hormone-releasing hormone (LHRH) antagonist [J]. Chem Pharm Bull, 2006, 54: 1259-1265. |
 2016, Vol. 51
2016, Vol. 51


