2. 中国药科大学, 江苏 南京 210009;
3. 安徽省中医药科学院药物制剂研究所, 安徽 合肥 230012
2. China Pharmaceutical University, Nanjing 210009, China;
3. Institute of Pharmaceutics, Anhui Academy of Chinese Medicine, Hefei 230012, China)
青藤碱是从常用中药青风藤中提取的一种生物碱单体。研究证实青藤碱具有抗炎、镇痛、抗风湿和免疫抑制等药理作用,广泛用于临床治疗类风湿性关节炎 (rheumatoid arthritis,RA)[1],目前临床主要用其盐酸盐—盐酸青藤碱 (sinomenine hydrochloride,SMH)。青藤碱有一定的不良反应,会促进组胺释放,导致皮疹和胃肠道刺激反应等,然而RA是慢性病,需要长期用药,所以有必要提高关节病变部位药物浓度,从而降低药物的全身毒副作用。
关节腔注射给药可直接将药物递送到炎症部位,提高关节局部药物浓度,降低给药剂量,降低药物的全身毒副作用,以最小的剂量发挥最大的疗效,适合有明显大关节炎症状的RA患者。由于青藤碱生物半衰期短,且普通的溶液剂关节腔注射后会迅速渗漏进入血液循环,使关节局部药物浓度下降,药效下降,因此需要频繁给药,患者顺应性差。开发可关节腔局部注射给药的缓释制剂可减少给药频率,具有重要意义。
原位液晶给药系统包括原位立方液晶 (in situ cubic liquid crystal,ISV2) 和原位六角相液晶 (in situ hexagonal liquid crystal,ISH2),是一类低黏度的液晶前体制剂,可用于注射。给药后可在给药部位吸水发生相转化形成立方液晶或六角相液晶,从而缓释药物。原位液晶递药系统具有制备方法简单、使用方便、给药剂量小和局部缓释药物等优点。近年来,可注射的原位液晶缓释制剂得到了广泛的研究[2, 3]。
本研究选用植烷三醇 (phytantriol,PT) 作为基质材料制备ISV2,通过三元相图、可注射性评价、pH值和相转化能力等研究,进行处方筛选。同时,考虑到近年来有研究表明六角相液晶与立方液晶相比缓释性能更好[4, 5, 6],通过在PT中添加维生素E醋酸酯 (vitamin E acetate,VitEA) 制备出ISH2,目前国内外未见相关研究报道。对ISV2和ISH2体外释药行为进行比较,获得缓释性能更好的原位液晶制剂,并研究其在大鼠关节局部的药动学。
材料与方法 仪器XP-330C偏光显微镜 (中国蔡康光学仪器有限公司); SAXSess MC2小角度X射线散射仪 (奥 地利Anton Paar公司); DHR-2流变仪 (美国TA公 司); Waters 1525高效液相色谱系统,ACQUITY UPLC H-Class超高效液相色谱系统 (美国Waters公司)。
药品与试剂PT (GC > 95%)、VitEA (GC > 98%) (梯希爱化成工业发展有限公司); 超纯水 (Milli-Q超纯水系统制备); SMH原料药 (纯度≥98%,成都曼斯特生物科技有限公司); SMH对照品 (纯度99.9%)、盐酸普鲁卡因对照品 (纯度99.8%) (中国食品药品检定研究院); 甲醇、乙腈为色谱纯,其他试剂为分析纯。
动物Sprague-Dawley (SD) 大鼠,雄性,体重 (250 ± 20) g,安徽医科大学实验动物中心提供,动物合格证号: SYXK (皖) 2014-002。
原位液晶的制备采用PT、乙醇 (ethanol,ET) 和水制备ISV2。精密称取处方量PT,(60 ± 0.5) ℃水 浴,待熔融后,加入处方量ET,涡旋混合均匀。将处方量的超纯水加入上述PT分散液中混合均匀,加入处方量的SMH,超声并涡旋混合直至药物全部溶解。取制备的ISV2,在单人净化工作台中过0.22 μm滤膜滤过除菌,密封存放于经高压蒸汽灭菌的安瓿中。样品静置48 h后才能进行后续研究。ISH2制备时需在PT中加入一定量的VitEA,其他操作同ISV2的制备。
PT-ET-水三元相图的绘制将PT与ET按质量比1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2和9∶1涡旋混合均匀。取一定量的上述混合物置离心管中与水按质量比1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2和9∶1涡旋混合均匀,制得混合样品0.2 g,样品室温静置48 h后,通过肉眼及偏光显微镜观察确定各样品的相结构,绘制PT-ET-水的三元相图。
相转化能力考察将各处方样品分别注入过量水中,肉眼观察相转化情况,偏光显微镜观察形成的液晶结构。
可注射性评价选择针头规格为25 G的1 mL注射器吸取样品0.5 mL,在室温条件下将针头伸入过量水中进行注射,考察各处方的可注射性,指标分为可注射和不可注射两种。
pH 值测定采用Mettler Toledo SevenMulti pH/电导率/离子综合测试仪测定各处方的pH值。
相转化最少吸水量 (Vmin) 与相转化时间 ( Tg) 测定采用转子法测定。分别精密称取ISV2 0.1 g置5 mL离心管中,加入搅拌子(10 mm × 6 mm),转速设置为30 r·min−1,(37.0 ± 0.5) ℃水浴平衡5 min,搅拌子停止转动时判断为实验终点。向离心管中每次加水20 µL并观察1 min,记录实验终点时加水总量即为Vmin。向离心管中加入过量的水 (0.3 mL),记录实验终点时间即为Tg。
小角度 X 射线散射检测将装有样品的样品池,置于小角度X射线散射仪检测室,抽真空至1×10−5 Pa,在37 ℃条件下平衡10 min后,开始进行小角度X射线散射测定 (X射线光源为CuKα辐射,λ = 0.154 18 nm,发射功率为40 kV×50 mA)。测试时间为10 min,以铝箔为载体,用影像板记录散射信息。得到的谱图已去除铝的散射。处理数据将散射强度对散射因子 (q) 作图。
流变学性质考察采用DHR-2流变仪进行流变学研究,采用锥板夹具 (直径40 mm,锥角1°1′1″),样品加载后稳定10 min开始测量。
采用Flow-Sweep测量模式考察样品是否为牛顿流体,测试温度为25 ℃,在100 s内剪切速率由1 s−1加速到200 s−1。
采用Oscillation-Frequency测量模式考察样品的黏弹性,测试温度为37 ℃,固定应力值 (60 Pa) 进行频率谱扫描 (0.1~100 rad·s−1)。
体外释放实验采用动态透析法进行体外释放实验。取样品约0.5 g,精密称定,置于6 cm长的透析袋中 (截留分子质量为14 000 Da),两端夹紧后,放入盛有6 mL pH 7.4 PBS的离心管中 [0.02% (w/v) NaN3抑菌],置 (37.0 ± 0.5) ℃的恒温摇床中,转速设置为60 r·min−1,于0.5、1、2、4、6、12、24、48、72、96、120、144、168、192、216和240 h定时取出全部释放介质,并补充等量新鲜释放介质,测定释放介质中SMH含量,计算累计释放度。实验平行3组。
采用高效液相色谱法测定释放介质中SMH含量。色谱柱: 依利特Sinachrom ODS BP C18柱 (250 mm × 4.6 mm,5 µm); 流动相: 甲醇−0.075% 磷酸、0.125% 三乙胺水溶液 (18∶82,v/v,用磷酸调pH为3); 流速: 1.0 mL·min−1; 检测波长: 265 nm; 柱温: 30 ℃; 进样量: 20 µL。
采用相似因子f2对不同处方的释放曲线进行对比研究[7]。f2的计算方程如下:
| ${f_z} = 50\log \left\{ {{{\left[ {1 + \frac{1}{{\rm{n}}}\sum\limits_{t = 1}^{\rm{n}} {{{({R_t} - {T_t})}^2}} } \right]}^{ - 0.5}} \times 100} \right\}$ |
其中,f2是相似因子,Rt和Tt分别为两对比制剂在各时间点的累积释放度[8]。当f2小于50时可认为两对比制剂的释放曲线存在差异[7]。
ISH2 大鼠关节局部药动学研究佐剂性关节炎大鼠模型的建立 取健康SD大 鼠,左后跖皮内注射完全弗氏佐剂0.1 mL致炎[9],造模后21天根据足跖肿胀度将佐剂性关节炎大鼠均匀分组。
给药方案及样品采集 取70只佐剂性关节炎大鼠,随机分成2组,每组35只。溶液组: 注射SMH溶液; ISH2组: 注射载SMH的ISH2。左膝关节腔分别注射给药,给药剂量为4.5 mg·kg−1 (按SMH计算),给药前禁食12 h,自由饮水。分别于给药后0.25、2、12、24、48、72和168 h,各组取5只大鼠麻醉后颈椎脱臼处死,取出滑膜用生理盐水冲洗去除黏附的制剂,用滤纸吸干水分后称重,于 −20 ℃保存。
大鼠滑膜样品的处理 将大鼠滑膜样品置5 mL离心管中,剪碎后加生理盐水0.8 mL,冰浴条件下经IKA高速匀浆机匀浆至乳白色,−10 ℃下6 000 r·min−1冷冻离心20 min,取上清液200 μL置于5 mL的具塞离心管中,加入盐酸普鲁卡因标准溶液 (202.8 ng·mL−1) 100 µL作为内标,加氨−氯化铵溶液 (pH 11.0) 80 μL碱化,涡旋混合1 min,加正己烷−二氯甲烷−异丙醇 (100∶50∶5,v/v) 混合液1.2 mL提取,涡旋混合3 min,3 500 r·min−1离心10 min,分取上层有机相,置于1.5 mL离心管中,50 ℃水浴下氮气吹干,用流动相100 μL溶解,4 ℃条件下12 000 r·min−1离心15 min,取上清液进样,采用UPLC测定药物浓度。
UPLC色谱条件色谱柱: ACQUITY UPLC BEH C18 (2.1 mm × 100 mm,1.7 µm); 流动相: 乙腈− 0.1% 乙酸水溶液 (12∶88,v/v); 检测波长: 265 nm; 流速: 0.2 mL·min−1; 柱温: 30 ℃; 进样量: 2 μL。
药物动力学参数的计算将各组滑膜药物浓度−时间数据输入3p97软件,计算药动学参数。
结果 1 ISV2处方筛选 1.1 PT-ET-水的三元相图不同比例的PT、ET和水的三元混合体系可形成各向同性溶液、乳状液和不同结构的液晶。各向同性溶液为均一透明的液体,流动性好,偏光显微镜观察为暗视野; 乳状液为乳白色液体,放置一段时间后分层; 层状液晶外观为透明黏稠液体,在偏光显微镜下呈现出十字状花纹或油纹状花纹; 立方液晶外观呈透明凝胶状,在偏光显微镜下呈现的也是暗视野,但是立方液晶黏度较大,可与各向同性溶液区别。各向同性溶液、层状液晶和立方液晶的偏光显微镜照片见图 1。
 | Figure 1 Images of samples under crossed polarized light microscopy (×100). A: Isotropic solution; B: Lamellar liquid crystal; C: Cubic liquid crystal |
通过肉眼及偏光显微镜观察,绘制PT-ET-水的三元相图,见图 2。从图中可见,不同比例PT、ET和水可形成不同的相态。各向同性液性质稳定,黏度低,可用于注射给药,拟作为关节腔注射用ISV2的候选区域。另外,由于关节腔含水量有限,PT-ET-水三元体系中ET含量越高,相转化形成立方液晶所需吸水量越多,因此选择ET含量较低的各向同性液区域的三元体系进行后续处方筛选工作,处方组成见表 1。
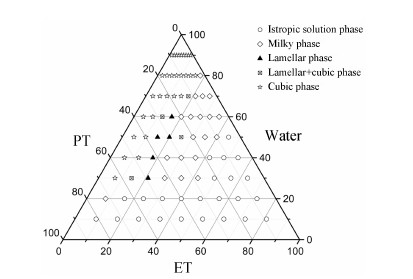 | Figure 2 Phase diagram of the PT-ET-water system. PT: Phytantriol; ET: Ethanol |
|
|
Table 1 Compositions of investigated in situ cubic liquid crystal (ISV2) formulations (all quantities are given as percentage by weight). SMH: Sinomenine hydrochloride |
处方F1~F5注射进入水中可发生相转化形成透明的凝胶状物质,偏光显微镜观察呈现暗视野,说明各向同性溶液F1~F5具有吸水相转化为立方液晶的能力。
1.3 ISV2理化性质对处方F1~F5的相关理化性质进行研究,考察处方因素对关节腔注射用ISV2可注射性、pH值、Vmin和Tg的影响,结果见表 2。从表中可见,所有制剂都可以顺利通过针头规格为25 G的1.0 mL注射器。值得一提的是,常用于关节腔注射的针头规格为20~25 G[10, 11],本研究选用最细的针头进行评价,所有ISV2都可以通过,说明其可注射性好。选用细的针头可以减少关节腔注射痛苦,增加患者顺应性。
|
|
Table 2 Physicochemical properties of investigated formulations. |
注射剂的pH值要求与血液 (pH 7.4) 相等或相近,一般控制在4~9之间[10]。本实验结果显示所有处方的pH值都符合要求 (表 2)。
由于关节滑液量较少,其中水的含量很低。ISV2关节腔注射给药后需吸水才能发生相转化形成立方液晶缓慢释药,因此ISV2的Vmin和Tg关系到其缓释性能,是评价其质量的重要指标。处方F1~F5的Vmin和Tg结果见表 2。F1、F2和F3的含水量相同 (20%),但PT/ET不同(8∶2,7∶3和6∶4); F1、F4和F5处方中PT/ET相同 (8∶2),但含水量不同 (20%、15%和10%)。当含水量保持不变时 (F1、F2和F3),随着PT/ET降低,Vmin和Tg增加; 当PT/ET保持不变 (F1、F4和F5),随着含水量降低,Vmin和Tg增加。从表 2可见,F1的Vmin和Tg最小,表明F1可在最短时间内吸收最少水量而相转化形成立方液晶。
2 ISH2的处方筛选 2.1 外观及相转化能力考察在筛选出的ISV2处方 (F1) 基础上加入VitEA制备ISH2。采用单因素考察法筛选VitEA的添加量,处方组成见表 3。F6~F11均为透明的液体,静置48 h后不分层; F12为乳白色液体,静置后分层。
|
|
Table 3 Compositions of investigated formulations (all quantities are given as percentage by weight). VitEA: Vitamin E acetate |
将F6~F11注入过量的水中均可形成透明凝胶状物质,取少量凝胶进行偏光显微镜观察,结果见图 3。从图中可见,F6吸水相转化形成的液晶存在部分扇形偏光花纹,为立方液晶和六角相液晶的混合物; F7~F11吸水相转化形成的液晶具有扇形偏光花纹,为六角相液晶。结果表明,处方F7~F11为ISH2,吸水后可发生相转化形成六角相液晶。
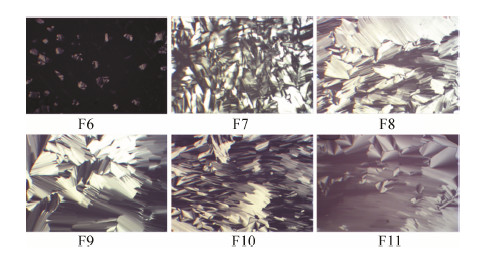 | Figure 3 Images of gels formed from formulations (F6−F11) in excess water under crossed polarized light microscopy (×100) |
以SMH峰面积 (A) 对SMH浓度 (C,µg·mL−1) 进行线性回归,得回归方程为A = 1 928.4C − 790.5,r = 0.999 7,在2.049~122.952 µg·mL−1内,峰面积与浓度呈良好的线性关系,方法回收率与日内、日间精密度均符合要求。
选择ISH2处方F7、F9和F11 (相当于在PT中 分别加入3%、5%、7% VitEA) 进行体外释放实验,释放曲线见图 4。从图中可见,处方F9的释药曲线 优于F7和F11。处方F9和F11可持续释放SMH长达240 h,240 h内累计释药量分别为92.5% 和99.9%,F9释药明显慢于F11 (f2 = 48.6); F7在240 h时释放 介质中已检测不到药物,释药不完全,这可能是由于PT对药物有吸附[2]。从图中插图 (阴影部分) 可看 出,在前2 h内F9和F11的释药速率快于F7,这可能是由于F9和F11中疏水性的VitEA含量较多,阻碍了PT吸水相转化形成六角相液晶,导致释放初期的释药速率较快。随着时间的延长,F9和F11完全相转化后形成六角相液晶释药速率变缓。
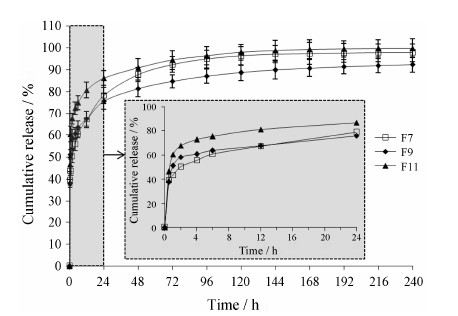 | Figure 4 Effect of the amount of VitEA on the SMH release from in situ hexagonal liquid crystals (ISH2, PT/VitEA/ET/water, 60.8:3.2:16:20, w/w/w/w) formulations. n = 3, x±s |
原位液晶吸水相转化后形成的液晶结构是其缓释药物的关键,因此有必要对其结构进一步表征。除了偏光显微镜,小角度X射线散射特别适用于鉴定液晶的相结构,根据小角度X射线散射图谱中各散射峰对应的散射因子的比值可确定溶致液晶的结构[12]。本研究在处方筛选基础上对F1和F9吸水相转化后形成的液晶结构进行表征 (以未载药的原位液晶作为对照) ,小角度X射线散射图谱见图 5。3个Bragg散射峰对应的散射因子的比值为$\sqrt 2 $∶$\sqrt 3 $∶$\sqrt 4 $ (图 5A),表明F1吸水相转化后形成的是双菱形晶格立方液晶; 3个Bragg散射峰对应的散射因子的比值为1∶$\sqrt 3 $∶$\sqrt 4 $ (图 5B),表明F9吸水相转化后可形成六角相液晶。另外,加入6 mg·g−1 SMH对相转化无影响。
 | Figure 5 Small angle X-ray scattering profiles for the gels obtained from F1 (A) and F9 (B) in excess water. Formulations without 6 mg·g−1 SMH were used as control |
采用高级流变仪对ISV2 (F1) 和ISH2 (F9) 的流变学性质进行研究,稳态剪切实验结果见图 6,从图中可见,ISV2和ISH2的剪切应力与剪切速率成正比,表现为牛顿流体的特性。
 | Figure 6 Flow curves of ISV2 (PT/ET/water, 64∶16∶20, w/w/w) and ISH2 |
采用小幅振荡实验对ISV2、ISH2、ISV2吸水相转化后形成的立方液晶和ISH2吸水相转化后形成的六角相液晶的黏弹性进行研究,频率扫描图谱见图 7。从图中可见,ISV2和ISH2的弹性模量 (G′) 和黏性模量 (G″) 没有交点,黏性模量始终大于弹性模量,表明ISV2和ISH2为黏性体系,有较好的生物黏附性,可使药物滞留于关节腔。ISV2和ISH2给药后吸水相转化形成的立方液晶和六角相液晶的弹性模量和黏性模量具有交点,随着角频率增大,弹性模量增大并超过黏性模量,该性质提示患者在休息状态时,液晶表现为黏性体系,起润滑作用; 当患者处于运动状态时,液晶表现为弹性体系,起缓冲、保护作用。
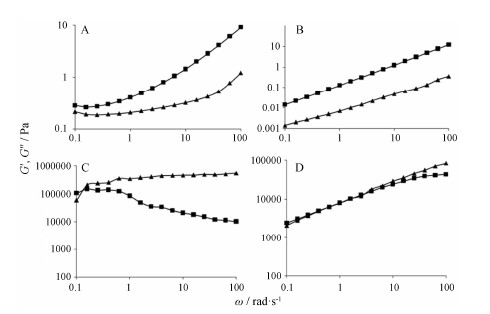 | Figure 7 Rheological properties of ISV2 (A), ISH2 (B), cubic liquid crystal obtained from ISV2 in excess water (C) and hexagonal liquid crystal obtained from ISH2 in excess water (D). Elasticity modulus (G′) and viscous modulus (G′′) are represented by ▲ and ■, respectively |
为了筛选出体外释药行为最佳的原位液晶,对ISV2和ISH2体外释药行为进行比较,在处方筛选研究基础上选择处方F1 (ISV2) 和F9 (ISH2) 进行体外释放研究,体外释放曲线见图 8。从图中可见,ISV2可持续释药144 h,ISH2可持续释药长达240 h。从插图 (图中阴影部分) 可见,在前1 hISH2释药快于ISV2,这可能是由于ISH2中添加的疏水性VitEA阻碍体系吸水发生相转化。随着时间的延长,ISV2和ISH2完全相转化形成立方液晶和六角相液晶,此时药物的释放主要受液晶结构影响 (如液晶中水道的直径、弯曲度及水道的闭合状态等因素)。众多研究表明[5, 13, 14],六角相液晶中的水道是闭合的,其释放水溶性药物显著慢于立方液晶 (有一条水道是与外界相通的),这可能是ISH2在1 h后释药较ISV2缓慢的原因。结果表明,ISH2缓释效果更明显,可减少给药频率,更适合于关节腔注射给药。
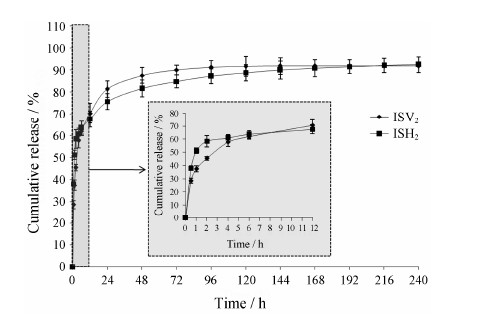 | Figure 8 In vitro release profiles of 6 mg·g−1 SMH from ISV2 and ISH2. Inserted panel shows the in vitro release profiles in the first 12 h. n = 3, x±s |
采用内标法测定滑膜样品中SMH含量。UPLC测定SMH峰面积Ai,内标峰面积As,以Ai/As作为纵坐标,药物浓度 (C,ng·mL−1) 作为横坐标,采用加权最小二乘法进行线性回归,得回归方程Ai/As = 5.018×10−4C − 2.410×10−4,r = 0.997 6。该方法在50.09~2 003.40 ng·mL−1内,峰面积比与药物浓度有良好的线性关系,最低定量限为50.09 ng·mL−1。在低、中、高3个浓度下,方法回收率为99.43%~103.67%,提取回收率为72.32%~78.41%,日内精密度和日间精密度小于10%,均符合生物样品分析方法的要求。
根据测得的滑膜中药物浓度,绘制平均药物浓度 (C) 对时间 (t) 的药时曲线 (图 9)。从图中可见,SMH溶液注射后,滑膜中药物浓度迅速升高,随后迅速下降,48 h后已无法检测; 载SMH的ISH2注射12 h后滑膜中药物浓度达到峰值,注射后第7天依然可以检测到SMH。造成此现象的原因可能是SMH为小分 子药物,以溶液形式关节腔注射后会迅速渗漏进入血液循环,关节腔中药物浓度迅速降低,从而导致被滑膜吸收的药物减少,滑膜中药物浓度随之迅速降低; 而ISH2关节腔注射后可缓慢释放药物,减少药物渗漏进入血液循环,更多的药物被滑膜吸收,提高药物在关节局部的生物利用度,降低药物的系统不良反应。
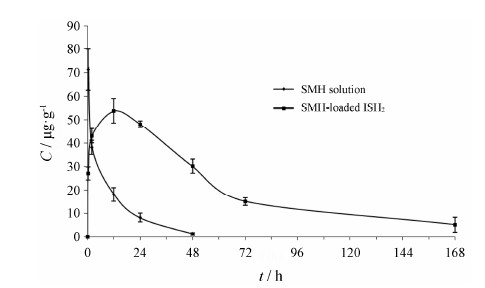 | Figure 9 The concentration curve of SMH in synovial membrane after intra-articular injection of the solution of SMH and SMH-loaded ISH2 in adjuvant-induced arthritis rats |
将各组滑膜药物浓度−时间数据输入3p97软件,计算药动学参数,结果见表 4。结果显示,ISH2组的分布项半衰期 (t1/2α)、消除项半衰期 (t1/2β)、达峰时间 (tmax) 和平均滞留时间 (MRT0−∞) 明显延长,ISH2组的AUC0−∞是溶液组的6.01倍。结果表明,ISH2可在关节局部缓释药物,从而延长药物的半衰期和驻留时间,使更多的药物被滑膜吸收,提高药物的生物利用度。
|
|
Table 4 The pharmacokinetic parameters of the SMH solution and SMH-loaded ISH2 in adjuvant-induced arthritis rats |
目前国内外关于关节腔注射用的原位液晶制剂研究刚刚起步,关节腔注射用原位液晶的质量控制方法仍在不断补充与完善。现有的质量研究方法包括对制剂外观、可注射性、pH值、流变学性质 (黏度、黏弹性等)、体外溶胀、吸水后液晶结构及体外释药行为等进行考察[3, 10]。某些关于原位液晶的文献[3, 15]对原位液晶的吸水溶胀行为进行考察,实验过程中人为干扰因素大,实验结果不可靠。因此本研究设计实验分别考察原位液晶的Vmin和Tg,从而预测制剂体内吸水相转化行为,控制制剂质量,实验人为干扰因素少,重复性好,有望推广使用。
本研究对关节腔注射用原位液晶的质量研究包括两方面: 一方面要对其理化性质进行考察,以确保制剂可用于关节腔注射,研究内容包括外观、可注射性、pH值、Vmin和Tg考察; 另一方面要对原位液晶相转化后形成的液晶结构进行表征,本研究采用偏光显微镜和小角度X射线散射对液晶结构进行表征,简单准确。另外,需要特别注明的是,由于六角相液晶黏度较低不能使转子停止转动,无法采用转子法考察ISH2的Vmin和Tg,因此本研究直接采用体外释放实验考察其释药性能。
关节腔注射给药的药动学研究方法多样,早期的研究由于条件的限制,采用皮下注射或皮下气囊模型等方法模拟关节腔体内释药行为,或是通过研究药物的血液药动学行为间接预测药物在关节局部组织的药动学行为,不能真实反映药物在关节腔的释放情况。采用固定的时间点处死动物,提取关节组织测定药物浓度的药动学研究方法,虽操作繁琐,但能真实反映各时间点关节腔局部药物浓度,具有重要参考价值。
| [1] | Xu M, Liu L, Qi C, et al. Sinomenine versus NSAIDs for the treatment of rheumatoid arthritis: a systematic review and meta-analysis [J]. Planta Med, 2008, 74: 1423-1429. |
| [2] | Han K, Pan X, Chen M, et al. Phytantriol-based inverted type bicontinuous cubic phase for vascular embolization and drug sustained release [J]. Eur J Pharm Sci, 2010, 41: 692-699. |
| [3] | Borgheti-Cardoso LN, Depieri LV, Diniz H, et al. Self- assembling gelling formulation based on a crystalline-phase liquid as a non-viral vector for siRNA delivery [J]. Eur J Pharm Sci, 2014, 58: 72-82. |
| [4] | Thomas K, Mmond CJ. Ordered 2-D and 3-D nanostructured amphiphile self-assembly materials stable in excess solvent [J]. Phys Chem Chem Phys, 2006, 8: 4957-4975. |
| [5] | Phan S, Fong WK, Kirby N, et al. Evaluating the link between self-assembled mesophase structure and drug release [J]. Int J Pharm, 2011, 421: 176-182. |
| [6] | Negrini R, Mezzenga R. pH-responsive lyotropic liquid crystals for controlled drug delivery [J]. Langmuir, 2011, 27: 5296-5303. |
| [7] | Shah VP, Tsong Y, Sathe P, et al. In vitro dissolution profile comparison-statistics and analysis of the similarity factor f2 [J]. Pharm Res, 1998, 15: 889-896. |
| [8] | Polli JE, Rekhi GS, Augsburger LL, et al. Methods to compare dissolution profiles and a rationale for wide dissolution specifications for metoprolol tartrate tablets [J]. J Pharm Sci, 1997, 86: 690-700. |
| [9] | Chen J, Wu H, Dai MM, et al. Identification and distribution of four metabolites of geniposide in rats with adjuvant arthritis [J]. Fitoterapia, 2014, 97: 111-121. |
| [10] | Réeff J, Gaignaux A, Goole J, et al. Characterization and optimization of GMO-based gels with long term release for intra-articular administration [J]. Int J Pharm, 2013, 451: 95-103. |
| [11] | Neustadt DH. Intra-articular injections for osteoarthritis of the knee [J]. Clev Clin J Med, 2006, 73: 897-911. |
| [12] | Fong W, Hanley T, Boyd BJ. Stimuli responsive liquid crystals provide ‘on-demand' drug delivery in vitro and in vivo [J]. J Control Release, 2009, 135: 218-226. |
| [13] | Lee KW, Nguyen TH, Hanley T, et al. Nanostructure of liquid crystalline matrix determines in vitro sustained release and in vivo oral absorption kinetics for hydrophilic model drugs [J]. Int J Pharm, 2009, 365: 190-199. |
| [14] | Rizwan SB, Hanley T, Boyd BJ, et al. Liquid crystalline systems of phytantriol and glyceryl monooleate containing a hydrophilic protein: characterisation, swelling and release kinetics [J]. J Pharm Sci, 2009, 98: 4191-4204. |
| [15] | Phelps J, Bentley MV, Lopes LB. In situ gelling hexagonal phases for sustained release of an anti-addiction drug [J]. Colloids Surf B Biointerfaces, 2011, 87: 391-398. |
 2016, Vol. 51
2016, Vol. 51


