创新霉素 (chuangxinmycin,简称CM,化学结构见 图 1 ) 是20世纪70年代我国科学家发现的一 个具有含氮、含硫杂环新骨架的抗生素,由从我国山东济南土壤中分离的1株游动放线菌 (Actinoplanes tsinanensis) 产生[1, 2, 3]。
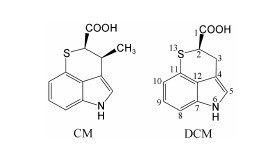 | Figure 1 Chemical structure of chuangxinmycin (CM) and demethylchuangxinmycin (DCM) |
在发现CM后,国内外学者对其进行了多方面研究: 化学方面,建立了CM化学全合成路线,获得了CM衍生物等[4, 5, 6, 7]; 生物学方面,从CM产生菌中分离纯化了一种可能参与催化CM生物合成的吲哚丙酮酸甲基转移酶,同位素标记实验推测CM分子中的硫原子可能来源于半胱氨酸 (Cys) 的巯基,以及维生素B12促进CM的生物合成[8, 9, 10, 11]; 药学方面,CM在临床上对大肠埃希菌等细菌感染引起的败血症、尿路感染、胆道感染和婴儿腹泻等有一定疗效[12],以及证实CM的抗菌作用是通过选择性抑制色氨酸tRNA合成酶活性实现的[13]。
本研究对CM产生菌——济南游动放线菌CPCC 200056产生的脂溶性次级代谢产物进行了分析,发现并鉴定了第一个CM生物合成类似物——3-去甲基 创新霉素 (3-demethylchuangxinmycin,DCM),比较了DCM与CM的抗菌活性,丰富了对CM构效关系的认识,并为继续深入研究CM生物合成提供了线索。
结果与讨论 1 结果 1.1 DCM的发现与化学结构鉴定在对不同培养时间的CPCC 200056乙酸乙酯提取物进行硅胶板TLC分析时,发现在紫外灯 (254 nm) 下紧靠CM的下方有一条吸收较弱条带 (图 2); 与CM一样,它在短波 (254 nm) 和长波 (365 nm) 波长下分别显示为黑色和蓝色条带; 借助于制备薄层色谱收集此条带,乙酸乙酯提取后进行HPLC分析,出现一个紫外吸收光谱与CM完全一致 (最大吸收波长均为230和296 nm)、但保留时间小于CM (tCM = 12.5 min,tDCM = 11.1 min,图 3) 的吸收峰,该洗脱峰可能为极性大于CM的类似物,它在发酵培养4天时含量较高,因此采用4天发酵培养物进行该CM类似物分离纯化。
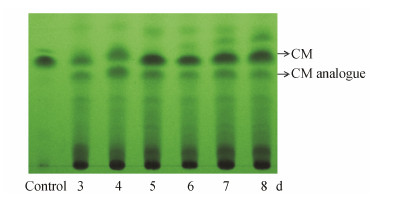 | Figure 2 Silica gel TLC of the EtOAc extract of Actinoplanes tsinanensis CPCC 200056 incubated at different time. The control is chemical synthesized CM |
 | Figure 3 Analytical HPLC of CM and the putative CM analogue |
CPCC 200056的5 L发酵物用乙酸乙酯萃取 后,采用制备型硅胶板TLC、半制备型反相HPLC和Sephadex LH-20凝胶柱分离纯化,得到了该CM类似物纯品约17.2 mg (纯度为98%),ESI-MS给出m/z 218 [M-H]-; HR-ESI-MS给出m/z 218.027 7 [M-H]-和220.042 7 [M+H]+,由此得出该CM类似物的分子式为 C11H9O2NS (理论值: 218.027 0 [M-H-]; 220.042 7 [M+H]+),比CM (分子式C12H11O2NS) 少一个CH2,参考CM化学结构推测该CM类似物可能是DCM。
将该CM类似物的1H NMR与参考文献[4]报道的CM 1H NMR数据 [δ 1.43 (3H,d,J = 6.35 Hz,CH3),3.51 (1H,brf,J = 7.82,6.35 Hz,H-3),3.69 (1H,d,J = 7.82 Hz,H-2),6.72~7.2 (m,ArH)] 进行比较,发现它缺失了一个δ 1.43甲基信号,同时多了一个化学位移δ 3.25氢信号,而其他信号基本一致,由此进一步推测该CM类似物可能是3-去甲基创新霉素。
随后,对该CM类似物的NMR谱进行了解析: 1H NMR的低场区给出一组1,2,3-三取代苯环的质子信号 [δ7.14 (1H,d,J = 7.2 Hz,H-8),7.02 (1H,t,J = 7.2 Hz,H-9),6.80 (1H,d,J = 7.2 Hz,H-10)],还给出 一个宽单峰质子信号δ 7.13 (1H,br s,H-5); 高场区给出3个质子信号 [δ 4.19 (1H,dd,J = 9.0,3.6 Hz,H-2),3.49 (1H,ddd,J = 15.6,3.6,0.6 Hz,H-3a),3.25 (1H,ddd,J = 15.6,9.0,1.2 Hz,H-3b)]。通过1H-1H COSY 相关谱,确定了高场区的3个质子为结构片段-CH-CH2-。该CM类似物13C NMR和DEPT除了给出以上结构片段的对应碳信号外,还给出了其他两个季碳信号,其中一个季碳信号 (δ 172.2) 推测为羧基或羧酸衍生物的羰基碳信号。利用HSQC将所有的氢及其对应的碳信号进行了归属。在该CM类似物HMBC中,H-3a/3b与C-1、C-4、C-5、C-12相关,H-2与C-1、C-4相关,H-5与C-3、C-7、C-12相关 (图 4)。
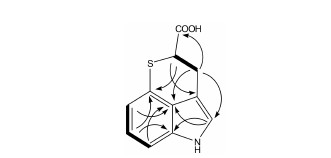 | Figure 4 1H-1H COSY (thick lines) and main HMBC (arrows) correlations of DCM |
通过以上分析,并将该CM类似物C-2位上的 质子和碳信号的化学位移 (表 1) 与参考文献[14]报道的创新霉素甲酯相应信号进行比较,以及该CM类 似物的分子中含有1个硫原子,可以确定C-2与C-11通过硫醚键相连。因此,该CM类似物结构被确定为DCM,与预期一致。
|
|
Table 1 NMR data of DCM (600 MHz for 1H, 150 MHz for 13C, CD3COCD3, J in Hz). * Not found |
(-)-3-去甲创新霉素 [(-)-3-demethylchuangxinmycin]: 白色无定形粉末; [α]D20=-30 (c 0.17,MeOH); UV (MeOH) λmax (log ε): 229 (4.28),286 (3.67),296 (3.73),306 (3.70) nm; 1H NMR (CD3COCD3,600 MHz) 和13C NMR (CD3COCD3,150 MHz) 数据见表 1; (-)ESI-MS m/z 218 [M-H]-; (-)HR-ESI-MS给出m/z 218.027 7 [M-H]- (理论值: 218.027 0),(+)HR-ESI-MS给出m/z 220.042 7 [M+H]+ (理论值: 220.042 7)。
由于DCM是济南游动放线菌CPCC 200056中CM生物合成酶系的催化产物,因此DCM分子中的C-2手性碳构型与CM分子中的一致,即为文献[15]报道的R构型。
1.2 DCM抗菌活性显著降低已知CM具有抗部分革兰阳性和阴性细菌活性。本研究对DCM与CM的体外抗菌活性进行对比测定,发现DCM对CM敏感菌株的抗菌活性 (MIC值) 显著低于CM (表 2),这表明C-3甲基对于CM的抗菌活性至关重要; 而对CM不敏感菌株例如假单胞菌 (P. aeruginosa ATCC 27853) 和粪肠球菌 (E. faecalis ATCC 29212) 等,DCM也不显示抗菌活性。
|
|
Table 2 The antibacterial activity of DCM and CM |
细菌氨酰tRNA合成酶抑制剂是抗菌药物发现的一个重要方向,来源于微生物次级代谢产物的莫匹罗星 (mupirocin) 作为选择性抑制细菌异亮氨酰tRNA合成酶的抑制剂,用于临床治疗革兰阳性球菌引起的皮肤感染。CM作为细菌色氨酸tRNA合成酶抑制剂在我国曾进行应用开发研究,但由于疗效有待提高,CM没有在临床上得到推广应用。尽管如此,对CM进行化学结构修饰改造以提高抗菌活性的研究仍在继续。
本文报道了从CPCC 200056中发现第一个天然的CM类似物组分——DCM。顾志平等[15]在创新霉素的立体化学研究中曾合成了去甲创新霉素,但未见活性报道。
在Brown等[13]化学合成获得的若干CM衍生物中,有一个C-3连接的甲基被羟基化修饰的化合物,它几乎没有抑制色氨酸tRNA合成酶活性 (该活性与抗菌活性平行); 本研究发现DCM的抗菌活性显著低于CM,这些结果说明CM分子中C-3连接的甲基对于CM抗菌活性非常重要,这一结论丰富了对CM构效关系的认识。
在CPCC 200056产生CM的发酵培养过程中,始终伴随着DCM的出现。目前还不清楚DCM是 CM生物合成过程中出现的正常中间产物 (normal intermediate) 还是支路产物 (shunt product),这有望在深入研究CM生物合成机制的过程中予以阐明。
目前,对CM的生物合成途径仍存在许多疑问。许津等[10]报道Cys分子中的巯基提供了CM生物合成中的硫原子。Cys通常作为含硫天然产物生物合成中的硫原子供体化合物,但在CM生物合成中硫原子掺入的具体分子机制并不清楚。Zhao等[16]最近报道了在林可霉素生物合成研究中发现一种新颖的硫原子掺入分子机制,但对天然产物生物合成中硫原子掺入分子机制的了解还比较有限。因此,阐明CM生物合成中硫原子的掺入机制有望丰富对微生物次级代谢产物生物合成的认识。
实验部分酵母提取物和麦芽提取物均为OXOID产品; 乙腈为Fisher产品; 乙酸乙酯等有机试剂为国产分析纯试剂; 制备型硅胶板为烟台江友硅胶开发有限公司产品; Sephadex LH-20凝胶为GE Healthcare公司产品; CM对照品,本研究所化学合成室提供; 分析色谱柱: Diamonsil C18反相柱 (4.6 mm × 150 mm,5 μm); 半制备色谱柱: YMC-Pack ODS-A反相柱 (250 mm × 10 mm,S-5 μm,12 nm)。
济南游动放线菌CPCC 200056 (以下简称CPCC 200056),CM产生菌,中国药学微生物菌种保藏中心提供。检定菌: 表皮葡萄球菌Staphylococcus epidermidis ATCC 12228 (甲氧西林敏感) 和金葡菌Staphylococcus aureusATCC 29213 (甲氧西林敏感),金葡菌Staphylococcus aureus ATCC 33591 (甲氧西林耐受),大肠埃希菌Escherichiacoli ATCC 25922 (不产超广谱β-内酰胺酶),铜绿假单胞菌Pseudomonas aeruginosa ATCC 27853,粪肠球菌Enterococcus faecalis ATCC 29212以及其他检定菌,本所药理室保藏。
ISP2培养基 (用于CPCC 200056的培养与发酵) 组成: 葡萄糖4.0 g·L-1、酵母提取物4.0 g·L-1、麦芽提取物10.0 g·L-1、琼脂粉15.0 g·L-1,pH自然; MH琼脂培养基和脑心浸液培养基 (美国BD公司产品); MH肉汤培养基购自中国食品药品检定研究院,北京三药科技开发公司生产。
EYELAN-1100型旋转蒸发仪; 安捷伦1260和岛津LC-20A高效液相色谱仪; Thermo Fisher Scientific公司LTQ XL质谱分析仪; Bruker AVIIIHD公司核磁共振仪 (600 MHz,TMS为内标)。
1 CPCC 200056培养与发酵CPCC 200056冷冻保藏孢子悬液,适量接种于ISP2平板 (直径9 cm,含20~25 mL培养基),28 ℃培养7~10天,用无菌水或20% 甘油洗涤培养基表面菌苔,得新鲜孢囊孢子悬液。新鲜孢子悬液作为种子涂布于若干ISP2平板 (接种量约5×105个孢子/平板),若发酵培养物用于早期发现CM类似物则28 ℃培养3~8天以跟踪发酵培养过程,若发酵培养物用于分离纯化所发现的CM类似物则28 ℃培养4天。
2 DCM的发现CPCC 200056发酵培养3~8天,每天取1个ISP2平板培养物,切成约1 cm大小方块,用2倍体积乙 酸乙酯萃取1次(过夜)/span>。乙酸乙酯萃取液经浓缩至1.0 mL,硅胶板TLC分析点样量为5 μL,展开剂系 统为乙酸乙酯-正己烷-二氯甲烷-冰醋酸 (9∶7∶6∶0.2,v/v),分别在254和365 nm观察。将可能的DCM条带刮下后,用乙酸乙酯萃取、挥干,复溶于 乙腈中,进行ESI(-)-MS及HPLC分析,条件如下: Diamonsil C18反相柱 (4.6 mm × 150 mm,5 μm),流动相MeCN-H2O (水相中含0.1% 冰醋酸),15%~100%,30 min,流速1.0 mL·min-1; 检测波长254 nm,柱温25 ℃。
3 DCM分离纯化和结构解析收集28 ℃培养4天的CPCC 200056的ISP2发酵物5 L(约200个 平板),用2倍体积乙酸乙酯提取并浓缩后,首先采 用制备型硅胶板TLC (展开剂系统为乙酸乙酯-正己烷-二氯甲烷-冰醋酸,9∶7∶6∶0.2,v/v) 进行分离,在254 nm下,收集CM类似物的黑色条带,乙酸乙酯萃取并挥干后得CM类似物粗品。粗品溶于乙腈中,采用半制备型反相HPLC (流动相MeCN-H2O,45%等度洗脱,水相含0.1% 冰醋酸,流速1.5 mL·min-1,30 min; 检测波长254 nm,柱温25 ℃) 和Sephadex LH-20凝胶柱 (柱长30 cm,直径3 cm; 甲醇洗脱) 分离纯化,收集目标洗脱峰,干燥后得DCM纯品,以氘代丙酮为溶剂进行NMR分析以确证结构。
4 DCM抗菌活性测定参照CLSI标准,采用平皿二倍稀释法和多点接种器接种检定菌。检定菌用MH肉汤或脑心浸液增菌,CM与DCM用MH肉汤二倍稀释成各种所需浓度,分别加适量到平皿中,MH琼脂培养基融化后定量注入含CM与DCM的平皿内混匀,使平皿内药物的终质量浓度分别为0.03、0.06、0.12…64 μg·mL-1。接种检定菌 (接种量为1×104 CFU) 后置35 ℃恒温培养18 h后观察结果,无菌生长的平皿中所含CM与DCM的最小浓度即为最低抑菌浓度 (MIC)[17]。
| [1] | Li Q, Li YY, Yao ZY, et al. Taxonomic study on the chuangxinmycin-producing microorganism, Actinoplanes tsinanensis n. sp. [J]. Acta Microbiol Sin (微生物学报), 1976, 16: 102- 105. |
| [2] | Anonymity. Studies on a new antibiotic-chuangxinmycin [J]. Sci Sin (中国科学), 1976, 19: 295-300. |
| [3] | Anonymity. Studies on a new antibiotic-chuangxinmycin [J]. Sci Sin (中国科学), 1977, 20: 106-112. |
| [4] | Guo XL, Zhang ZP. A new total synthesis of chuangxinmycin and the study of its stereoisomers [J]. Acta Pharm Sin (药学学报), 1987, 22: 671-678. |
| [5] | Wang YC. Research of chuangxinmycin [J]. Chin Pharm J (中国药学杂志), 1992, 27: 520-522. |
| [6] | Su SH, Tu J, Zhang SW. Synthesis of some derivatives of chuangxinmycin [J]. Chin J Pharm (中国医药工业杂志), 1984, 3: 17-21. |
| [7] | Wang YC, Xu XD, Zhang ZP. Studies on new antitumor activities of chuangxinmycin derivatives [J]. Chin J Antibiot (中国抗生素杂志), 1992, 17: 417-421. |
| [8] | Cao J, Qi TQ. A study on indolepyruvic acid methyltransferase in chuangxinmycin-producing strain [J]. Acta Microbiol Sin (微生物学报), 1989, 29: 63-67. |
| [9] | Qi TQ, Liu X, Yang YF. Repression on the biosynthesis of enzymes involved in tryptophan synthetic pathway by chuangxinmycin [J]. Acta Acad Med Sin (中国医学科学院学报), 1980, 2: 32-37. |
| [10] | Xu J, Ma Y, Li Y. Studies on the biogenesis of sulfur in chuangxinmycin molecule [J]. Acta Microbiol Sin (微生物学报), 1978, 18: 66-70. |
| [11] | Zhou XZ, Liu L. Vitamine B12 plays an important role in biosynthesis of chuangxinmycin [J]. Acta Acad Med Sin (中国医学科学院学报), 1984, 6: 109-111. |
| [12] | Yan GH, Wang CD, Lin FT, et al. Antibacterial activity of chuangxinmycin in vivo and in vitro and distribution [J]. Chin J Antibiot (中国抗生素杂志), 1980, 5: 41-46. |
| [13] | Brown MJ, Carter PS, Fenwick AS, et al. The antimicrobial natural product chuangxinmycin and some synthetic analogues are potent and selective inhibitors of bacterial tryptophanyl tRNA synthetase [J]. Bioorg Med Chem Lett, 2002, 12: 3171-3174. |
| [14] | Xu XB, Liu J, Zhang JJ, et al. Nickel-mediated inter- and intramolecular C-S coupling of thiols and thioacetates with aryl iodides at room temperature [J]. Org Lett, 2013, 15: 550-553. |
| [15] | Gu ZP, Liang XT. The stereochemistry of chuangxinmycin [J]. Acta Chim Sin (化学学报), 1985, 43: 250-256. |
| [16] | Zhao QF, Wang M, Xu XD, et al. Metabolic coupling of two small-molecule thiols programs the biosynthesis of lincomycin A [J]. Nature, 2015, 518: 115-119. |
| [17] | Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing; Twenty- Third Informational Supplement [M]. PA, USA: Wayne, 2013. |
 2016, Vol. 51
2016, Vol. 51


