2. 辽宁中医药大学附属医院, 辽宁 沈阳 110032;
3. 中国医科大学, 辽宁 沈阳 110122;
4. 南华大学, 湖南 衡阳 421001
2. The Affiliated Hospital of Liaoning University of Traditional Chinese Medicine, Shenyang 110032, China;
3. China University of Medicine, Shenyang 110122, China;
4. University of South China, Hengyang 421001, China
动脉硬化闭塞症是全身性的动脉粥样硬化 (atherosclerosis,AS) 在相应局部的表 现。吸烟、糖尿病、高脂血症、高血压、高同型半胱氨酸血症、高凝状态及高龄等均为其危险因素。该病常累及下肢动脉,导致下肢动脉栓塞或下肢缺血性坏死[1]。据统计,老年人发病率达20%以上。随着我国人口老龄化日益加剧,动脉硬化闭塞症在临床的发病率呈逐年上升趋势,而且由于该病往往伴随进行性加剧静息痛及缺血性溃疡等表 现,致残性极高,严重影响患者的生活质量。因此探究动脉硬化闭塞症的致病机制,对于提高临床治疗效果具有十分重要的意义。
临床研究发现,动脉血管内皮功能紊乱、失调是动脉粥样硬化的根本诱因,而炎症性反应则促进了动脉粥样硬化的发生与发展。冠状动脉斑块中存在大量的巨噬细胞、淋巴细胞和肥大细胞,其中巨噬细胞是破裂斑块中细胞的主要成分。研究显示,在AS病变部位同时存在着M1型和M2型巨噬细胞,在特定条件下两者之间还可相互转化[2],这说明巨噬细胞对不同的微环境信号刺激具有多样反应性和可塑性。自噬 (autophagy) 是一种不同于凋亡的程序性细胞死亡方式,对于维持细胞结构、代谢和功能的平衡发挥着举足轻重的作用。近期研究[3]发现氧化型低密度脂蛋白 (oxidized low density lipoprotein,ox-LDL)、内质网应激、炎症和缺氧等与AS发生相关的因素均可促进斑块内细胞发生自噬。自噬不足或过度均会引发细胞的坏死或自噬性死亡,从而激发斑块内炎症因子的表 达[4]。在此环境作用下巨噬细胞可被诱导向M1型的分化,因M2型细胞能够削弱M1型细胞极化所带来的高炎症反应状态,因此在炎症反应后期,M2型细胞被大量激活,从而对受损组织发挥有效地修复和重塑作用。因此,作者认为巨噬细胞的自噬与极化的过程存在着必然的联系,但是两者究竟通过何种方式进行交互作用,目前尚未见报道。本实验旨在通过对下肢动脉硬化闭塞症患者股动脉粥样硬化斑块中巨噬细胞的极化表 型与自噬信号的分析,探讨动脉粥样硬化斑块中巨噬细胞自噬与极化的相互联系,从而为动脉粥样硬化的临床治疗和开发新型靶向治疗药物提供新的思路。
材料与方法 实验样本及资料收集病例来自2014年7月至2015年7月于辽宁中医药大学附属医院血管外科住院患者,所有患者已签署知情同意书,并经辽宁中医药大学附属医院伦理委员会审核通过。实验组标本取自下肢动脉硬化闭塞症截肢患者的股动脉,共12例。其中男9例,女3例; 平均年龄 (67 ± 8) 岁; 其中合并高血压5例,合并冠心病7例,排除其他合并疾病。管腔狭窄面积小于25% 患者2例,管腔狭窄面积为25%~50% 患者3例,管腔狭窄面积为51%~75% 患者3例,管腔狭窄面积为76%~100% 患者4例。对照组标本取自同期外伤截肢患者的股动脉,共5例。其中男3例,女2例; 平均年龄 (45 ± 7) 岁; 其中合并高血压2例,合并糖尿病3例。排除结节性多动脉炎及风湿性疾病等导致血管狭窄、房颤导致动脉急性闭塞以及凝血系统功能异常导致血栓形成的患者。
试剂PE-anti CD197 (chemokine receptor-7,CCR-7) 抗体购自eBioscience公司(USA); Alexa Fluor488-anti CD206 (macrophage mannose receptor,MMR) 抗体购自Biolegend公司 (USA); 兔抗-LC3抗体购自MBL公司 (Japan); Dylight405-羊抗兔抗 体购自Jackson Immuno Research公司 (USA)。Real time RT-PCR试剂盒购自Takara公司; 兔抗p-NF-κB/ NF-κB/p-STAT6/STAT6/p-STAT1/STAT1/Beclin-1/GAPDH抗体购自CST公司 (USA)。
动脉血管标本处理将每份动脉标本沿横断面切开分为两份: 一份置4% 多聚甲醛固定1~2天。行梯度酒精脱水、透明、常规石蜡包埋、切片,以备HE染色、油红O染色和免疫荧光检测用; 另一份标本置−80 ℃保存,用于后续基因及蛋白检测。
苏木精−伊红 (HE)染色取标本石蜡切片脱蜡至水,经水洗后,苏木素浸染10 min,10% 盐酸酒精分化10 s,0.5% 氨水返蓝,伊红浸染3~5 min,行梯度酒精脱水,二甲苯透明后,中性树脂封片,显微镜下观察。
油红O染色血管组织石蜡切片脱蜡至水,经水洗后,用异丙醇放置5 min,轻轻吸去异丙醇溶液,加入0.5% 油红O/异丙醇溶液,染色30 min; 蒸馏水清洗3次; 苏木素染色5 min,盐酸乙醇分色,氨水返蓝; 显微镜下观察并摄像。
荧光染色标本脱蜡后置于柠檬酸缓冲液,微波炉中火蒸沸3 min,冷却至室温,然后再重复蒸煮 1次,冷却至室温; 10% 山羊血清37 ℃封闭30 min,PBS清洗; 分别用1∶100稀释的PE-anti CD197 (CCR-7)、Alexa Fluor488-anti CD206 (MMR) 和兔抗- LC3抗体4 ℃避光染色1 h; PBS清洗; 用于LC3染色的切片加入Dylight405-羊抗兔抗体,4 ℃避光染色1 h; PBS清洗; 磷酸甘油缓冲液封片后于荧光显微 镜下以相应波长激发光激发后观察、拍照和分析。用Image ProPlus 6.0软件 (Media Cybemeties,silver Spring,USA) 对荧光标记阳性细胞所占面积百分比进行计数。
动脉组织基因检测采用实时荧光定量 (real time polymerase chain reaction,RT-PCR) 检测组 织巨噬细胞M1与M2型标记物的mRNA表 达。组织液氮研磨后,提取总RNA,反向转录成cDNA,以cDNA为模板,采用SYBR Green进行实时荧光PCR反应; 反应参数: 95 ℃ 30 s,1个循环; 95 ℃ 5 s,55 ℃ 10 s,40个循环 (具体引物序列见表 1)。将标准品进行倍比稀释后与待测样品同时进行反应,制作标准曲线,根据Ct值计算出待测样品目的基因及管家基因的起始浓度。以样本中目的基因起始浓度/内参基因起始浓度×100进行结果统计。
| Table 1 Primers of the genes for RT-PCR |
动脉组织用蛋白裂解液充分研磨于冰上裂解30 min。10 000 × g 4 ℃离心15 min,取上清用BCA蛋白定量试剂盒进行蛋白定量。取40 μg蛋白样品加入各个泳道,经SDS-PAGE电泳后,于半干转印槽中,将蛋白质从凝胶转移至PVDF膜上。PVDF膜用TBST室温洗涤3次。用含5% 脱脂奶粉的TBST封闭2 h。加入兔抗NF-κB/p-STAT6/p-STAT1/LC3抗体(1∶1 000稀释),4 ℃孵育过夜。次日经1∶4 000稀释羊抗兔IgG-HRP 37 ℃孵育2 h。以ECL发光试剂盒进行发光,胶片经显影、定影后拍照,测量条带灰度值,以目标蛋白/内参蛋白×100进行计算,定量分析蛋白表 达量。
统计学处理数据用均数 ± 标准差 (Mean ± SD) 表 示,采用GraphPad Prism 5.0软件或SPSS 11.0软件进行统计分析,两组间差异比较采用Student’s t检验分析,以P < 0.05为差异有统计学意义。
结果 1 动脉标本HE及油红O染色形态对照组光镜下可见动脉管腔圆形,内膜、中膜和外膜分界清楚 (如图 1中黄色及蓝色虚线所示区域),内膜层平滑,油红O染色显示巨噬细胞内未见或少见脂滴; 实验组光镜下可见动脉横断面上有多少不等的内膜局部增厚病灶,内膜和中膜分界不清 (如图 1中黄色及蓝色虚线所示区域),弹力纤维排列紊乱,可见脂质沉积和泡沫细胞及炎性细胞大量浸润。基本可分为两种典型的形态,即纤维斑块 (fibrous plaque) 及粥样斑块 (atheromatous plaque)。
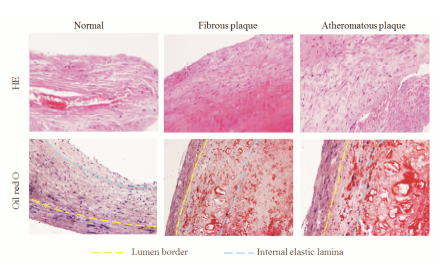 | Figure 1 Morphology of histopathological sections (stained with HE and Oil red O) (×200) |
纤维斑块: 皮下和坏死中心之间可见密集的胶原纤维、散在性血管平滑肌细胞和巨噬细胞以及少量弹力纤维、细胞外脂质和坏死碎片; 基底部可见增生的血管平滑肌细胞、结缔组织和炎性细胞; 油红O染色显示,泡沫细胞内有中等量的红色脂质颗粒存在,并聚集成滴,环状排列在细胞膜内侧。
粥样斑块: 可见大量无定形坏死物质组成的纤维帽,其中可见针形或梭形空隙的胆固醇结晶及钙化。坏死物底部及周边可见肉芽组织、少量泡沫细胞和淋巴细胞。病灶处中膜平滑肌受压萎缩而变薄。外膜可见毛细血管新生、结缔组织增生及淋巴细胞、浆细胞浸润; 油红O染色显示,泡沫细胞明显变圆且体积增大,内有大量红色脂滴,部分泡沫细胞已破裂,脂滴遍布分散 (图 1)。
2 动脉标本自噬及巨噬细胞极化表 型相关蛋白荧光表 达荧光显微镜下可见CD206+巨噬细胞 (M2) 染为绿色,CCR7+巨噬细胞 (M1) 染为红色,LC3+自噬细胞染为兰紫色。本实验分别对两种典型斑块的荧光染色进行了分析,结果表 明,纤维斑块组织中CCR7+巨噬细胞明显高于粥样斑块组织 (P < 0.05),CD206+巨噬细胞明显低于粥样斑块组织 (P < 0.01),LC3+细胞百分比明显低于粥样斑块组织 (P < 0.05),提示早期动脉粥样硬化斑块中巨噬细胞以M1型为主,自噬水平较低; 而晚期斑块中巨噬细胞M1与M2表 型同时高表 达,其中M2表 型增强尤为显著,且显示出较高的自噬水平 (图 2和图 3)。
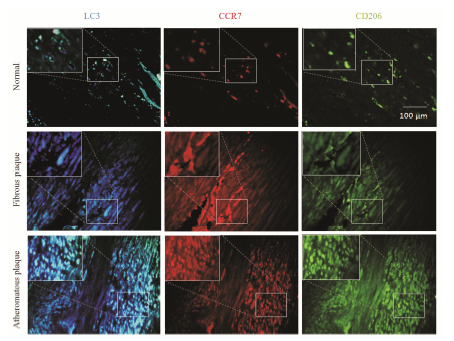 | Figure 2 Expression of surface molecules on macrophages (×200) |
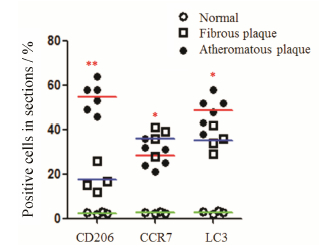 | Figure 3 The percentage of surface molecules on macrophages in sections. n = 4−6, x±s. P < 0.05, **P < 0.01 atheromatous plaque group vs fibrous plaque group |
本实验分别对两种典型斑块组织中与巨噬细胞极化表 型相关的mRNA水平进行了分析,结果表 明纤维斑块中巨噬细胞以M1型mRNA水平升高为主 (与对照组比较P < 0.01),其中TNF-α、MCP-1、iNOS、IL-6、IL-12 mRNA表 达水平均明显高于粥样斑块 (P < 0.01或0.05); 粥样斑块中巨噬细胞M1型与M2型mRNA表 达水平均明显高于正常对照 (P < 0.01或0.05),其中M2型mRNA如Arg-1、TGF-β、CD163及IL-10表 达水平均明显高于纤维斑块 (P < 0.01),见图 4。此结果提示,早期动脉粥样硬化斑块巨噬细胞以M1表 型为主,晚期斑块巨噬细胞M1与M2表 型同时高表 达,M1与M2型细胞处于动态平衡状态,其中M2表 型显著高于早期斑块。
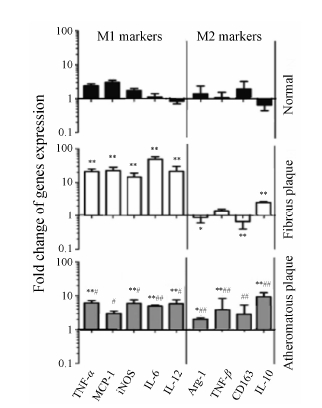 | Figure 4 Expression of relative mRNA of M1/M2 markers. n = 5, x±s. P < 0.05, **P < 0.01 vs normal group; #P < 0.05, ##P < 0.01 vs fibrous plaque group |
本实验分别对两种典型斑块组织中与细胞自噬相关的信号通路蛋白进行了分析,结果表 明,纤维斑块组织p-STAT1及p-NF-κB表 达水平显著升高,与粥样斑块组织相比P < 0.01; 而粥样斑块组织p-STAT6表 达显著升高,与纤维斑块组织相比P < 0.01; 粥样斑块组织自噬体蛋白LC3-II表 达水平明显高于纤维斑块组织 (P < 0.01),见图 5。以上结果提示,早期动脉粥样硬化斑块中巨噬细胞通过p-STAT1/NF-κB通路诱导向M1型极化,而晚期斑块中巨噬细胞则通过激活p-STAT6通路诱导向M2型极化过渡,M2型较M1型巨噬细胞表 达更高的自噬体蛋白水平。
 | Figure 5 Level of relative protein. n = 5, x±s. P < 0.05, **P < 0.01 vs normal group; ##P < 0.01 vs fibrous plaque group |
巨噬细胞是参与炎症反应应答的重要细胞,对于维持机体稳态、机体防御和修复机体损伤等具有 重要作用。根据巨噬细胞不同的功能特性及其诱导Th1或Th2应答的特点,人们将巨噬细胞分为两型: M1型巨噬细胞,即经典活化的巨噬细胞 (classically activated macrophage),在细菌或其产物脂多糖 (lipopolysaccharides,LPS) 或interferon-γ (IFN-γ) 的诱导下产生[5, 6, 7],具有较高的抗原提呈能力,可通过分泌多种细胞因子,如大量interleukin (IL)-12、tumor necrosis factor-α (TNF-α) 和IL-23及少量IL-10等,高表 达调理受体如FcRⅢ (CD16),参与Thl型免疫应答。可诱导性一氧化氮合成酶 (inducible nitric oxide synthase,iNOS) 在胞内合成大量一氧化氮 (nitric oxide,NO) 及活性氧中间产物等,对细胞内感染病原体和肿瘤细胞有杀伤作用。M1型巨噬细胞可促进一系列趋化因子的转录[8],有利于清除细胞内 病原体和肿瘤[9]; M2型巨噬细胞,即选择性活化的 巨噬细胞 (alternatively activated macrophage),可由IL-4、IL-13、糖皮质激素、维生素D3和前列腺素E2 (prostaglandins E2,PGE2) 等诱导产生[10]。能够分泌IL-1受体拮抗剂 (IL-1RA)、IL-10、转化生长因子-β (transforming growth factor-β,TGF-β) 等细胞因子,高表 达精氨酸酶 (arginase,Arg-1)、壳多糖酶样蛋白 (chitinase-like 3,CHI3L3/YM-1) 及大量非调理受体如巨噬细胞甘露糖受体(MMR/CD206)、清道夫受 体 (scavenger receptor,SR/CD23)、FcεRII (CD163) 等[11]。M2型巨噬细胞杀伤病原体的能力下降,不能有效地提呈抗原,但具有较好的促进血管生成和创伤愈合的能力,主要参与免疫抑制、组织修复、血管生成和间质形成等过程[12]。
研究显示,不稳定斑块组织中主要以M1型巨噬细胞为主,而稳定斑块组织中M2型巨噬细胞比例增加,M1与M2型巨噬细胞处于动态平衡[13, 14]。在AS晚期患者血浆中出现Th2型细胞因子,并通过激活M2型巨噬细胞促进纤维帽形成,从而增强斑块的稳定性[15]。研究表 明,M2型巨噬细胞对于炎症反应后期的组织损伤具有修复和重塑作用[16]。可见,通过调节巨噬细胞的功能性分化,不仅能减少M1型巨噬细胞对血管的免疫损伤,而且可增强M2型巨噬细胞的抗炎能力,促进血管修复,可能成为临床治疗AS的新策略。由于IL-4和IL-13等可诱导M2型细胞极化的细胞因子尚不能应用于临床,因此,除糖皮质激素和PPARs激动剂外,目前亟待研究、开发其他可改变单核−巨噬细胞分化方向的药物[17]。阐明不同亚型巨噬细胞的功能及其免疫调节机制无疑会对临床治疗策略及减少心肌梗死的发生具有重要意义。
目前认为,基础性或适度的自噬是AS斑块内细胞对抗氧化应激和炎症的重要保护方式,是AS斑块稳定性的一个重要决定因素,自噬不足或者自噬过度均会影响斑块的发生发展进程。既然巨噬细胞的自噬和极化的相互作用决定着AS的进展,那么巨噬细胞自噬和极化信号通路之间一定存在着必然的联系。国内外研究[18, 19]表 明,NF-κB和STAT6信号通路在巨噬细胞极化过程中发挥着重要的作用。本课题组前期对骨髓来源巨噬细胞的极化研究也证实,NF-κB及STAT6分别是调控M1型及M2型巨噬细胞活化信号通路中的关键蛋白[20]。M2诱导信号可有效上调STAT6的表 达,选择性诱导巨噬细胞高表 达与M2型巨噬细胞相关的转录基因Fizz和YM-1,诱导与Th2型免疫反应相关趋化因子的表 达,同时M2型诱导信号可下调NF-κB的表 达,限制与Th1型免疫反应和炎症相关因子的表 达[21]。本实验结果表 明,早期动脉粥样硬化斑块中巨噬细胞通过p-STAT1/NF-κB通路诱导细胞向M1型极化,表 达适度的自噬水平; 而晚期斑块中巨噬细胞则通过激活p-STAT6通路诱导细胞向M2型极化过渡,M2型较M1型巨噬细胞具有更高的自噬水平。本结果提示,动脉粥样硬化发病初期,某些感染因素可诱导单核细胞移行至内皮下分化为巨噬细胞并摄取大量脂质后成为泡沫样细胞,分泌炎性细胞因子及黏附分子,趋化淋巴细胞,加重内皮损伤,引起平滑肌细胞增殖、迁移以及基质胶原成分的改变。此时血管内环境可诱导巨噬细胞向M1表 型分化,释放大量炎症因子,加剧炎症的形成。因人体免疫系统具有维持自稳的能力,因此在炎症反应后期,M2型巨噬细胞被大量激活,且M1与M2型细胞处于一个动态平衡的状态,M2型细胞的活化可有效削弱M1型细胞极化所带来的高炎症反应状态,从而对受损组织发挥有效地修复和重塑作用。同时,AS早期巨噬细胞的自噬减少了泡沫细胞的积聚,抑制了斑块的形成和发展。而在AS的中晚期,巨噬细胞的自噬可以有效减少斑块中的炎症反应,起到稳定斑块的作用。但是,如果此时自噬水平过度升高,可促使纤维帽变薄,使斑块向不稳定方向发展。近年研究表 明,自噬主要由自噬相关基因 (autophagy associated gene,Atg) 编码的蛋白完成。mTOR (mammalian target of rapamycin,雷帕霉素靶蛋白) 是丝氨酸/ 苏氨酸蛋白激酶,对细胞生长具有重要调节作用,可以抑制自噬的发生。其信号转导通路包括上游的Akt (serine/threonine kinase)、I型PI3K/PKB (phosphatidylinositol 3-kinase)、IGF-1/2 (insulin-like growth factor-1)、MAPK (mitogen-activated protein kinase) 等及其下游分子p70S6 (核糖体蛋白质S6) 等[22]。同时mTOR也参与免疫细胞极化过程的调控[23, 24]。据此推测通过动态调控巨噬细胞内的某些关键靶点(如mTOR、PI3K和Akt等),可以有效平衡动脉粥样硬化不同阶段M1与M2型巨噬细胞的活化水平,适度诱导细胞的自噬,提高动脉粥样硬化斑块的稳定性。对于其确切的调控机制,作者将在后续的研究中进行深入的报道。综上所述,本研究从巨噬细胞极化与自噬的角度探讨了动脉粥样硬化发生发展的内在免疫学机制,为进一步揭示动脉粥样硬化的发病机制提供了有利的证据。
| [1] | Chu L, Liu FY, Wang LC. Polarization of macrophages and its correlation with the occurrence of atherosclerosis in elderly patients [J]. J Pract Med (实用医学杂志), 2015, 31: 944- 947. |
| [2] | Bouhlel MA, Derudas B, Rigamonti E, et al. PPARγ activetion primes human monocytes into alternative M2 macrophages with anti-inflammatory properties [J]. Cell Metab, 2007, 6: 137-143. |
| [3] | Ding J, Zeng CM, Jin HF, et al. Effect of oxidized low density lipoprotein on ultra-micro structure of human macrophages [J]. J Appl Clin Pediatr (实用儿科临床杂志), 2010, 25: 11-13. |
| [4] | Liao X, Sluimer JC, Wang Y, et al. Macrophage autophagy plays a protective role in advanced atherosclerosis [J]. Cell Metab, 2012, 15: 545-553. |
| [5] | Zhang F, Xiong SD. The polarization of macrophages and the significance [J]. Chin J Cell Biol (细胞生物学杂志), 2007, 29: 27-30. |
| [6] | Wu XH, Zhang H, Wu ZG. Macrophage and atherosclerosis [J]. Adv Cardiovasc Dis (心血管病学进展), 2005, 26: 302- 306. |
| [7] | Edwards JP, Zhang X, Frauwirth KA, et al. Biochemical and functional characterization of three activated macrophage populations [J]. J Leukoc Biol, 2006, 80: 1298-1307. |
| [8] | Mantovani A, Sica A, Sozzani S, et al. The chemokine system in diverse forms of macrophage activation and polarization [J]. Trends Immunol, 2004, 25: 677-686. |
| [9] | Chen WN, Liu JL, Meng JJ, et al. Macrophage polarization induced by neuropeptide-methionine enkephalin (MENK) promotes tumoricidal responses [J]. Cancer Immunol Immunother, 2012, 61: 1755-1768. |
| [10] | Donahue RN, McLaughlin PJ, Zagon IS. Cell proliferation of human ovarian cancer is regulated by the opioid growth factor-opioid growth factor receptor axis [J]. Am J Physiol Regul Integr Comp Physiol, 2009, 296: R1716-R1725. |
| [11] | Stein M, Keshav S, Harris N, et al. Interleukin 4 potently enhances murine macrophage mannose receptor activity: a marker of alternative immunologic macrophage activation [J].J Exp Med, 1992, 176: 287−292. |
| [12] | Montuenga LM, Pio R. Tumour-associated macrophages in nonsmall cell lung cancer: the role of interleukin-10 [J]. Eur Respir J, 2007, 30: 608-610. |
| [13] | Hirose K, Iwabuchi K, Shimada K, et al. Different responses to oxidized low-density lipoproteins in human polarized macrophages [J]. Lipids Health Dis, 2011, 10: 1. |
| [14] | Khallou-Laschet J, Varthaman A, Fornasa G, et al. Macrophage plasticity in experimental atherosclerosis [J]. PLoS One, 2010, 5: e8852. |
| [15] | Brochériou I, Maouche S, Durand H, et al. Antagonistic regulation of macrophage phenotype by M-CSF and GM-CSF: implication in atherosclerosis [J]. Atherosclerosis, 2011, 214: 316-324. |
| [16] | Van Tits LJ, Stienstra R, van Lent PL, et al. Oxidized LDL enhances pro-inflammatory responses of alternatively activated M2 macrophages: a crucial role for Kruppel-like factor 2 [J]. Atherosclerosis, 2011, 214: 345-349. |
| [17] | Guo CB, Li S. Advances in the study of anti-atherosclerosis drugs [J]. Acta Pharm Sin (药学学报), 2007, 42: 231-235. |
| [18] | Martinez FO. Regulators of macrophage activation [J]. Eur J Immunol, 2011, 41: 1531-1534. |
| [19] | Delgoffe GM, Pollizzi KN, Waickman AT, et al. The kinase mTOR regulates the differentiation of helper T cells through the selective activation of signaling by mTORC1 and mTORC2 [J]. Nature Immunol, 2011, 12: 295-303. |
| [20] | Chen WN, Liu JL, Jia LQ, et al. Signal transduction mechanism of macrophages polarization induced by methionine enkephalin [J]. Chin Pharm J (中国药学杂志), 2013, 48: 1550-1554. |
| [21] | Ogata M, Hino S, Saito A, et al. Autophagy is activated for cell survival after endoplasmic reticulum stress [J]. Mol Cell Biol, 2006, 26: 9220-9231. |
| [22] | Abu-Amer Y. IL-4 abrogates osteoclastogenesis through STAT6-dependent inhibition of NF-κB [J]. J Clin Invest, 2001, 107: 1375-1385. |
| [23] | Lee K, Gudapati P, Dragovic S, et al. Mammalian target of rapamycin protein complex 2 regulates differentiation of Th1 and Th2 cell subsets via distinct signaling pathways [J]. Immunity, 2010, 32: 743-753. |
| [24] | Powell JD, Delgoffe GM. The mammalian target of rapamycin (mTOR) provides a critical link between T cell differentiation, function and metabolism [J]. Immunity, 2010, 33: 301-311. |
 2016, Vol. 51
2016, Vol. 51


