2. 河南大学 环境医学研究所, 河南 开封 475004;
3. 河南大学 第一附属医院, 河南 开封 475004
2. Institute of Environmental Medicine, Medical College, Henan University, Kaifeng 475004, China;
3. First Affiliated Hospital, Henan University, Kaifeng 475004, China
人体亚硝酸盐有两个主要来源,内源性来自体内一氧化氮氧化,外源性来自饮食[1]。近年来研究发现,亚硝酸盐本身或其还原的一氧化氮是一种信号分子,作用靶点为线粒体呼吸链复合物,具有器官缺血再灌注细胞保护、降血压和降血脂等有益的生物学作用[2]。也有一些实验发现,亚硝酸盐具有促进癌细胞增殖和侵袭等促癌作用[3]。直到目前,国际癌症机构 (International Agency for Research on Cancer,IARC)仍将亚硝酸盐列为可能致癌物[4]。因此,深入研究亚硝酸盐与癌症的关系,对客观评价亚硝酸盐的生物学作用有着非常重要的意义。癌细胞与其起源的正常细胞相比,原有的正常功能几乎消失。癌细胞本身只需要维持分裂增殖、迁移和侵袭能力,所以少量的ATP即可维持细胞活力。过量ATP反而会导致癌细胞损伤[5]。因此,癌细胞即使在常氧下,也会依赖ATP产生效率低的糖酵解,而不是效率更高的线粒体有氧氧化获取能量,这就是癌细胞的“瓦波效应” (Warburg effect)[6]。肝癌细胞与其起源的正常肝细 胞相比,线粒体质量明显减少,且线粒体质量减少与癌的恶性程度有关[7]。细胞线粒体质量取决于线粒 体生成 (mitochondrial biogenesis) 和线粒体自噬 (mitophagy)。肝癌细胞内线粒体自噬能够增强瓦波效应,促进癌症的演进[8]。亚硝酸盐在体内以亚硝酸根离子 (NO2−1) 存在,因为携带有电荷,所以不能自由通过细胞膜。只有NO2−1质子化 (HNO2) 后,才可通过中性脂质分子层进入线粒体[9]。癌细胞有氧糖酵解的代谢方式,使得细胞内乳酸堆积,H+ 增加,有利于NO2−1进入线粒体基质。NO2−1抑制线粒体呼吸链复合物,导致细胞内活性氧 (reactive oxygen species,ROS) 水平增加[10]。事实上,许多癌细胞与其起源的正常细胞相比,ROS水平要高[11]。癌细胞维持一定水平的ROS可以促使细胞缺氧诱导因子-1α (hypoxia inducible factor-1α,HIF-1α)堆积[12]。HIF-1α一方面启动下游一系列糖酵解相关基因,促进糖酵解,另一方面促进线粒体自噬,从而促使癌细胞恶性程度增加[13]。为了验证NO2−1增加癌细胞ROS水平,通过HIF-1α诱导线粒体自噬,下调线粒体质量,促进癌细胞的迁移和侵袭能力这一假说,本文用亚硝酸钠 (sodium nitrite,SN) 代表 亚硝酸盐,以人肝癌SMMC- 7721细胞为实验对象,观察了亚硝酸钠对肝癌细胞线粒体自噬的影响以及与癌细胞迁移和侵袭能力的关系。
材料与方法 材料和主要仪器人肝癌SMMC-7721细胞株 购自中国医学科学院基础医学研究所,生长在含10% 胎牛血清的DMEM培养基中,置于5% CO2、37 ℃培养箱培养。SN购自天津市晨福化学试剂厂 (分析纯); 胎牛血清 (FBS) 购自杭州四季青生物公司; 二甲基亚砜 (DMSO)、噻唑兰(3-[4,5-dimethylthiazol-2-yl]- 2,5-dephenyl tetrazolium bromide,MTT)、N-乙酰半胱氨酸 (N-acetylcysteine,NAC)、氯喹 (chloroquine,CQ)、DAPI购自Sigma公司;细胞色素C氧化酶亚基Ⅰ (cytochrome C oxidase subunitⅠ,COXⅠ) 和细胞色素C氧化酶亚基Ⅳ (cytochrome C oxidase subunit Ⅳ,COXⅣ) 的引物由苏州金唯智生物科技有限公司合成 (表 1);细胞ATP检测试剂盒、活性氧检测试剂盒 (Reactive Oxygen Species Assay Kit)、微丝示踪剂 (Actin-Tracker Green)、线粒体示踪剂 (Mito-TrackerGreen,Mito-Tracker Red) 购自碧云天公司; 兔抗人LC3、HIF-1α、Beclin-1和Bnip3以及鼠抗鸡囊 (C4) β-actin单抗、ECL Western blot 化学发光检测试剂盒均购自Santa Cruz公司。细胞形态观察用DM2500徕卡荧光显微镜 (德国);梯度PCR仪 (Thermo公司,美国);蛋白质定量用UV-540紫外−可见分光光度计 (UNICAM,美国)。SDS-PAGE凝胶电泳以及蛋白质转移用DYY-7C型电泳仪 (北京市六一仪器厂) 完成,用WD-9413B凝胶成像分析仪 (北京市六一仪器厂) 检测蛋白质印迹条带。
| Table 1 Sequences ofprimers used in PCR |
SMMC-7721细胞于5% CO2、37 ℃恒温培养。至对数生长期,用胰酶和EDTA消化,调整细胞数为每毫升1×104个接种到96孔细胞培养板 (每孔0.2 mL),继续培养24 h后换液。不同处理的细胞作用一定时间,每孔加入5 g·L−1 MTT 20 μL培养4h后,吸去培养液,每孔加入DMSO 150 μL于振荡器上振摇,待紫色晶体完全溶解后,在酶标仪上测定570 nm处的吸光度值 (A值)。以含有等体积的培养液和DMSO的无细胞孔测得的吸光度值为空白对照。
Transwell侵袭实验 当细胞生长到对数生长期,将细胞均分4组: 亚硝酸钠处理组 (SN组),培养液内加入终质量浓度为16 mg·L−1 SN; 活性氧清除剂组 (NAC组),培养液内加入终质量浓度为16 mg·L−1 SN和10mmol·L−1 NAC; 氯喹干预组 (CQ组),培养液内加入终质量浓度为16 mg·L−1 SN和20 μmol·L−1自噬抑制剂CQ; 对照组 (control),加入等量培养基。细胞培养24 h后,消化收获细胞,用无血清DMEM培养基洗3次,各组分别接种1.0×105个细胞于已行Matrigel包被的transwell小室中,滤膜微孔直径为 8 μm,小室内的培养基为无血清的DMEM 200 μL。然后于小室外即24孔板的孔内加入800 μL含10% 胎牛血清的DMEM培养基,以提供细胞侵袭运动的趋化因子。每组3个复孔,培养24 h后自24孔板中取出transwell小室,PBS轻轻冲洗3次,用自备小棉签小心擦净小室底部微孔滤膜上层的细胞,然后将小室置于甲醇固定液中放置10 min,取出小室放于结晶紫中染色5 min; 沿小室底部边缘剪下滤膜,显微镜下观察穿过Matrigel及微孔至滤膜反面的细胞,实验重复3次,于200倍光学显微镜下计数5个视野的细胞,取平均值。
Transwell迁移实验实验分组和步骤同transwell侵袭实验,所用transwell未经Matrigel包被。
细胞活性氧荧光检测各组细胞分别接种于预置盖玻片的6孔板中,实验结束时取出盖玻片,按试剂盒说明书用示踪剂DCFH-DA处理,使用488nm激发波长、525 nm发射波长,在DM2500徕卡荧光显微镜下拍照。用Image-proplus图 像分析软件分析荧光强度。
细胞线粒体和微丝检测各组以1×104个细胞接种于6孔板中,板内预置经多聚赖氨酸预处理的 盖玻片,24 h后取出盖玻片,先用Mito-Tracker Red工作液孵育30 min,然后用3.7% 甲醛溶液室温固定,含0.1% Triton X-100的PBS洗涤,把Actin-Tracker Green染色工作液按照约每个片子200 μL的比例滴加,室温避光孵育60 min,PBS洗涤,DAPI复染,DM2500徕卡荧光显微镜下观察,拍照。
RT-PCR分析各组实验结束时,TRIzol试剂提取细胞总RNA,Nanodrop检测RNA含量,Dnase处 理,并用RNA试剂盒进行纯化。应用逆转录试剂盒进行cDNA第一链的合成,按说明书操作,总体积为20 μL。COXⅠ的PCR扩增条件为: 95 ℃预变性2 min,循环40次 (94 ℃变性35s,58 ℃退火35s,72 ℃延伸35s),72 ℃终延伸10 min。COXⅣ的PCR扩增条件为: 95 ℃预变性2 min,循环40次 (95 ℃变性30s,60 ℃退火35s,72 ℃延伸40s),72 ℃终延伸10 min。β-Actin的PCR扩增条件为: 95 ℃预变性1 min,循 环30次(94 ℃变性35s,51.9 ℃退火35s,72 ℃延伸40s),72 ℃终延伸10 min。以β-actin为内参进行分析,比较COX/β-actin的比值。
活细胞线粒体检测各组以1×104个细胞接种于6孔板中,板内预置经多聚赖氨酸预处理的盖玻片。实验结束时,吸去培养液,加入含Mito-TrackerGreen的无血清培养基孵育20 min,取出盖玻片,PBS 洗3次,立即用激光扫描共聚焦显微镜 (FV1000升级型,Olympus公司)扫描采集图 像,用自带软件随机计量5个视野,计算细胞平均荧光强度。
细胞ATP含量测定细胞分组处理同上,实验结束时,消化收获各种处理的细胞,充分匀浆,其余步骤按试剂盒说明书进行。
免疫荧光检测细胞内LC3荧光颗粒各组以1×104个细胞接种于6孔板中,板内预置经多聚赖 氨酸预处理的盖玻片。实验分3组: 对照组,加等体积的培养液; SN处理组,加入SN(终质量浓度为16 mg·L−1);CQ干预组,加入SN和CQ (20 μmol·L−1)。各组细胞培养24 h后,取出盖玻片,冷丙酮固定6 min,自然干燥。3% H2O2室温孵育15 min,10% BSA 4 ℃封闭过夜,PBS冲洗3次,每次5 min; 每张盖玻片加100 µL兔抗人LC3B工作液,4 ℃过夜孵育,PBS洗3次每次5 min; 加FITC标记的羊抗兔IgG二抗,37 ℃孵育30 min,PBS洗3次,每次5 min,自来水冲洗,自然干燥,硅油封片,实验重复3次,徕卡DM2500荧光显微镜下拍照。
透射电镜标本的制备实验结束时,离心收获细胞,用2.5% 戊二醛及1% 锇酸双重固定,乙醇丙酮逐级脱水,环氧树脂包埋,德国LEICAULTRACUTUCT超薄切片机切片,醋酸双氧铀和枸橼酸铅双重染色后,JEM100CX-Ⅱ透射电镜观察,拍照。
Western blot检测蛋白表 达消化收获各种处理的细胞,用RIPA 200 μL充分裂解提取蛋白,考马斯亮蓝G-250法测样品蛋白浓度,均衡每组蛋白浓度后,以12% SDS-PAGE凝胶电泳分离。电转移蛋白至NC膜,5%脱脂奶粉封闭过夜,加入各种一抗 (1∶200) 于4 ℃封闭袋中孵育过夜,二抗孵育1 h。化学发光法显示结果,压片曝光,凝胶图 像分析系统拍照,采用IPP软件对目的条带进行灰度分析。实验重复3次。
统计学分析数据均采用均数±标准差 (x±s) 表 示,应用SPSS 13.0软件包处理,正态分析和方差齐性检验后,进行单因素方差分析处理组与对照组的差别,处理组之间两两比较采用行×列表 的卡方检验。P < 0.05被认为统计学具有显著性。
结果 1 SN 对人肝癌SMMC-7721细胞活力的影响呈双向剂量效应MTT实验检测A570值是反映细胞活力常用的指标。用不同浓度的SN孵育细胞24 h,进行MTT实验,检测A570值。SN终质量浓度在256 mg·L−1以下时对细胞活力有促进作用,最大效应剂量为16 mg·L−1。SN终质量浓度大于256 mg·L−1时,对细胞活力有抑制作用 (图 1)。结果表 明,SN对人肝癌SMMC-7721细胞活力的影响呈双向剂量效应。本文旨在探讨SN对肝癌细胞促进效应,所以后续研究所用SN终质量浓度均为16 mg·L−1。
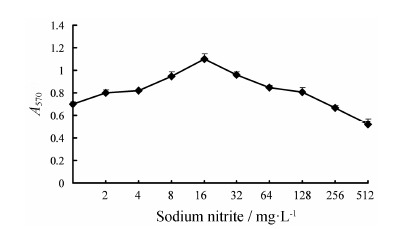 | Figure 1 The doseresponse relationship of sodium nitrite on cell viability of humanhepatocellular carcinoma SMMC-7721 cells was reflected by the MTT absorbance (n = 3) |
ROS在一定剂量水平以下发挥信号分子作用,在一定程度范围内升高ROS水平,对癌细胞有促进作用[14]。SN是一种独特的氧化还原剂,可能影响细胞内ROS水平。荧光探针DCFH-DA本身没有荧光,可以自由穿过细胞膜,进入细胞内后,可以被细胞内的酯酶水解生成DCFH。DCFH不能通透细胞膜,从而使探针很容易被装载到细胞内。细胞内的ROS可以氧化无荧光的DCFH生成有荧光的DCF。检测DCF的荧光就可以知道细胞内活性氧的水平。
图 2是用荧光探针DCFH-DA检测的细胞内ROS 结果,对照组荧光多呈颗粒状,在细胞质内弥散分布。与对照组相比,SN组细胞质内绿色荧光明显增强 (P < 0.05),增强的荧光铺满整个细胞,呈现亮绿色。NAC是常用的ROS清除剂,当用NAC与SN共同处理细胞后,与单纯SN组相比,细胞内荧光强度明显减弱 (P < 0.05)。结果表 明,SN在常氧条件下可以增加肝癌SMMC-7721细胞内ROS水平。
 | Figure 2 Effect ofsodium nitrite (SN) on ROS production in SMMC-7721 cells (n = 3). SMMC-7721cells were pre-treated with SN (16 mg·L−1) plus N-acetylcysteine(NAC, 10 mmol·L−1) or not for 24 h, subsequently co-incubated withROS assay kit for 2 h, and then detected by fluorescence microscope. A:Control; B: SN group; C: SN+NAC group; D: Cellular ROS production was detectedby Image-pro plus. P < 0.05 vs controlgroup, #P < 0.05 vsSN group |
SN在常氧条件下增加肝癌SMMC-7721细胞内ROS水平有可能影响到细胞的迁移和侵袭能力,为此本文用transwell细胞迁移和侵袭实验观察了SN 的作用。结果发现 (图 3),与对照组相比,SN组(16 mg·L−1) 明显增强transwell小室底部微孔滤膜背面每视野迁移或侵袭的细胞数(P < 0.05)。用ROS清除剂NAC (10 mmol·L−1) 或自噬抑制剂CQ(20 μmol·L−1) 与SN共同处理细胞,与单纯SN组相比,侵袭或迁移的细胞数明显减少 (P < 0.05)。结果表 明,清除细胞内ROS或抑制自噬可以明显减弱SN对SMMC-7721细胞迁移和侵袭的促进作用。
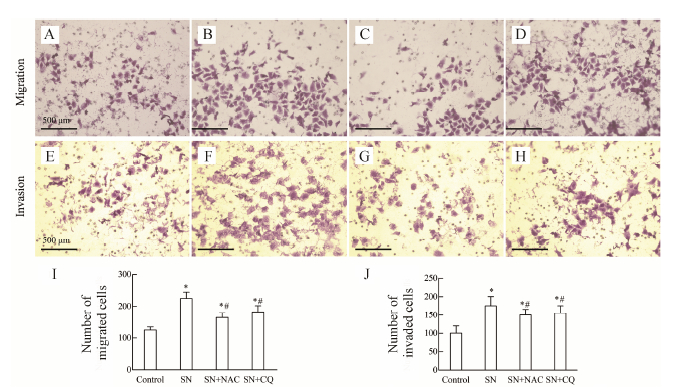 | Figure 3 Effect of SN onthe ability of migration and invasion in SMMC-7721 cells(n = 3). A, E: Control; B, F: SN group; C, G: SN+NAC group; D, H: SN+CQgroup; I: Number of migrated cells per field; J: Number of invaded cells perfield. *P < 0.05 vs control group, #P < 0.05 vsSN group. CQ: Chloroquine |
细胞迁移和侵袭依赖细胞内形成大量应力纤维和伪足,线粒体在细胞内分布状态一定程度上反映细胞功能状态。为了进一步证实SN具有促进SMMC- 7721细胞运动能力的作用,本文观察了细胞微丝和线粒体分布情况。图 4是细胞微丝 (绿色荧光)、线粒体 (红色荧光) 和细胞核 (蓝色荧光) 合成图 。对照组微丝主要沿细胞膜聚集,形成较厚的皮质层,在细胞质内弥散分布,应力纤维和伪足较少; 线粒体数量较多,在细胞质内呈平均分布 (homogeneous,H)。与对照组相比,SN组微丝皮质层变薄,细胞质内应力纤维明显增加,并向板状伪足方向聚合; 细胞质内线粒体表 现为绕核分布 (perinuclear,P),数量明显变 少。与SN组相比,NAC组微丝多聚集形成较厚的皮质层,应力纤维和伪足明显减少; 线粒体数量增加,平均分布于细胞质内。结果表 明,SN引起SMMC-7721细胞伪足和应力纤维增加,线粒体核周分布与其增加细胞ROS水平有关。
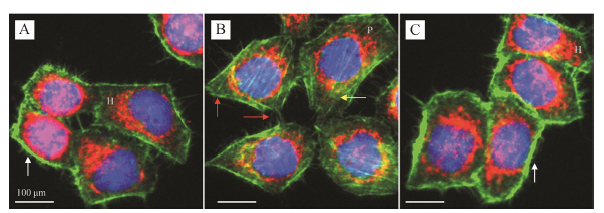 | Figure 4 Effect of SN onthe distribution of mitochondria and microfilament in SMMC-7721 cells(n = 3). A: Control, the cells displayedmore homogeneous mitochondrial distribution (H) and microfilament cortex (whitearrow); B: SN group, the cells displayed more perinuclear mitochondrialdistribution (P) and lamellipodia (red arrow), stress fiber of microfilamentincreased (yellow arrow); C: SN+NACgroup, the cells displayed more homogeneous mitochondrial distribution (H) andthickening of microfilament cortex (white arrow) |
为了进一步证实SN对细胞线粒体质量的影响,本文又观察了线粒体DNA含量的变化。COXⅠ是由线粒体DNA编码的蛋白质,是线粒体标志蛋白,它的mRNA表 达水平一定程度代表 了线粒体DNA(mtDNA) 含量。COXⅣ是由核DNA编码的蛋白质,是线粒体呼吸链的标志蛋白,它的mRNA表 达水平一定程度可反映线粒体质量。图 5显示COXⅠ和COXⅣ半定量PCR结果。与对照组相比,SN组COXⅠ和COXⅣ mRNA表 达水平明显下降 (P < 0.05)。与SN组相比,NAC组COXⅠ和COXⅣ mRNA表 达水平明显升高 (P < 0.05)。结果表 明,SN下调SMMC-7721细胞线粒体DNA含量与其增加细胞内ROS水平有关。
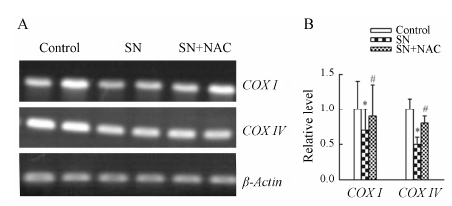 | Figure 5 Effect ofSN on mitochondrial markers COXⅠ and COXⅣ mRNAexpression in SMMC-7721 cells (n = 3). SMMC- 7721cells treated with SN (16 mg·L−1) for 24 h, plus or not NAC (10mmol·L−1), and then COXⅠ and COXⅣ mRNA expression was detected by RT-PCR. P < 0.05 vs controlgroup; #P < 0.05 vs SN group |
Mito-Tracker Green是一种不依赖于线粒体膜电位的线粒体荧光示踪剂,通常用于分析线粒体质量。图 6是活细胞经Mito-Tracker Green孵育后在激光共聚焦下的图 像。对照组线粒体多呈线状,密集成网,在细胞质内弥散分布。与对照组相比,SN组线粒体多呈颗粒状,围绕细胞核分布,数量明显减少 (P < 0.05),ATP含量下降 (P < 0.05)。与SN组相比,NAC组线粒体数量增多,在细胞质内分散存在,ATP含量有增加趋势,但没有统计学差别。结果再次表 明,SN下调SMMC-7721细胞线粒体质量,减少ATP含量与ROS有关。
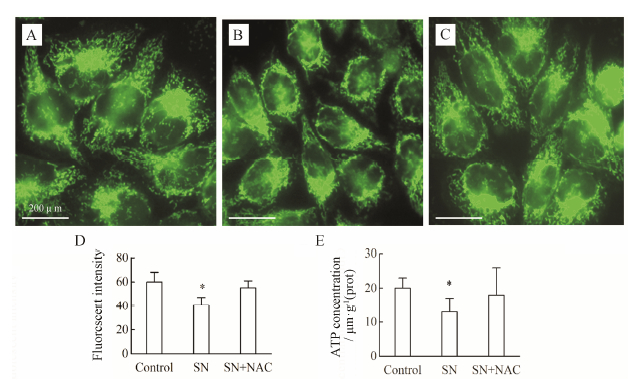 | Figure 6 Effect of SN on mitochondrial mass and ATP content in SMMC-7721 cells (n = 3). Mito-Tracker Green was used to label mitochondria in live cells per manufacturer’s protocol. A: Control; B: SN group; C: SN+NAC group; D: The mean intensitymitochondrial fluorescence of cells; E: Cellular ATP production. P < 0.05 vs controlgroup |
细胞自噬有两个重要阶段,即自噬体形成阶段和自噬体降解阶段。自噬体形成阶段,LC3-I转化为LC3-II; 在自噬体降解阶段,自噬体与溶酶体融合,LC3连同自噬体内包裹的物质一同被降解,这个过程被称为自噬流。CQ可以抑制自噬体与溶酶体融合,阻断自噬溶酶体的形成,从而可使自噬发生时LC3在细胞内堆积。图 7免疫荧光结果显示,与对照组相比,SN组LC3颗粒荧光小点数明显增多 (P < 0.05); 与SN组相比,CQ加SN处理组,LC3颗粒荧光小点数明显增多 (P < 0.05)。Westernblot结果LC3-II蛋白表 达与其一致。结果提示,SN导致的SMMC-7721细胞线粒体质量下降很可能是由其促进线粒体自噬引起的。
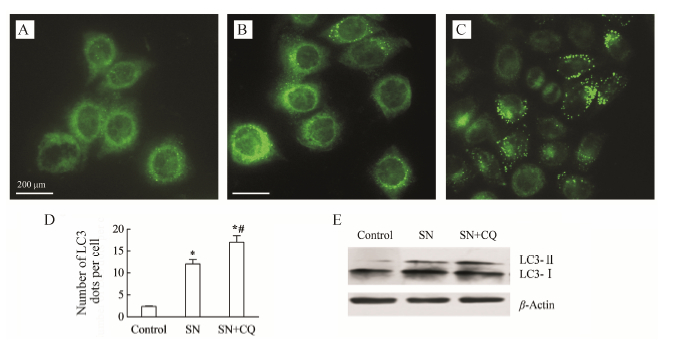 | Figure 7 SN increaseautophagy flux in SMMC-7721 cells(n = 3).SMMC-7721 cells were pre-treated with SN (16 mg·L−1) plus CQ (20mmol·L−1) or not for 24 h, subsequently the cells were stained withLC3 immunofluorescence or detected by Western blot. A: Control; B: SNgroup; C: SN+CQ group; D: The number of LC3 immunostaining puncta per cell; E: CellularLC3-II expression production detected byWestern blot. P < 0.05 vs controlgroup, #P < 0.05 vs SN group |
为了进一步观察线粒体自噬情况,本文又用透射电镜观察了SN对细胞自噬的作用。图 8是透射电镜结果,可见对照组的肝癌细胞线粒体数量较多,体积较小,棘的密度较大,线粒体内空泡常见。与对照组相比,SN处理组线粒体数量减少,体积较大,棘清晰,空泡较少,可见处于降解阶段的大小不一的自噬体。与SN组相比,NAC组自噬体明显减少,且多停留在自噬体形成阶段。结果提示,SN促进SMMC- 7721细胞线粒体自噬与ROS有关。
 | Figure 8 Effect of SN onmitophagy in SMMC-7721 cells detected by TEM. A:Control, there are many mitochondria ?in the cells; B:SN group, a lots of autolysosome (indicatedby arrows) could be detected in the cells; C: SN+NAC group, fragmentedmitochondria was packaged with double membrane to form a large of autophagosome(asterisk) |
为了进一步证实SN促进SMMC-7721细胞自噬是以线粒体自噬为主,本文又用Western blot方法检测了自噬关键分子蛋白表 达情况。图 9结果显示,与对照组相比,SN组HIF-1α、调控线粒体自噬的关键分子Beclin-1和Bnip3蛋白表 达水平明显增加 (P < 0.05); 与SN组相比,NAC组HIF-1α、Beclin-1和Bnip3蛋白表 达水平明显下降 (P < 0.05)。结果表 明,SN促进SMMC-7721细胞线粒体自噬与ROS和HIF-1α有关。
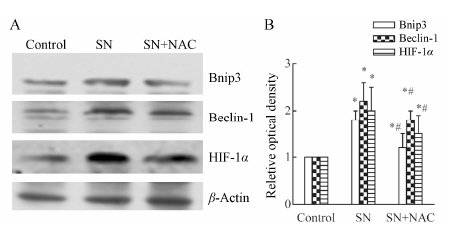 | Figure 9 Effect of SN on HIF-1α、Beclin-1 and Bnip3 expression in SMMC-7721 cells detected by Western blot analysis (n = 3). P < 0.05 vs controlgroup, #P < 0.05 vs SN group |
本实验发现,亚硝酸钠暴露24 h,最大促进细胞活力的质量浓度为16mg·L−1。正常人餐后唾液亚硝酸盐质量浓度为170 mg·L−1,到胃内可被稀释10倍以上[15],这就意味着人餐后胃内亚硝酸盐质量浓度有可能达到17 mg·L−1,非常接近于本实验亚硝酸钠最大促进SMMC-7721细胞活力的浓度。因此,本研究后续的实验所用亚硝酸钠质量浓度选为16 mg·L−1。亚硝酸钠对人肝癌SMMC-7721细胞活力的影响很可 能与其改变细胞氧化还原状态有关。肝癌细胞和正 常肝细胞能量代谢方式不同,前者主要依赖有氧糖酵解方式获取ATP,因此细胞内乳酸浓度要明显高于正常肝细胞。肝癌细胞质内酸度增加,质子含量升 高,为NO2−1进入细胞膜,继而进入线粒体基质创造了便利条件。亚硝酸盐在体内是一个非常稳定的化 合物,半衰期达30 min,具有独特的氧化还原能力。在缺氧环境下,被单电子还原为NO。在常氧条件下,亚硝酸盐可被单电子氧化为NO2•[16]。NO2• 是一种ROS。本实验用ROS示踪剂DCFH-DA在常氧下处理,检测亚硝酸钠对细胞DCF荧光的影响,结果发现,亚硝酸钠显著增加细胞内DCF颗粒荧光强度,提示NO2−1可以进入线粒体基质转化为NO2• ,明显增加SMMC-7721细胞内的ROS水平。常氧下,亚硝酸钠可以增加SMMC-7721细胞内的ROS水平,除了增加细胞内NO2• 外,NO2−1直接抑制线粒体呼吸 链复合物也会导致ROS增加[17]。癌细胞与正常细胞相比,细胞内往往具有较高水平的ROS,在一定程度范围内升高ROS水平,对癌细胞有促进作用[14]。本实验发现,在常氧条件下,亚硝酸钠具有促进人肝癌SMMC-7721细胞迁移和侵袭能力的作用,这种作用可以被ROS清除剂NAC抑制。结果表 明,亚硝酸钠促进癌细胞迁移和侵袭能力与其诱导细胞ROS水平升高有关。实验也发现,用自噬抑制剂氯喹也可以抑制亚硝酸钠对SMMC-7721细胞迁移和侵袭的促进作用。结果提示,亚硝酸钠对SMMC-7721细胞迁移和侵袭能力的促进作用很有可能与其促进细胞自噬有关。
细胞内微丝形成应力纤维和伪足对细胞迁移和侵袭是必需的。细胞迁移和侵袭所需能量来源于ATP。通常情况下ATP主要由线粒体产生。众所周知,细胞内ROS的主要来源也是线粒体。发生氧化磷酸化的线粒体因为要利用氧气,所以常靠近细胞膜分布,而依赖糖酵解的细胞线粒体多为核周分布。线粒体在细胞内的分布一定程度上反映了细胞能量代谢方式[18]。为此,本实验用微丝示踪剂和线粒体示踪剂共染色,观察了细胞微丝和线粒体分布情况。结果发现,亚硝酸钠明显增加细胞应力纤维和伪足,促使线粒体远离细胞膜,转向核周聚集。结果提示,亚硝酸钠作用SMMC-7721细胞后,可增加微丝形成应力纤维和伪足的能力,但是线粒体利用氧气的能力可能下降了。
线粒体不但是细胞ATP产生的场所,也是控制细胞增殖、运动、衰老和凋亡的中枢。肝癌细胞和正常肝细胞相比,线粒体质量往往减少,细胞内ATP含量也明显降低,且线粒体质量越少,细胞恶性程度越高[5]。一些侵袭性强的癌细胞,不但线粒体数量会减少,ATP合成酶活性也会下降[19]。本研究发现,亚硝酸钠显著减少SMMC-7721细胞线粒体质量和ATP含量,这种现象可以被ROS清除剂NAC所逆转。结果提示,亚硝酸盐通过转化为NO2• 和抑制线粒体呼吸链复合物,增加细胞内ROS水平可能是亚硝酸钠降低SMMC-7721细胞线粒体质量和ATP含量的启动因素。
细胞内线粒体的质量取决于线粒体生成和线粒体自噬之间的平衡。ROS可以促使HIF-1α累积,而HIF-1α具有诱导细胞线粒体自噬的作用[13]。本实验发现,亚硝酸钠具有诱导SMMC-7721细胞自噬流的作用,ROS清除剂NAC可以阻止自噬溶酶体的形成。本实验还发现,亚硝酸钠可以促使线粒体自噬标志蛋白Beclin-1和Bnip3表 达增加,促使HIF-1α蛋白在细胞内积累,这些现象同样会被ROS清除剂NAC所抑制。这些结果表 明,亚硝酸钠通过ROS,促使HIF-1α蛋白在细胞内积累,增强SMMC-7721细胞线粒体自噬[20],可能是细胞内线粒体质量和ATP含量下降的原因。
癌细胞内的线粒体质量减少和ATP含量下降有利于维持细胞的恶性特征[21]。癌细胞和正常细胞相比,生物量 (biomass)累积的意义要远远大于能量生成,因此,进入癌细胞内的营养物质优先转化为癌细胞生长侵袭所必需的蛋白质、核酸和脂类物质,而不是分解产生能量[22]。SMMC-7721细胞是来自肝癌患者的细胞株,恶性程度较高。本实验在电镜下发现,未经处理的SMMC-7721细胞内线粒体棘短小,空泡形成等异常线粒体较多。亚硝酸钠诱导细胞线粒体自噬后,细胞内剩余的线粒体趋于正常。癌细胞通过线粒体自噬,清除损伤或多余的线粒体,对保持癌细胞的恶性特征有非常重要的意义[23]。
综上所述,16 mg·L−1亚硝酸钠孵育人肝癌SMMC- 7721细胞24 h,细胞内ROS水平升高,HIF-1α累积,线粒体自噬增强,从而使线粒体质量和ATP含量下降,生物量增加,进而促进了癌细胞的迁移和侵袭能力。
| [1] | George TW, Waroonphan S, Niwat C, et al. Effects of acute consumption of a fruit and vegetable purée-based drink on vasodilation and oxidative status [J]. Br J Nutr, 2013, 109: 1442-1452. |
| [2] | Pellegrino D, Parisella ML. Nitrite as a physiological source of nitric oxide and a signalling molecule in the regulation of the cardiovascular system in both mammalian and non- mammalian vertebrates [J]. Recent Pat Cardiovasc Drug Discov, 2010, 5: 91-96. |
| [3] | Xu HR, Lin B, Wang SQ, et al. Sodium nitrite improves epithelial-mesenchymal transition of hepatoma cells in mice bearing H22 [J]. Acta Pham Sin (药学学报), 2012, 47: 1470-1476. |
| [4] | IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Ingested nitrate and nitrite, and cyanobacterial peptide toxins [M]. IARC Monogr Eval Carcinog Risks Hum, 2010, 94: v-vii, 1-412. |
| [5] | Sánchez-Aragó M, Chamorro M, Cuezva JM. Selection of cancer cells with repressed mitochondria triggers colon cancer progression [J]. Carcinogenesis, 2010, 31: 567-576. |
| [6] | Dai Q, Yin Y, Liu W, et al. Two p53-related metabolic regulators, TIGAR and SCO2, contribute to oroxylin A-mediated glucose metabolism in human hepatoma HepG2 cells [J]. Int J Biochem Cell Biol, 2013, 45: 1468-1478. |
| [7] | Yin PH, Lee HC, Chau GY, et al. Alteration of the copy number and deletion of mitochondrial DNA in human hepatocellular carcinoma [J]. Br J Cancer, 2004, 90: 2390- 2396. |
| [8] | Lu H, Li G, Liu L, et al. Regulation and function of mitophagy in development and cancer [J]. Autophagy, 2013, 9: 1720-1736. |
| [9] | Murillo D, Kamga C, Mo L, et al. Nitrite as a mediator of ischemic preconditioning and cytoprotection [J]. Nitric Oxide, 2011, 25: 70-80. |
| [10] | Kumar S, Barthwal MK, Dikshit M. Nitrite-mediated modulation of HL-60 cell cycle and proliferation: involvement of cyclin-dependent kinase 2 activation [J]. J Pharmacol Exp Ther, 2011, 337: 812-821. |
| [11] | Sotgia F, Martinez-Outschoorn UE, Lisanti MP. Mitochondrial oxidative stress drives tumor progression and metastasis: should we use antioxidants as a key component of cancer treatment and prevention? [J]. BMC Med, 2011, 9: 62. |
| [12] | Movafagh S, Crook S, Vo K. Regulation of hypoxia- inducible factor-1a by reactive oxygen species: new developments in an old debate [J]. J Cell Biochem, 2015, 116: 696-703. |
| [13] | Wu H, Chen Q. Hypoxia activation of mitophagy and its role in disease pathogenesis [J]. Antioxid Redox Signal, 2015, 22: 1032-1046. |
| [14] | Gu Q, He Y, Ji J, et al. Hypoxia-inducible factor 1α (HIF-1α) and reactive oxygen species (ROS) mediates radiation-induced invasiveness through the SDF-1α/CXCR4 pathway in non- small cell lung carcinoma cells [J]. Oncotarget, 2015, 6: 10893-10907. |
| [15] | Lundberg JO, Gladwin MT, Ahluwalia A, et al. Nitrate and nitrite in biology, nutrition and therapeutics [J]. Nat Chem Biol, 2009, 5: 865-869. |
| [16] | Wang L, Frizzell SA, Zhao X, et al. Normoxic cyclic GMP- independent oxidative signaling by nitrite enhances airway epithelial cell proliferation and wound healing [J]. Nitric Oxide, 2012, 26: 203-210. |
| [17] | Soetkamp D, Nguyen TT, Menazza S. S-Nitrosation of mitochondrial connexin 43 regulates mitochondrial function [J]. Basic Res Cardiol, 2014, 109: 433. |
| [18] | Lonergan T, Bavister B, Brenner C. Mitochondria in stem cells [J]. Mitochondrion, 2007, 7: 289-296. |
| [19] | Sánchez-Aragó M, Formentini L, Cuezva JM. Mitochondria- mediated energy adaption in cancer: the H+-ATP synthase- geared switch of metabolism in human tumors [J]. Antioxid Redox Signal, 2013, 19: 285-298. |
| [20] | Dang K, Myers KA. The role of hypoxia-induced miR-210 in cancer progression [J]. Int J Mol Sci, 2015, 16: 6353- 6372. |
| [21] | Gogvadze V, Zhivotovsky B, Orrenius S. The Warburg effect and mitochondrial stability in cancer cells [J]. Mol Aspects Med, 2010, 31: 60-74. |
| [22] | Ngo DC, Ververis K, Tortorella SM, et al. Introduction to the molecular basis of cancer metabolism and the Warburg effect [J]. Mol Biol Rep, 2015, 42: 819-823. |
| [23] | Galluzzi L, Pietrocola F, Bravo-San Pedro JM, et al. Autophagy in malignant transformation and cancer progression [J]. EMBO J, 2015, 34: 856-880. |
 2016, Vol. 51
2016, Vol. 51


