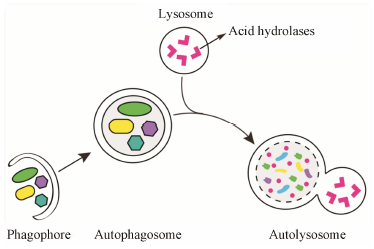
自噬(autophagy) 是保护细胞对抗应激、依赖溶酶体的细胞分解代谢过程, 用以降解受损蛋白质、衰老或损伤的细胞器等细胞结构。降解产物可被重新 用于蛋白合成, 参与损伤修复等。自噬可通过不同的途径, 将细胞中的物质运送到溶酶体进行降解, 包 括:大自噬、分子伴侣介导的自噬以及小自噬。除非特别指出作者将着重讨论大自噬 (以下简称为自噬)。自噬是细胞自己吞噬自己的一个过程, 由双层或多层膜的小泡将细胞质成分包裹, 运送到溶酶体进行降解。上述过程可分为三个相对独立的步骤: 自 噬诱导阶段、自噬小体形成阶段以及成熟降解阶段。在自噬的诱导阶段, 胞浆的某处形成一个小的新月形双层膜结构, 被称为自噬泡(phagophore)。在自噬小体形成阶段, 双层膜不断扩张、延伸, 将胞浆中损伤的细胞器、错误折叠的蛋白和病原体等揽入“杯”中,然后“收口”, 成为密闭的囊泡——自噬小体 (autophagosome, AP)。在成熟降解阶段, 自噬小体与溶酶体融合形成自噬溶酶体 (autolysosome, AL), 期间自噬溶酶体中包裹的“货物”被降解 (图 1)。
|
Figure 1 Schematicdiagram of the steps of autophagy. Autophagybegins with the formation of a crescent-shaped double membrane, the phagophore,which expands around a portion of cytoplasm, including organelles and fuses to form the autophagosome. Theautophagosome then fuses directly with a lysosome to generate anautolysosome. Finally, the sequestered material is degraded insidethe autophagolyosome |
对于自噬这一细胞生物学过程来说, 形态学研究在所有的研究手段中占有举足轻重的地位。自噬研究过程中涉及的形态学研究方法包括电镜技术、免疫荧光技术和活细胞成像技术等。对于刚进入这个领域的初学者, 正确的实验操作以及合理的结果阐释是获得有效数据的关键环节。本文将就自噬形态学研究方法中的实验操作以及结果阐释的主要步骤和注意事项进行简要阐述。
1 透射电镜技术在自噬研究中的应用透射电子显微镜技术在1933年建立, 其放大倍数可以高达1.2万倍, 能分辨小于0.1 nm的距离, 比普通的光学显微镜的分辨能力高3个数量级。50多年以前, 科学家正是通过透射电子显微镜技术首先发现了自噬这一细胞生物学现象[1]。在此之后的10多年时间中, 电镜技术一直是用以检测细胞内自噬组分的唯一可靠手段。20世纪70年代以后, 生化检测、荧光显微镜观察以及遗传学手段逐渐成为自噬研究的重要方法。然而, 电镜依然是自噬研究中不可或缺的手段, 其他研究方法获得的结果, 往往需要电镜进行验证; 某些特定的自噬类型和细胞器等超微结构的辨别也需要借助电镜进行观察。
1.1 样本制备对于电镜观察来说, 第一步也是至关重要的一步为样本制备。自噬现象的发现历史证实了这一步的重要性。早在1954年Johannes Rhodin在小鼠的肾脏上皮细胞中观察到了包裹在膜状结构中的线粒体, 但未能给出合理的解释。3年后, 在研究新生小鼠肾脏上皮细胞时, Sam Clark也观察到了高电子密度的、膜样结构包裹的线粒体。但由于固定不充分, 膜并不连续, 使得这一现象再度被忽略。因此, 在样本制备过程中, 需要遵循几个关键原则: ① 观察样本的天然状态。基于这一点, 要尽可能多地保持样本的天然特征, 避免人为因素干扰; ② 保持样本在电镜检测环境中的稳定性。电镜观察时, 样本置于高度真空的环境中, 且电子束会产生高热。这些因素对于生物样品来说都具有很强的破坏性。生物样品含水很多, 真空会使水分蒸发从而破坏细胞结构; 高温会使蛋白变性, 也会影响精细结构。所以首先需要对样本进行固定, 使细胞中蛋白成为交联状态, 从而稳定并保持蛋白的精细结构。此外, 还需要使用透明、且自身没有结构的物质将水取代, 一般选用树脂包埋剂温和取代水, 既保持了细胞形态, 也不影响观察。
电镜样本的制备包括了固定、脱水、包埋、切片、染色等步骤。对于大多数的研究者来说, 需要自己进行操作的环节一般只有样本固定, 后续的操作通常由专业人员进行。因此在本文中, 仅对固定的注意事项和固定液进行简述。电镜样本的固定方法有化学固定和物理固定 (冷冻固定), 化学固定是处理生物样本最常用的方法。固定液必须现用现配, 取材后样本应迅速浸入固定液, 以最大程度保持样本的天然状态。首先将组织样本剪为大约3 mm3大小, 置入玻璃皿中, 用2.5%戊二醛进行固定, 当样本变硬后, 将其进一步切成1 mm3大小的组织块, 放入带旋盖的玻璃瓶中4 ℃固定过夜。一般来说, 固定液的体积应该是样本体积的10~20倍[2]。固定液的类型有醛类和强氧化剂类。醛类固定液常用多聚甲醛和戊二醛; 强氧化剂一般是四氧化锇。醛类固定液主要起到交联作 用, 而强氧化剂固定液则起到固定细胞膜作用, 使其丧失半透膜功能。四氧化锇由于其原子数高, 还可增强电镜片子的对比度, 利于拍照和观察。在实验的实际操作中, 往往采用双固定法, 即先用醛类固定液进行前固定, 再用四氧化锇固定液进行后固定。通常, 完成前固定的样本即可送交专业的电镜操作人员进行处理了。戊二醛穿透能力较弱, 适合体积较小的样本 (小于1 mm3) 固定; 而体积较大的样本, 则可使用穿透力强的多聚甲醛固定。但不管哪种情况, 大的组织样本最好采用灌注的方法进行固定[3]。对于贴壁培养的细胞, 在汇合度达到一半的情况下, 固定步骤可在培养皿中进行, 利用2% 电镜级戊二醛室温固定30 min后, 将细胞刮下并全速离心5 min, 收集的细胞团块继续固定2 h。不论是悬浮还是贴壁培养的细胞, 收集的细胞团块在10~30 μL为宜[3]。
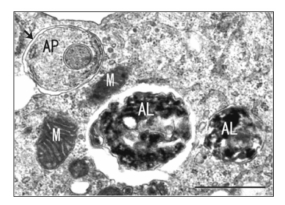
1.2 电镜结果的观察自噬是一个动态的过程, 当自噬信号活化, 且自噬流通畅时, 自噬小体形成并与溶酶体融合为自噬溶酶体, 包裹的内容物被溶酶体水解酶降解, 降解产物进入重循环利用。然而, 当自噬的起始诱导阶段活化, 而自噬小体的“周转”缺陷时, 由于降解受阻, 可以在细胞中观察到大量堆积的自噬小体。因此, 为了准确评价细胞是否产生有效的自噬流 (autophagic flux), 在电镜检测中需要辨别自噬小体和自噬溶酶体形成的情况, 并对它们在细胞中所占比例进行定量分析, 从而判断自噬流的活化情况。但在实际操作中, 由于样本的复杂和多样, 准确区分自噬小体和自噬溶酶体并不是十分容易, 但有一些基本的准则可以参考[4]: ① 自噬小体也被称为起始自噬小泡 (initialautophagic vacuoles,AVi), 通常具有双层膜或至少在部分区域能见到平行的双层膜。自噬小体中包裹了胞浆中的内容物及细胞器, 这些组分形态完整, 与细胞中其他位置的胞浆内容物和细胞器形态相似 (图 2)。② 自噬溶酶体也被称为晚期自噬小泡或降解型自噬小泡 (degradative autophagicvacuole, AVd)。由于与溶酶体融合, 包裹的内容物及双层膜均可被溶酶体中的蛋白酶降解, 因此在电镜 下往往只能观察到有限的单层膜结构, 以及处于不同降解阶段的内容物, 这些成分往往呈现无定形的高电子密度区 (图 2)。但是, 需要特别注意的是, 并非所有含高电子密度物质的小泡都是自噬溶酶体。事实上, 自噬溶酶体中胞浆组分虽然处于降解阶段, 但是形态依然可以辨认, 可利用这一点进行区别鉴定。
|
Figure 2 Transmission electron microscopy (TEM) image showing autophagosomes at different stages. One autophagosome(AP) and one autolysosome (AL) are shown. The AP is a double-membranestructure (indicated with an arrow) containing intact cytoplasm, while the AL is a single membrane structure containing electron dense material that is being degraded.M represents mitochondria. Scale bar, 1 μm. This figure was not modified and fromFigure 3 published in Tabata et al. Morphologicalanalysis of autophagy.Methods in Molecular Biology, 2013, 931: 449−466, by permission of Springer Press |
由于不同的细胞大小不同、细胞浆所占的比例也会有较大的差异。因此获得电镜图片后, 仅通过对自噬小体或自噬溶酶体进行简单计数来判断自噬活化情况, 往往会得到与实际情况偏差较大的结果。简便且易于操作的方法是, 同样放大倍数下获取的电镜图片, 对胞浆面积和自噬小体或自噬溶酶体面积进行定量, 计算自噬小体或自噬溶酶体占胞浆面积的比例[2, 5]。为了尽量降低样本间差异, 每个样品至少统计20个细胞。自噬小体或自噬溶酶体在细胞中的聚集可提示自噬调节的不同环节。如果细胞中以自噬小体聚集为主, 可能的原因有: 自噬信号活化, 自噬小体形成增多; 或自噬小体成熟为自噬溶酶体受阻或缺陷, 导致自噬小体堆积。自噬小体与溶酶体融合形成自噬溶酶体后, 其寿命比较短, 会较快进入降解途径。因此, 如果细胞中观察到大量聚集的自噬溶酶体, 也可能反映了自噬溶酶体降解功能障碍。因此, 为了更好地判断自噬流是否通畅, 可在实验中使用leupeptin、E64及pepstatin等溶酶体水解酶抑制剂, 以提供更为准确的信息。例如, 利用溶酶体水解酶抑制剂抑制溶酶体活性, 如果自噬溶酶体并不会进一步增多, 可能反映了溶酶体本身降解功能障碍; 而如果自噬溶酶体显著增多则说明自噬流通畅, 自噬小体能与溶酶体有效融合进行降解。
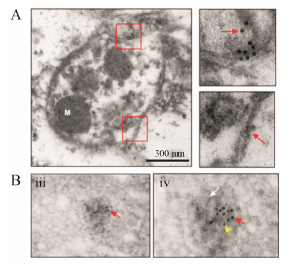
1.4 免疫透射电镜在自噬研究中的应用随着对泛素−蛋白酶体和自噬这两大蛋白降解系统研究的深入, 研究人员已经了解到很多细节, 然而对于某个特定蛋白通过哪个系统进行降解及其调控机制, 依然还有很多工作要做。在自噬研究中, 电镜能观察到细胞中自噬小体或自噬溶酶体的形成, 辅助判断细胞的自噬活化状态。然而, 这样的方法不具有针对性, 无法准确知道某种蛋白或细胞组分能否通过自噬途径进行降解。将透射电镜技术与免疫金标记技术相结 合, 可以直观检测某种特定蛋白在自噬小体中的定位。肌萎缩性侧索硬化症和大多数神经退行性疾病 一样, 也由错误折叠蛋白堆积形成的包涵体引起。超氧岐化酶 (superoxide dismutase-1, SOD1) 基因突变是导致家族性肌萎缩性侧索硬化症的主要原因。Hetz等[6]在研究内质网应激与家族性肌萎缩性侧索硬化症时意外发现, 自噬活化能够降低突变型SOD1在细胞中的堆积, 抑制疾病进程。为进一步确证SOD1是否通过自噬途径进行降解, 研究者将SOD1蛋白用免疫金颗粒进行标记。电镜检测发现, 金颗粒在具有双层膜结构的自噬小体中聚集, 自噬小体中还能观察到包裹的其他细胞组分, 例如线粒体等, 该结果直观证明SOD1蛋白可以进入自噬小体 (图 3A)。免疫金标记的方法非常实用, 一次可以标记两种或更多种的蛋白, 只要使用的金颗粒直径不同就可以进行区分。Hetz等[6]利用两种直径的金颗粒分别标记SOD1和微管相关蛋白1A/1B轻链3 (microtubule-associated protein 1A/1B-light chain 3, LC3), 电镜下可以清晰观察到两种大小不同的高电子密度颗粒在空间上共定位于自噬小体中, 进一步证明SOD1可进入自噬途径进行降解 (图 3B)。
|
Figure 3 Immunogold labeling TEM analysis inthe study of autophagic degradation ofSOD1. A: Autophagosomes were identifiedby the presence of double-membrane vesicles containing cytosol and organelles,such as mitochondria (M). Higher magnification ofthe areas marked with red squares is shown to indicatethe double membrane and the electron-dense gold particles of SOD1. B: Thecolocalization of SOD1 and LC3 by double-immunogold staining. Goldspheres were 5 nm (SOD1) and 10 nm (LC3) respectively. This figure was modified from data previously published in ref.6 and is reproduced bypermission according to the Attribution-NonCommercial 4.0International |
除了电镜以外, 自噬研究中另一个重要的形态学检测手段就是免疫荧光。自从将生化检测手段引 入自噬研究中, LC3就成为检测自噬的关键标志性 分子之一。对于LC3的检测, 免疫荧光是一项重要 的指标。LC3前体合成后, C末端被自噬相关蛋白4 (autophagy-related protein 4, Atg4)水解切割掉一段多肽暴露出甘氨酸, 即为LC3-I, 它主要在胞浆分 布。自噬活化过程中, LC3-I在Atg7和Atg12-Atg5- Atg16L作用下与磷脂酰乙醇胺共价结合成为LC3-II, 它可以结合到自噬小体膜上。LC3-I到LC3-II的转变体现在免疫荧光上就是胞浆中弥散分布的LC3变为点状聚集[7]。
2.1 LC3荧光在自噬研究中的应用及其注意事项对于LC3的荧光检测, 既可以通过间接免疫荧光检测细胞中内源的LC3变化, 也可以通过外源表达GFP-LC3进行直接的荧光检测。检测内源或外源表达的LC3在实际的实验操作中各有利弊。检测内源性蛋白可以避免转染试剂以及过表达GFP-LC3带来的人为因素影响; 不过, 内源LC3并非任何时间都能检测到。因此, 需要根据实际情况进行合理选择。那么在外源性表达GFP-LC3时, 是应该建立转染的稳定克隆还是进行瞬时转染即可呢?稳定转染有助于降低基因低表达产生的背景信号以及转染试剂造成的干扰。但是当研究某个蛋白对自噬的影响时, GFP- LC3和目标的蛋白质粒共转染会便于实验的设计和实施。稳定表达的细胞株由于表达量均衡, 易于定量分析。然而, 在建立GFP-LC3的稳定转染细胞株时, 需要注意有时挑选的单细胞克隆会呈现不具有代表性的特征, 因此将挑选的多个克隆混合成为一个混合群可以减少上述因素干扰的可能。不过, 细胞群的弊端在于随着培养时间的延长, 细胞的组分会发生变化, 因此必须不定期地进行细胞表达和表型的检测和验证。由于自噬是一个动态过程, 在某一时间点单纯的LC3点状聚集既可能是自噬信号活化的体现, 也可能是自噬降解的障碍, 并不能直接说明自噬流是通畅还是阻滞。因此, 配合使用自噬诱导剂或抑制剂有助于结果的准确判断。此外, 在LC3检测中常用的GFP荧光固有的特点也会影响结果的判断。GFP对溶酶体的酸性环境非常敏感, 当处于低pH值环境时, GFP荧光迅速淬灭。因此GFP-LC3一般适合观察用多聚甲醛固定的细胞样本。当然, 也可以选择其他的荧光基团, 例如红色荧光蛋白单体 (monomeric red fluorescent protein,mRFP) 或mCherry, 它们即使在低pH环境下也能保持荧光[8]。mCherry的荧光强度和光稳定性都比GFP强几个数量级, 非常利于图像的捕获以及减少结果阐释中的偏差[9]。但需要特别注意的是mCherry容易在溶酶体富集, 并且聚集后的蛋白对细胞会产生毒性[10]。
除了利用LC3的点状聚集观察自噬信号调节外, LC3的荧光信号还用于研究与其他自噬相关靶标的共定位情况。例如, LC3与磷酸化α-synuclein共定位提示α-synuclein可以进入自噬途径进行降解[11]; LC3与LAMP1/2的共定位用以指示自噬小体与溶酶体的融合[12]; LC3与caspase 3或TUNEL的共着色反映与自噬相关的细胞死亡[13]等。
2.2 新的自噬标记手段——Keima在自噬研究中的应用 LC3虽然是广泛应用的自噬标志蛋白, 但它也有一些缺陷: ① 对LC3相关标签的检测只能在自噬过程的某个点进行, 如果想要进行更敏感的定量分析, 就得进行延时成像, 对显微镜的分辨率有较高的要求。② 由于LC3可以分布在自噬小体的外膜和内膜, 分布在自噬小体外膜的LC3可以去脂化成为游离的LC3重新循环利用。重循环既可能发生在与溶酶体融合前, 也可能发生在与溶酶体融合后。分布在内膜的LC3与溶酶体融合后降解。由于LC3在内外膜分布比例以及重循环环节的不确定性影响了利用LC3荧光成像对自噬过程的准确阐释[14]。③ 在某些条件下, LC3会发生与自噬无关的点状聚集。例如在细胞固定前使用皂素等去污剂进行透化会引起LC3聚集在类似自噬小体的结构中, 但这种聚集与自噬无关[15]。此外, LC3还可能因为与p62等蛋白结合, 从而间接发生聚集[16]。因此, 需要发展更优势的标志性蛋白分子或检测手段。
在现有的自噬研究中, 串联荧光蛋白标记的LC3 (mRFP-EGFP-LC3) 被广泛用于自噬流监测。因为绿色荧光蛋白对酸性环境敏感, 当自噬小体与溶酶体融合后, 溶酶体的酸性环境促使绿色荧光淬灭; 而红色荧光蛋白对酸性环境的稳定性, 使得红色荧光在自噬小体和自噬溶酶体中都能得以保持。通过 激光共聚焦荧光显微镜或活细胞成像, mRFP-EGFP- LC3被广泛用于有效自噬的判断[17]。近年, 一种来源于珊瑚虫的荧光蛋白Keima被用于自噬小体的标记及检测。该荧光蛋白具有较大的斯托克斯位移, 并且具有依赖于pH值、可逆的双峰激发光谱。在酸性pH条件下, 电离的Keima发红色荧光; 而在高pH条件下, 中性的Keima发绿色荧光。因此, 基于Keima的荧光标签可以方便用于标示自噬溶酶体, 从而可在某一时间点就通读自噬过程, 在进行高通量筛选时具有比其他荧光标签更好的优势[18]。Keima较mRFP-EGFP-LC3的优势在于, 单荧光基团比两个荧光基团具有更好的均一性, 可以排除mRFP和EGFP在蛋白成熟以及蛋白酶对其的消化效率等方面差异产生的影响。将Keima与特定胞浆蛋白融合或靶向标记某一细胞器可产生一系列基于Keima的标签, 用于选择性自噬研究。例如, Katayama等[14]将Keima与COXVIII的线粒体定位序列融合, 观察了Parkin在受损线粒体输送到溶酶体中的作用。Keima的缺陷在于不能用于固定的细胞样品, 因为固定后的细胞样品溶酶体膜pH梯度会发生丢失。
2.3 WIPI-1, 一种有效的自噬标志性蛋白WD重复结构域磷酸肌醇相互作用蛋白1 (WD repeat domain phosphoinositide-interacting protein 1, WIPI-1) 属于进化上高度保守的WD重复蛋白家族, 拥有WIPI-1、WIPI-2、WIPI-3和WIPI-4四个家族成员。其中, WIPI-1与酵母的Atg18蛋白同源。自噬小体的形成依赖 于磷脂, 例如磷脂酰肌醇-3-磷酸 [phosphoinositidephsophatidylinositol-3-phosphate, PI(3)P] 运输到自噬泡组装位点对于自噬小体的形成十分关键。近年研究发现, WIPI家族蛋白是PI(3)P的结合蛋白, 参与了自噬起始阶段调节。WIPI-1与PI(3)P结合后会在自噬小泡处形成点状聚集, 通过免疫荧光非常方便观察, 因此WIPI-1的点状聚集被认为是进行自噬定量分析的又一个有效手段[19, 20]。在某些条件下GFP-LC3在自噬检测中有其固有的缺陷。例如, GFP-LC3具有聚集倾向, 有时并不能真实反映自噬小体结构[21]。在细胞中过表达WIPI-1不会产生聚集, 因此GFP-WIPI-1融合蛋白非常适于在内源性WIPI-1表达水平不高或内源性LC3不易于检测的细胞中进行自噬相关的检测和分析。
2.4 免疫荧光检测自噬的定量分析利用免疫荧光检测自噬也可以进行定量分析。计数细胞中GFP-LC3或GFP-WIPI (或内源经免疫荧光染色的LC3或WIPI) 的点状聚集可以对自噬的活化情况进行定量, 但这种方法较为繁琐。需要注意的是, 计数并不是将细胞中的荧光点数目简单相加, 而是应该计算单位细胞或单位细胞面积中的荧光点数目。当自噬小体和溶酶体的融合被阻断时, 往往可以观察到体积增大的自噬小体, 这可能是由于自噬小体-自噬小体发生融合所致。因此, 在分析时不建议对荧光点的大小进行定量, 这样可能会造成对结果的误判。但是利用图像分析软件, 例如Image-Pro Plus对荧光强度进行定量分析可对蛋白的聚集提供有效测量[22]。
在实验中, 最好对单位细胞中荧光点数建立一个“阈值”, 用以定义“低自噬”活性和“高自噬”活性。阈值的确定需要一定经验, 可将细胞暴露于自噬的诱导剂或阻断剂, 分别计数给予诱导剂、给予阻断剂以及对照细胞群中单位细胞荧光阳性点数目, 进行比较后即可确定出阈值。使用该方法进行定量至关重要的是要计数大量的细胞以及多个代表性组织切片或细胞爬片 (至少3次独立实验, 每次50个细胞以上) 才能获得可靠数据, 并应进行统计学分析。高内涵成像分析可对一个样本中成千上万个细胞进行定量分析, 提供更为可信的数据。利用这种自动分析方法需要特别注意, 不同的细胞处理方法以及不同的细胞类型需要手动评估背景阈值。此外, 有的处理条件下细胞形态会发生变化 (例如细胞变圆), 形态改变会对荧光点的计数造成非常大的影响, 为避免因为形态变化对结果的影响, 在进行自动分析前最好在显微镜下对细胞形态进行初步观察。
3 结语自噬是一个复杂、动态的细胞过程, 利用单一指标对自噬进行检测和分析往往会造成结果的偏差, 甚至错误阐释。在自噬相关研究中, 结合多种分析手段和检测标志物是获得有效数据的关键。
| [1] | Eskelinen EL, Reggiori F, Baba M, et al. Seeing is believing: the impact of electron microscopy on autophagy research[J]. Autophagy, 2011, 7: 935-956. |
| [2] | Swanlund JM, Kregel KC, Oberley TD. Investigating autophagy: quantitative morphometric analysis using electron microscopy[J]. Autophagy, 2010, 6: 270-277. |
| [3] | Ylä-Anttila P, Vihinen H, Jokitalo E, et al. Monitoring autophagy by electron microscopy in mammalian cells[J]. Methods Enzymol, 2009, 452: 143-164. |
| [4] | Klionsky DJ, Abdalla FC, Abeliovich H, et al. Guidelines for the use and interpretation of assays for monitoring autophagy[J]. Autophagy, 2012, 8: 445-544. |
| [5] | Hua F, Li K, Yu JJ, et al. TRB3 links insulin/IGF to tumour promotion by interacting with p62 and impeding autophagic/ proteasomal degradations[J]. Nat Commun, 2015, 6: 7951. |
| [6] | Hetz C, Thielen P, Matus S, et al. XBP-1 deficiency in the nervous system protects against amyotrophic lateral sclerosis by increasing autophagy[J]. Genes Dev, 2009, 23: 2294- 2306. |
| [7] | Ladoire S, Chaba K, Martins I, et al. Immunohistochemical detection of cytoplasmic LC3 puncta in human cancer specimens[J]. Autophagy, 2012, 8: 1175-1184. |
| [8] | Kimura S, Noda T, Yoshimori T. Dissection of the autophagosome maturation process by a novel reporter protein, tandem fluorescent-tagged LC3[J]. Autophagy, 2007, 3: 452-460. |
| [9] | Shaner NC, Campbell RE, Steinbach PA, et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein[J]. Nat Biotechnol, 2004, 22: 1567-1572. |
| [10] | Strack RL, Keenan RJ, Glick BS. Noncytotoxic DsRed derivatives for whole-cell labeling[J]. Methods Mol Biol, 2011, 699: 355-370. |
| [11] | Watanabe Y, Tatebe H, Taguchi K, et al. p62/SQSTM1- dependent autophagy of Lewy body-like α-synuclein inclusions[J]. PLoS One, 2012, 7: e52868. |
| [12] | Zhou J, Tan SH, Nicolas V, et al. Activation of lysosomal function in the course of autophagy via mTORC1 suppression and autophagosome-lysosome fusion[J]. Cell Res, 2013, 23: 508-523. |
| [13] | Salazar M, Carracedo A, Salanueva IJ, et al. Cannabinoid action induces autophagy-mediated cell death through stimulation of ER stress in human glioma cells[J]. J Clin Invest, 2009, 119: 1359-1372. |
| [14] | Katayama H, Kogure T, Mizushima N, et al. A sensitive and quantitative technique for detecting autophagic events based on lysosomal delivery[J]. Chem Biol, 2011, 18: 1042-1052. |
| [15] | Ciechomska IA, Tolkovsky AM. Non-autophagic GFP- LC3 puncta induced by saponin and other detergents[J]. Autophagy, 2007, 3: 586-590. |
| [16] | Wang L, Chen M, Yang J, et al. LC3 fluorescent puncta in autophagosomes or in protein aggregates can be distinguished by FRAP analysis in living cells[J]. Autophagy, 2013, 9: 756-769. |
| [17] | Wang Y, Li P, Wang S, et al. Anticancer peptidyl arginine deiminase (PAD) inhibitors regulate the autophagy flux and the mammalian target of rapamycin complex 1 activity[J]. J Biol Chem, 2012, 287: 25941-25953. |
| [18] | Proikas-Cezanne T, Codogno P. A new fluorescence-based assay for autophagy[J]. Chem Biol, 2011, 18: 940-941. |
| [19] | Proikas-Cezanne T, Pfisterer SG. Assessing mammalian autophagy by WIPI-1/Atg18 puncta formation[J]. Methods Enzymol, 2009, 452: 247-260. |
| [20] | Proikas-Cezanne T, Ruckerbauer S, Stierhof YD, et al. Human WIPI-1 puncta-formation: a novel assay to assess mammalian autophagy[J]. FEBS Lett, 2007, 581: 3396-3404. |
| [21] | Kuma A, Matsui M, Mizushima N. LC3, an autophagosome marker, can be incorporated into protein aggregates independent of autophagy: caution in the interpretation of LC3 localization[J]. Autophagy, 2007, 3: 323-328. |
| [22] | Geng J, Baba M, Nair U, et al. Quantitative analysis of autophagy-related protein stoichiometry by fluorescence microscopy[J]. J Cell Biol, 2008, 182: 129-140. |
 2016, Vol. 51
2016, Vol. 51


