在生理状态下, 细胞通过自噬 (autophagy) 清除衰老细胞器和突变蛋白, 以维持自身结构稳定和功能正常。自噬还参与胚胎发育、免疫调节等生理过程。病理状态下细胞自噬水平显著升高, 以耐受缺血、饥饿和凋亡等情况。此外, 自噬功能的障碍还会导致某些疾病的发生[1]。根据细胞内底物运送到溶酶体腔的方式不同, 自噬可分为大自噬 (macroautophagy)、小自噬 (microautophagy)、分子伴侣介导的自噬(chaperon-mediated autophagy, CMA)。此外, 还有些选择性自噬如线粒体自噬 (mitophagy)、聚集体自噬 (aggrephagy)等[2]。不同类型的自噬其发生过程不同, 参与的蛋白分子也不同。检测不同自噬过程中的分子标志物的水平、状态与定位有助于评价细胞的自噬水平。常见标志物如表 1。
|
|
Table 1 Molecular markers of autophagy |
大自噬的囊泡膜结构起源于内质网和高尔基体等。这些膜片段形成杯状结构, 包裹胞内物质并最终形成闭合的双层膜的囊泡即自噬体, 然后自噬体与溶酶体融合, 自噬体内蛋白质或细胞器在溶酶体中被溶酶体酶降解[3]。因此该过程的标志物包括自噬体囊泡形成过程的标志物、溶酶体标志物和自噬底物标志物三类。
1.1 自噬体标志物自噬相关蛋白 (autophagy-related protein, Atg) 是一类自噬组成蛋白, 参与调节自噬起始和延伸等过程。其中几个关键蛋白, 也成为自噬标志物。
1.1.1 Atg12-Atg5复合物Atg12与Atg5会形成复合物, 甚至在一些哺乳动物细胞中似乎所有Atg5和Atg12都表现为结合体的形式。Atg12-Atg5复合物在自噬的形成中至关重要[4]。此外, Atg12-Atg5复合物还可以充当Atg8-磷脂酰乙醇胺 (phosphatidylethanolamine, PE) 结合系统的E3样连接酶。Atg12-Atg5的缺失会导致自噬缺陷[5]。但在短时饥饿状态, Atg12-Atg5的水平改变并不明显。
Atg12-Atg5复合物的水平检测可采用蛋白质印迹技术(Western blot) 方法进行。Atg12分子质量预期为15 kDa, 但在SDS-PAGE胶上目测大约在19 kDa的位置上。Atg5分子质量大约为32 kDa。由于Atg12分子质量小, 不易检测, 并且Atg5与Atg12的结合是非可逆的, 因此可分别用Atg5和Atg12的抗体孵育, 然后直接检测Atg12-Atg5的结合形式, 其分子质量大约在55 kDa左右。
1.1.2 自噬相关16样蛋白1 (autophagy related 16- like 1, Atg16L1)Atg16L1与Atg12-Atg5复合物相互作用, 并以自身寡聚化的方式形成Atg12-Atg5- Atg16L1复合物 (图 1), 附着在自噬体表面, 在自噬前体膜的延伸中发挥作用。在自噬前体膜完全融合 形成封闭的自噬体后, Atg12-Atg5-Atg16L1复合物被释放到胞质中[6]。在细胞膜转移作为自噬膜供体的过程中, Atg16L1可作为一个指标, 其定位在自噬体上, 但在完整的自噬溶酶体膜上尚未见分布。因此, Atg16L1可以用来检测早期自噬体的形成。
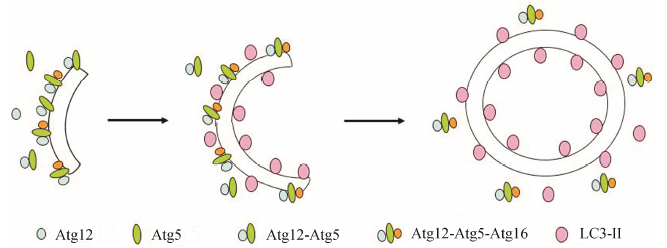
|
Figure 1 The formation process of autophagy and the Atg12-Atg5-Atg16L complex |
可对Atg5、Atg12或Atg16L1进行免疫透射电镜和免疫染色的检测。检测内源性的Atg5、Atg12或Atg16L1所形成的点状聚集或斑块可监测自噬的改变。在生理情况下, 内源性蛋白主要是在胞浆中弥散分布的; 而在饥饿等环境应激下自噬被诱导, 则细胞中Atg5、Atg12或Atg16L1的点状聚集或斑块会明显增加。
1.1.3 Atg8/微管相关蛋白1轻链3 (microtubule- associated protein1 light chain 3, LC3)Atg8/LC3是目前研究中被最广泛使用的分子标志物。在酵母 中, Atg8与PE偶联形成Atg8-PE[5]。LC3参与了自噬体膜的形成, 包括两种可相互转化的形式即LC3-I和LC3-II。细胞内新合成的LC3经过加工, 成为胞浆可溶形式的LC3-I, 后者经泛素化加工修饰, 与自噬体膜表面的PE结合, 成为膜结合形式的LC3-II。LC3-II定位于前自噬体和自噬体, 是自噬体的标志分子, 随自噬体膜的增多而增加[7]。
SDS-PAGE电泳中, LC3-I的表观分子质量为 18 kDa, LC3-II的表观分子质量为16 kDa。尽管PE偶联形式的LC3-II的分子质量较LC3-I大, 但是其具有强疏水性, 因此在SDS-PAGE中电泳迁移率反而比LC3-I (非PE偶联的LC3) 快。可以通过Western blot比较组间LC3-II水平, 也可通过计算LC3-II/LC3-I的比值来评价LC3-II水平, 并推测自噬囊泡数量的多少。LC3在含SDS的样品裂解液中易降解, 因此样品经煮沸裂解后应当尽快进行Western blot实验,并避免反复冻融。
LC3-II的含量或LC3-II/LC3-I的比例与自噬体的数量呈正相关, 在某种程度上反映了细胞的自噬活性。但是需要注意的是, 自噬是动态的, 自噬体的聚集可能是自噬活化待降解底物聚集而成, 也可能是自噬效应部分阻断, 自噬体无法被清除导致的。因此仅评价自噬体数量或LC3-II的表达均不能代表整个自噬过程。只有客观地分析自噬动态变化才能准确地判断自噬活性。基于自噬流 (autophagic flux) 的检测成为反映自噬活性更为可靠的指标。
1.1.4 Atg9/mAtg9Atg9是所有Atg蛋白中唯一的跨膜蛋白, 进化上高度保守, 在酵母以及哺乳动物细胞中都存在。酵母Atg9存在于30~60 nm的、来源于高尔基体膜的单层囊泡上, 这些Atg9囊泡在胞浆快速运动, 并整合到自噬囊泡外膜上[8]。哺乳动物细胞mAtg9与自噬囊泡存在动态相互作用。在形成成熟自噬体后, mAtg9并未整合进自噬体囊泡上, 而是又游离进入胞浆。有研究表明, mAtg9在形成双FYVE结构域蛋白1 (double FYVE-containing protein 1, DFCP1) 阳性的自噬体前体中是必需的, 但不依赖于早期的一些自噬蛋白如UNC-51样激酶1 (UNC-51-like kinase 1, ULK1) 和磷酸肌醇相互作用蛋白2 (WD repeat domain, phosphoinositide-interacting protein 2, WIPI2)[9]。mAtg9定位在内体和内体样的部位, 推测其在多种细胞器如再循环的内体间活动, 在自噬的起始进程中发挥极为关键的作用。mAtg9可用来检测自噬的发生。
1.1.5 Atg6/Beclin1哺乳动物Beclin1是酵母 Atg6/液泡分选蛋白30 (vacuole protein sorting 30, Vps30) 基因的同源物。Beclin1主要定位于反面高 尔基体 (trans-Golgi network, TGN)、内质网和线 粒体。Beclin1与Vps34形成III型磷脂酰肌醇3激 酶复合物 (phosphatidylinositol 3-kinase Class III complex, PI3KC3)。Vps34可磷酸化磷脂酰肌醇 (phosphatidylinositol, PI) 生成3-磷酸磷脂酰肌醇(PI3-phosphate, PI3P), 而PI3P募集胞浆中其他自 噬相关蛋白Atg结合到前自噬体膜上, 在自噬体形 成早期发挥重要作用[10]。磷脂酰肌醇3激酶 (phosphatidylinositol 3-kinase, PI3K) 抑制剂可干扰自噬体的形成。此外, Bcl-2与Beclin1结合也可抑制自噬活性[11]。
用荧光显微镜或透射电镜可检测Beclin1-GFP的点状聚集或斑块作为自噬标志物。但Beclin1自身有核定位信号[12], 且GFP融合蛋白的定位受到GFP的干扰, 因此Beclin1-GFP荧光显微结果显示有核定位倾向, 可能会影响对自噬状态的评判。在Beclin1依赖的自噬中, PI3K活性在自噬体形成中至关重要, 因此在Beclin1免疫沉淀物中测定PI3K活性可用来监测其对自噬的调节影响。
1.1.6 Atg14/BarkorAtg14定位在自噬体上, 其羧基端被命名为BATS (barkor autophagosome targeting sequence) 区域。BATS区域在Beclin1招募和自噬活化中意义重大。Atg14的BATS区域通过α螺旋的疏水表面与自噬囊泡膜结合。在应激情况下, BATS点状聚集或斑块与Atg16和LC3以及部分自噬早期标志物DFCP1重合[13]。Atg14-GFP或BATS-GFP在用荧光显微镜或投射电镜技术检测自噬水平时可作为自噬标志物。但除了定位于自噬体, Atg14也定位于自噬溶酶体和内质网上[14]。因此, 用Atg14作为标志物时最好也结合用其他自噬标志物做鉴定。
1.1.7 损伤调节自噬蛋白 (damage-regulated autophagy modulator 1, DRAM1)DRAM1是一个具有六个跨膜结构的疏水蛋白。除了定位于顺面高尔基 体, DRAM1也定位于早期和晚期内体和溶酶体, 它与早期核内体相关蛋白1 (early-endosome-associated protein 1, EEA1) 和溶酶体相关膜蛋白2 (lysosome- associated membrane protein type 2, LAMP-2) 共定位。在应激情况下, DRAM1可被活化的p53激活。DRAM1基因沉默会阻断自噬的发生[15]。由于DRAM1分子质量很小, 大约28 kDa, 加之其疏水性强, 蛋白水平检测有一定难度, 可考虑用实时定量PCR对其mRNA水平进行检测。
1.1.8 ZFYVE1/DFCP1锌指FYVE结构域蛋白1 (zinc finger FYVE domain-containing protein 1, ZFYVE1) 也被称为双FYVE结构域蛋白1 (DFCP1), 其羧基端即为两个锌结合的FYVE结构域。FYVE结构域参与膜转运和细胞信号, 促进其与含PI3P的膜结合。ZFYVE1/DFCP1与PI3P结合后, 定位于内质网和高尔基体。饥饿诱导DFCP1转位至粗面内质网的粗粒上, 显示在欧米茄体 (omegasome) 形成的部位[16]。因此DFCP1可作为自噬形成初期的标志物。DFCP1的表达可用荧光免疫组化方法观察, 出现DFCP1阳性的点状分布则意味着自噬囊泡正在开始形成期。
1.2 溶酶体标志物因为自噬过程最终的完成是在溶酶体中进行的, 因此溶酶体标志蛋白在自噬功能研究中就显得极为重要。在酸性水解酶的作用下, 进入溶酶体的自噬体内容物被降解。降解生成的可溶性小分子物质经自噬溶酶体膜渗透入细胞质, 参与细胞的物质代谢活动。
目前已识别的25个溶酶体膜蛋白都是高糖基化的。含量最高的膜蛋白就是溶酶体相关膜蛋白1 (lysosome-associated membrane protein type 1, LAMP- 1)、LAMP-2和溶酶体整合膜蛋白 (lysosomal integral membrane protein, LIMP-2)[17]。可用免疫组化或Western blot的方法检测溶酶体重要膜蛋白的水平, 并与其他自噬相关蛋白结合使用。
1.3 自噬底物p62也被称为SQSTM1, 在多种细胞和组织中 都有表达, 可作为一个货车蛋白参与多种信号转导过程。p62可连接LC3和泛素化的底物, 随后被整合到自噬体中, 并在自噬溶酶体中被降解[18]。当自噬被激活时自噬体与溶酶体融合, 自噬囊泡中p62等蛋 白或细胞器被溶酶体酶降解, p62水平降低; 当自噬被抑制时自噬体积累, p62水平升高。因此, 可以用Western blot方法检测p62的水平, 作为自噬能力变化的指征。
除了与LC3和泛素化蛋白结合外, p62可能还参与形成雷帕霉素靶蛋白复合物 (target of rapamycin complex 1, TORC1)。p62还与蛋白酶体功能相关。当蛋白酶体功能被抑制时, p62水平也会增高。此外, p62也是钙依赖的非溶酶体蛋白酶calpain 1的底物[19], 因此很难解释它在自噬与死亡检测中的意义。
在自噬被激活时, LC3的上调和p62的表达下降不一定有明显的关联。尽管p62可以作为自噬损害或者自噬流改变的辅助标志, 但最好联合其他指标如LC3进行自噬流的评估。
2 CMA的标志物CMA是胞浆内某些蛋白质被分子伴侣如热休克蛋白质70 (heat shock cognate protein of 70 kDa, HSC70) 识别, 并将其运送到溶酶体膜上, 再经溶酶体膜蛋白LAMP-2a结合后被转运到溶酶体腔中被溶酶体酶消化的过程 (图 2)。与大自噬和小自噬相比, CMA的主要特点是细胞质内的蛋白质直接经溶酶体膜蛋白转运入溶酶体腔, 不需形成自噬囊泡[20]。
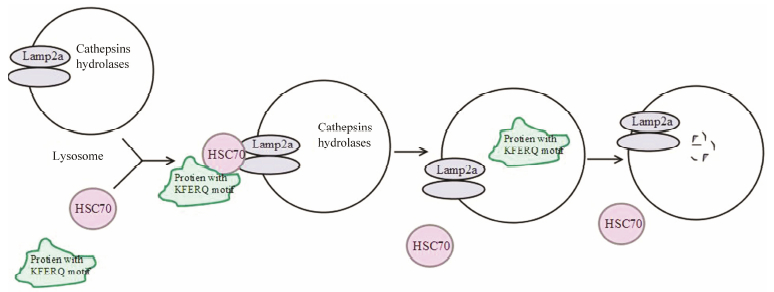
|
Figure 2 The process of chaperon-mediated autophagy and the markers |
HSC70是分子质量为70 kDa的热休克同源蛋白, 它是分子伴侣, 在胞浆识别带有KFERQ样序列的CMA底物。HSC70与定位于溶酶体腔面的Hsp90相互作用。在HSC70的帮助下, 底物在穿越溶酶体膜时开始从折叠状态去折叠, 并在LAMP-2a复合物形成之前完成。将底物转运穿越溶酶体膜还需要定位在溶酶体膜上的HSC70 (lys-HSC70)。HSC70的稳定性依赖于溶酶体的pH值。pH值轻微的上升都会促进HSC70的降解[21]。
2.2 LAMP-2aLAMP-2有3个亚型, LAMP-2a、LAMP-2b和LAMP-2c, 借助RNAi技术显示只有LAMP-2a才是CMA途径重要的受体。CMA的速率直接依赖于溶酶体膜上LAMP-2a的含量[22]。LAMP-2a在胞内的水平可由于转录水平改变或降解速率改变而发生变化。抑制LAMP-2a将引起CMA底物GAPDH的聚集; 过表达LAMP-2a, 则引起GAPDH水平下降。
3 线粒体自噬标志物线粒体自噬指在ROS、营养缺乏和细胞衰老等内外环境的刺激下, 细胞内的线粒体发生去极化, 而这些被损伤的线粒体将被特异性地包裹进自噬体中并与溶酶体融合, 从而完成损伤线粒体的降解, 维持细胞内环境稳定的过程[23]。
细胞主要通过选择性自噬来进行线粒体的更新。损伤的线粒体在发生线粒体自噬之前先发生动力相关蛋白1 (dynamin-related protein 1, DRP1) 介导的 线粒体分裂。线粒体膜电位的下降引起PTEN诱导假定激酶 (phosphatase and tensin homolog-induced putative kinase 1, PINK1) 的聚集, 接着招募E3泛素连接酶Parkin到线粒体。Parkin促进线粒体膜上蛋白质泛素化, p62蛋白与线粒体上泛素化蛋白相互作用, 借助p62与LC3的互作引导线粒体被自噬体包裹[24]。同时, 线粒体上存在自噬受体如BNIP3 (Bcl-2 and adenovirus E1B 19-kD interacting protein 3) 和NIX/ BNIP3L (BNIP3-like) 也可以与LC3互作使得受损线粒体通过自噬方式被去除[25]。
研究中通常用线粒体标志物和自噬标志物LC3共定位来显示线粒体自噬。此外, 还有几个线粒体自噬受体也可以考虑用作线粒体自噬的标志。
3.1 Atg32酵母中, Atg32是一个分子质量约59 kDa的跨膜蛋白, 定位在线粒体外膜上。在氨基端有与Atg8和Atg11结合的结构域, 在线粒体自噬的发生中作用巨大。Atg11是个脚手架蛋白, 在选择性自噬中为Atg蛋白的装配提供平台。羧基端可能发挥调节线粒体自噬的作用。抑制Atg32表达会减少线粒体自噬的效率, 同样地, 过表达Atg32则增加线粒体自噬的效率。研究认为Atg32是酵母线粒体自噬发生的限速步骤[26]。进一步的研究发现酵母中Atg32缺失并不明显影响普遍意义上的自噬, 因此认为Atg32是引导线粒体自噬专属分子。尽管线粒体自噬是进化上保守的现象, 但是在哺乳动物细胞中并未发现Atg32的同源基因。
3.2 BNIP3和NIXBNIP3和NIX序列上有56% 的同源度, 且都有BH3结构域, 并与Bcl-2作用。NIX与BNIP3定位在线粒体和内质网上, 通过影响线粒体呼吸和ROS水平调节凋亡和程序性坏死。BNIP3插入线粒体的外层膜, 其氨基端在胞浆中, 而羧基端在线粒体内。BNIP3诱导线粒体嵴消失并促进细胞色素C释放, 同时, NIX和BNIP3包含有与LC3结合的LC3相互作用区域 (LC3-interaction region, LIR), 因而也被称为是线粒体自噬受体。BNIP3的17位丝氨酸和24位丝氨酸的磷酸化会促进其与LC3结合, 易化线粒体自噬的发生。NIX与Ras家族小GTPase—Rheb互作促进线粒体自噬[27]。此外, NIX可促进Parkin定位到受损线粒体上, Parkin又对线粒体膜上蛋白质进行泛素化, 从而引导p62与LC3的互作而发生线粒体自噬[28]。
4 小结自噬标志物的检测在自噬研究中发挥了巨大的作用, 使得人们可以简便、动态、实时并定量地检测细胞内自噬水平。然而单独检测每一种自噬标志物都有一定的局限性和影响因素, 在研究自噬时必须慎重考虑研究条件, 适当设置阴性与阳性对照, 使用多种自噬抑制剂或者基因沉默等技术, 多方面、多层次进行实验以确认细胞的自噬水平。
| [1] | Murrow L, Debnath J. Autophagy as a stress-response and quality-control mechanism: implications for cell injury and human disease [J]. Annu Rev Pathol, 2013, 8: 105-137. |
| [2] | Hale AN, Ledbetter DJ, Gawriluk TR, et al. Autophagy: regulation and role in development [J]. Autophagy, 2013, 9: 951-972. |
| [3] | Wang CW, Klionsky DJ. The molecular mechanism of autophagy [J]. Mol Med, 2003, 9: 65-76. |
| [4] | Mizushima N, Noda T, Yoshimori T, et al. A protein conjugation system essential for autophagy [J]. Nature, 1998, 395: 395-398. |
| [5] | Otomo C, Metlagel Z, Takaesu G, et al. Structure of the human Atg12-Atg5 conjugate required for LC3 lipidation in autophagy [J]. Nat Struct Mol Biol, 2013, 20: 59-66. |
| [6] | Kuma A, Mizushima N, Ishihara N, et al. Formation of the approximately 350-kD Apg12-Apg5.Apg16 multimeric complex, mediated by Apg16 oligomerization, is essential for autophagy in yeast [J]. J Biol Chem, 2002, 277: 18619- 18625. |
| [7] | Dancourt J, Melia TJ. Lipidation of the autophagy proteins LC3 and GABARAP is a membrane-curvature dependent process [J]. Autophagy, 2014, 10: 1470-1471. |
| [8] | Reggiori F, Shintani T, Nair U, et al. Atg9 cycles between mitochondria and the pre-autophagosomal structure in yeasts [J]. Autophagy, 2005, 1: 101-109. |
| [9] | Orsi A, Razi M, Dooley HC, et al. Dynamic and transient interactions of Atg9 with autophagosomes, but not membrane integration, are required for autophagy [J]. Mol Biol Cell, 2012, 23: 1860-1873. |
| [10] | Backer JM. The regulation and function of class III PI3Ks: novel roles for Vps34 [J]. Biochem J, 2008, 410: 1-17. |
| [11] | Levine B, Sinha S, Kroemer G. Bcl-2 family members: dual regulators of apoptosis and autophagy [J]. Autophagy, 2008, 4: 600-606. |
| [12] | Liang XH, Yu J, Brown K, et al. Beclin 1 contains a leucine-rich nuclear export signal that is required for its autophagy and tumor suppressor function [J]. Cancer Res, 2001, 61: 3443-3449. |
| [13] | Fan W, Nassiri A, Zhong Q. Autophagosome targeting and membrane curvature sensing by Barkor/Atg14(L) [J]. Proc Natl Acad Sci U S A, 2011, 108: 7769-7774. |
| [14] | Diao J, Liu R, Rong Y, et al. Atg14 promotes membrane tethering and fusion of autophagosomes to endolysosomes [J]. Nature, 2015, 520: 563-566. |
| [15] | Crighton D, Wilkinson S, O'Prey J, et al. DRAM, a p53-induced modulator of autophagy, is critical for apoptosis [J]. Cell, 2006, 126: 121-134. |
| [16] | Nanao T, Koike M, Yamaguchi J, et al. Cellular localization and tissue distribution of endogenous DFCP1 protein [J]. Biomed Res, 2015, 36: 121-133. |
| [17] | Callahan JW, Bagshaw RD, Mahuran DJ. The integral membrane of lysosomes: its proteins and their roles in disease [J]. J Proteomics, 2009, 72: 23-33. |
| [18] | Pankiv S, Clausen TH, Lamark T, et al. p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy [J]. J Biol Chem, 2007, 282: 24131-24145. |
| [19] | Bitto A, Lerner CA, Nacarelli T, et al. P62/SQSTM1 at the interface of aging, autophagy, and disease [J]. Age, 2014, 36: 9626. |
| [20] | Kaushik S, Cuervo AM. Chaperone-mediated autophagy: a unique way to enter the lysosome world [J]. Trends Cell Biol, 2012, 22: 407-417. |
| [21] | Cuervo AM, Wong E. Chaperone-mediated autophagy: roles in disease and aging [J]. Cell Res, 2014, 24: 92-104. |
| [22] | Arias E, Cuervo AM. Chaperone-mediated autophagy in protein quality control [J]. Curr Opin Cell Biol, 2011, 23: 184-189. |
| [23] | Kim I, Rodriguez-Enriquez S, Lemasters JJ. Selective degradation of mitochondria by mitophagy [J]. Arch Biochem Biophys, 2007, 462: 245-253. |
| [24] | Han JY, Kang MJ, Kim KH, et al. Nitric oxide induction of Parkin translocation in PTEN-induced putative kinase 1 (PINK1) deficiency: functional role of neuronal nitric oxide synthase during mitophagy [J]. J Biol Chem, 2015, 290: 10325-10335. |
| [25] | Novak I, Kirkin V, McEwan DG, et al. Nix is a selective autophagy receptor for mitochondrial clearance [J]. EMBO Rep, 2010, 11: 45-51. |
| [26] | Okamoto K, Kondo-Okamoto N, Ohsumi Y. Mitochondria- anchored receptor Atg32 mediates degradation of mitochondria via selective autophagy [J]. Dev Cell, 2009, 17: 87-97. |
| [27] | Liu L, Sakakibara K, Chen Q, et al. Receptor-mediated mitophagy in yeast and mammalian systems [J]. Cell Res, 2014, 24: 787-795. |
| [28] | Ding WX, Ni HM, Li M, et al. Nix is critical to two distinct phases of mitophagy, reactive oxygen species-mediated autophagy induction and Parkin-ubiquitin-p62-mediated mitochondrial priming [J]. J Biol Chem, 2010, 285: 27879- 27890. |
 2016, Vol. 51
2016, Vol. 51


