白藜芦醇 (resveratrol) 化学名称为3,4',5-三羟基-1,2-二苯乙烯, 是一种天然的非黄酮类多酚化合物, 广泛存在于葡萄、花生、虎杖及桑葚等植物中, 具有广泛的生物学和药理学活性, 且易透过血−脑屏障进入脑组织, 神经保护作用突出[1]。有研究指出白藜芦醇对多种神经退行性疾病具有显著保护作用, 其作用机制复杂, 可能与抗炎、抗凋亡等作用有关[2, 3]。细胞自噬是一种清除损伤或衰老的蛋白和细胞器、维持细胞新陈代谢和稳态的重要自我保护机制, 在细 胞生长、发育和衰老以及疾病发生发展中起重要的作用。特别是在神经退行性疾病中, 自噬在降解与疾病相关的错误折叠和聚集蛋白方面起着关键作用[4]。最新研究表明白藜芦醇对自噬具有调节作用[5, 6], 本文以神经退行性疾病为对象, 综述了白藜芦醇诱导细胞自噬在阿尔茨海默病 (Alzheimer’s disease, AD)、帕金森病 (Parkinson’s disease, PD) 和亨廷顿病 (Huntington’s disease, HD) 等神经退行性疾病进展中的作用, 为白藜芦醇的进一步研发和应用提供新思路。
1 白藜芦醇的作用白藜芦醇具有强大的抗氧化、抗肿瘤、抗突变、抗衰老、抗炎症、诱导细胞凋亡及雌激素调节等生物药理活性, 并且是迄今为止发现的、最强的沉默信息调控因子1 (silent information regulator 1, SIRT1) 的天然激活剂[7]。SIRT1是NAD+依赖的组蛋白脱乙酰基酶, 是细胞自我保护的重要分子之一, 具有调节基因转录、染色体稳定性和靶蛋白活性的作用, 参与细胞周期、细胞衰老、凋亡和新陈代谢等过程。SIRT1在动物脑神经细胞中高表达, 在神经损伤修复调节和神经保护中起着重要作用[8, 9]。在神经退行性疾病中, 白藜芦醇上调SIRT1从而诱导自噬产生神经保护作用, 对延缓神经退行性疾病进展有重要意义[10]。
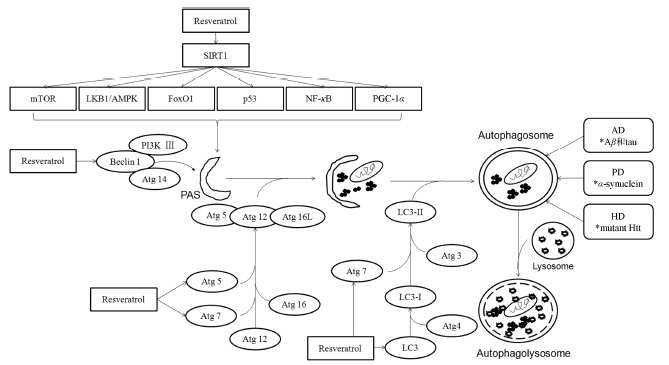
2 白藜芦醇调节自噬的机制自噬是真核细胞利用溶酶体对异常蛋白和受损细胞器的一种主动清除方式, 贯穿于细胞生长发育和疾病发生发展的病理生理过程。自噬起始于包绕部分细胞质的双层膜结构, 即自噬前体结构 (preautophagosomal structure, PAS), 随后PAS不断延伸, 包裹异常蛋白或功能障碍的细胞器, 最终形成密闭的球状结构, 称为自噬体 (autophagosome)。随后自噬体与溶酶体(lysosome) 融合, 形成自噬溶酶体 (autophagolysosome), 完成对自噬体包裹物的降解和循环利用。目前已发现30多个自噬相关基因 (Atgs) 及其编码的蛋白 (Atg1~Atg35) 参与这一过程, 其中最核心的蛋白是Atg5、Atg6 (Beclin1) 和Atg8 (LC3)。Atg5和Atg6被证明是自噬的必要基因的标志, LC3由I型转化为II型是自噬体形成的标志性改变[11, 12]。
自噬的发生受到各种信号因子的调节, 主要有具有抑制作用的哺乳动物雷帕霉素靶蛋白 (mTOR), 具有双向调节作用的Beclin 1和具有激活作用的LC3-II。近来研究发现SIRT1也能有效调节自噬, 白藜芦醇作为SIRT1激活剂, 也可有效调节自噬[13]。SIRT1对mTOR具有负调节作用, 白藜芦醇可通过激活SIRT1从而降低mTOR活性达到调控自噬的效果[14]。SIRT1作为脱乙酰基酶, 能使Atg5、Atg7和LC3去乙酰化, 对自噬体的形成和自噬过程进行调控[15, 16]。Wu等[10]在人神经母细胞瘤细胞 (SH-SY5Y) 和大鼠肾上腺嗜铬细胞瘤细胞 (PC12) 上发现, 白藜芦醇诱导的自噬可保护细胞免受鱼藤酮的损伤, 若将SIRT1活性抑制, 会使LC3的表达量减少, LC3-I向LC3-II的转化不足, 使自噬水平降低。SIRT1还能使LKB1去乙酰化, 激活AMP依赖的蛋白激酶 (AMPK), 形成SIRT1/LKB1/AMPK通路调控细胞自噬[13]。此外, 白藜芦醇具有基因转录网络调节作用, 通过增加SIRT1活性, 使叉头状转录因子O1 (FoxO1) 去乙酰化, 进而减少其自身磷酸化水平, 导致基因转录活性增强, 细胞自噬水平提高[17]。SIRT1对其他转录因子如p53、核转录因子κB (NF-κB) 和过氧化物酶体增殖活化受体γ共激活因子-1α (PGC-1α) 也进行乙酰化/去乙酰化调节, 对自噬产生重要的调控作用[18]。总之, 白藜芦醇作用于SIRT1经多条通路调控自噬, 有效地清除细胞中异常蛋白或功能障碍的细胞器, 参与对机体各系统的保护。
3 白藜芦醇与神经退行性疾病神经退行性疾病是年龄依赖性疾病, 大量突变或错误折叠的蛋白质, 如β淀粉样蛋白 (Aβ)、tau蛋白和α突触核蛋白 (α-synuclein), 在神经细胞内聚集, 使神经细胞进行性变性死亡, 引起中枢神经系统功能逐渐缺失, 导致患者表现出进行性的认知和运动功能障碍的一类疾病, 包括AD、PD和HD等。细胞自噬是有效清除这些病理性蛋白的主要方式之一。随着年龄的增长, 自噬功能减弱或障碍, 导致神经系统内异常聚集的病理性蛋白清除障碍, 引起神经退行性疾病的发生发展。白藜芦醇通过诱导和促进自噬过程, 加速病理性蛋白的清除, 对神经退行性疾病的防治具有重要意义。
3.1 ADAD是最常见于老年人的神经退行性疾病, 主要病理特征为神经元外Aβ聚集形成老年斑、神经元内的tau蛋白异常磷酸化聚集形成神经纤维缠结和相关脑区 (海马和皮层) 突触及神经元丢失。AD的病因尚不明确, Aβ和tau蛋白可能在其中发挥重要作用。正常情况下, Aβ和tau蛋白随着自噬体进入溶酶体降解。如果自噬体不能有效与溶酶体融合, 完成清除过程, 自噬体将成为蛋白聚集的场所, 这说明自噬与AD发病机制有关。
在AD的早期阶段, 激活自噬可加速病理性蛋白 (Aβ和tau蛋白) 的清除, 阻止疾病的发展。流行病学调查结果提示适度饮用葡萄酒 (含白藜芦醇) 可以有效地预防AD[19]。在AD动物模型中, 白藜芦醇可以上调LC3-II和Beclin 1的表达, 增强自噬水平, 减轻Aβ和tau蛋白引起的病理反应, 改善模型动物的学习记忆能力[20]。白藜芦醇还通过激活SIRT1, 使PGC-1α和p53去乙酰化, 诱导自噬, 延缓海马神经元变性, 减轻模型动物学习障碍[21]。细胞实验也证实, Atg5敲除的细胞中Aβ聚集增加, 而白藜芦醇通过诱导自噬加速胞内Aβ的清除[22, 23]。白藜芦醇使p53去乙酰化后可以促进神经细胞存活, 而用RNA干扰敲除SIRT1则会阻断自噬发生, 对异常磷酸化tau蛋白降解不利, 致使毒性的tau蛋白聚集[24]。目前, 白藜芦醇已经进入治疗轻度至中度AD的II期临床试验[11]。
3.2 PDPD是另一种多见于中老年人的神经退行性疾病, 主要病理特征为大量黑质多巴胺能神经元进行性丢失, 纹状体多巴胺含量显著减少, 黑质残存的神经元内α-synuclein错误折叠后聚集, 出现嗜酸性包涵体—路易小体。正常情况下, α-synuclein是具有α螺旋结构的可溶性蛋白, 当其结构改变—β折叠后, 产生不溶聚集。虽然多巴胺能神经元变性的病因尚不清楚, 但过度聚集错误折叠的α-synuclein, 联合神经毒素或突变蛋白 (DJ-1、PINK1和LRRK2) 引起线粒体功能障碍, 与PD的发病机制有关[25]。自噬可以有效地清除这些错误折叠并易聚集的蛋白。自噬功能的失调和PD的病理生理过程有重要联系。
在PD细胞模型中, SIRT1激活剂白藜芦醇可以促进具有毒性的错误折叠的α-synuclein聚集, 形成较大、毒性较弱的聚集体, 并通过诱导自噬通路将其降解, 达到保护细胞的目的。白藜芦醇通过激活细胞自噬流保护鱼藤酮诱导的PD细胞模型, 然而使用巴伐洛霉素A1 (自噬抑制剂) 可以中止该效应[26]。在PD动物模型中也证实通过白藜芦醇诱导自噬, 可以有效清除这些病理性蛋白, 产生神经保护作用。Long等[27]发现白藜芦醇诱导SIRT1活化, 激活自噬通路, 防止线粒体功能障碍, 发挥神经保护作用, 改善模型动物PD症状。Mudò等[28]证实在1-甲基-4苯基-1,2, 3,6-四氢吡啶 (MPTP) 诱导的PD小鼠模型中, 白藜芦醇通过活化SIRT1/PGC-1α/自噬途径保护多巴胺能神经元, 减轻多巴胺黑质纹状体的退化。Lin等[26]研究发现鱼藤酮诱导的PD大鼠模型, 多巴胺能神经元丢失严重, 白藜芦醇干预后, 诱导血红素加氧酶-1的表达, 促进自噬流发生, 减少多巴胺能神经元凋亡。以此为基础, 白藜芦醇可提高自噬功能, 清除易聚集的病理性蛋白, 保护多巴胺能神经元, 延迟PD症状的出现, 是一种潜在的抗PD药物。
3.3 HDHD是一种常染色体显性遗传的神经退行性疾病, 发病年龄集中在35~50岁, 是编码亨廷顿蛋白 (Huntingtin, HTT) 的基因发生突变所致。该基因上编码谷氨酰胺的胞嘧啶−腺嘌呤−鸟嘌呤 (CAG) 三核苷酸序列异常扩增, 形成异常HTT蛋白 (mutant Huntingtin, mHTT), 其氨基端有一段重复的谷氨酰胺序列 (poly Q, 重复次数大于35), 蛋白构象以β-折叠为主, 蛋白易聚集形成不溶性包涵体, 最终导致纹状体和皮层神经元进行性死亡。自噬可有效地清除mHTT, 维持细胞稳态。在HD的细胞模型中, 应用自噬抑制剂3-甲基腺嘌呤阻断细胞自噬流, 将明显提高mHTT的形成及聚集, 导致细胞死亡[29], 而通过上调自噬不仅可以减少mHTT的聚集, 而且还可以降低mHTT表达水平, 提示细胞自噬水平可能与HD的发生发展有关[30]。
在HD的动物和细胞模型发现, 白藜芦醇通过SIRT1-mTOR-自噬通路可以降解mHTT, 减轻其对神经细胞的毒性[31, 32]。白藜芦醇通过活化SIRT1, 对FoxO产生去乙酰化调节, 对细胞自噬调控也起重要作用。SIRT1-FoxO-自噬通路保护神经元, 减少具有poly Q蛋白聚集体的毒性作用[33]。SIRT1还可上调PGC-1α活性, 增强自噬功能, 在HD中起到神经保护作用[34]。作为SIRT1的强激活剂, 白藜芦醇激活自噬, 有利于在HD发病早期减少mHTT聚集体的形成并减轻疾病症状, 提示白藜芦醇对HD患者神经元具有保护作用, 对延缓HD进展具有一定的潜力。
4 总结自噬是高度保守并受严密调控的, 参与异常蛋白和受损细胞器降解的过程。自噬功能障碍会导致异常蛋白聚集, 这与神经退行性疾病密切相关。白藜芦醇能有效地诱导和促进自噬流的发生, 清除易形成聚集体的病理性蛋白, 对AD、PD及HD的症状具有不同程度的缓解 (调节机制见图 1)。但是, 白藜芦醇除了调控细胞自噬外, 还调控着其他重要的生物学过程, 因此其可能带来毒副作用。本实验室发现长期 (10个月) 喂养添加白藜芦醇 (30 mg∙kg−1) 饲料的c57小鼠出现肾小球系膜增生, 肾脏受到不同程度损伤 (结果待发表)。需进一步探究白藜芦醇诱导细胞自噬在神经退行性疾病进展中的内在调控机制, 加强自噬相关分子机制的基础研究及相应的毒理研究。相信, 白藜芦醇诱导细胞自噬防治神经退行性疾病将会有更广阔的前景。
|
Figure 1 The relationship between resveratrol induced cellular autophagy signaling pathway and neurodegenerative diseases. AD: Alzheimer’s disease; HD: Huntington’s disease; PD: Parkinson’s disease |
| [1] | Pervaiz S, Holme AL. Resveratrol: its biologic targets and functional activity [J]. Antioxid Redox Signal, 2009, 11: 2851-2897. |
| [2] | Albani D, Polito L, Signorini A, et al. Neuroprotective properties of resveratrol in different neurodegenerative disorders [J]. Biofactors, 2010, 36: 370-376. |
| [3] | Foti CV, Ciurleo R, Giacoppo S, et al. Role of resveratrol and its analogues in the treatment of neurodegenerative diseases: focus on recent discoveries [J]. CNS Neurol Disord Drug Targets, 2011, 10: 849-862. |
| [4] | Yang Z, Zhao B. Autophagy and neurodegeneration [J]. Hainan Med (海南医学), 2011, 22: 119-122. |
| [5] | Jeong JK, Moon MH, Lee YJ, et al. Autophagy induced by the class Ⅲ histone deacetylase Sirt1 prevents prion peptide neurotoxicity [J]. Neurobiol Aging, 2013, 34: 146-156. |
| [6] | Ding Q, Zhang XN, Chen XP. Autophagy regulation, a novel biological activity mechanism of resveratrol [J]. Chin J New Drugs Clin Rem (中国新药与临床杂志), 2014, 33: 634-638. |
| [7] | Das DK, Mukherjee S, Ray D. Resveratrol and red wine, healthy heart and longevity [J]. Heart Fail Rev, 2010, 15: 467-477. |
| [8] | Ramadori G, Lee CE, Bookout AL, et al. Brain SIRT1: anatomical distribution and regulation by energy availability [J]. J Neurosci, 2008, 28: 9989-9996. |
| [9] | Sun AY, Wang Q, Simonyi A, et al. Resveratrol as a therapeutic agent for neurodegenerative diseases [J]. Mol Neurobiol, 2010, 41: 375-383. |
| [10] | Wu Y, Li X, Zhu JX, et al. Resveratrol-activated AMPK/ SIRT1/autophagy in cellular models of Parkinson's disease [J]. Neurosignals, 2011, 19: 163-174. |
| [11] | Ghavami S, Shojaei S, Yeganeh B, et al. Autophagy and apoptosis dysfunction in neurodegenerative disorders [J]. Prog Neurobiol, 2014, 112: 24-49. |
| [12] | Hua F, Yu JJ, Li K, et al. Autophagy in ageing and ageing- related diseases [J]. Acta Pharm Sin (药学学报), 2014, 49: 764-773. |
| [13] | Pallàs M, Porquet D, Vicente A, et al. Resveratrol: new avenues for a natural compound in neuroprotection [J]. Curr Pharm Des, 2013, 19: 6726-6731. |
| [14] | Ghosh HS, McBurney M, Robbins PD. SIRT1 negatively regulates the mammalian target of rapamycin [J]. PLoS One, 2010, 5: e9199. |
| [15] | Morselli E, Maiuri MC, Markaki M, et al. Caloric restriction and resveratrol promote longevity through the Sirtuin-1- dependent induction of autophagy [J]. Cell Death Dis, 2010, 1: e10. |
| [16] | Lee IH, Cao L, Mostoslavsky R, et al. A role for the NAD- dependent deacetylase Sirt1 in the regulation of autophagy [J]. Proc Natl Acad Sci U S A, 2008, 105: 3374-3379. |
| [17] | Bennetzen MV, Mariño G, Pultz D, et al. Phosphoproteomic analysis of cells treated with longevity-related autophagy inducers [J]. Cell Cycle, 2012, 11: 1827-1840. |
| [18] | Chung S, Yao H, Caito S, et al. Regulation of SIRT1 in cellular functions: role of polyphenols [J]. Arch Biochem Biophys, 2010, 501: 79-90. |
| [19] | Truelsen T, Thudium D, Grønbaek M, et al. Amount and type of alcohol and risk of dementia: the Copenhagen city heart study [J]. Neurology, 2002, 59: 1313-1319. |
| [20] | Wang JF, Yi HL, Yuan XL, et al. Effects of resveratrol on learning and memory and P-tau in hippocampus in AD rats [J]. J Apoplexy Nerv Dis (中风与神经疾病杂志), 2014, 31: 22-25. |
| [21] | Kim D, Nguyen MD, Dobbin MM, et al. SIRT1 deacetylase protects against neurodegeneration in models for Alzheimer's disease and amyotrophic lateral sclerosis [J]. EMBO J, 2007, 26: 3169-3179. |
| [22] | Vingtdeux V, Giliberto L, Zhao H, et al. AMP-activated protein kinase signaling activation by resveratrol modulates amyloid-beta peptide metabolism [J]. J Biol Chem, 2010, 285: 9100-9113. |
| [23] | Ohta K, Mizuno A, Ueda M, et al. Autophagy impairment stimulates PS1 expression and γ-secretase activity [J]. Autophagy, 2010, 6: 345-352. |
| [24] | Min SW, Cho SH, Zhou Y, et al. Acetylation of tau inhibits its degradation and contributes to tauopathy [J]. Neuron, 2010, 67: 953-966. |
| [25] | González-Polo RA, Gómez-Sánchez R, Sánchez-Erviti L, et al. Autophagy: a possible defense mechanism in Parkinson's disease? [M] // Gowder S. New Insights into Toxicity and Drug Testing. [S.l.]: InTech, 2013: 177-196. |
| [26] | Lin TK, Chen SD, Chuang YC, et al. Resveratrol partially prevents rotenone-induced neurotoxicity in dopaminergic SH- SY5Y cells through induction of heme oxygenase-1 dependent autophagy [J]. Int J Mol Sci, 2014, 15: 1625-1646. |
| [27] | Long J, Gao H, Sun L, et al. Grape extract protects mitochondria from oxidative damage and improves locomotor dysfunction and extends lifespan in a Drosophila Parkinson's disease model [J]. Rejuvenation Res, 2009, 12: 321-331. |
| [28] | Mudò G, Mäkelä J, Di Liberto V, et al. Transgenic expression and activation of PGC-1α protect dopaminergic neurons in the MPTP mouse model of Parkinson's disease [J]. Cell Mol Life Sci, 2011, 69: 1153-1165. |
| [29] | Qin ZH, Wang Y, Kegel KB, et al. Autophagy regulates the processing of amino terminal huntingtin fragments [J]. Hum Mol Genet, 2003, 12: 3231-3244. |
| [30] | Ross CA, Tabrizi SJ. Huntington's disease: from molecular pathogenesis to clinical treatment [J]. Lancet Neurol, 2011, 10: 83-98. |
| [31] | Ravikumar B, Vacher C, Berqer Z, et al. Inhibition of mTOR induces autophagy and reduces toxicity of polyglutamine expansions in fly and mouse models of Huntington disease [J]. Nat Genet, 2004, 36: 585-595. |
| [32] | Mendelsohn AR, Larrick JW. Rapamycin as an antiaging therapeutic?: targeting mammalian target of rapamycin to treat Hutchinson-Gilford progeria and neurodegenerative diseases [J]. Rejuvenation Res, 2011, 14: 437-441. |
| [33] | Shin BH, Lim Y, Oh HJ, et al. Pharmacological activation of Sirt1 ameliorates polyglutamine-induced toxicity through the regulation of autophagy [J]. PLoS One, 2013, 8: e64953. |
| [34] | Wang Y, Gao J, Qian JJ. SIRT1 and neurodegenerative diseases [J]. Chin Bull Life Sci (生命科学), 2010, 22: 317-320. |
 2016, Vol. 51
2016, Vol. 51


