2. 中国中医科学院江苏分院, 中药组分与微生态研究中心, 江苏南京 210028
2. Multi-component of Traditional Chinese Medicine and Microecology Research Center, Jiangsu Branch of China Academy of Chinese Medical Sciences, Nanjing 210028, China
淫羊藿苷是淫羊藿的主要药效成分,具有良好的抗骨质疏松作用。然而淫羊藿苷口服后,经过肠道酶、肠道菌转化形成的宝藿苷І或苷元是其发挥药效的主要形式[1]。因此,肠道中相关酶和肠道菌对淫羊藿苷的吸收前代谢能够显著影响其吸收及药效的发挥。为了避免种族、年龄以及生理状态对人体肠道内的肠道酶、肠道菌的影响,在体外将淫羊藿苷转化成次级苷或苷元,能够有效避免吸收前代谢不同对吸收和药效的影响,是提高淫羊藿苷药效作用的有效策略之一[2, 3]。目前,淫羊藿苷体外转化的方法主要有化学法和生物酶解法。采用化学法转化淫羊藿苷虽然效率高,但副产物多、环境污染严重且产物分离工艺复杂。而采用生物酶解法转化淫羊藿黄酮在克服上述缺陷的同时具有专一、高效和环保的特点[4]。本课题组曾采用β-葡萄糖苷酶和蜗牛酶转化淫羊藿苷,获得的转化产物与体内代谢产物基本一致,但由于游离酶对环境敏感,易失活,难于重复使用而不适宜工业化生产。酶固定化是用固体载体材料将酶束缚或限制于一定区域内,能保持其特有的催化反应,并可回收重复利用的一类技术。固定化酶具有稳定性强、易与底物分离、可重复使用的优点[5]。本文分别制备了固定化的β-葡萄糖苷酶和蜗牛酶,用于转化淫羊藿苷,并分别比较了固定化酶与游离酶以及两种固定化酶转化淫羊藿苷性能的差异。
材料与方法 仪器与试药Agilent 1260高效液相色谱仪 (美国Agilent公司); UV-1800PC型紫外可见分光光度 计 (上海凤凰光学科仪有限公司); 酶标仪 (上海美谷分子仪器有限公司,Molecular Devices SpectraMax 190)。淫羊藿苷 (上海源叶生物科技有限公司,纯度>98%); 淫羊藿苷、宝藿苷Ⅰ对照品 (中国药品食品检定研究院,批号: 20110206、20120222); 蜗牛酶 (上海源叶生物科技有限公司); β-葡萄糖苷酶 (Sigma公司,酶活力2 U·mg−1); 异硫氰酸荧光素 (fluorescein isothiocyanate,FITC,北京索来宝生物科技有限公司); 海藻酸钠、BaCl2、戊二醛 (国药集团化学试剂有限公司); 甲醇、乙腈为色谱纯,水为高纯水,其余试剂均为分析纯。
酶活力的测定方法以淫羊藿苷为底物,在一定反应条件下反应1 h后,取反应液加入9倍体积的甲醇终止反应,涡旋离心后采用高效液相色谱法 (high performance liquid chromatography,HPLC) 测定。酶活力(U·mg−1) 定义为: 在一定条件下,1 mg酶每小时分解消耗淫羊藿苷的量[6, 7]。
相对酶活力 (%) = 酶活力/ 最高酶活力 × 100%,在一定反应条件下,最大的酶活力按100% 计算。
淫羊藿苷含量测定方法色谱条件Zorbax SB C18色谱柱 (150 mm × 4.6 mm,5 µm); 流动相: 乙腈−水系统,梯度洗脱程序为: 0~5 min,32% 乙腈; 5~7 min,32%~60% 乙腈; 7~12 min,60% 乙腈; 检测波长: 270 nm; 流量: 1.0 mL·min−1; 柱温: 30 ℃,进样量10 μL。
淫羊藿苷测定方法学考察精密量取淫羊藿苷对照品储备液适量,甲醇稀释成质量浓度为160.0、80.0、40.0、20.0和10.0 µg·mL−1的标准品溶液,按上述HPLC方法测定考察线性关系,另考察其精密度、重复性、稳定性及加样回收率。
固定化β-葡萄糖苷酶和固定化蜗牛酶的制备与工艺优化固定化β-葡萄糖苷酶和固定化蜗牛酶的制备 称取β-葡萄糖苷酶30 mg、蜗牛酶40 mg分别溶于 10 mL水中,加体积分数为0.1% 的戊二醛,混匀后固定20 min,再与1.5% 海藻酸钠溶液90 mL混合均匀。混合液 (滴加高度4 cm) 以2.0 mL·min−1流速滴入1.0%、100 r·min−1的BaCl2溶液中,静置固化10 min,蒸馏水洗涤,4 ℃冰箱中保存备用。
海藻酸钡球制备工艺的优化① 滴加高度: 取质量浓度1.5% 海藻酸钠溶液,分别从不同高度 (2、4、6、8和10 cm) 滴入质量浓度1.0% BaCl2溶液; ② BaCl2浓度: 滴加高度为4 cm,将1.5%海藻酸钠溶液滴入不同质量浓度 (0.1%、0.2%、0.4%、0.6%、0.8%、1.0%、1.5% 和2.0%) 的BaCl2溶液; ③ 海藻酸钠浓度: 滴加高度为4 cm,将不同质量浓度 (0.5%、1.0%、1.5% 和2.0%) 的海藻酸钠溶液分别滴入1.0% BaCl2溶液。以海藻酸钡球的圆整度为优化指标,其测定方法: 取样品20份,千分尺测定每份样品的最大直径与最小直径,海藻酸钡球的圆整度 (%) = 最小直径 / 最大直径 × 100%,取平均值。
固定化酶包封率和结合效率的测定分别配制1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0 mg·mL−1的β-葡萄糖苷酶和蜗牛酶溶液,制备固定化酶。蒸馏水洗涤固定化酶,洗涤液与滤液混合后用BCA法[8]测定吸收度值,计算包封酶的总量,考察酶包封率。固定化酶和游离酶均按酶与淫羊藿苷质量比1∶1 (固定化酶质量 = 所需游离酶的质量 / 固定化酶包封率,下同),酶解淫羊藿苷,反应1 h后均加入甲醇终止反应,HPLC测定,计算酶与海藻酸钡球的结合效率。
包封率 (%) = 包载的酶质量 / 游离酶的总质量 × 100%
酶结合效率 (%) = 固定化酶的总酶活 / 游离酶总酶活 × 100%
淫羊藿苷的转化率 (%) = (反应初始淫羊藿苷量 − 反应终止淫羊藿苷量) / 反应初始淫羊藿苷量 × 100%
固定化酶在海藻酸钡球中的分布在酶的磷酸盐溶液 (pH 7.43) 中加入过量异硫氰酸荧光素 (fluorescein isothiocyanate,FITC),室温避光搅拌12 h后流水透析24 h (3 kDa),测定透析介质吸光度,确保完全除去游离的FITC,冷冻干燥得FITC标记酶[9, 10]。取空白酶液、FITC溶液和FITC标记酶液各3 mL,测定吸光度,考察酶是否成功被FITC标记。将FITC标记酶进行固定,观察酶在海藻酸钡球中的分布情况。
固定化酶的酶学性质表征乙醇浓度对酶活力的影响 分别称取适量游离及固定化β-葡萄糖苷酶、蜗牛酶,在50 ℃条件下,于不同乙醇浓度 (0%、10%、20%、30%、40%、50%、60% 和70%) 的pH 5磷酸盐缓冲液中,底物质量浓度0.1 mg·mL−1,酶与底物质量比为1∶1,恒温酶解淫羊藿苷,反应1 h后取样,甲醇终止反应,HPLC测定。
酶反应的最适温度 在pH 5磷酸盐缓冲液中,分别于4 ℃、25 ℃、37 ℃、50 ℃、60 ℃和70 ℃不同温度条件下,其他条件不变,考察酶反应的最适温度。
酶反应的最适pH 在各个酶的最佳温度下,分别于不同pH (2、3、4、5、6、7和8) 条件下,其他条件不变,考察酶反应的最适pH。
固定化酶重复利用性测定 在固定化β-葡萄糖苷酶、固定化蜗牛酶的最佳反应条件下,酶解淫羊藿苷,反应24 h后取样,甲醇终止反应,HPLC测定。滤出固定化酶,蒸馏水充分洗涤,在相同条件下反应,取样测定,重复上述步骤,测定固定化酶的重复利用性。
固定化酶贮藏稳定性测定 固定化β-葡萄糖苷酶、固定化蜗牛酶置于4 ℃条件下保存,每周取样1次,分别测定其酶活,连续测定4周。
固定化酶热稳定性测定 游离及固定化β-葡萄糖苷酶、蜗牛酶置于不同温度 (50 ℃、60 ℃、70 ℃、80 ℃、90 ℃和100 ℃) 条件下放置1 h后,在各自的最佳反应条件下反应1 h,取样处理,HPLC测定。
固定化β-葡萄糖苷酶和固定化蜗牛酶转化淫羊藿苷效率的比较乙醇浓度、温度、pH对淫羊藿苷转化率的影响 在不同温度 (4 ℃、25 ℃、37 ℃、50 ℃、60 ℃和 70 ℃) 条件下,于不同乙醇浓度 (0%、10%、20%、30%、40%、50%、60% 和70%) 或不同pH (2、3、4、5、6、7和8) 的磷酸盐缓冲液中,淫羊藿苷质量浓度0.1 mg·mL−1,酶与淫羊藿苷质量比均为1∶1,固定化β-葡萄糖苷酶、固定化蜗牛酶酶解淫羊藿苷,反应1 h后取样,甲醇终止反应,HPLC测定。
酶与底物质量比对淫羊藿苷转化率的影响 固定化β-葡萄糖苷酶、固定化蜗牛酶与淫羊藿苷质量比分别为0.5∶1、1∶1、2∶1、3∶1、4∶1,其他均在最佳条件下,反应、取样及处理同上。
底物浓度对淫羊藿苷转化率的影响 淫羊藿苷质量浓度分别为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9和1.0 mg·mL−1,其他均在最佳条件下,反应、取样及处理同上。
反应时间对淫羊藿苷转化率的影响 在最佳反应条件下酶解淫羊藿苷,分别于不同时间点 (0.5、1、2、3、4、5、6、7、8、16和24 h) 取样,样品处理同上。
使用次数对淫羊藿苷转化率的影响 在最佳反应条件下酶解淫羊藿苷,固定化β-葡萄糖苷酶和固定化蜗牛酶分别于6和2 h取样,样品处理同上。滤出固定化酶,蒸馏水充分洗涤,在相同条件下反应,取样测定,重复上述步骤,考察使用次数对淫羊藿苷转化率的影响。
优化条件下淫羊藿苷转化工艺的验证取淫羊藿苷按最佳转化工艺酶解: 淫羊藿苷转化温度为50 ℃,pH为5,淫羊藿苷质量浓度0.1 mg·mL−1,酶与淫羊藿苷质量比1∶1,固定化β-葡萄糖苷酶和蜗牛酶的转化时间分别为6和2 h,均转化5次,HPLC测定。
转化产物的结构鉴定固定化β-葡萄糖苷酶和蜗牛酶转化淫羊藿苷的产物分别利用MS、1H NMR和13C NMR进行分析。
统计学分析数据均采用SPSS for windows 16.0软件包进行统计分析。t检验中,P < 0.05时认为有显著性差异。
结果 1 淫羊藿苷测定方法学考察以质量浓度 (x,µg·mL−1) 为横坐标,峰面积 (y) 为纵坐标,得淫羊藿苷回归方程: y = 11.891 x + 19.252,r = 0.999 4,线性范围为10.0~160.0 µg·mL−1,线性 关系良好。精密度实验、重复性实验和稳定性实验的RSD值分别为1.52% (n = 6)、1.38% (n = 6) 和1.02%,加样回收率实验结果在90%~105%,均符合实验方法学 要求 (图 1)。
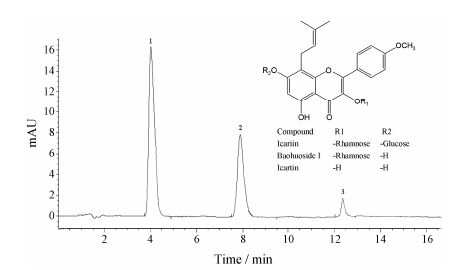
|
Figure 1 HPLC chromatogram of icariin,baohuoside I and icartin. Peak 1: Icariin; 2: Baohuoside I; 3: Icartin |
当BaCl2溶液质量浓度小于0.8% 时,初始海藻酸钠的成球性差; 当海藻酸钠溶液浓度小于1.0% 时,海藻酸钡球圆整度较差,仅为67.4%。海藻酸钠浓度1.5%,BaCl2溶液浓度1.0%,海藻酸钡球的滴加高度为4 cm,制得的海藻酸钡球圆整度最好,可达98.7%,直径约为2 mm。
2.2 固定化酶包封率和结合效率的测定β-葡萄糖苷酶的标准曲线为: y = 0.000 6 x + 0.118 2,r = 0.999 1; 蜗牛酶的标准曲线为: y = 0.000 8 x + 0.123,r = 0.999 2。由图 2可知,β-葡萄糖苷酶溶液终质量浓度介于0.1~0.3 mg·mL−1时,酶的包封率和结合效率逐渐增大; 介于0.4~1.0 mg·mL−1时其包封率和结合效率逐渐减小。在终质量浓度为0.3 mg·mL−1时包封率和结合效率最大,分别为69.78% 和57.02%。蜗牛酶溶液终质量浓度介于0.1~0.4 mg·mL−1时,酶的包封率和结合效率逐渐增大; 介于0.5~1.0 mg·mL−1时其包封率和结合效率逐渐减小。在终质量浓度为0.4 mg·mL−1时包封率和结合效率最大,分别为64.09%和54.48%。
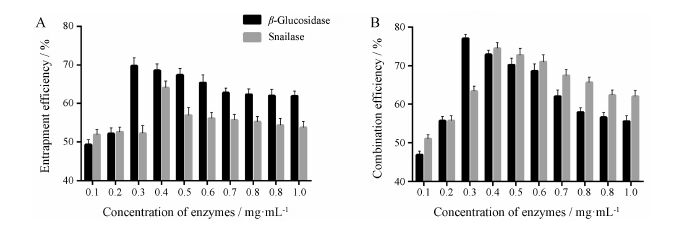
|
Figure 2 Entrapment efficiency(A) and combination efficiency (B) of enzyme. n = 3,x± s |
FITC标记的酶液同时具有空白酶液和FITC溶液的最大吸收 (图 3A),表明酶成功标记了FITC。在荧光显微镜下观察的固定化酶海藻酸钡球呈现均匀荧光 (图 3B),表明酶均匀地分散在整个海藻酸钡球中。
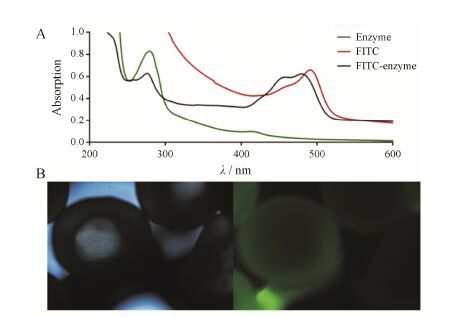
|
Figure 3 Distribution of immobilized enzyme in barium alginate. A: UV analysis of FITC,enzyme and enzyme labeled FITC; B: Immobilized enzyme in barium alginate under the fluorescence microscope under the white light (left) and fluorescence (right) |
随着乙醇浓度的增高,游离酶和固定化酶的相对酶活均逐渐降低。乙醇浓度大于40%时,酶的相对酶活均减少至10%以下;乙醇浓度在0%~40% 之间,固定化酶相对酶活的降低程度明显低于游离酶,乙醇浓度对游离酶相对酶活的影响明显大于固定化酶 (图 4A,B)。固定化酶在乙醇浓度小于10%的溶液中反应,可以保持酶的有效催化活性,保证淫羊藿苷的顺利转化。
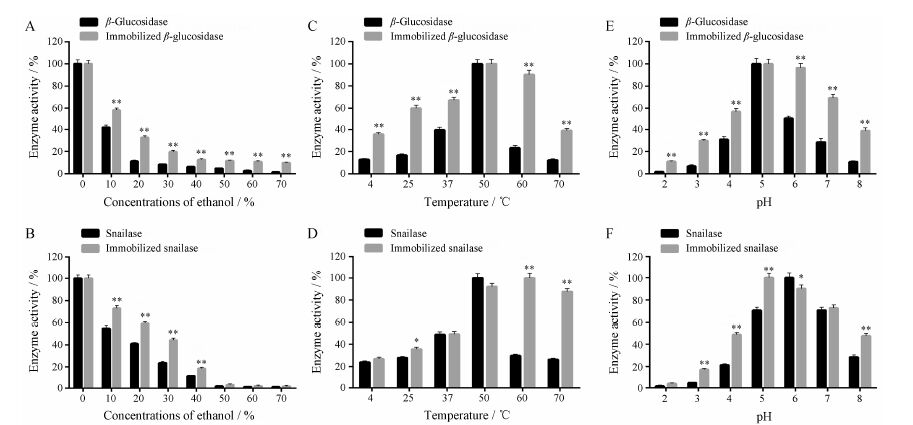
|
Figure 4 Effect of concentrations of ethanol,temperature and pH values on enzyme activity. A,C,E: β-glucosidase and immobilized β-glucosidase,P < 0.05,**P < 0.01 vs β-glucosidase; B,D,F: Snailase and immobilized snailase,P < 0.05,**P < 0.01 vs snailase; A,B: Different concentrations of ethanol; C,D: Different temperatures; E,F: Different pH values. n = 3,x± s |
游离和固定化的β-葡萄糖苷酶在50 ℃时相对酶活最高 (图 4C,D),游离蜗牛酶在50 ℃时相对酶活最高,固定化蜗牛酶在60 ℃时相对酶活最高。因此,游离和固定化的β-葡萄糖苷酶最适反应温度为50 ℃,游离蜗牛酶的最适反应温度为50 ℃,固定化蜗牛酶的最适反应温度为60 ℃。与游离酶相比,固定化酶在不同反应温度下相对酶活变化较小,固定化酶在高温条件下,相对酶活均高于游离酶,酶反应的适宜温度范围变大,更适合用于不同温度下的各种反应。
4.3 酶反应的最适pH游离和固定化的β-葡萄糖苷酶在pH 5时相对酶活最高 (图 4E,F),游离蜗牛酶在pH 6时相对酶活最高,固定化蜗牛酶在pH 5时相对酶活最高。因此,游离和固定化的β-葡萄糖苷酶最适反应pH为5,游离蜗牛酶最适反应pH为6,固定化蜗牛酶最适反应pH为5。与游离酶相比,固定化酶在不同反应pH下相对酶活变化较小,在极端pH条件下固定化酶的相对酶活高于游离酶,且具有显著性差异。
4.4 固定化酶的重复利用性固定化β-葡萄糖苷酶和固定化蜗牛酶首次使用酶活最高为100%,重复使用第2次酶活分别为83.34% 和86.99%、第3次酶活分别为70.51% 和74.26%、第4次酶活分别为54.47% 和61.03%,活力仍可保持在50% 以上,平均转化率分别为77.08% 和80.58%,体现了固定化酶能够循环使用、节约资源的优点,实现了工业化的绿色生产。
4.5 固定化酶的贮藏稳定性固定化β-葡萄糖苷酶和固定化蜗牛酶在4 ℃条件下,贮藏7天后酶活分别保留91.70% 和88.23%; 贮藏14天后酶活分别保留81.13% 和76.17%; 贮藏21天后酶活分别保留70.24% 和66.48%; 贮藏28天后酶活分别保留64.81% 和58.65%,仍可以用于转化生产使用。
4.6 固定化酶的热稳定性在不同的温度条件下,游离及固定化β-葡萄糖苷酶、蜗牛酶的酶活均随温度的增加而减小。但与游离β-葡萄糖苷酶和蜗牛酶相 比,固定化β-葡萄糖苷酶和蜗牛酶的热稳定性均有所提高,β-葡萄糖苷酶和固定化β-葡萄糖苷酶的酶活在60 ℃、70 ℃和80 ℃时分别保留85.26% 和92.15%、53.52% 和74.30%、11.13% 和24.80%; 蜗牛酶和固定化蜗牛酶的酶活在60 ℃、70 ℃和80 ℃时分别保留76.64% 和90.57%、48.71% 和76.35%、17.39% 和 35.11%。在60 ℃、70 ℃和80 ℃条件下,游离β-葡萄糖苷酶、蜗牛酶与固定化β-葡萄糖苷酶、蜗牛酶的酶活具有显著性差异 ( P < 0.05)。
5 固定化β-葡萄糖苷酶和固定化蜗牛酶转化淫羊藿苷效率的比较 5.1 乙醇浓度、温度、pH对淫羊藿苷转化率的影响固定化β-葡萄糖苷酶和蜗牛酶对淫羊藿苷的转化率 均随乙醇浓度的增加而降低 (图 5A)。当乙醇浓度为10%时,固定化β-葡萄糖苷酶对淫羊藿苷的转化率约降低一半; 乙醇浓度为20% 时,固定化蜗牛酶对淫羊藿苷的转化率约降低一半,固定化蜗牛酶对乙醇的耐受性强于固定化β-葡萄糖苷酶。当温度为50 ℃ 时固定化β-葡萄糖苷酶对淫羊藿苷的转化率最大为24.61%; 60 ℃时固定化蜗牛酶对淫羊藿苷的转化率最大为68.09% (图 5B)。但在实验过程中,固定化蜗牛酶在60 ℃下转化淫羊藿苷时,结构变松、体积膨胀,不利于重复使用,所以选择固定化蜗牛酶转化淫羊藿苷的温度为50 ℃,转化率为63.86%。在pH 5磷酸缓冲盐溶液中,固定化β-葡萄糖苷酶和固定化蜗牛酶对淫羊藿苷的转化率均达到最大,分别为24.40% 和63.01%(图 5C)。在乙醇浓度、温度和pH对淫羊藿苷转化率影响的考察中,固定化蜗牛酶对淫羊藿苷的转化率均约为固定化β-葡萄糖苷酶的3倍。
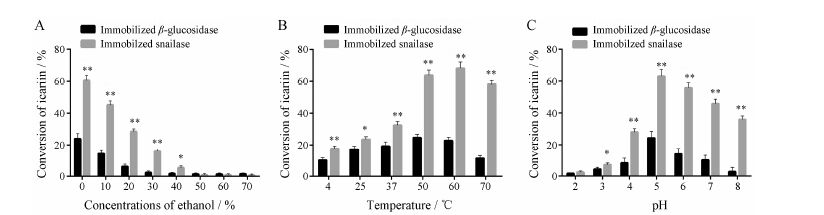
|
Figure 5 Effect of different concentrations of ethanol,temperature and pH values on conversion of icariin. A: Effect of different concentrations of ethanol; B: Effect of temperature; C: Effect of pH values. n = 3,x± s. P < 0.05,**P < 0.01 vs immobilized β-glucosidase |
固定化β-葡萄糖苷酶和固定化蜗牛酶在酶与底物质量比为1∶1时对淫羊藿苷的转化率最大,分别为26.9% 和68.75% (图 6A)。固定化蜗牛酶对淫羊藿苷的转化率约为固定化β-葡萄糖苷酶的3倍。在不同的酶与底物质量比条件下,固定化蜗牛酶对淫羊藿苷的转化率均高于固定化β-葡萄糖苷酶,且具有显著性差异。
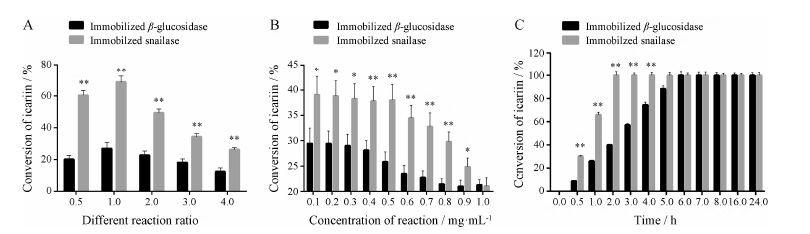
|
Figure 6 Effect of different reaction ratio,concentrations of reaction and reaction time on conversion of icariin. A: Effect of different reaction ratio; B: Effect of concentrations of reaction; C: Effect of reaction time. n = 3,x± s. P < 0.05,**P < 0.01 vs immobilized β-glucosidase |
随着淫 羊藿苷浓度的增大,固定化β-葡萄糖苷酶和蜗牛酶对淫羊藿苷的转化率均减小 (图 6B)。在不同浓度条件下,固定化蜗牛酶对淫羊藿苷的转化率高于固定化β-葡萄糖苷酶。当淫羊藿苷质量浓度介于0.1~0.3 mg·mL−1时,两种固定化酶对淫羊藿苷的转化率均较大,由于淫羊藿苷在水中的溶解性较低,在低浓度时与酶充分接触的淫羊藿苷相对更多,转化速率更快,因此实验选择反应的淫羊藿苷质量浓度为0.1 mg·mL−1。
5.4 反应时间对淫羊藿苷转化率的影响在最佳反应条件下,固定化β-葡萄糖苷酶与淫羊藿苷反应0.5、1、2、3、4和5 h后,对淫羊藿苷的转化率分别为8.83%、26.12%、40.17%、57.21%、74.65% 和88.43%,反应6 h后淫羊藿苷酶解完全 (图 6C); 固定化蜗牛酶与淫羊藿苷反应,在0.5和1 h后对淫羊藿苷的转化率分别为30.32% 和66.18%,反应2 h后淫羊藿苷酶解完全。在反应过程中,固定化蜗牛酶转化淫羊藿苷的速率约为固定化β-葡萄糖苷酶的3倍。
5.5 使用次数对淫羊藿苷转化率的影响固定化β-葡萄糖苷酶重复5次转化淫羊藿苷的转化率分别为100%、85.27%、73.46%、56.74% 和38.35%,固定化蜗牛酶重复5次转化淫羊藿苷的转化率分别为100%、84.17%、76.33%、63.28% 和51.09%。经过多次使用后固定化酶的形态发生改变、体积变大,影响对淫羊藿苷的转化率。在重复使用5次过程中,固定化β-葡萄糖苷酶对淫羊藿苷的平均转化率为70.76%,固定化蜗牛酶对淫羊藿苷的平均转化率为74.97%。
6 优化条件下淫羊藿苷转化工艺的验证两种固定化酶各转化淫羊藿苷5次,样品经HPLC测定,固定化β-葡萄糖苷酶转化淫羊藿苷的平均转化率分别为 (70.63 ± 0.15) %、(70.70 ± 0.18) % 和 (70.79 ± 0.23) %,固定化蜗牛酶转化淫羊藿苷的平均转化率分别为 (74.88 ± 0.17) %、(74.90 ± 0.13) % 和 (74.83 ± 0.19) %,说明固定化β-葡萄糖苷酶和固定化蜗牛酶转化淫羊藿苷的工艺稳定,重复性好。
7 转化产物的结构鉴定固定化β-葡萄糖苷酶转化淫羊藿苷的产物经过MS、1H NMR和13C NMR分析,结果与文献[11]报道一致,确定淫羊藿苷的转化产物为宝藿苷І; 固定化蜗牛酶转化淫羊藿苷的产物利用MS、1H NMR和13C NMR分析,也与文献[12]结果一致,确定淫羊藿苷的转化产物为宝藿苷І和苷元。
讨论本实验采用交联−包埋法制备固定化β-葡萄糖苷酶和蜗牛酶,联合运用了化学和物理两种固定化方法,避免了单一固定化方法的缺点,既保持了高效的酶活力,又可使酶与载体牢固结合。β-葡萄糖苷酶和蜗牛酶经固定化后,具有可重复利用的特性,同时其热稳定性、贮藏稳定性增强,酶活受环境的影响减小,对环境条件要求较游离酶低,适于大规模生产使用。固定化酶酶解淫羊藿苷的转化率受外界条件影响较小,因为酶固定化后结构确定,酶的结合位点处于充分暴露的稳定状态,更容易与底物结合反应[13],同时载体材料对酶也具有隔离保护作用,固定化酶性质更加稳定[14]。
反应底物淫羊藿苷在水中溶解性差,在反应体系中加入能与水互溶的乙醇,可以提高其溶解度,加快反应进行。然而,乙醇等有机溶剂影响酶的催化活性,所以本实验首次考察了β-葡萄糖苷酶和蜗牛酶对乙醇的耐受性,结果表明固定化酶对乙醇的耐受性强于游离酶。与游离酶相比,在较高的乙醇浓度下,固定化酶仍可有效地转化淫羊藿苷,对反应介质的要求降低,使酶转化在中药领域中的应用更加广泛。
中药种类繁多,除淫羊藿苷外,很多有效成分都存在水溶性差的问题,固定化酶在乙醇溶液中转化反应的研究,为上述类型中药的研究开辟了新途径,应用前景广阔。反应中为了提高酶对乙醇等有机溶剂的耐受性,可以将酶修饰或利用固定化载体材料的保护作用[15, 16]。本实验利用海藻酸盐作为载体材料将酶 固定化后,其乙醇耐受性增强[17]。
本实验同时利用固定化β-葡萄糖苷酶和固定化蜗牛酶转化淫羊藿苷,比较二者转化淫羊藿苷的异同。经过比较,固定化蜗牛酶转化淫羊藿苷的速率约为固定化β-葡萄糖苷酶的3倍,转化效率较高,更适于淫羊藿苷大规模的生物转化。同时,二者均具有较高的pH耐受性和热稳定性,受酶反应环境的影响较小,延长酶的使用寿命。制得的两种固定化酶易与底物分离,且分离工艺简单,使酶反应在中药转化方面得以广泛的应用。
| [1] | Liu TH, Wang Y, Wang BX, et al. Studies on the metabo-lism of icariin by intestinal bacteria part Ⅰ:the transformation of icariin by intestinal flora[J]. Chin Tradit Herb Drugs(中草药), 2000, 31:834-837. |
| [2] | Gao X, Chen Y, Wang Y, et al. Study on different factors affecting the bionic enzymatic hydrolysis of icariin[J]. Acta Pharm Sin(药学学报), 2013, 48:1716-1721. |
| [3] | Yang QX, Liu YQ, Wang L, et al. Screening of bioactive components in epimedium for osteoporosis treatment by model population analysis[J]. Acta Pharm Sin(药学学报), 2012, 47:1205-1209. |
| [4] | Yang YS, Cheng T, Yang J, et al. Preparation of baicalin using radix scutellariae hydrolysised by immobilized enzyme in duplex system[J]. China J Chin Mater Med(中国中药杂志), 2014, 39:669-673. |
| [5] | Yang J, Zhang YB, Wu WT. New progress of immobilized enzyme technology and application in medicine[J]. Pharm Biotechnol(药物生物技术), 2013, 6:022. |
| [6] | Li YL, Chen LZ, Tao YN. Immobilized tea saponin decoloring enzyme by chitosan and study of properties[J]. J Zhejiang Agric Sci(浙江农业科学), 2014, 1:380-389. |
| [7] | Zhang B, Sun Q, Ren YP, et al. Study of immobilized β-glucuronic acid glycosides enzyme by alginate[J]. J Chin Food Addit(中国食品添加剂), 2011,(1):110-115. |
| [8] | Zhou ZJ, Li CS, Li TJ, et al. Optimization and verification of BCA method for determination of protein content in human coagulation factor Ⅷ[J]. Chin J Biol(中国生物制品学杂志), 2013, 26:1488-1492. |
| [9] | Zhang C, Song XJ, Wang J, et al. Stability and fluorescence spectra of lipase labeled with FITC[J]. Chin J Appl Chem(中国应用化学), 2009, 25:1381-1384. |
| [10] | Fang Z, Ju W, Qin YN, et al. Preparation and evaluation of FITC labeled Escherichia coli O157:H7 polyclonal anti-body[J]. J Jilin Univ Med(吉林大学学报 医学版), 2013, 39:165-169. |
| [11] | Zhang ZH, Chen LL, Jia XB, et al. Preparation technology of baohuoside Ⅰ by enzymolysis of icariin with β-glucosidase[J]. China Pharm(中国药房), 2011, 22:4059-4061. |
| [12] | Jia DS, Jia XB, Xue J, et al. Study on preparation of icari-tin by enzymolysis of icariin with snail hydrolase[J]. China J Chin Mater Med(中国中药杂志), 2010, 35:857-860. |
| [13] | Miletić N, Nastasović A, Loos K. Immobilization of biocatalysts for enzymatic polymerizations:possibilities, advantages, applications[J]. Bioresource Technol, 2012, 115:126-135. |
| [14] | Rodrigues RC, Ortiz C, Berenguer-Murcia Á, et al. Modifying enzyme activity and selectivity by immobilization[J]. Chem Soc Rev, 2013, 42:6290-6307. |
| [15] | Datta S, Christena LR, Rajaram YRS. Enzyme immobiliza-tion:an overview on techniques and support materials[J]. Biotechnology, 2013, 3:1-9. |
| [16] | Rodrigues RC, Berenguer-Murcia Á, Fernandez-Lafuente R. Coupling chemical modification and immobilization to im-prove the catalytic performance of enzymes[J]. Adv Synth Catal, 2011, 353:2216-2238. |
| [17] | Garcia-Galan C, Berenguer-Murcia Á, Fernandez-Lafuente R, et al. Potential of different enzyme immobilization strategies to improve enzyme performance[J]. Adv Synth Catal, 2011, 353:2885-2904. |
 2015, Vol. 50
2015, Vol. 50


