呋布西林钠又称呋脲苄青霉素钠 (图 1)。1969年由美国Bristol & Mayer公司报道[1, 2],1971年由上海医药工业研究院、上海第四制药厂和太原制药厂进行研发,1976年起国内首先应用于临床[3],是目前仅在中国上市使用的半合成广谱抗生素。呋布西林钠对多种革兰阳性菌及革兰阴性菌均有良好抗菌活性[3, 4, 5, 6],与大肠杆菌、绿脓杆菌的青霉素结合蛋白 (PBPs) 呈多位点结合,且结合作用较强; 对大肠杆菌的PBP-2和PBP-3有高度亲和力,对PBP-1a和PBP-1b也有较强的亲和力[6]; 呋布西林钠对绿脓杆菌PBP-1a、PBP-2、PBP-3的亲和力优于哌拉西林,对PBP-2、PBP-3的亲和力明显强于头孢哌酮[7]。其对绿脓杆菌的外膜穿透力强,对绿脓杆菌的抗菌作用比羧苄西林强8~16倍[2, 3, 4, 5, 6],是最具有应用价值的抗绿脓杆菌的酰脲类抗生素,与β-内酰胺酶抑制剂配伍还具有良好的药物动力学性能[8]。临床上主要用于败血症、创面感染、呼吸道、泌尿道感染及脑膜炎等疾病[3, 4, 5]。
由于合成工艺相对复杂等因素,对呋布西林钠的深入研发一直处于相对停滞状态,目前,仅卫生部药品标准抗生素药品 (第一册) 1989年版中收载有呋脲苄青霉素钠 (WS1-C2-0021-89)[9]和注射用呋脲苄青霉素钠 (WS1-C2-0022-89)[10]标准,采用容量法测定含量,且未对有关物质进行控制。呋布西林钠原料按生产工艺可以分为溶媒法和非溶媒法两类[1, 11, 12, 13]。已有采用HPLC分析呋布西林钠含量和有关物质的报道[14, 15, 16, 17],并发现不同厂家/批号原料中有关物质差异很大[15, 16, 17],推测产品中可能存在较大量的呋布西林钠的同分异构体[18, 19],其在原料中所占比例与该原料的生物活性成反比[17],但未见对其结构和生物活性的详细报道。为促进呋布西林钠的工艺改进,本研究在以往文献的基础上,首先建立了呋布西林钠有关物质分析的HPLC方法,再制备其主要杂质,探讨其结构、色谱行为和生物活性特性。
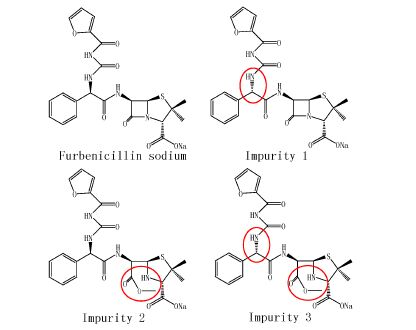
|
Figure 1 Structures of the furbenicillin sodium and its impurities |
Waters高效液相色谱仪 (包括Waters 2690 Separations Module、Waters 996 Photodiode Array Detector和Millennium 32 Software)。戴安高效液相色谱仪 (包括a P680 HPLC pump,ASI-100 autosampler,PDA-100 diode-array detector,Dionex)。Q-Trap 3200质谱仪。Varian INOVA NMR spectrometer核磁共振仪。JASCO-815 CD spectrometer圆二光谱仪。Laborota 4000旋转蒸发仪。色谱柱: ACCHRM XUnion C18,Waters Atlantis T3,Dikma Diamonsil,CAPCELL PAK C18 MGⅡ (均为4.6 mm × 250 mm,5 μm); 依利特YWG C18,4.6 mm × 200 mm,10 μm。
甲醇、乙腈均为色谱纯,美国Fisher公司; 1-氟-2,4-二硝基苯基-5-L-丙氨酰胺(1-fluoro-2-4-dinitrophenyl- 5-L-alanine amide,FDAA)、磷酸二氢钾、磷酸、氢氧化钠、盐酸、醋酸、碳酸氢钠均为分析纯,北京化学试剂公司; MIC值测定法所用菌株均由国家食品药品监督管理局耐药性监测中心提供; MH固体培养基 (美国BD公司)。样品1: 呋布西林钠 (批号: 20120301,furbenicillin sodium,溶媒法)、样品2: 呋布西林钠 (批号: 20110502,furbenicillin sodium,非溶媒法),样品1和2均由山西朗致集团博康药业有限公司提供。样品3: 呋布西林钠 (批号: 120201,furbenicillin sodium,非溶媒法) 由苏州二叶制药有限公司提供。
呋布西林钠杂质的制备采用HPLC分离制备杂质。色谱柱为Grace Prevail C18,5 µm,10 mm × 250 mm; 流动相为0.01 mol·L-1磷酸二氢钾 (磷酸调pH 3.2)-甲醇 (48∶52),等度洗脱; 流速: 2 mL·min-1; 检测波长: 254 nm; 进样体积: 25 µL。按各组分的保留时间分段收集流出液,30 ℃旋转蒸发除去有机溶剂后,冻干即可。杂 质1: 采用非溶媒法原料,用水溶解制成10 mg·mL-1的溶液,用于分离制备杂质1; 杂质2: 采用溶媒法原料,用甲醇溶解制成50 mg·mL-1的溶液,室温放置7天后用于分离制备杂质2; 杂质3: 采用非溶媒法原料,用甲醇溶解制成50 mg·mL-1的溶液,室温放置14天后用于分离制备杂质3。
色谱方法用十八烷基硅烷键合硅胶为填充剂; 流动相A为甲醇-乙腈-0.1 mol·L-1磷酸二氢钾溶液 (用磷酸调至pH3.0) (130∶170∶700),流动相B为甲醇-乙腈-0.05 mol·L-1磷酸二氢钾溶液 (用磷酸调至pH3.0) (260∶340∶400),按比例梯度洗脱0~20 min,100% A; 20~60 min,100%~10% A; 应通过改变流动相B中有机相的比例使得呋布西林主峰保留时间在30~35 min之间; 流速: 1.0 mL·min-1; 柱温: 35 ℃; 检测波长: 225 nm; 供试品浓度: 4 mg·mL-1; 进样量: 20 µL。
酸降解取呋布西林钠各样品适量,分别加水溶解并稀释制成约4 mg·mL-1的溶液; 取10 mL,加0.01 mol·L-1盐酸溶液1 mL,室温放置6 h后,加0.01 mol·L-1氢氧化钠溶液1 mL,摇匀,作为酸降解溶液; 取10 mL,加0.1 mol·L-1醋酸溶液0.5 mL,室温放置12 h,作为弱酸降解溶液; 分别测定。
碱降解取呋布西林钠各样品适量,分别加水溶解并稀释制成约4 mg·mL-1的溶液; 取10 mL,加0.01 mol·L-1氢氧化钠溶液1 mL,室温放置30 min后,加0.01 mol·L-1盐酸溶液1 mL,摇匀,作为碱降解溶液; 取10 mL,加0.1 mol·L-1碳酸氢钠溶液0.5 mL,室温放置12 h,作为弱碱降解溶液; 分别测定。
水解取呋布西林钠各样品适量,分别加水溶解并稀释制成约4 mg·mL-1的溶液,取10 mL,100 ℃水浴放置1 h,测定。
甲醇降解取呋布西林钠各样品适量,分别加甲醇溶解并稀释制成每1 mL中约含4 mg的溶液,室温放置24 h,测定。
线性关系取呋布西林钠样品适量,分别制成13个不同浓度(1~200 μg·mL-1) 的样品溶液,相当于供试品溶液浓度 (4 mg·mL-1) 的0.025%~5.0%。
精密度取呋布西林钠样品适量,加水溶解并稀释制成40 μg·mL-1的溶液 (相当于供试品溶液浓度的1.0%); 日内精密度,重复测定6次; 日间精密度,连续测定3天,每天重复进样6次; 计算呋布西林峰面积的RSD。
稳定性取呋布西林钠各样品适量,加水溶解并分别稀释制成0.4和4 mg·mL-1溶液; 4 ℃条件下分别重复进样测定24 h; 前者计算呋布西林峰面积,后者计算杂质峰面积的RSD。
耐用性分别考察色谱柱、流速 (± 0.2 mL·min-1)、柱温 (± 5 ℃)、流动相比例 (± 5%)、流动相pH值 (± 0.2) 等参数对HPLC系统耐用性的影响。考察相对保留时间 (RRT) 指标: ① 约为0.36和0. 41杂质峰的分离度; ② 约为0.41和0.43杂质峰的分离度; ③ 约为0.86杂质峰和主峰的分离度; ④ 主峰与RRT约为1.05杂质峰的分离度; ⑤ 主峰与RRT约为1.35杂质峰的分离度; ⑥ 约为1.31和1.35杂质峰的分离度。
MIC测定取各菌株的过夜培养物,用无菌生理盐水配制1个麦氏浊度的菌悬液,再用无菌生理盐水1∶100稀释后,参照CLSI琼脂稀释法[20],制成分别含不同浓度呋布西林钠和杂质的混合培养液,在 (35 ± 1) ℃培养22~24 h,读取结果。
结果 1 HPLC方法建立溶媒样品和非溶媒样品中的杂质谱不同。不同生产工艺、不同厂家生产的呋布西林钠HPLC典型色谱图见图 2。
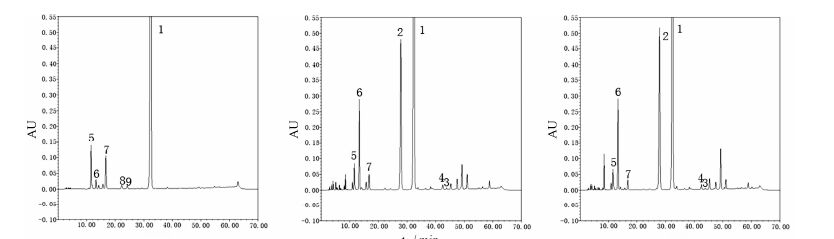
|
Figure 2 HPLC chromatogram of different furbenicillin sodium productions. RRT: Relative retention time. 1: Furbenicillin sodium; 2-4: Impurity 1-3; 5: Impurity of RRT 0.36; 6: Impurity of RRT 0.41; 7: Impurity of RRT 0.52; 8: Impurity of RRT 0.69; 9: Impurity of RRT 0.75 |
溶媒法样品和非溶媒法样本的各降解产物峰均不干扰对呋布西林色谱峰的测定,且诸降解物色谱峰之间也可以实现较好的相互分离,说明方法的专属性良好。
2.2 最低检测限和定量限以S/N= 3,得最低检测限为4.8 ng(0.24 μg·mL-1); 以S/N=10,得最低定量限为15.4 ng (0.77 μg·mL-1)。
2.3 线性关系对呋布西林峰面积 (y) 和进样浓 度 (x) 进行线性回归分析,溶媒法回归方程: y = 1 877158 627 x - 2 764.622 8,r2 = 0.999 5; 非溶媒法回归方程: y = 1 841 184 208 x - 1 816.799 3,r2 = 0.999 6。经统计分析,两回归方程的斜率和截距间均无显著性差异 (t斜率 = 1.810 < tα,v = 2.074,t截距 = 0.000 < tα,v = 2.069),即两者为同一回归方程: y =1 867 895 240 x - 1 328.509 8。
结果显示,呋布西林钠在0.02~4 μg内,进样量与峰面积呈良好的线性关系。
2.4 精密度呋布西林峰面积的日内RSD = 0.27% (n = 6); 日间RSD = 0.33% (n = 18)。
2.5 溶液稳定性在室温下48 h内,呋布西林峰面积呈降解趋势; 经统计分析,峰面积随时间变化的相关系数 (r) 为 -0.829,回归方程: y = -166.11 x + 23 593 609,r2 = 0.686 82; 进一步分析,37 h内峰面积的回归检验Sig. = 0.133 > 0.05,即主峰面积不随时间变化; 提示呋布西林在溶液中室温放置37 h稳定。
RRT约为0.36、0.41和0.52处的杂质为溶媒法和非溶媒法产品的共有杂质,进一步分析这3个杂质在溶液中的稳定性。在室温和4 ℃条件下,各连续进样24 h,分别记录在呋布西林峰RRT约为0.36、0.41和0.52处3个有关物质的峰面积。无论在室温或4 ℃的条件下,RRT约为0.36和0.41的两个杂质的峰面积均有明显增加的趋势; 而RRT约为0.52的杂质峰面积呈明显减少趋势。详见图 3。提示杂质分析时供试品溶液应立即使用。
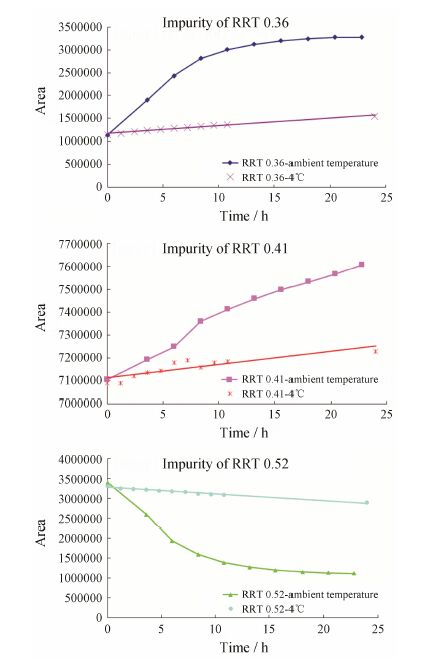
|
Figure 3 Solution stability of furbenicillin sodium at different temperatures |
不同类型的色谱柱、柱温、流动相pH值等的变化对杂质的分离均存在影响,最主要的影响因素为柱温和流动相pH值,当柱温升高或流动相pH值波动范围超过 ± 0.2时,难分离物质对的分离度明显下降,且无法满足分离要求 (分离度不得小于1.0),故实验过程中应保证各参数稳定可控。
3 呋布西林钠杂质分析分离制备的呋布西林杂质1、2、3 (图 1) 经HPLC测定,其纯度分别为92.1%、95.7% 和91.6%。经结构解析,杂质1、2、3分别为呋布西林钠同分异构体[21]、呋布西林钠的开环物和呋布西林钠同分异构体的开环物 (未发表资料)。
4 杂质活性测定测定呋布西林钠 (纯度90.57%) 和各杂质对 27株金葡菌、26株绿脓杆菌和23株大肠埃希菌的MIC值 (表 1)。可见,杂质1、2、3的MIC值均明显大于呋布西林,提示诸杂质的活性均远低于呋布西林。
|
|
Table 1 MIC results of furbenicillin sodium and its impurities |
本文建立的HPLC方法可有效分离呋布西林钠中的诸杂质,并通过对诸杂质纯品的MIC值测定可知,诸杂质生物活性均明显低于呋布西林,在质量标准中应作为非活性物质加以控制。
采用建立的HPLC方法对不同工艺生产的呋布西林钠样品进行分析可知,不同工艺生产的呋布西林钠样品的杂质总量明显不同,主要差别为产品中的呋布西林钠同分异构体 (杂质1) 和降解物杂质明显不同。溶媒法样品中杂质总量约为10%,主要杂质为RRT约为0.36和0.52的两个杂质 (含量分别约为5% 和4%),但不含有杂质1; 非溶媒法样品中杂质总量约为40%,主要杂质为杂质1和RRT约为0.41的杂质 (含量分别约为15% 和5%),其他明显杂质包括呋布西林钠的开环物 (杂质2)、呋布西林钠同分异构体的开环物 (杂质3) 和RRT约为0.24、0.36、0.52、1.41、1.47、1.53的杂质。另由强制降解实验可知,呋布西林钠和其同分异构体 (杂质1) 的主要降解产物各有不同,呋布西林钠的主要降解杂质包括杂质2和RRT约为0.36、0.52、0.69、0.75的杂质; 呋布西林钠同分异构体 (杂质1) 的主要降解杂质包括杂质3和RRT约为0.33、0.41的杂质。上述结果可为呋布西林钠的工艺改进提供有益的指导。
| [1] | Guo JH, Li ZW, Zhou GP. Study on synthesis technology of furbenicillin sodium[J]. J Taiyuan Univ Technol(太原理工大学学报), 2013, 44:298-301. |
| [2] | Bodey GD, Stewart D. In vitro studies of semisyntheic alpha(substituted-ureido) penicillins[J]. Appl Microbiol, 1971, 21:710. |
| [3] | Zhang MF, Gu YM, Zhang JD, et al. The laboratory studies of furbenicililin[J]. Chin J Antibiot(中国抗生素杂志), 1985, 10:85-91. |
| [4] | Xu XJ, Li JT. Pharmacokinetics and drug distribution of furbenicillin[J]. J Beijing Med Univ(北京医科大学学报), 1992, 24:215-217. |
| [5] | Li JT. Research and Development of Furabencillin(呋苄青 霉素的研究与开发)[M]. Beijing:Peking Union Medical College Press, 1994:15-21. |
| [6] | Guan LN, Li JT. Affinity of penicillin-binding proteins of pseu-domonas aeruginosa K799/WT for furbenicillin and other antipseudomonal antibiotics[J]. J Beijing Med Univ(北京医科大学学报), 1989, 21:357-360. |
| [7] | Lei Y, Li JT. Affinity of penicillin-binding proteins of Escherichia coli K12 for furbenicillin and other antipseudo-monal antibiotics[J]. Acta Pharmacol Sin(中国药理学报), 1989, 10:177-180. |
| [8] | Li JT. The effects of beta-lactamase inhibitors on character-ised beta-lactamase extracts and enzyme producing organisms[J]. J Bejing Med Coll(北京医学院学报), 1982, 14:195-200, 309-310. |
| [9] | WS1-C2-0021-89, Ministry of Health Drug Criteria Antibiotics(卫生部药品标准·抗生素药品 第一册)[S]. |
| [10] | WS1-C2-0022-89, Ministry of Health Drug Criteria Antibiotics(卫生部药品标准·抗生素药品 第一册)[S]. |
| [11] | Chu B, He YM, Chen WH, et al. Furbenicillin[J]. Chin J Antibiot(中国抗生素杂志), 1980, 5:55-56. |
| [12] | Li ZH, Yang F. New process for the synthesis of furbenicillin sodium[J]. J Taiyuan Univ Technol(太原理工大学学报), 2004, 35:575-576. |
| [13] | Ma YZ, Liu YX, Zhou YP, et al. Improved synthesis of furbenicillin sodium[J]. Chin J Med Chem(中国药物化学杂志), 2006, 16:51-53. |
| [14] | Wei MJ, Li JT, Dong SN. HPLC determination of furbenicillin and its metabolites in biological samples[J]. Chin J Pharm Anal(药物分析杂志), 2001, 21:225-227. |
| [15] | Pan Y, Xiang JZ, Liu H, et al. Determination of furbenicillin sodium and its related substances by HPLC[J]. Chin J Antibiot(中国抗生素杂志), 2006, 31:753-754, 767. |
| [16] | Zhang J, Wang JL, Jiang JG. Determination of furbenicillin sodium and related substances by HPLC[J]. 2008, 17:29-30. |
| [17] | Zhang J, Jiang JG, Gao YX. Determination of furbenicillin sodium related substances and in vitro antibacterial activity comparison[J]. China Pharm(药物鉴定), 2010, 19:34-35. |
| [18] | Zhang J, Jiang JG, Gao YX. HPLC-electrospray ionization-mass spectrum analysis of furbenicillin sodium and its related substances[J]. China Pharm(中国药业), 2009, 18:16-17. |
| [19] | Rong KW, Yu P, Wang DY. Inference of major impurity in furbenicillin sodium for injection[J]. Chin J Pharm(中国医药工业杂志), 2010, 41:373-374, 391. |
| [20] | Clinical and Laboratory Standards Institute. Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically[M]. 8th ed. Wayne:Clinical and Laboratory Standards Institute, 2009:M07-A7. |
| [21] | Tian Y, Chang Y, Feng YC, et al. Isolation, identification and characterization of related substances in furbenicillin[J]. J Antibiot, 2015, 68:133-136. |
 2015, Vol. 50
2015, Vol. 50


