2. 甘肃省肿瘤医院, 甘肃兰州 730050;
3. 甘肃省中医药防治慢性疾病重点实验室甘肃兰州 730000
2. Tumor Hospital of Gansu Province, Lanzhou 730050, China;
3. Key Lab of Prevention and Treatment for Chronic Disease by Traditional Chinese Medicine of Gansu Province, Lanzhou 730000, China
目前,就世界范围而言,无论肝癌的高发地区还是低发地区,在尸检中肝癌发病率均呈上升趋势,且其死亡率接近发病率[1]。我国更是全球肝癌的“重灾区”。由于该病起病隐匿、进展迅速,很多患者确诊时已属晚期,其中合并恶性腹水的比例更是高达80% 以上,严重影响患者的生活质量,且平均生存期也仅约20周[2]。传统的手术、射频消融 (RFA)、肝动脉灌注化疗栓塞 (TACE)、经皮无水乙醇注射 (PEI) 等治疗方法均受到极大的限制,腹腔穿刺放液、腹腔内热灌注化疗、腹腔内放射性核素治疗等虽然可有效缓解恶性腹水患者的临床症状,但均为有创性治疗,且常伴随轻重不等的不良反应。近几十年来,随着人们对肝癌认识的逐步深入,放疗被越来越多地应用于各期肝癌的临床治疗中,已有研究发现采用无创的Co60全腹腔移动条野照射技术可明显提高各类化疗疗效不佳的原发性恶性肿瘤及腹腔转移癌所引起的腹水[3]。新兴发展起来的重离子束因具有物理学和生物学效应两方面的优点,提供了比传统射线更为优越的条件。碳离子作为重离子的一种,更是被考虑可作为因各种情况不能耐受手术或者拒绝手术的肝癌患者的最佳手术代替手段[4]。但碳离子放疗在一定程度上仍然会损伤机体的细胞免疫功能,导致照射剂量受限及肿瘤复发[5]。黄芪作为我国传统的“扶正中药”,具有良好的抗肿瘤作用,且对辐射后机体的免疫系统有很好的保护作用[6, 7]。本研究主要探讨黄芪超滤物 (UEMAM) 对增强H22腹水瘤小鼠的辐射敏感性及可能的作用机制。
材料与方法 黄芪超滤物称取500 g采自甘肃岷县的黄芪 (经甘肃中医药大学药学院生药学教室鉴定为豆科植物蒙古黄芪的根),加8 L水浸泡2 h后,用1 000 W的电磁炉大火煎煮半小时后改为中火煎煮1 h,将药液倒出并收集。在剩余的药渣中再加入8 L水,采用同样的方法,收集第二遍的药液。将2遍收集的药液混合在一起,用8层无菌纱布过滤,再将过滤液倒入电磁炉中,小火加热蒸发滤液,直至滤液浓缩为6 L,将浓缩后的滤液冷却至室温后装入容器内,随即送往甘肃省膜科学技术研究所进行膜分离处理。在30 ℃、0.35 MPa、进料流速为0.467 L/S的条件下,采用孔径为0.2 μm的陶瓷膜微滤黄芪煎剂浓缩液,在同样的技术参数条件下采用截留分子量为200 kDa和10 kDa的聚丙烯腈中空纤维超滤膜超滤微处理黄芪煎剂浓缩液。继续浓缩超滤液,直至每毫升的药液含生药量为1 g。在进口温度172 ℃、出口温度90 ℃的条件下,用喷雾干燥剂将浓缩后的药液喷成干燥的粉末,再置于121 ℃的高压灭菌器中灭菌40 min。待自然冷却后取出配置成所需要的浓度,经检测其黄芪多糖的含量高达86.8%。
实验动物SPF级雄性昆明种小鼠 (合格证号为SCXK (甘) 2004-0006-152) 64只,4~6周龄,体重18~20 g,由甘肃中医药大学实验动物中心提供。H22腹水瘤模型小鼠购自中国医学科学院上海肿瘤研究所,由甘肃中医药大学中西医结合重点实验室昆明小鼠腹腔内接种保存。
试剂和仪器Annexin V/PI凋亡试剂盒 (美国BD公司); p53、Bax、Bcl-2、cleaved Caspase-3和β-Actin多克隆兔抗 (Abcam公司),辣根过氧化物酶标记的羊抗兔二抗 (武汉博士德生物工程有限公司); 电泳仪、酶标仪 (美国Bio-Rad公司); 低熔点琼脂糖凝胶 (LMA,Promega公司); 荧光显微镜 (Olympus公司); 中国科学院近代物理研究所兰州重离子研究装置 (HIRFL)。
昆明种小鼠H22腹水瘤模型的建立腹腔穿刺抽取H22腹水瘤模型鼠的腹水,加入适量生理盐水,配制成细胞悬液,细胞计数并测定细胞活力,活细胞率达95%以上。调整细胞数为每毫升2×107个以备用。用75% 乙醇消毒小鼠的腹部,每只小鼠腹腔注入肿瘤细胞悬液0.2 mL (相当于每只接种2×106个肿瘤细胞)。小鼠接种当天为第0天。
最佳UEMAM浓度的制定小鼠造模后利用EXCEL产生随机数字法按体重随机分成4组,每组6只。自腹腔接种24 h后进行药物灌胃,每天一次,连续10天。其中对照组每日给予0.9% 生理盐水0.2 mL,治疗的3组每日分别按50、100和150 mg∙kg−1的剂量给予黄芪超滤物等体积灌胃。
后续实验分组与干预采用同法将造模后小鼠分成4组,每组16只,分别为对照组 (等体积生理盐水灌胃)、中药组 (UEMAM按100 mg•kg−1•d−1等体积灌胃,连续至实验结束)、放疗组 (腹腔接种后第7天予6Gy12C6+离子束外照射)、中药加放疗组 (UEMAM按100 mg•kg−1•d−1等体积灌胃,连续至实验结束,同时于腹腔接种后第7天给予6Gy12C6+离子束外照射),分组后即刻给予药物干预。
观察指标在不同剂量UEMAM治疗结束24 h后,采用脱颈法随机处死各组腹水瘤小鼠6只,用 10 mL无菌注射器抽取每只小鼠的腹水,并记录腹水量。根据统计的平均腹水量计算腹水抑制率 (%)= (1−治疗组平均腹水量/对照组平均腹水量)×100。观 察后续实验中的各组小鼠毛色、活动状况、进食、水情况及精神状态等一般生活状况,每天用药前称量小鼠体重、测量腹围,连续观察其变化,记录各组小鼠死亡时间,并计算生命延长率。生命延长率ILS (%) = [(干预组平均生存天数/空白对照组平均生存天数) − 1] × 100。
流式细胞术 (FCM) 检测细胞凋亡率及周期实验第8、9、10天 (即放疗后24、48、72 h) 分别抽取各组小鼠的腹水,PBS清洗3次后重悬于PBS中,调整细胞数为每毫升2×106个。分别按试剂盒说明书操作,上流式细胞仪检测凋亡率及周期变化。
Western blot检测蛋白表达取放疗后72 h各组腹水瘤细胞,制成细胞悬液,RIPA细胞裂解液提 取蛋白,离心取上清,用BCA法对总蛋白浓度进行定量。15% SDS-PAGE,80 V恒压1.5 h,蛋白转移至PVDF膜上,5% 脱脂牛奶封闭2 h,一抗孵育过夜,TBST洗涤3次,加入二抗孵育2 h,TBST洗涤3 次,增强型化学放光液试剂 (ECL) 显影和曝光,以β-actin为内参,检测目的蛋白p53、Bax、Bcl-2及cleaved Caspase-3的表达情况。
单细胞凝胶电泳实验 (SCGE)取放疗后72 h各组腹水瘤细胞,制成细胞悬液,置4 ℃冰箱备用。取1% 正常熔点琼脂糖凝胶溶液100 μL滴于毛载玻片上铺第一层胶,置4 ℃冰箱固化,取腹水瘤细胞悬液25 μL与低熔点琼脂糖凝胶75 μL混匀后均匀铺 于第1层凝胶上面,置于4 ℃冰箱固化。在中性裂解液中裂解1 h (4 ℃); 双蒸水漂洗,于4 ℃电泳液中静置20 min,然后在20 V、200 mA电泳条件下电泳 20 min。随即用溴化乙锭 (EB) 染色5 min,双蒸水漂洗3次,每次3 min。荧光显微镜下观察彗星。采集到的彗星图片用CASP软件分析。计算尾长 (tail length)、头部DNA (head DNA) 百分含量、 尾部DNA (tail DNA) 百分含量、尾矩 (tail moment,TM) 和Olive尾矩 (Olivetail moment,OTM) 等指标。
统计学分析测定结果均以x± s表示,采用SPSS17.0软件处理数据,并用单因素方差分析进行数据统计; 以α = 0.05为检验水准,P < 0.05时认为差异具有统计学意义,P < 0.01时认为差异具有显著的统计学意义。 结果 1 UEMAM对小鼠腹水抑制作用
UEMAM对小鼠腹水的生成具有抑制作用,其抑制程度与UEMAM剂量有关系,在50~150 mg∙kg−1内,其抑制作用随药物剂量增加而增强。与对照组比较,50 mg∙kg−1 UEMAM组小鼠平均腹水量差异无统计学意义 (P > 0.05),但100 mg∙kg−1及150 mg∙kg−1 UEMAM组小鼠平均腹水量明显减少,差异有统计学意义 (P < 0.05),且150 mg∙kg−1 UEMAM组小鼠 平均腹水量最少,腹水抑制率最高,但与UEMAM 100 mg∙kg−1组比较,二者差异并无统计学意义 (P > 0.05),故取UEMAM 100 mg∙kg−1作为后续实验的药物剂量。见表 1。
|
|
Table 1 Comparison of the average volume of ascites and ascites inhibition rate after different doses of ultra-filtration extract mixture from Astragalus mongholicus (UEMAM) on mice. a: P < 0.05 vs control group; b: P < 0.05 vs UEMAM 50 mg•kg−1 |
对照组腹腔接种瘤细胞后第4~5天即可见到小鼠腹部开始胀大,渐至少动,进食、水减少,晚期肢体极度消瘦,腹部膨隆明显,毛发不荣,嗜睡,刺激反应差。中药组第6~7天出现腹水,呈缓慢增长状态,进食、水量稍减少,毛发较有光泽,对刺激反应较好。放疗组第4~5天腹部开始胀大,日渐显著,至放疗48 h后,体重增加明显缓慢,毛发易脱落。中药加放疗组后期出现少量腹水,相对活动多,进食、水量较其他组多,体重增加缓慢。
3 体重与腹围变化情况对照组小鼠自第6天起体重、腹围迅速增长,曲线几乎呈陡直直线。中药组小鼠体重、腹围增长较对照组缓慢,但曲线亦呈陡直直线,斜率较对照组小。放疗组小鼠自第6天起体重、腹围迅速增长,但自放疗24 h后,体重、腹围增加明显缓慢。中药联合放疗组小鼠体重、腹围增长均缓慢,曲线较低平。第11天各治疗组小鼠体重、腹围均低于对照组,差异具有统计学意义 (P < 0.05); 中药联合放疗组小鼠体重、腹围均低于单纯放疗组与单纯中药组,差异亦具有统计学意义 (P < 0.05); 此外,单纯放疗组与单纯中药组比较,前者体重、腹围值更低,差异具有统计学意义 (P < 0.05)。见图 1A和1B。
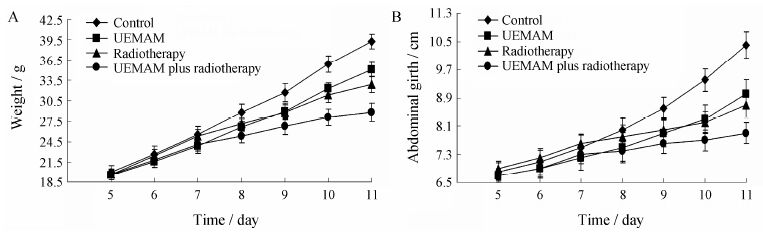
|
Figure 1 A: Weight change trend of every group mice. B: Abdominal girth change trend of every group mice |
中药组、放疗组及中药联合放疗组小鼠平均生存时间 (天) 分别为14.7 ± 0.7、15.3 ± 1.2和17.0 ± 0.8,均较对照组13.5 ± 0.8延长,生命延长率分别为8.9%、13.3% 和25.9%,各治疗组小鼠与对照组小鼠比较,生存时间差异均具有统计学意义 (P < 0.05),中药联合放疗组小鼠与单纯放疗组、单纯中药组小鼠比较,差异亦均具有统计学意义 (P < 0.05)。见图 2。

|
Figure 2 Survival curves of every group mice (n = 6) |
取实验第8、9和10天 (即放疗后24、48和72 h) 各组中每只小鼠的腹水瘤细胞进行流式细胞仪检测,凋亡的结果表明: 与对照组比较,各治疗组小鼠的凋亡率均随时间的延长而增高,差异均具有显著的统计学意义 (P < 0.01),中药联合放疗组小鼠腹水瘤细胞凋亡率与单纯放疗组、单纯中药组小鼠放疗后各时间点比较,差异亦具有统计学意义 (P < 0.05)。且各治疗组于放疗后72 h细胞总凋亡率均高于放疗后24 h细胞总凋亡率 (P < 0.05),但与放疗后48 h比较,差异不明显。见表 2。
|
|
Table 2 Comparison of total cell apoptosis rate after the effects of UEMAM and 12C6+ions on mice. a: P < 0.01 vs control group; b: P < 0.05 vs UEMAM; c: P < 0.05 vs radiotherapy; d: P < 0.05 vs each group of 24 h |
取实验第8、9和10天 (即放疗后24、48和72 h) 各组中每只小鼠的腹水瘤细胞,通过流式细胞仪检测细胞G2/M比例的结果表明: 单纯放疗组与中药联合放疗组引起的腹水瘤细胞G2/M期阻滞均在放疗后24 h即达到高峰,随后逐渐下降。而单纯中药组也出现了G2/M期细胞阻滞比例的上升,且随着时间的延长缓慢升高。与对照组比较,各治疗组小鼠各时间点G2/M期细胞阻滞比例均升高,且差异均具有显著的统计学意义 (P < 0.01),中药联合放疗组与单纯放疗组、单纯中药组比较,各时间点G2/M期细胞阻滞比例亦升高,差异具有统计学意义 (P < 0.05)。见表 3。
|
|
Table 3 Comparison of H22 cell cycle arrest rate after the effects of UEMAM and 12C6+ ions on mice. a: P < 0.01 vs control group; b: P < 0.05 vs UEMAM; c: P < 0.05 vs radiotherapy; d, e, f: P < 0.05 vs each group of 24 h, 48 h, 72 h |
Western blot检测结果表明,单纯放疗组与单纯中药组小鼠72 h促凋亡蛋白p53及cleaved Caspase-3的表达量均较空白对照组上调 (P < 0.05); 其中中药联合放疗组上调最明显 (P < 0.01); 且中药联合放疗组与单纯放疗组、中药组相比,各表达量均上调,差异具有统计学意义 (P < 0.05); 单纯放疗组促凋亡蛋白Bax表达量较空白对照组上调 (P <0.01),而单纯中药组促凋亡蛋白Bax表达量与空白对照组比,无明显差异; 但中药与放疗联合治疗后与单纯放疗组、单纯中药组及空白组比较,Bax表达量显著上调 (P < 0.05); 单纯放疗组与单纯中药组72 h抑制凋亡蛋白Bcl-2表达量均较空白对照组下调; 以中药联合放疗组下调最明显 (P <0.01)。中药联合放疗组72 h抑制凋亡蛋白Bcl-2表达量均较单纯放疗组与单纯中药组具有显著性差异 (P < 0.05)。见图 3。

|
Figure 3 Changes of p53, Bax, Bcl-2 and cleaved Caspase-3 protein expression in H22 cell at 10th day |
实验第10天,与空白对照组比较,各治疗组小鼠腹水瘤细胞的尾部DNA百分含量 (TDNA%)、尾长 (TL)、尾短 (TM) 及尾距 (OTM) 均升高,差异均具有显著的统计学意义 (P < 0.01),且中药联合放疗组与单纯中药组、单纯放疗组比较,四者也明显升高,差异亦具有显著的统计学意义 (P < 0.01)。见表 4。
|
|
Table 4 Comparison of H22 cell DNA double-strand break after the effects of UEMAM and 12C6+ ions on mice. a: P < 0.01 vs control group; b: P < 0.01 vs UEMAM. TDNA: Tail DNA; TL: Tail length; TM: Tail moment; OTM: Olivetail moment |
黄芪始载于《神农本草经》,是传统重要的益气类中药,有补气固表、利尿托毒、敛疮生肌、益气补中之功效。现代药理学研究表明,黄芪的化学成分主要为多糖类、三萜皂苷类以及多种黄酮类等[8]。近年来,越来越多的研究发现黄芪的提取物中含抑癌活性物质,能有效抑制体外培养的肝癌细胞增殖、降低线粒体代谢活性、增强小鼠腹腔吞噬细胞活性; 并对正常动物以及荷瘤、药物等引起的免疫功能低下的动物,均能有效地提高细胞免疫和体液免疫功能[9, 10]。由甘肃省膜科学研究院与甘肃中医药大学科研实验中心联合制备的UEMAM,其多糖的含量高达86.8%,远高于其他方法所得,且操作简单,同时可以降低口服给药剂量。
本实验通过观察发现,一定剂量的UEMAM与12C6+离子束外照射H22腹水瘤小鼠,均可有效改善腹水瘤小鼠的一般状况、减慢小鼠体重、腹围的增长速度,并延长生存期,其中单纯放疗组疗效优于单纯中药组,且二者联用时对腹水瘤小鼠的治疗作用最明显,与单纯放疗组、单纯中药组比较,差异均具有统计学意义。通过FCM的检测结果也发现,各治疗组小鼠腹水瘤细胞凋亡率在各时间点均明显高于对照组,并以联合治疗组小鼠腹水瘤细胞凋亡率最高,且明显高于单纯放疗组与单纯中药组 (P <0.05)。此外,与单纯中药组各时间点比较,单纯放疗组小鼠腹水瘤细胞凋亡率更高,差异亦具有统计学意义。通过各项数据均显示UEMAM及12C6+离子束外照射均可有效治疗H22腹水瘤小鼠,以12C6+离子束外照射疗效更优,且UEMAM可增加12C6+离子束的辐射敏感性。
p53基因是目前发现的与人类肿瘤相关性最高的基因,它可以诱导细胞周期阻滞,通过转录激活或抑制各种不同的基因,主要促进促凋亡基因表达的上调,抑制凋亡基因的下调,来启动凋亡反应。研究发现当细胞受一定剂量的电离辐射后可导致DNA损伤,在毛细血管扩张共济失调突变 (ATM) 蛋白激酶的作用下磷酸化p53,进而建立p53的磷酸化和乙酰化级联反应,修饰后的p53与靶基因的p53反应元件结合后可控制下游靶基因的表达,其主要是通过促进促凋亡蛋白如Bax、Fas、Apaf-1等表达上调,抑制凋亡蛋白如Bcl-2等表达下调,介导细胞色素C从线粒体中释放,激活下游的Caspase 9,活化的Caspase 9进一步激活Caspase 3,引起Caspases级联激活反应,进而诱导细胞凋亡[11]。在由p53介导的该信号通路中,Bax蛋白与Bcl-2蛋白的比值变化可以调节细胞增殖与凋亡的平衡,当Bax表达过量,而Bcl-2表达下降时,二者主要形成同源二聚体,进而促进细胞凋亡[12]。位于其下游的Caspase家族是一群含有半胱天冬氨酸的蛋白酶,Caspase的激活在细胞凋亡的执行过程中也起着非常重要的作用,是细胞凋亡发生机制中最关键的环节之一。而Caspase 3是Caspase引起细胞凋亡的最下游分子,也是细胞凋亡信号转导中关键的效应分子[13]。正常情况下,Caspase 3以无活性的蛋白酶原形式存在 (即pro-Caspase 3),当受到信号刺激后,酶解为活性酶碎片 (即cleaved Caspase 3),故通过检测cleaved Caspase 3的表达量可以反映细胞的凋亡水平[14]。本实验通过SCGE技术发现UEMAM及12C6+离子束均可造成H22细胞DNA链的损伤,且UEMAM可加重12C6+离子束对H22细胞DNA 双链的损伤,其作用机制可能是阻滞损伤的H22腹水瘤细胞的DNA修复,进而加速细胞的凋亡。同时Western blot检测结果也表明,中药联合放疗组与对照组及单纯放疗组比较,均出现了促凋亡蛋白p53、Bax及cleaved Caspase 3的表达量上调,而抑制凋亡蛋白Bcl-2表达量下调,表明UEMAM能够增强p53、Bax及cleaved Caspase 3蛋白的活性,降低Bcl-2蛋白的活性,从而诱导H22细胞凋亡。此外,通过FCM的分析发现,UEMAM除可增加12C6+离子束所致的腹水瘤细胞的凋亡率外,还具有明显的G2/M阻滞效应。
综上所述,UEMAM具有对H22腹水瘤小鼠12C6+离子束的放疗增敏作用,其作用机制可能是通过抑制H22细胞损伤的DNA双链修复,上调p53、Bax蛋白水平,下调Bcl-2蛋白水平,从而阻滞细胞周期于G2/M期,并通过线粒体激活其下游的信号通路分子cleaved Caspase 3的表达,进而诱导H22细胞凋亡。通过本实验的研究,有望在将来利用12C6+离子束治疗恶性腹水瘤,并联合UEMAM提高12C6+离子束的辐射敏感性,更好地发挥12C6+离子束治疗恶性肿瘤的优势。但目前针对UEMAM对12C6+离子的放疗增敏作用机制的探讨仍很表浅,尚需更深入的完善和明确。
| [1] | Forner A, Llovet JM, Bruix J. Hepatocellular carcinoma[J]. Lancet, 2012, 379:1245-1255. |
| [2] | Ren XF, Chen YX, Xie WF. The countermeasure and treatment of malignant ascites[J]. Chin J Dig(中华消化杂志), 2006, 28:573-576. |
| [3] | Qin YC. The clinical observation of whole abdominal moving strip radiotherapy on malignant ascites[J]. J Changzhi Med Coll(长治医学院学报), 2005, 19:48-49. |
| [4] | Schulz-Ertner D, Tsujii H. Particle radiation therapy using proton and heavier ion beams[J]. J Clin Oncol, 2007, 25:953-964. |
| [5] | Li YM, Gao LY, Wang XH, et al. Influence of carbon ion beam radiation therapy on T-cell subsets in patients with malignant tumor[J]. Mod Oncol(现代肿瘤医学), 2013, 21:1115-1117. |
| [6] | Zhao LH, Li Q, Lin F, et al. Cytotoxicity of Astragalus polysaccharides combined with cisplatin of human BEL-7404 hepatoma combined with cisplatin on tumor cells[J]. Pract J Cancer(实用癌症杂志), 2005, 20:34-35. |
| [7] | Wang N, Li YD, Liu K. The radioresistance on active ingredient of angelica and Astragalus[J]. Chin J Radiol Health(中国辐射卫生), 2008, 17:121-122. |
| [8] | Hu B, Shen KP. The antitumous effect and mechanism of Astragalus[J]. J Chin Med Mater(中药材), 2008, 31:461-465. |
| [9] | Xiao ZM, Zhao LH, Qiu J, et al. The effect of astragalus extract on human heaptoma cell line and mouse tumor immune cells[J]. J Shandong Univ Tradit Chin Med(山东中医药大学学报), 2004, 28:136-139. |
| [10] | Choi EM, Kim AJ, Kim YO, et al. Immunomodulating activity of arabinogalactan and fucoidan in vitro[J]. J Med Food, 2005, 8:446-453. |
| [11] | Ola MS, Nawaz M, Ahsan H. Role of Bcl-2 family proteins and caspases in the regulation of apoptosis[J]. Mol Cell Biochem, 2011, 351:41-58. |
| [12] | Cory S, Huang DC, Adams JM. The Bcl-2 family:roles in cell survival and oncogenesis[J]. Oncogene, 2003, 22:8590-8607. |
| [13] | Wu H, Che X, Zheng Q, et al. Caspases:a molecular switch node in the crosstalk between autophagy and apoptosis[J]. Int J Biol Sci, 2014, 10:1072-1083. |
| [14] | Parrish AB, Freel CD, Kornbluth S. Cellular mechanisms controlling caspase activation and function[J]. Cold Spring Harb Perspect Biol, 2013, 5:a008672. |
 2015, Vol. 50
2015, Vol. 50


