逍遥散出自宋代《太平惠民和剂局方》,由柴胡、当归、白术、茯苓、甘草、生姜、白芍、薄荷8味药组成,是治疗抑郁症的经典名方之一,具有疏肝解郁、养血健脾的功效。实验研究和临床应用均表明[1−5],逍遥散抗抑郁效果确切。然而,由于抑郁症本身的病因、病机比较复杂,而逍遥散组方成分较多,目前对逍遥散抗抑郁的作用机制尚未完全阐明,因此借助网络药理学的思路从系统生物整体的角度探究逍遥散的抗抑郁作用机制具有重要意义。
网络药理学基于系统生物学和多向药理学提出了药物设计新方法,而“多靶点”药物的发现正在成为一种新的趋势[6, 7]。网络药理学从多靶点的研究策略出发将药物−靶点网络与生物系统网络相结合,为新药研发提供新途径和新策略[7]。基于网络药理学的反向药效团匹配方法 (PharmMapper) 是通过对Targetbank、Drugbank、binding DB和PDTD四大数据库进行快速检索而获得药物靶点信息。该服务器内含7 302个药效团模型,涵盖110种临床适应症,具有运算速度快、靶点信息全面等优点[8]。PharmMapper反向分子对接在中药靶点研究中得到广泛应用。这些潜在的分子靶点参与多种生理和 (或) 病理过程,对于具有潜在药理活性的小分子的作用机制研究有较大的指导意义。Liu等[9]应用反向预测了茵陈蒿汤的直接分子靶标 (大黄酸、大黄素等6种) 和间接分子靶标 (异秦皮啶等8种); Liu等[10]采用网络药理学和反向药效团匹配方法发现在细胞过程中丝氨酸苏氨酸蛋白激酶是四物汤及其类方共有的潜在作用靶点群; Cheng等[11]基于网络药理学的清肺消炎丸抗炎机制的初步研究,揭示了清肺消炎丸抗炎的多维调控机制。Bai等[12]采用三种靶点预测方法探讨罗格列酮复方作用机制,结果表明这种靶点预测方法可能更适合分析药物的靶点信息。因此,可采用PharmMapper的网络药理学方法解释逍遥散“多成分、多靶点、多途径”的作用机制。
目前,已有研究表明逍遥散主要活性成分具有良好的抗抑郁作用,如Li和Zhu等[13−15]发现柴胡 皂苷类成分具有较强的神经保护作用; Wang和Sun等[16−18]研究结果表明芍药苷和甘草苷具有抗抑郁的功效。本课题组前期按照现代中药提取分离方法获得逍遥散抗抑郁有效部位,且基本明确了主要大类化学成分及其结构。其中含量较高的化学成分主要包括来自柴胡的柴胡皂苷类、当归的藁本内酯以及白术的白术内酯等,同时上述成分也是主要的入血成分,可能是有效部位发挥抗抑郁效果的主要活性成分[19, 20]。
上述研究结果表明逍遥散抗抑郁主要活性成分基本明确,然而其作用机制仍不清楚。因此,本文以逍遥散中抗抑郁的主要活性成分为研究对象,运用网络药理学方法通过构建成分−靶点网络,全面系统预测发现作用靶点,为深入探讨逍遥散抗抑郁的作用机制提供科学依据。
材料与方法 化合物信息柴胡皂苷A (C42H68O13,CAS号: 20736-09-8)、柴胡皂苷C (C48H78O18,CAS号: 20736- 08-7)、柴胡皂苷D (C42H68O13,CAS号: 20874-52-6)、阿魏酸 (C10H10O4,CAS号: 1135-24-6)、藁本内酯 (C12H14O2,CAS号: 81944-09-4)、白术内酯Ⅰ(C15H18O2,CAS号: 73069-13-3)、白术内酯Ⅱ (C15H20O2,CAS号: 73069-14-4)、白术内酯Ⅲ (C15H20O3,CAS号: 73030- 71-4)、芍药苷 (C23H28O11,CAS号: 23180-57-6)、芍药内酯苷 (C23H28O11,CAS号: 39011-90-0)、甘草苷 (C21H22O9,CAS号: 551-15-5)、甘草酸 (C42H62O16,CAS号: 1405-86-3)、茯苓酸 (C33H52O5,CAS号: 29070-92-6),以上化学信息来源于美国化学文摘数据库 (Chemical Abstract Service,CAS)。
Sdf-mol格式文件建立从CAS数据库中确定13种活性成分的化学结构。在Chembiodraw Ultra 12.0软件中以structure选项下的“convert name to struc-ture”功能画出其各自的结构图,并以MDL Molfile (*.mol) 格式存储[21]。将建立的MDL Molfile (*.mol) 格式文件导入OpenBabel软件,使用其convert功能,将MDL Molfile格式转换成为sdf-MDL MOL format格式文件。
潜在作用靶点反向预测
登陆PharmMapper服务器 (http://59.78.96.61/pharmmapper/,Update in 2012- 12-25),上传逍遥散主要活性成分sdf-mol格式文件,采用“反向药效团匹配方法”得到虚拟筛选结果[8]。以活性小分子为探针,搜寻潜在药物靶点,进而预测化合物生物活性。由于检索到的药物靶点存在命名 不规范等问题,因此,本实验使用UniProt数据库中UniProtKB搜索功能 (http://www.uniprot.org/,Update in 2014-04-10),通过输入蛋白名称并限定物种为人,将检索得到的所有蛋白校正为其官方名称 (Official Symbol),经上述数据库检索和转化操作,获取与活性成分相关的蛋白信息。
靶点的筛选将反向预测获得的靶点信息与DrugBank (http://www.drugbank.ca/,Version 4.2) 数据库中FDA批准的小分子抗抑郁药物的靶点比对分析,归纳总结预测靶点中有明确抗抑郁作用的靶点。 靶点通路注释分析
通过MAS 3.0 (http://bio-info. capitalbio.com/mas3/,Version 3.37) 生物分子功能注释系统对获取的靶点信息进行GO富集分析和KEGG通路注释分析。逍遥散对应的靶蛋白 (基因) 直接映射到通路上,药物靶点富集的通路被认为是药物调控的通路。
活性成分−靶点网络构建根据上述逍遥散的 化学成分的靶点预测结果,采用Cytoscape软件的Merge功能构建逍遥散成分−靶点−通路网络模型[22]。网络中,节点 (node) 表示活性成分、靶点以及作用通路。若某一靶点为某化合物的潜在作用靶点,则以边 (edge) 相连。节点间的连接原则为当活性成分作用靶点与作用通路相关靶点相同时,则将活性成分与作用通路以边 (edge) 关联起来。通过构建网络研究逍遥散抗抑郁多成分、多靶点、多通路的作用。
结果 1 逍遥散主要活性成分的潜在靶点信息PharmMapper返回的300个潜在作用靶点根据匹配度fit score由高到低进行排序。将获得的靶点信息与DrugBank数据库中FDA批准的小分子抗抑郁药物的靶标比对分析,归纳总结筛选出25个可能与逍遥散治疗抑郁症相关联的潜在作用靶点 (基因和蛋白) 见表 1。逍遥散中13个活性成分分别对应的靶点数见表 2。涉及25个作用靶点总频率为247次平均。通过预测靶点的频率发现,在细胞过程中发挥重要作用的glutathione S-transferase P、glucocorticoid receptor和amine oxidase [flavin-containing] B等是逍遥散主要活性成分潜在靶点蛋白群,NR3C1、MAOB 和GSTP1等是其潜在靶点基因群。由表 2可知,逍遥散中不同活性成分可作用于相同的靶点,也可作用于不同的靶点,体现其多成分、多靶点的抗抑郁作用机制。
|
|
Table 1 Information of potential targets from active ingredients of Xiaoyaosan |
|
|
Table 2 Information of potential targets from active ingredients of Xiaoyaosan |
将逍遥散活性成分预测出的25个作用靶点通过MAS 3.0生物分子功能注释系统对获取靶点信息进行GO富集分析和KEGG通路注释分析。GO富集分析指在某一功能层次上统计蛋白或者基因的数目或组成的一个有限无环图,包括三个分支,即: 生物过程 (biological process)、分子功能 (molecular function) 和细胞组分 (cellular component)。通过GO分析探讨逍遥散预测靶点的功能分布,图 1为逍遥散抗抑郁作用预测靶点的GO分析结果。其中预测靶点在生物 过程中oxidation reduction和signal transduction排 列靠前; 在分子功能中cytoplasm和nucleus比例最 大; 在细胞组分中bind (metalion、protein) 和activity (transferase oxidoreductase) 关系密切。通过KEGG分析探讨逍遥散抗抑郁作用预测靶点的通路分布 (图 2)。其中25个靶点参与的通路富集有Glioma、Long- term potentiation、Melanogenesis、GnRH signaling pathway、Insulin signaling pathway、Alzheimer’s dis-ease、Calcium signaling pathway等72条,图 2列举排在前面的24条相关通路。
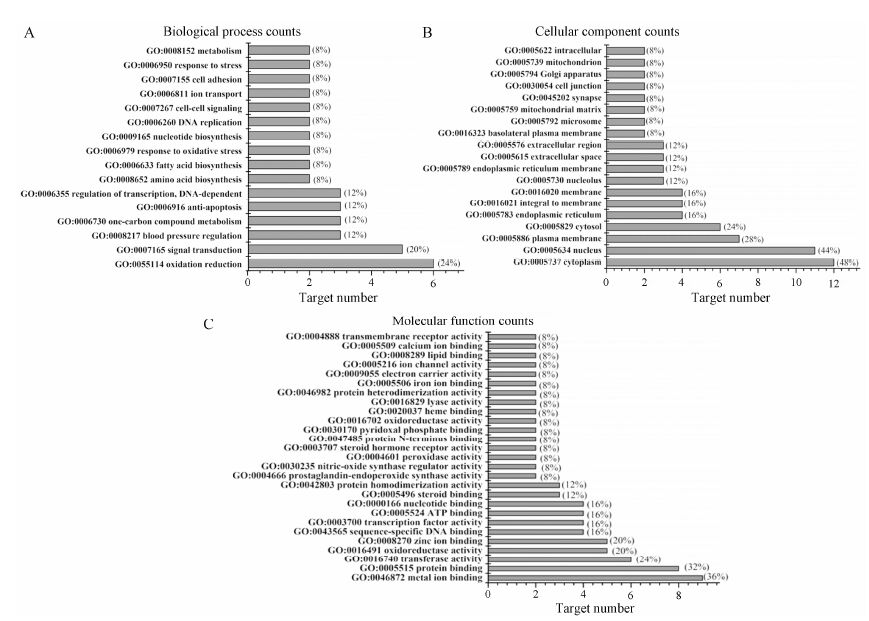
|
Figure 1 Enriched gene ontology terms for biological processes (A), cellular components (B), and molecular functions (C) of potential targets from main active ingredients of Xiaoyaosan |
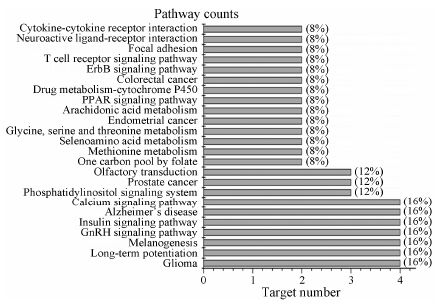
|
Figure 2 Enriched KEGG pathways of potential targets from main active ingredients of Xiaoyaosan |
采用Cytoscape软件的Merge功能构建逍遥散活性成分−作用靶点−代谢通路网络模型,如图 3所示。其中25个靶点中23个比对到代谢通路上 (progesterone receptor和estrogen receptor除外)。逍遥散主要活性成分的作用靶点分布于不同的代谢通路,相互协调、共同调节药物抗抑郁的作用机制。逍遥散抗抑郁的作用机制与目前炎症反应学说、细胞分子机制学说、兴奋性氨基酸及内分泌激素学说等多种发病学说均有相关性,可从不同角度揭示逍遥散抗抑郁的作用特点。
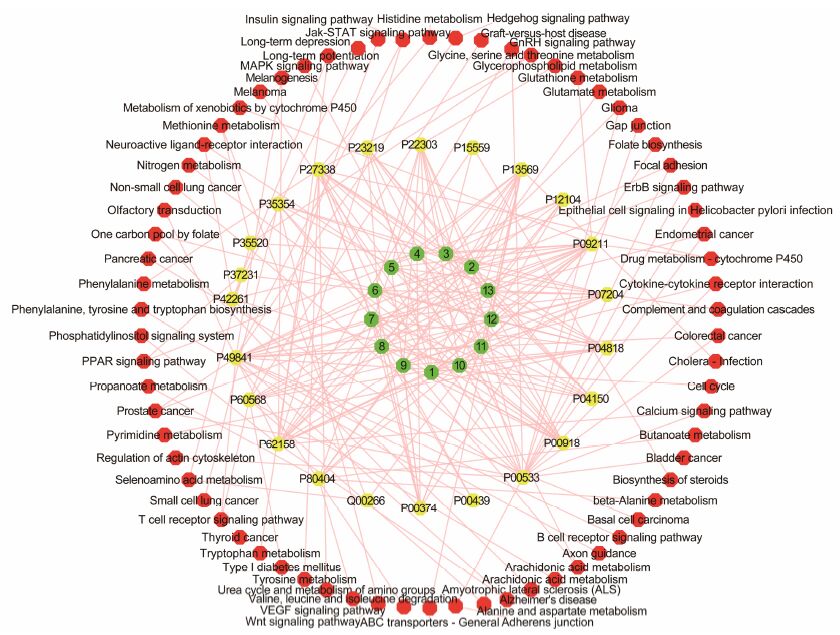
|
Figure 3 Components-targets network of major active ingredients of Xiaoyaosan ( ) main active ingredients, ( ) main active ingredients, ( ) targets, ( ) targets, ( ) pathways ) pathways
|
抑郁症的发生与遗传、生物化学、心理、社会和环境等多种因素有关,其发病机制涉及神经、内分泌、免疫等多方面的改变。本研究采用“反向药效团匹配方法”虚拟筛选结合DrugBank抗抑郁药物分析,发现25个逍遥散抗抑郁相关靶点,并对靶点进行GO富集分析和KEGG通路注释分析,借助网络药理学的方法对逍遥散抗抑郁的作用机制进行探讨,发现其多靶点、多通路作用特点。
PharmMapper是以活性小分子为探针,搜寻潜在的药物靶点,进而预测化合物生物活性,并建立相应的公共网络服务器[8]。这些潜在的分子靶点参与多种生理和 (或) 病理过程,对于具有潜在药理活性的小分子的作用机制研究有较大的指导意义。该方法针对中药多成分、多靶点的特点,可减少实验资源的大量消耗,加快研究进程,增强实验目的性。因此,可采用PharmMapper的网络药理学方法解释逍遥散“多成分、多靶点、多途径”的作用机制。
近年来研究人员从神经递质神经营养素、下丘 脑−垂体−肾上腺轴、炎症因子、氨基酸以及能量代谢等多个角度研究了逍遥散可能的抗抑郁机制。Tian等[23]从神经递质的角度揭示逍遥散增加抑郁模型大鼠5-HT代谢产物5-HIAA的量,在CUMS大鼠粪便中发现可抑制单胺氧化酶 (MAO) 活性的尿嘧啶含量降低; Liu等[24]发现CUMS抑郁模型大鼠血液中合成乙酰胆碱的胆碱前体显著升高,逍遥散能够通过影响差异代谢物使其恢复正常水平。乙酰胆碱酯酶 能够选择性地水解乙酰胆碱,具有促进神经元发育和神经再生的功能。预测靶点也发现逍遥散可通过 单胺氧化酶B (amine oxidase [flavin-containing] B)、乙酰胆碱酯酶 (acetylcholinesterase) 发挥抗抑郁的作用。
Ding等[25]发现逍遥散对慢性束缚应激大鼠海马及杏仁核谷氨酸受体1、谷氨酸受体2的表达调节具有选择性、时相性和双向调节的特点。针对单胺类神经递质的药物只针对大部分患者有效,Sun等[26]从神经内分泌角度发现糖皮质激素通过激活HPA轴,导致糖皮质激素的分泌,长时间作用下会引起内分泌系统紊乱,逍遥散能够显著下调CUMS抑郁模型的HPA轴的激进状态。通过预测发现糖皮质激素受体 (glucocorticoid receptor)、谷氨酸受体-1 (glutamate receptor 1) 是逍遥散发挥抗抑郁作用的靶点。
抑郁症的发生常伴有一定程度的炎症反应启动,Li等[27]从细胞因子的角度发现逍遥散能显著下调体内炎症因子的表达水平,改善机体的免疫功能发挥抗抑郁作用。预测靶点也发现逍遥散可通过白细胞介素-2 (interleukin-2) 发挥抗抑郁的作用。
本实验室前期基于代谢组学的方法通过逍遥散干预CUMS抑郁模型大鼠的研究,发现了在组织和体液不同部位的差异代谢物,包括苯丙氨酸、酪氨酸、柠檬酸和α-酮戊二酸等[1, 2, 28]。Cao等[29]同样发现星形胶质细胞内ATP与抑郁行为关系密切。预测靶点也发现4-氨基丁酸转氨酶 (4-aminobutyrate aminotransferase)、苯基丙氨酸-4-羟化酶 (phenylalanine-4-hydroxylase)、NAD(P)H脱氢酶 (NAD(P)H dehydrogenase [quinone] 1) 和糖原合成酶激酶-3β (glycogen synthase kinase-3 beta) 等作用靶点发挥抗抑郁的作用。
GO富集分析和KEGG通路注释分析结果可知,逍遥散主要活性成分的靶点主要通过能量代谢、氧化应激、信号转导在细胞核、细胞质、细胞膜部位发生蛋白结合、离子结合、酶反应等分子反应。具体包括: T细胞受体、PPAR、GnRH、Insulin和钙离子等信号通路; 甘氨酸、丝氨酸、苏氨酸、甲硫氨酸、花生四烯酸等物质代谢; 神经胶质瘤、阿尔兹海默症等疾病通路。综上所述,逍遥散可通过信号转导−内分泌−能量代谢发挥抗抑郁症的作用。
分析结果表明逍遥散作用于多个靶点发挥抗抑郁的作用。上述预测靶点与已知文献报道的药理作用相吻合,说明预测靶点的准确性。此外,对于上述讨论中剩余靶点的相关研究报道较少,可为今后深入研究逍遥散抗抑郁作用潜在靶点的分子机制研究提供线索。本研究通过对逍遥散多成分−靶点−通路网络分析发现,逍遥散主要活性成分可作用于多个靶点,呈现出方剂多成分、多靶点、整合调节作用的特点。逍遥散是传统中药复方,有其独特的配伍规律,针对逍遥散活性成分是否符合逍遥散方的配伍规律,需要后续进一步研究。
| [1] | Tian JS, Peng GJ, Gao XX, et al. Dynamic analysis of the endogenous metabolites in depressed patients treated with TCM formula Xiaoyaosan using urinary 1H NMR-based metabolomics[J]. J Ethnopharmacol, 2014, 158:1-10. |
| [2] | Dai Y, Li Z, Xue L, et al. Metabolomics study on the anti-depression effect of Xiaoyaosan on rat model of chronic unpredictable mild stress[J]. J Ethnopharmacol, 2010, 128:482-489. |
| [3] | Gao X, Zheng X, Li Z, et al. Metabonomic study on chronic unpredictable mild stress and intervention effects of Xiaoyaosan in rats using gas chromatography coupled with mass spectrometry[J]. J Ethnopharmacol, 2011, 137:690-699. |
| [4] | Lin H, Ye X, Guo ZP, et al. Combination of paroxetine and Xiaoyaosan for postpartum depression[J]. Appl J Gen Pract(实用全科医学), 2008, 6:476-477. |
| [5] | Zhu X, Xia O, Han W, et al. Xiao Yao San improves depressive-like behavior in rats through modulation of β-arrestin 2-mediated pathways in hippocampus[J]. Evid Based Complement Alternat Med, 2014, 2014:902516. |
| [6] | Verpoorte R, Crommelin D, Danhof M, et al. Commentary:"a systems view on the future of medicine:inspiration from Chinese medicine?"[J]. J Ethnopharmacol, 2009, 121:479-481. |
| [7] | Liu AL, Du GH. Network pharmacology:new guidelines for drug discovery[J]. Acta Pharm Sin(药学学报), 2010, 45:1472-1477. |
| [8] | Liu X, Ouyang S, Yu B, et al. PharmMapper server:a web server for potential drug target identification using pharmacophore mapping approach[J]. Nucleic Acids Res, 2010, 38:W609-W614. |
| [9] | Liu T, Huang HB, Lin ZC, et al. Exploring the potential molecular target proteins of Yinchenhao decoction using computer systemic biology[J]. J Chin Med Mater(中药材), 2011, 34:1648-1651. |
| [10] | Liu P, Duan JA, Bai G, et al. Network pharmacology study on major active compounds of Siwu decoction analogous formulae for treating primary dysmenorrhea of gynecology blood stasis syndrome[J]. China J Chin Mater Med(中国中药杂志), 2014, 39:113-120. |
| [11] | Cheng BF, Hou YY, Jiang M, et al. Anti-inflammatory mechanism of Qingfei Xiaoyan Wan studied with network pharmacology[J]. Acta Pharm Sin(药学学报), 2013, 48:686-693. |
| [12] | Bai Y, Fan XM, Sun H, et al. The mechanism of rosiglita-zone compound based on network pharmacology[J]. Acta Pharm Sin(药学学报), 2015, 50:284-290. |
| [13] | Li ZY, Guo Z, Liu YM, et al. Neuroprotective effects of total saikosaponins of Bupleurum yinchowense on corticosterone-induced apoptosis in PC12 cells[J]. J Ethnopharmacol, 2013, 148:794-803. |
| [14] | Li ZY, Jiang YM, Liu YM, et al. Saikosaponin D acts against corticosterone-induced apoptosis via regulation of mitochondrial GR translocation and a GR-dependent pathway[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2014, 53:80-89. |
| [15] | Zhu J, Luo C, Wang P, et al. Saikosaponin A mediates the inflammatory response by inhibiting the MAPK and NF-κB pathways in LPS-stimulated RAW 264.7 cells[J]. Exp Ther Med, 2013, 5:1345-1350. |
| [16] | Wang W, Hu X, Zhao Z, et al. Antidepressant-like effects of liquiritin and isoliquiritin from Glycyrrhiza uralensis in the forced swimming test and tail suspension test in mice[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2008, 32:1179-1184. |
| [17] | Sun R, Wang K, Wu D, et al. Protective effect of paeoniflorin against glutamate-induced neurotoxicity in PC12 cells via Bcl-2/Bax signal pathway[J]. Folia Neuropathol, 2012, 50:270-276. |
| [18] | Mao QQ, Xian YF, Ip SP, et al. Protective effects of peony glycosides against corticosterone-induced cell death in PC12 cells through antioxidant action[J]. J Ethno-pharmacol, 2011, 133:1121-1125. |
| [19] | Zhou YZ, Ren YL, Ma ZJ, et al. Identification and quantification of the major volatile constituents in antidepressant active fraction of Xiaoyaosan by gas chromatography-mass spectrometry[J]. J Ethnopharmacol, 2012, 141:187-192. |
| [20] | Liu JL, Yang L, Cui J, et al. Preliminary study on serum pharmacochemistry of petroleum ether fraction in ethanol extract from Xiaoyao Powder based on UPLC-PDA[J]. Chin Tradit Herb Drugs(中草药), 2013:2816-2822. |
| [21] | Cousins KR. Computer review of ChemDraw Ultra 12.0[J]. J Am Chem Soc, 2011, 133:8388. |
| [22] | Saito R, Smoot ME, Ono K, et al. A travel guide to Cytoscape plugins[J]. Nat Methods, 2012, 9:1069-1076. |
| [23] | Tian JS, Shi BY, Feng GM, et al. 1H-NMR metabonomic study on fecal of chronic unpredicted mild stress model of depression in rats[J]. Chin Tradit Herb Drugs(中草药), 2013, 44:3170-3176. |
| [24] | Liu XJ, Zhou YZ, Li ZF, et al. Anti-depressant effects of Xiaoyaosan on rat model of chronic unpredictable mild stress:a plasma metabonomics study based on NMR spectroscopy[J]. J Pharm Pharmacol, 2012, 64:578-588. |
| [25] | Ding J, Chen JX, Rao HM, et al. Influence of Xiaoyao Powder on expressions of GluR1 and GluR2 of central nervous system in rat model of liver-stagnation and spleen-deficiency syndrome[J]. J Beijing Univ Tradit Chin Med(北京中医药大学学报), 2009, 32:389-393. |
| [26] | Sun Q, Ao HQ, Fu WJ, et al. Study on central Glu-NR-Ca2+-GR signaling pathway mechanism of Xiaoyao powder on counteracting chronic stress[J]. Tradit Chin Drug Res Clin Pharmacol(中药新药与临床药理), 2011, 22:627-632. |
| [27] | Li YJ, Luo HC, Qian RQ, et al. Effect of Danzhi Xiaoyao Powder on neuro-immuno-endocrine system in patients with depression[J]. Chin J Integr Tradit Chin West Med(中国中西医结合杂志), 2007, 27:197-200. |
| [28] | Zhou Y, Lu L, Li Z, et al. Antidepressant-like effects of the fractions of Xiaoyaosan on rat model of chronic unpre-dictable mild stress[J]. J Ehnopharmacol, 2011, 137:236-244. |
| [29] | Cao X, Li LP, Wang Q, et al. Astrocyte-derived ATP modulates depressive-like behaviors[J]. Nat Med, 2013, 19:773-777. |
 2015, Vol. 50
2015, Vol. 50


