抗蛇毒免疫球蛋白 (snake antivenomimmu-noglobulins) 简称蛇毒抗毒素 (snake antivenoms),广义上说是来源于被蛇毒毒素高免的动物血液的一类产品,主要有效成分为免疫球蛋白lgG及其组分,能有效中和毒素,从而缓解毒素引发的病理生理反应,可以使蛇咬伤的致死率从5%~25% 降低至1% 以下,甚至低于0.1%[1]。蛇毒抗毒素的生产可以追溯到100年前,发展至今,生产工艺由粗制到精制,经历了3次主要的技术改进: 由针对毒液的粗制抗血清 (antiserum) 产品 (即第一代抗毒素) 发展到纯度较高的免疫球蛋白 (即第二代抗毒素),再到用胰蛋白酶或胃蛋白酶消化、盐析或亲和色谱纯化去除免疫球蛋白lgG的Fc端后得到的单价Fab或双价F(ab')2片段 (即第三代抗毒素)[2]。
第一代抗毒素是采集毒素免疫马匹血液,去除红细胞后直接制成的血清产品。19世纪80年代到20世纪早期,巴斯德研究所的Albert Calmette将第一个可有效治疗毒蛇咬伤的血液制品销售到了世界各地,使抗血清产品获得了商业上的首次成功[3]。20世纪 初,在白喉毒素抗血清产品的临床应用中人们发现,特别是对于马类血清过敏的患者或反复接受马血清制品的患者极易产生过敏反应,甚至导致死亡,引发了人们对粗制血清产品安全习惯的关注。
进入20世纪,血清组分分离技术取得了很大的发展,免疫球蛋白治疗逐步代替血清治疗。研究者通过利用硫酸铵盐析或辛酸沉淀的方法[4]除去不需要的组分,获得纯度相对较高的免疫球蛋白。第二代抗毒素提高了免疫球蛋白含量,使免疫不良反应相对于粗制血清大大减少,但是在实际应用中,这种纯度提高的产品也不能完全避免不良反应的发生[5],在临床使用中仍有发生严重过敏反应的报道: 在斯里兰卡和印度,约43%~81% 的患者产生急性不良反应[6]; 在美国,急性过敏反应发生率为1%~38%,后续的血清病发生率在50%~75%[7]。
20世纪后半叶,人们利用胰蛋白酶或胃蛋白酶消化免疫球蛋白lgG产生Fab或 F(ab')2片段,并用盐析或亲和色谱的方法去除Fc端,纯化得到第三代抗毒素。第三代抗毒素由于极大程度地去除了Fc片段,可降低补体反应的发生,理论上有效降低了不良反应的发生,具有更高的安全性。但是,临床研究发现,根据产品的纯化和工艺的不同,不良反应的发生率差异很大: 早期急性过敏反应发生率为0%~37%,血清学疾病的发生率在0%~19%之间[8]。
抗毒素的每次技术改进都以提高产品疗效、降低不良反应发生率为出发点,但是由于蛇毒组分的复杂性、动物免疫的不可控性以及产品纯化工艺的局限性等,使得抗蛇毒产品的开发还相对滞后,不良反应发生率虽然有所降低,但仍然没有达到最理想的状态。我国于20世纪50年代由上海生物制品研究所开始研制抗蛇毒血清,相继研制出抗蝮蛇毒血清、抗五步蛇毒血清、抗眼镜蛇毒血清、抗蝰蛇毒血清、抗金环蛇毒血清和抗银环蛇毒血清。到目前为止,我国生产蛇毒抗毒素的企业仅有上海赛伦生物技术有限公司,上市销售4种蛇毒抗毒素单价液体制剂,即抗蝮蛇毒、抗五步蛇毒、抗眼镜蛇毒和抗银环蛇蛇毒的单价免疫球蛋白F(ab')2分子。这些产品均按照《中华人民共和国药典2010年版 (三部)》中相关规程生产,以胃蛋白酶消化原血浆后用硫酸铵盐析方法进行纯化,F(ab')2纯度不低于60%,且为液体制剂,不便于保存和运输。抗蛇毒血清的研发生产给我国蛇伤患者带来了福音,蛇伤治疗有效率可达100%[9],近年来处于一支难求的状况,但其不良反应也不容忽视。Lu报道[10]使用蛇毒抗血清时按照常规治疗,273例中 约53例发生不良反应 (约19.41%); 进行临床相应 抗过敏治疗后,980例中仍有60例发生不良反应 (约6.12%)。Yuan等[11]报道,1 162例患者接受抗蛇毒血清治疗的不良反应发生率为6.38%。因此,如何提高产品的有效性、稳定性和安全性,也依然是我国研发机构亟需考虑的问题。成都军区疾病预防控制中心近十几年来一直致力于蛇毒抗毒素的开发,目前针对我国常见陆生毒蛇相继研发了高纯度的抗竹叶青、抗烙铁头、抗蝰蛇和抗眼镜王蛇蛇毒等9种单价冻干蛇毒抗毒素以及3种多价蛇毒抗毒素 (抗蝰科蛇毒五价抗毒素、抗银环蛇两价抗毒素和抗眼镜眼镜王蛇两价抗毒素)。制品均采用改进工艺进行生产,抗毒素产品纯度可达80% 以上,甚至接近于WHO要求纯度 (高于90%),但目前仅限于军队内部使用。
蛇毒抗毒素作为一种关乎生死的治疗性急救药品,不仅需要注重产品的安全、有效,使其能够实现“全球化”运用,也是药品研究者的终极目标。然 而,由于毒蛇分布具有较强的地域性,毒液组成差异较大,蛇毒抗毒素产品的开发也受到地域的局限,同时还缺乏国际间的合作和数据共享。截止2015年4月,全球约有45个实验室或公司注册生产蛇毒抗毒素近100种 (http://apps.who.int/bloodproducts/snakean tivenoms/database/),分布于各大洲,由于蛇毒种类以及免疫等相关技术的限制,目前生产的蛇毒抗毒素产品只能满足本国的自需,还无法达到“全球化”治疗的目的。
多样化的生物学方法为蛇毒抗毒素生产提供了一些新的手段[12],如单克隆抗体生产、单链抗体片段 (single-chain antibody fragment,scFv) 重组以及亲和色谱纯化等。随着转录组学和DNA免疫技术的发展,一部分研究者已经开始用理性的方法来设计开发抗毒素产品,如多位点DNA免疫原 (multiepitope DNA immunogens) 法[13]。研究者[14]通过对非洲蝰蛇Echisocellatus蛇毒金属蛋白酶 (snake venom metalloproteinases,SVMPs) 表达序列进行测定和生物信息学比对,识别出7个在所有金属蛋白酶异构 体中均存在、且免疫性或结构重要的位点 (epitope),构建在一个线性DNA免疫原上对小鼠进行DNA免疫。获得的抗毒素血清对多数SVMPs以及一些其他非洲蝰蛇均具有特异性,更重要的是该血清还具有对其他蛇种 (E. ocellatu和Cerastescerastescerastes) 出血毒素的种属间交叉中和活性 (cross-specifically neutralized activity)。这一方法的提出改变了抗毒素 生产的传统思路,对于不同种类的毒蛇,如果它们的主要致死性毒素相似,就可以针对这些主要毒素的共同免疫原位点进行重组合成,利用分子生物学手段即可获得广谱高效的免疫原,加之对马匹进行蛇毒DNA免疫也是可行的[15],有望可以运用到抗毒素生产中,获得高效、具有广泛地域性和蛇种覆盖性的高效蛇毒抗毒素。但是这些技术尚还处于实验阶段,就目前的蛇毒抗毒素工业化生产方式而言,从蛇毒全毒素免疫动物的血浆中分离纯化抗蛇毒有效成分仍然是蛇毒抗毒素产品制备最重要和最主要的途径。
2 抗蛇毒药物开发的策略 2.1 免疫球蛋白分子类型的选择目前在全世界销售的抗蛇毒免疫球蛋白产品主要为纯化的lgG分子、双价F(ab')2分子及单价Fab分子[16]。这三种蛋白分子量差异较大,分别约为150、100和50 kDa,因而呈现不同的药代动力学特点,在选择使用哪一类抗蛇毒分子时应该充分考量蛇毒毒素种类以及主要致死性蛋白分子等在体内的分布特点,如低分子量Fab片段的分子量最小 (50 kDa),具有较大的分布体积,静脉注射后能迅速分布到血管外组织,因而比较适合快速中和靶器官分布速度快的蛇毒毒素分子,如眼镜蛇毒素和银环毒素等一些以神经毒为主的低分子量毒素。相反地,一些高分子量毒素分子 (如蝰蛇蛇毒) 分布到血管外组织时间较长、半衰期也长,如果选择半衰期较短的Fab片段,往往会导致中毒症状的反复。因此,在这种情况下选择半衰期相对较长的lgG或F(ab')2片段则更为合适。同时,考虑到蛇毒在与抗蛇毒免疫球蛋白 (或片段) 结合后可能导致蛇毒动力学的改变,逐渐从外周组织向血管中重新分配,在血液中保持较长时间的免疫球蛋白浓度是非常必要的,因此半衰期长的lgG或F(ab')2分子在多种蛇毒中毒治疗中都是较为有效的。
2.2 免疫过程的控制和优化蛇毒免疫球蛋白药物的生产通常要经过免疫原的制备、马匹 (或其他生产动物) 的免疫、免疫血浆的采集和lgG及其组分的分离纯化等4个主要步骤。自抗蛇毒免疫球蛋白出现以来,免疫球蛋白纯化方法不断改进,但是抗蛇毒免疫原理并没有得到重大突破。免疫相关程序是抗蛇毒生产中耗时较长的步骤,从第一次免疫到被免疫动物的血浆达到要求的效价往往需要5~8个月,而且免疫血浆效价的高低和质量在很大程度上影响着终产品的质量,如产品的有效性、安全性和成本等,因此获得高质量的免疫动物血浆在抗毒素产品生产中是极为关键的。
2.2.1 免疫用蛇毒的选择
蛇毒是制备抗蛇毒高免血浆的免疫原,蛇毒的成分往往决定了免疫血浆的中和范围和效果,即中和谱 (neutralizing spectrum),因此如何最有效地选择免疫原蛇毒成为众多研究者关注的热点。
毒蛇的分布通常呈现地域性特点,免疫原蛇毒选择的传统方法往往是基于该区域中临床危害蛇类的流行病学调查数据,然后在相对广泛的区域采集不同年龄、不同季节、可以代表该地区特点的一种蛇毒或多种蛇毒混合物制成免疫原,免疫动物后生产单价蛇毒抗毒素 (monospecific snake antivenom) 或多价蛇毒抗毒素 (polyspecific snake antivenom)。当某一地区同时存在几种毒蛇,使受害者产生相似的生理和病理反应,因而在实际治疗中无法准确区分究竟是哪一种毒蛇咬伤时,比较适宜制备针对该地区这几种蛇毒的多价蛇毒抗毒素,以争取有效治疗时间。多价蛇毒抗毒素与单价蛇毒抗毒素相比,广谱性增加,但针对每种蛇类的免疫球蛋白的数量减少,在实际治疗中常常不如单价蛇毒抗毒素有效。而单价蛇毒抗毒素仅针对这一地域单个蛇种,而对其他区域、其他蛇类咬伤治疗可能无效。因此,采用传统免疫原生产的蛇毒抗毒素产品使用范围十分有限。
在用蛇毒免疫动物制备高免血浆时,有时会遇到免疫应答的效果达不到要求的情况。究其原因,除了与动物在免疫应答上的个体差异外,还有一个重要因素就是蛇毒毒液的组成。蛇毒毒液的成分中,许多蛇毒蛋白是没有毒性的,而有毒蛋白组分中还存在一些毒性较高但分子量较低的小分子蛋白或多肽类物质,因而不能很好地激发免疫应答反应。除此之外,毒素中某些成分可能会抑制免疫应答,使得蛇毒免疫动物后不能取得满意的效价,而将这些抑制性成分去除后再进行免疫,则可以取得好的免疫效果[17]。然而,目前广泛采用的免疫方法还无法特异性针对蛇毒中的主要致死性毒素进行免疫,使所生产的高免血浆中可能存在大量针对非毒性蛋白的免疫球蛋白,同时针对小分子量毒素的免疫球蛋白含量也较低。在此情况下,需要使用高剂量的蛇毒抗毒素对患者进行治疗才可以取得较好的治疗效果,而药物剂量的增加难免会增加蛇伤患者过敏和罹患血清病等不良反应的风险[18]。
为了辅助抗蛇毒药物的设计,评价抗毒素药 物的临床试验范围以及出于商业价值的考虑,2008年基于蛋白质组学原理发展了“抗蛇毒组学 (antivenomics)”[19],来评价抗蛇毒药物对同源或异源蛇毒的交叉保护效果[20]。近年来,“抗蛇毒组学”已经发展到第二代[21],利用免疫亲和色谱的方法,可定性和定量检测抗蛇毒药物位点 (epitopes) 所识别的毒素及低免疫原性的毒素组分,还可以评价蛇毒混合物配方是否可以有效引发理想的抗蛇毒免疫反应,是否还需要进一步优化等。可以预测,研究者在基于对蛇毒蛋白质组学和抗蛇毒药物交叉免疫图谱的深入了解后,可不必考虑毒蛇的地域分布特点,选择或设计最佳的毒素组成作为免疫原,从而提高抗蛇毒药物的有效性、地理覆盖性和蛇种覆盖性,这无疑将成为一种新的蛇毒抗毒素生产策略。
2.2.2 免疫佐剂的选择免疫佐剂被用于提高抗原引起的抗体反应,抗毒素生产中最常使用的是铝盐和氟氏佐剂 ( Freund’s adjuvant)。氟氏佐剂可以分为氟氏完全佐剂 (Freund’s complete adjuvant,FCA) 和氟氏不完全佐剂 (Freund’s incomplete adjuvant,FIA)。FIA是由液体石蜡油、无水羊毛脂和磷酸缓冲盐制成,FCA是在FIA中加入杀死的分枝杆菌或卡介苗制成。FCA被认为是最有效的,但它常引起注射部位的损伤、易残留,因此用于动物免疫的起始阶段。后续增强型免疫 (booster injections) 常使用FIA、铝盐佐剂或盐溶液。
除此之外,诸如脂质体[22]和通过激活细胞及刺激细胞因子生成来激活免疫的新型商品化Montanide佐剂 (Montanide adjuvants)[23]等陆续被尝试用于抗蛇毒毒素的制备研究。Montanide佐剂由法国Seppic公司开发,根据用户不同的需要有多种选择,即开即用,有较好的免疫潜能,性价比和安全性高。常用于动物免疫的Montanide佐剂有Montanide ISA系列佐剂和Montanide IMS系列佐剂。Montanide ISA系列佐剂是一种即开即用的乳化佐剂,用于W/O (water in oil)、O/W (oil in water) 和W/O/W (water in oil in water) 配方的兽用疫苗,无最大残留限量,免疫耐受性好。Montanide IMS系列佐剂是一种含有免疫活性有机化合物和特殊赋形剂的水溶性复合物,可以改善用传统油佐剂和铝盐佐剂安全性差的免疫原配方。Waghmare等[24]分别使用3种Montanide佐剂 (基于水相微粒的佐剂IMS 3012、基于矿物油的W/O/W佐剂ISA 206和基于非矿物油的O/W佐剂ISA 35) 和FIA (对照佐剂) 为免疫佐剂,与多种混合蛇毒一起制备免疫原免疫马匹,每两周免疫1次,至44周。观察马匹在整个免疫程序周期中对多种蛇毒混合免疫原的免疫反应,同时测定马匹生理和生化指标等来评价这几种佐剂的安全性。实验显示,IMS3012和ISA 206免疫效果好于ISA 35和FIA,且Montanide佐剂在免疫全过程并未对免疫动物造成明显伤害。在蛇毒首轮免疫阶段 (primary phase of immunization) 可以更加安全地替代传统佐剂。
2.2.3 免疫动物的选择马、羊和驴等动物目前均可用于抗毒素高免血浆的生产。由于马性格温顺,血浆采集量相对较大的优点使之成为了毒素免疫最常用的动物种类,且在未来较长一段时间内很可能仍然是获得高免血浆的主要生产动物。而在非洲、中东和南美等一些气候条件较为特殊而且对抗蛇毒具有一定需求的地区,由于马和羊无法较好地适应当地炎热干燥环境,因此在这些区域多选择骆驼作为高免血浆的提供者。骆驼不仅在对免疫原的反应效果方面可以与马和羊媲美[25],而且其免疫球蛋白lgG热稳定性佳[26],结构复杂性较低,具有较低的免疫原性,不易激活补体级联反应,可在保证有效性的同时,有助于降低抗蛇毒免疫球蛋白在临床应用中一直面临的过敏等不良反应问题[27]。然而,我国骆驼养殖业受生态条件、管理和科技水平等条件的制约,发展欠佳,并呈现逐年下降的趋势,还不具备将骆驼作为大规模抗毒素生产动物的条件。
2.2.4 免疫程序的优化在抗蛇毒生产过程中,免疫程序的合理选择是十分重要的。低剂量[28]、低体积和多位点免疫的免疫方法[29]可以有助于免疫应答细胞与抗原良好接触,取得好的免疫效果。特别是在首轮免疫周期中,这样的免疫方法可以产生亲和性较好的免疫球蛋白,有利于提高抗蛇毒中和效价。而且,适当延长两次免疫间隔时间 (大于两周),使两轮免疫周期之间有合理的休整期,可以有效促进lgG的成熟[30]。一般说来[16],首次免疫可用FCA与1~4 mg/匹马的蛇毒制备成2 mL免疫原,免疫注射时应该尽量靠近马匹的主要淋巴结,通常在颈部或背部,每个部位采用免疫原100~200 µL,可注射8~12个部位,有的也仅注射3~4个部位或在臀部注射1~2个部位。两周后,需用FIA与首次免疫同等剂量蛇毒混合进行加强免疫。后续加强免疫,每两周进行一次,可以用盐水或铝盐等作为佐剂,加大免疫蛇毒剂量(5~10 mg/匹马)。首次免疫8~10周待效价满足要求即可采血。马匹采血后需要3~8周修养,修养期过后可以展开新一轮免疫,此轮免疫不再使用FCA。
免疫程序往往不是固定不变的。上海生物制品研究所采用FIA佐剂加小剂量减毒蛇毒基础免疫马,休息两个月后正式免疫,剂量逐渐加大,直至免疫成功[31]。当使用高致死性毒素免疫时,为了免疫动物的健康,必须减少单次免疫蛇毒用量,继而增加了免疫方案总时长,有时也需要对免疫方案进行较大的调整。研究者[32]在响尾蛇Crotalusdurissusterrificus毒素的高免血清制备过程中,开发了一种利用响尾蛇毒素 (crotoxin) 致死性相关主要成分磷脂酶A2 (phospholipase A2,PLA2) 预先免疫动物,再用全毒素进行后续免疫的混合免疫方案。与高剂量和低剂量全毒素免疫的传统方案相比,该方案减少了蛇毒用量和对免疫动物的伤害,高免血浆的中和活性最高。
由于蛇毒组成差异较大,免疫动物对毒素的反应也是无法预计的,由于免疫蛇毒的过量长期使用,给免疫动物的健康带来了很大损害。因此,在抗蛇毒血浆生产中应该准确跟踪记录每次免疫过程 (如免疫时间、免疫蛇毒批次、免疫蛇毒剂量和人员信息等) 以及免疫结果 (如血浆效价以及动物健康状况等),使整个免疫程序具有可追溯性。而整个免疫过程涉及多个阶段,监测动物免疫效果,及时调整免疫程序是高免血浆质量控制的关键。小鼠体内中和实验是迄 今为止评价蛇毒抗毒素效价的唯一金标准,但此法需要消耗大量的动物,花费较高,因此只有当免疫达到平台期、收集高免血浆或终产品效价测定时才使用。研究者们希望开发一种简单、敏感、廉价和易操作体外效价检测方法以代替体内效价检测法。Kumar等[33]对一种标准化的酶联免疫法 (enzyme-linked immunosorbent assay,ELISA) 进行了详细的方法学验证,可以代替或辅助目前使用的体内效价检测方法及时有效地监控抗毒素生产的各个阶段。
3 免疫球蛋白及其分子纯化工艺的发展蛇毒抗毒素中大约只有10% 免疫球蛋白能与蛇毒蛋白结合[34],不难想象,约90% 免疫球蛋白是不具治疗作用的,如何提高有效中和蛇毒蛋白分子的纯度对于减少各种急性和慢性不良反应的发生是非常关键的,因此分离纯化技术也是蛇毒抗毒素生产中的关键环节。
在过去60~70年内,lgG中移除Fc片段的纯化方法被广泛的使用。目的是为了阻止补体的激活作用,阻止免疫复合物的形成 (与迟发型不良反应相关)。然而,人们逐渐认识到不良反应发生的另一个重要原因是抗蛇毒蛋白的聚集而不仅仅是补体激活作用。因此,抗蛇毒生产过程中一个重要的安全性问题可能在于抗毒素的物理化学性质,而非仅仅在于中和分子的种类[16],研究者们越来越多地关注免疫球蛋白的物理化学性质方面。就目前免疫球蛋白纯化工艺的发展来看,一方面更加关注如何提高具有毒素中和作用的免疫球蛋白的纯度和控制蛋白聚集,以获得物理化学性质更加优秀的产品; 另一方面着力于使纯化的工艺更加简化、成本更低。
硫酸铵或硫酸钠盐析的工艺是lgG、F(ab')2片段或Fab片段纯化中使用的历史最悠久的纯化方法。硫酸铵沉淀法的免疫球蛋白收率在40%~50%,终产品中不仅会含有较多的非lgG蛋白 (如白蛋白),而且在目标蛋白沉淀分离的过程中势必会引起蛋白的聚集 [以F(ab')2片段纯化为例,图 1],对于药品的疗效和安全都是很大的隐患[5]。利用辛酸纯化法在去除血浆中非lgG蛋白的效果方面是非常显著的。在辛酸 处理过程中,目的蛋白一直以溶液的形式存在,不需要沉淀和复溶的过程,大大减少了聚集,而杂质蛋白则以沉淀的形式被去除 [以F(ab')2片段纯化为例,图 2]。辛酸纯化法不仅可使终产品产量提高至60%~75%,不良反应的发生率也有所降低。改进的辛酸纯化法可以在不干扰蛋白酶活性的情况下,直接在辛酸溶液中进行酶切反应,制备抗蛇毒F(ab')2片段或Fab[35]片段。
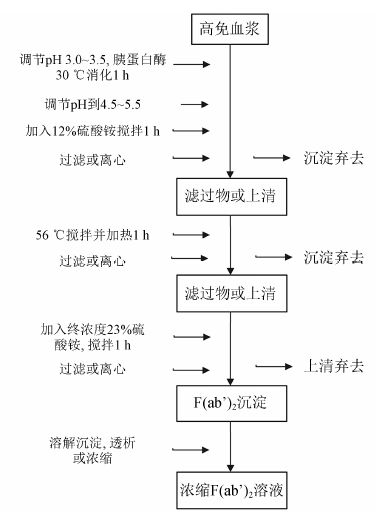
|
图 1 硫酸铵法纯化免疫球蛋白F(ab')2片段[16] |

|
图 2 辛酸法纯化免疫球蛋白F(ab')2片段[16] |
然而,在辛酸法纯化的过程中,需要去除大量杂蛋白颗粒,这一过程比较费时费力。为了解决这个问题,Vargas等[36]借鉴并改进了PEG/磷酸钾液体两相分离系统 (aqueous two phase system,ATPS),配合辛酸沉淀纯化了蛇毒抗毒素,纯化后的免疫球蛋白理化性质、免疫学纯度和产量都比传统方法有所提高。辛酸纯化法也无法根除内毒素的污染[37],即使可以获得纯度更高的免疫球蛋白,但在某些情况下不良反应的发生率仍然会维持在一个较高的水平 (11%~25.6%)[8, 38]。为了更加有针对性地纯化有效成分,基于色谱的纯化方法已用于抗蛇毒免疫球蛋白产品的生产。例如,DEAE-Sepharose或 Q-Sepharose快速离子交换柱、氨基纤维素多孔膜等可将原料药中不需要的组分吸附,活性组分则可通过柱或膜。毒素亲和色谱也是一种有效的方法: 将蛇毒固定在色谱柱凝胶上,当含有免疫球蛋白的未纯化组分通过色谱柱时,通过抗原免疫球蛋白反应,与蛇毒具有相互作用的免疫球蛋白被保留在色谱柱上。这种方法理论上可以产生接近100% 针对蛇毒组分的特异性免疫球蛋白,极大程度消除了由于产品中含有大量非中和性免疫球蛋白带来的不良反应问题。但是,亲和色谱技术受高成本的限制,无法广泛运用到蛇毒抗毒素生产中,只在经济条件比较好的美国和欧洲的市场使用[12]。亲和色谱洗脱条件对蛋白质的活性存在一定影响,对相关技术参数的控制比较严苛,一些新方法也将不断出现,如基于疏水相互作用的膜分离技术[39]很有可能成为代替亲和色谱法的新型分离方法。
4 结语蛇毒抗毒素的生产虽然历史悠久,但传统生产工艺并不尽善尽美,尚存在许多环节需要改进。在研发和实际生产工作中,相关人员应从免疫球蛋白分子类型选择、免疫原的筛选和制备、免疫程序优化以及蛋白分离纯化等方面多加考虑,注重药品生产的各个环节和细节,不断优化现有工艺流程,以更高、更严的质量标准来控制药品生产。同时还应不断关注相关学科前沿,将蛋白质组学、转录组学、生物信息学和DNA免疫技术等较为先进研究手段运用到蛇毒抗毒素研究中,不断尝试和创新,探索研发更广谱、更有效、更安全和不良作用更小的抗蛇毒药物新途径,使蛇毒抗毒素这一传统药物重新焕发新的活力。
| [1] | Dart RC, McNally J. Efficacy, safety, and use of snake antivenoms in the United States[J]. Ann Emerg Med, 2001, 37:181-188. |
| [2] | Boyer L, Degan J, Ruha AM, et al. Safety of intravenous equine F(ab')2:insights following clinical trials involving 1534 recipients of scorpion antivenom[J]. Toxicon, 2013, 76:386-393. |
| [3] | Calmette A. The treatment of animals poisoned with snake venom by the injection of antivenomous serum[J]. Br Med J, 1896, 2:399-400. |
| [4] | Rojas G, Jiménez JM, Gutiérrez JM. Caprylic acid fractionation of hyperimmune horse plasma:description of a simple procedure for antivenom production[J]. Toxicon, 1994, 32:351-363. |
| [5] | Otero R, Gutiérrez JM, Rojas G, et al. A randomized blinded clinical trial of two antivenoms, prepared by caprylic acid or ammonium sulphate fractionation of IgG, in Bothrops and Porthidium snake bites in Colombia:correlation between safety and biochemical characteristics of antivenoms[J]. Toxicon, 1999, 37:895-908. |
| [6] | De Silva HA, Pathmeswaran A, Ranasinha CD, et al. Low-dose adrenaline, promethazine, and hydrocortisone inthe prevention of acute adverse reactions to antivenom following snakebite:a randomized, double-blind, placebo-controlled trial[J]. PLoS Med, 2011, 8:e1000435. |
| [7] | LoVecchio F, Klemens J, Rounday EB, et al. Serum sicknessfollowing administration of antivenin(Crotalidae) polyvalent in 181 cases of presumed rattlesnake envenomation[J]. Wilderness Environ Med, 2003, 14:220-221. |
| [8] | Abubakar IS, Abubakar SB, Habib AG, et al. Randomised controlled double-blind non-inferiority trial of two antivenoms for saw-scaled or carpet viper(Echisocellatus) envenoming in Nigeria[J]. PLoS Negl Trop Dis, 2010, 4:e767. |
| [9] | Wu MB, Wu GL, Wu GQ. 1569 cases of antivenom treatment of snake bite[J]. J Snake(蛇志), 2005, 17:13-14. |
| [10] | Lu HR. Prevention and nursing of the side-effect induced by antivenom[J]. Contemporary Med(当代医学), 2009, 15:103. |
| [11] | Yuan CD. Analysis of allergic reaction induced by antivenom[J]. Chin J General Pract(中华全科医学), 2014, 12:516-518. |
| [12] | Harrison RA, Cook DA, Renjifo C, et al. Research strategies to improve snakebite treatment:challenges and progress[J]. J Proteomics, 2011, 74:1768-1780. |
| [13] | Harrison RA. Development of venom toxin-specific antibodies by DNA immunisation:rationale and strategies to improve therapy of viper envenoming[J]. Vaccine, 2004, 22:1648-1655. |
| [14] | Wagstaff SC, Laing GD, Theakston RD, et al. Bioinformatics and multiepitope DNA immunization to design rational snake antivenom[J]. PLoS Med, 2006, 3:e18. |
| [15] | Leão LI, Ho PL, Junqueira-de-Azevedo Ide L. Transcrip-tomic basis for an antiserum against Micrurus corallinus(coral snake) venom[J]. BMC Genomics, 2009, 10:112. |
| [16] | Word Health Organization. WHO Guidelines for the Production Control and Regulation of Snake Antivenom Immunoglobulins[R]. Word Health Organization, 2010. |
| [17] | Stephano MA, Guidolin R, Higashi HG, et al. The improve-ment of the therapeutic anti-Lachesismuta serum production in horses[J]. Toxicon, 2005, 45:467-473. |
| [18] | Calvete JJ, Sanz L, Angulo Y, et al. Venoms, venomics, antivenomics[J]. FEBS Lett, 2009, 583:1736-1743. |
| [19] | Lomonte B, Escolano J, Fernández J, et al. Snake venomics and antivenomics of the arboreal neotropical pitvipers Both-riechis lateralis and Bothriechis schlegelii[J]. J Proteome Res, 2008, 7:2445-2457. |
| [20] | Calvete JJ. Proteomic tools against the neglected pathology of snake bite envenoming[J]. Expert Rev Proteomics, 2011, 8:739-758. |
| [21] | Pla D, Gutiérrez JM, Calvete JJ. Second generation snake antivenomics:comparing immunoaffinity and immunodepletion protocols[J]. Toxicon, 2012, 60:688-699. |
| [22] | New RR, Theakston RD, Zumbuhl O, et al. Immunization against snake venoms[J]. N Engl J Med, 1984, 311:56-57. |
| [23] | Waghmare AB, Deopurkar RL, Salvi N, et al. Comparison of montanide adjuvants, IMS 3012(nanoparticle), ISA 206 and ISA 35(emulsion based) along with incomplete Freund's adjuvant for hyperimmunization of equines used for production of polyvalent snake antivenom[J]. Vaccine, 2009, 27:1067-1072. |
| [24] | Waghmare AB, Salvi NC, Deopurkar RL, et al. Evaluation of health status of horses immunized with snake venom and montanide adjuvants, IMS 3012(nanoparticle), ISA 206 and ISA 35(emulsion based) during polyvalent snake antivenom production:hematological and biochemical assessment[J]. Toxicon, 2014, 82:83-92. |
| [25] | Cook DA, Owen T, Wagstaff SC, et al. Analysis of camelid IgG for antivenom development:serological responses of venom-immunised camels to prepare either monospecific or polyspecific anti-venoms for West Africa[J]. Toxicon, 2010, 56:363-372. |
| [26] | Omidfar K, Rasaee MJ, Kashanian S, et al. Studies of thermostability in Camelus bactrianus(Bactrian camel) sin-gle-domain antibody specific for the mutant epider-mal-growth-factor receptor expressed by Pichia[J]. Biotechnol Appl Biochem, 2007, 46:41-49. |
| [27] | Herrera M, Leon G, Segura A, et al. Factors associated with adverse reactions induced by caprylic acid-fractionated whole IgG preparations:comparison between horse, sheep and camel IgGs[J]. Toxicon, 2005, 46:775-781. |
| [28] | Freitas TV, Fortes-Dias CL, Diniz CR, et al. Immunization of horses with Crotalus durissus terrificus(South American rattlesnake) venom. A comparison of four different procedures[J]. Braz J Med Biol Res, 1991, 24:281-290. |
| [29] | Chotwiwatthanakun C, Pratanaphon R, Akesowan S, et al. Production of potent polyvalent antivenom against three elapid venoms using a low dose, low volume, multi-site immunization protocol[J]. Toxicon, 2001, 39:1487-1494. |
| [30] | El-Kady EM, Ibrahim NM, Wahby AF. Assessment of the anti-Naja haje antibodies elicited in a low dose multi-site immunization protocol[J]. Toxicon, 2009, 54:450-459. |
| [31] | Wang LL. The progress of snake antivenom application[J]. J Mod Clin Med Bioengineer(现代临床医学生物工程学杂志), 1995, 1:71-73. |
| [32] | Fusco LS, Rodríguez JP, Teibler P, et al. New immunization protocol to produce crotalicantivenom combining Crotalus durissus terrificus venom and its PLA2[J]. Biologicals, 2015, 43:62-70. |
| [33] | Pornmuttakun D, Ratanabanangkoon K. Development of an in vitro potency assay for antivenom against Malayan pit viper(Calloselasmarhodostoma)[J]. Toxicon, 2014, 77:1-5. |
| [34] | Casewell NR, CookDA, Wagstaff SC, et al. Pre-clinical assays predict pan-African Echis viper efficacy for a spe-cies-specific antivenom[J]. PLoS Negl Trop Dis, 2010, 4:e851. |
| [35] | Al-Abdulla I, Casewell NR, Landon J. Single-reagent one-step procedures forthe purification of ovine IgG, F(ab')2 and Fab antivenoms by caprylic acid[J]. J Immunol Methods, 2014, 402:15-22. |
| [36] | Vargas M, Segura Á, Villalta M, et al. Purification of equine whole IgG snake antivenom by using an aqueous two phase system as a primary purification step[J]. Biologicals, 2015, 43:37-46. |
| [37] | Raweerith R, Ratanabanangkoon K. Fractionation of equine antivenom using caprylic acid precipitation in combination with cationic ion-exchange chromatography[J]. J Immunol Methods, 2003, 282:63-72. |
| [38] | Otero-Patiño R, Segura A, Herrera M, et al. Comparative study of the efficacy and safety of two polyvalent, caprylic acid fractionated IgG and F(ab')2 antivenoms, in Bothropsasper bites in Colombia[J]. Toxicon, 2012, 59:344-355. |
| [39] | Wang L, Sun X, Ghosh R. Purification of equine IgG using membrane based enhanced hybrid bioseparation technique:a potential method for manufacturing hyperimmune antibody[J]. Biotechnol Bioeng, 2008, 99:625-633. |
 2015, Vol. 50
2015, Vol. 50


