鞘脂 (sphingolipids,SPL) 广泛存在于动物、植物、真菌、原核动物和病毒中,是细胞膜结构的重要组成部分。近年来,随着鞘脂代谢过程中多种调控蛋白和酶类被克隆、鞘脂代谢通路特定基因敲除小鼠和酶抑制剂的出现、以及质谱技术的进步,鞘脂功能及其与疾病关系的研究突飞猛进,不断有新的发现被报道,其中研究较多的为神经酰胺 (ceramide)、鞘氨醇 (sphingosine)、1-磷酸神经酰胺 (ceramide-1-phosphate,C-1-P) 和1-磷酸鞘氨醇(sphingosine-1-phosphate,S-1-P)。越来越多的证据显示这些鞘脂不仅是细胞膜的组成成分,而且具有重要的生物学功能,参与多种生理过程,包括血管生成、基因表达、细胞增殖、细胞分化、迁移、黏附、衰老和凋亡等。
肝脏是多功能器官,在机体的代谢、生物合成、分泌及解毒等方面处于核心地位。近年来有研究发现鞘脂代谢参与了肝脏疾病的发生发展过程。本文就鞘脂的基本结构、代谢通路、生物学功能及其在肝脏疾病中作用的最新进展进行总结与讨论。
1 鞘脂 1.1 鞘脂的结构鞘磷脂是人类细胞中最丰富的复杂鞘脂,是由鞘氨醇、脂肪酸、磷酸胆碱组成的两性脂类。鞘氨醇是包括鞘磷脂在内所有鞘脂的基本结构骨架,其骨架上连接饱和或单不饱和脂肪酸衍生物构成神经酰胺,通常这些脂肪酸的碳链长度在14到26个碳原子之间,特殊皮肤表层还存在碳链长度大于26个碳原子的神经酰胺。神经酰胺被进一步修饰连接一个磷酸胆碱头部,形成鞘磷脂 (图 1)。因连接在鞘氨醇基上的脂肪酸碳链长度、饱和度和羟基个数多样,使得鞘脂的种类数量巨大。
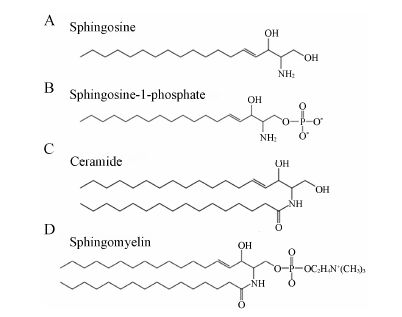
|
Figure 1 Structure of key sphingolipid molecules |
鞘脂的合成包括从头合成途径和补救合成途径。从头合成途径 (图 2) 开始于内质网的胞浆侧及与内质网相连的质膜上: L-丝氨酸和棕榈酰CoA通过丝氨酸棕榈酰转移酶 (serine palmitoyltransferase,SPT) 合成3-酮基二氢鞘氨醇,然后被 还原酶还原为二氢鞘氨醇,SPT是鞘脂从头合成途径的限速酶。生成的二氢鞘氨醇在神经酰胺合成酶 (ceramide synthase,CerS) 的作用下合成二氢神经酰胺。已发现的CerS有6种,每种CerS的组织分布不同,对不同碳链长度的乙酰CoA亦具有不同的优先选择性 (表1),从而合成多样的二氢神经酰胺。生成的二氢神经酰胺再由去饱和酶 (desaturase,DES) 引入双键合成神经酰胺。
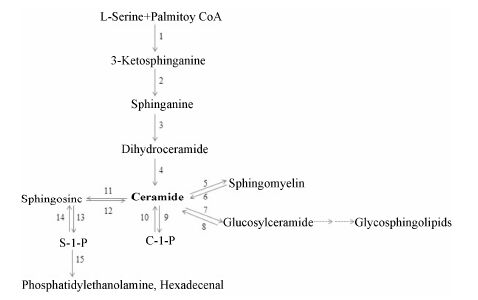
|
Figure 2 Biosynthesis of sphingolipids. 1: Serine palmitoyltransferase; 2: 3-Ketosphinganine reductase; 3: Dihydroceramide synthase; 4: Desaturase; 5: Sphingomyelin synthase; 6: Sphingomyelinase; 7: Glc-ceramide synthase; 8: Glucosidase; 9: Ceramide kinase; 10: Ceramide-1-phosphate phosphatase; 11: Ceramidase; 12: Ceramide synthase; 13: Sphingosine kinase; 14: Lipid phosphate phosphatases or sphingosine-1-phosphate phosphatase; 15: Sphingosine-1-phosphate lyase |
合成的神经酰胺被转运到高尔基体合成复杂的鞘脂、鞘糖脂及C-1-P。细胞通过两种机制转运神经酰胺: 囊泡和神经酰胺转运蛋白 (ceramide transfer protein,CERT)。CERT是胞浆蛋白,由4个功能结构域构成,即PH区域 (N-末端)、FFAT区域、START区域 (C-末端) 及球状结构域。由CERT转运到高尔基体的神经酰胺可以在鞘磷脂合成酶 (sphingomyelin synthase,SMS) 的作用下生成鞘磷脂,也可被神经酰胺激酶 (ceramide kinase,CERK) 磷酸化为C-1-P。囊泡运输主要负责将神经酰胺转运到顺式高尔基体合成葡糖神经酰胺 (glucosylceramide,GluCer),再由4-磷酸接头蛋白2将葡糖神经酰胺转运到反式高尔基体上合成更为复杂的鞘糖脂类。生成的鞘磷脂、鞘糖脂及C-1-P被转运到质膜上,行使功能。
|
|
Table 1 The tissue distribution and fatty acid specificity of CerS |
SPL是细胞膜的重要组成部分,通过合成和降解维持其在膜上的稳态十分重要。鞘磷脂酶 (sphingomyelinase,SMase) 能水解鞘磷脂的磷酸胆碱头部生成神经酰胺和磷酸胆碱。根据目前的研究,哺乳动物SMase家族根据最适pH值不同可分为3类: 碱性鞘磷脂酶 (alkaline sphingomyelinase,ALKSMase)、酸性鞘磷脂酶 (acid sphingomyelinase,ASMase) 和中性鞘磷脂酶 (neutral sphingomyelinase,NSMase),此3类SMase催化相似的反应,但有不同的组织和亚细胞器分布。ALKSMase只分布于肠和肝脏,主要负责消化食物中的鞘磷脂,也参与细胞信号转导过程。ASMase以3种形式存在于细胞内: 溶酶体ASMase、分泌型ASMase及位于质膜上的ASMase。Hannun等[1]研究发现PKCδ (protein kinase Cδ) 对于ASMase的激活至关重要。NSMase有3种亚型: NSMase 1、NSMase 2和NSMase 3,其中NSMase 2初始状态分布于高尔基体,当细胞受到刺激 (如肿瘤坏死因子、过氧化氢) 或者发生融合时,NSMase 2半胱氨酸位点发生棕榈酰化,转位于细胞膜,调控细胞信号转导及多种生理过程[2]。
在SMase的作用下,所有鞘磷脂最终被降解为神经酰胺。神经酰胺又在神经酰胺酶 (ceramidase,CDase) 的作用下去乙酰化生成鞘氨醇,这是体内生成鞘氨醇的唯一途径。鞘氨醇能被鞘氨醇激酶磷酸 化为S-1-P。生成的S-1-P可被脂质磷酸盐磷酸酶 (lipid phosphate phosphatase,LPP) 及S-1-P磷酸酶 (sphingosine-1-phosphate phosphatase,SPPase) 去磷酸化。SPPase催化产生的鞘氨醇能参与体内神经酰胺的补救合成途径。此外,S-1-P还能被S-1-P裂解酶 (S1P lyase,SPL) 降解生成磷酸乙醇胺和十六碳醛,最终经一系列酶降解为棕榈酰-CoA,进入甘油磷脂代谢通路。
前已提及,除从头合成途径外,鞘磷脂合成还存在补救合成途径: 溶酶体内的鞘磷脂及鞘糖脂降解产生神经酰胺,神经酰胺由CDase催化产生鞘氨醇,鞘氨醇离开溶酶体,重新进入鞘脂代谢途径,生成神经酰胺和鞘磷脂等。研究[3]发现,在过氧化氢、肿瘤坏死因子等的刺激下,细胞内通过补救合成途径生成的神经酰胺增多。并且,补救合成途径产生的神经酰胺在激活神经酰胺激活蛋白磷酸酶 (ceramide- activated protein phosphatases,CAPPs)、抑制PKC依赖的胞内物质转运、抑制端粒酶活性、介导细胞凋亡等方面发挥重要作用。
2 鞘脂代谢在肝脏疾病中的作用许多肝脏疾病都伴随着肝细胞凋亡,包括病毒性肝炎、脂肪肝、缺血再灌注性肝损伤、爆发性肝炎、肝硬化及肝细胞癌等。许多研究表明,鞘脂参与了应激及死亡配体诱导的肝细胞凋亡[4]。在众多死亡配体中,肿瘤坏死因子(tumor necrosis factor,TNF) 与肝脏病理损伤过程最为相关。TNF主要是由激活的巨噬细胞产生的一种多功能促炎症细胞因子,能影响肝细胞一系列生理过程,包括细胞增殖、生长、炎症及再生和凋亡。TNF受体包括TR55 (TNF-receptors 55)、TR75 (TNF-receptors 75)、TNF-R1 (TNF-receptors 1) 及TNF-R2 (TNF-receptors 2),其中TNF-R1是介导凋亡信号的主要受体。TNF-R1在肝实质细胞、Kupffer细胞上高表达,其胞内结构域有死亡结构域 (death domain,DD)、内化结构域 (internalization domain,TRID) 及中性鞘磷脂酶结构域 (neutral sphingomyelinase domain,NSD) 等,研究显示NSD结构域能与NSMase结合因子 (factor associated with neutral sphingomyelinase,FAN) 结合,激活质膜上的NSMase,从而水解鞘磷脂使神经酰胺含量增加[5]。有研究显示,在选择性去除TNF-R1的TRID结构域后,在TNF的刺激下,虽然细胞内死亡诱导信号复合物 (death inducing signaling complex,DISC) 不能形成,但仍然可由于FAN介导NSMase的激活而引起caspase-3活化和细胞凋亡[6]。除NSMase外,ASMase也参与了TNF介导的肝细胞凋亡。Carmen等[7]研究发现ASMase基因敲除的小鼠原代肝细胞能抵抗TNF-α介导的肝细胞凋亡; 其体内实验也表明,ASMase基因敲除的小鼠能降低TNF-α或脂多糖 (lipopolysaccharide,LPS) 联合半乳糖胺引起的肝细胞损伤。研究显示ASMase可能通过双重机制参与TNF介导的肝细胞凋亡: TNF-α结合受体TNF-R1,激活ASMase使胞内神经酰胺生成增加,一方面神经酰胺使神经节苷脂靶向定位于线粒体,激活线粒体依赖的凋亡小体形成,并抑制NF-κB依赖的细胞存活途径; 另一方面神经酰胺下调腺苷蛋氨酸转移酶,引起细胞内谷胱甘肽的耗竭及线粒体去极化,从而诱导肝细胞氧化应激损伤[4]。此外有研究发现,在紫外线照射等应激条件下,成纤维母细胞溶酶体内的ASMase被激活,生成的神经酰胺能直接激活组织蛋白酶D,从而引起下游促凋亡蛋白Bid活化[8]。不同于溶酶体内的ASMase,研究发现细胞内的ASMase被激活后可转位于质膜上,通过水解质膜上的鞘磷脂产生神经酰胺,进而影响脂筏等脂质微区的形成,影响信号转导过程[9, 10]。
除鞘磷脂酶,还有研究表明神经酰胺/S-1-P是决定肝细胞是否凋亡的关键因子,TNF-α能激活肝细胞内的ASMase,引起C-16神经酰胺堆积并导致细胞凋亡,而NCDase(neutral ceramidase)可促进C-16神经酰胺降解及S-1-P的生成,激活AKT通路,从而保护肝细胞,因此,神经酰胺/S-1-P可直接影响TNF-α诱导的肝细胞凋亡[11]。此外Ullio等[12]研究显示,鞘氨醇也是诱导肝细胞凋亡的因素之一,使用TNF联合放线菌酮诱导大鼠肝癌细胞系HTC,由神经酰胺降解产生的鞘氨醇引起溶酶体膜通透性增加、组织蛋白酶释放,最终引起细胞凋亡。各类鞘脂分子在肝细胞凋亡中的作用值得进一步深入研究。
2.1 鞘脂与肝脏缺血再灌注损伤肝脏缺血再灌注 (ischemia reperfusion,IR) 损伤是肝脏外科手术 常见的病理过程,由于肝细胞大量凋亡坏死而引起肝脏功能降低,直接影响到疾病的预后、手术的成功率和患者的存活率。通过基质辅助激光解吸电离飞 行时间质谱技术检测大鼠肝脏缺血再灌注模型,发现再灌注后6 h,肝脏内鞘磷脂和神经酰胺含量显著增加[13]。研究[14]发现,在IR时,肝脏中被激活的Kupffer细胞及迁移到肝脏中的白细胞均能释放TNF,TNF结合于肝细胞的TNFR1,激活胞内ASMase,使神经酰胺含量增加。肝细胞内增加的神经酰胺激活JNK(c-Jun N-terminal kinase),导致线粒体功能失调,膜通透性增加及细胞色素C释放,引起肝细胞凋亡。使用ASMase抑制剂丙咪嗪 (能水解被激活的ASMase) 或通过siRNA技术干扰体内ASMase活性,能显著降低IR时肝脏内神经酰胺的产生、血清转氨酶的释放及肝细胞的损伤程度[15]。这些研究表明神经酰胺在IR诱导的肝细胞损伤中起着重要的作用,抑制ASMase活性可能是治疗IR损伤的潜在靶点。
2.2 鞘脂与脂肪性肝病非酒精性脂肪性肝病 (non-alcoholic fatty liver disease,NAFLD) 是一种慢性肝脏疾病,包括脂肪变性(肝脏脂肪堆积)、非酒精性脂肪肝炎 (non-alcoholic steatohepatitis,NASH),NASH很可能恶化为肝硬化及肝细胞癌。近年来,NAFLD的发病率呈逐年增加的趋势。1998年Day等[16]提出NAFLD发病机制的“二次打击”假说,“一次打击”指肝脏中脂质堆积及胰岛素抵抗,使肝脏对各种刺激的敏感度增加,“二次打击”包括氧化应激及炎症性细胞因子的释放,促进NAFLD发生,最终导致炎症、纤维化及NASH。在众多打击因素中,甘油三酯堆积及胰岛素抵抗是NAFLD发生发展过 程中关键性的危险因子[17],胰岛素抵抗能增加肝脏负担,引起线粒体功能失调及脂毒性,促进NAFLD发生[18, 19]。近年来,越来越多的实验表明,神经酰胺也是影响NAFLD发生发展的重要因素。首先,神经酰胺促进肝脏胰岛素抵抗。研究表明使用含有短链 神经酰胺的培养液培养肝细胞,能降低胰岛素介导的PKB及葡糖激酶的激活[20, 21]。给高脂肪饮食诱导的肥胖小鼠注射神经酰胺从头合成途径抑制剂多球壳菌素 (myriocin),能促进肝脏及肌肉中AKT磷酸化,增敏胰岛素信号传递,促进机体葡萄糖利用及平衡[22]。神经酰胺促进胰岛素抵抗会加剧脂肪分解,增加进入肝脏游离脂肪酸 (FFA) 的含量,导致肝脏脂质堆积。其次,神经酰胺促进线粒体ROS的产生: 一方面神经酰胺通过抑制线粒体复合物Ⅲ及调控NADPH直接调节离体线粒体呼吸链; 另一方面TNF-α激活ASMase,产生的神经酰胺及GD3引起线粒体功能失调及ROS的产生,促进炎症细胞因子的募集,增加肝细胞炎症[23]。Jonathan等[24]研究发现脂联素受体能调控CDase的活性,增加神经酰胺的降解并促进S-1-P的生成,体内注射脂联素能降低肝脏中神经酰胺的含量,增加高脂饮食诱导动物模型中肝脏对胰岛素的敏感度,从而降低肝细胞凋亡。这些研究提示神经酰胺参与了NAFLD的发生发展过程,是胰岛素抵抗和炎症的诱发性因子之一,最终导致NASH的发生及恶化[25]。
酒精性肝病 (alcoholic liver disease,ALD) 亦是目前发病率较高的肝脏疾病之一。流行病学统计显示约40% 的脂肪肝患者会发展为肝纤维化,8%~20%的患者将恶化为肝细胞癌[26, 27],严重影响了ALD患者的预后及生存率。近年来研究发现,除炎症细胞因子、基因的多态性等因素[28]外,神经酰胺在ALD的发生发展中亦起着重要作用。Fernandez等[29]研究发现,慢性酒精饲养能激活肝细胞内的ASMase,使神经酰胺含量增加并诱导脂肪肝,而ASMase-/-小鼠能抵抗酒精诱导的线粒体内胆固醇堆积及谷胱甘肽的降解,提示,由ASMase激活产生的神经酰胺可能是诱导内质网应激及后续脂肪合成的关键因子。此外,使用神经酰胺从头合成抑制剂myriocin能明显降低ALD大鼠肝脏内脂质及神经酰胺的堆积,降低氧化应激,改善ALD[30]。体外实验也证明神经酰胺在ALD发生发展过程中的重要作用,使用乙醇刺激肝癌细胞系HepG2细胞,可见细胞内NSMase的激活、神经酰胺增多及肝细胞凋亡,Liangpunsakul等[31]和Ramirez等[32]认为,酒精诱导的肝脏胰岛素抵抗能激活mal信号转导通路,一方面使脂质分解增加并使神经酰胺堆积于内质网,从而抑制MAPK激活 ,导致内质网应激; 另一方面神经酰胺被转运到肝细胞膜脂筏上,加剧胰岛素抵抗,最终导致炎症、ROS的产生及肝细胞凋亡。
2.3 鞘脂与病毒性肝炎丙型肝炎病毒 (hepatitis C virus,HCV) 是一种线性正链RNA病毒,属于黄病毒家族。目前全球大约有8 000万人感染HCV[33],其中,巴基斯坦、尼日利亚、埃及、印度、中国和俄罗斯的感染者约占总感染人数的50%。需要引起注意 的是,HCV感染更易慢性化,而约1/3的慢性HCV感染者将会进一步恶化为肝硬化及肝细胞癌。研究表明,HCV的生活周期、复制增殖与脂质代谢过程密切相关,众多功能性鞘脂参与了HCV的感染过程。Voisset等[34]研究发现,使用SMase增加质膜上神经酰胺的含量,能改变细胞膜的生物物理特性,加速四跨膜蛋白CD81的内化,从而抑制HCV病毒进入细胞,提示质膜上特定鞘脂可能成为抑制HCV进入肝细胞的潜在靶点。同时,HCV复制时其非结构蛋白通常与宿主高尔基体和内质网的脂筏相连接,使用myriocin的结构类似物——NA255能阻断鞘脂的合成,破坏脂筏的结构从而抑制HCV的复制[35, 36]。研究亦表明,慢性HCV感染患者血清中ASMase水平明显高于正常人,提示特定鞘脂及相关酶可能成为HCV感染的新型标志物[37]。
乙型肝炎病毒 (hepatitis B virus,HBV) 是一种DNA病毒,全球大概有3.5亿人口感染HBV[38],我国就有1亿感染者。HBV感染、HBV慢性肝炎及由HBV引起的肝硬化和肝癌是多年来影响我国人民健康的重大疾病。Tatematsu等[39]研究发现SPT参与了HBV的复制过程,使用SPT特异性抑制剂myriocin处理HuH7细胞,能显著降低细胞上清液中HBV DNA的表达。体内实验也证明,使用myriocin联合聚乙二醇干扰素能显著抑制小鼠体内HBV的复制,因此推测SPT有可能成为抑制HBV复制药物的潜 在靶点。作者的研究团队最近研究[40]发现: 乙型肝炎、乙肝相关肝硬化及乙肝相关慢加急性肝衰竭患者 (HBV-acute-on-chronic liver failure,HBV-ACLF) 血清中各鞘脂成分组成不同于正常对照组,更重要的是,HBV-ACLF预后不良的患者血清中dhCer (d18:0/ 24:0) 含量显著低于HBV-ACLF预后良好的患者,dhCer (d18:0/24:0) 有可能成为判断HBV-ACLF患者预后的生物标记物,这对及时治疗和降低HBV-ACLF死亡率具有重要意义,正在进一步研究。
2.4 鞘脂与肝癌脂肪性肝病、病毒性肝炎、肝纤维化等都有可能恶化为肝细胞性肝癌 (hepatocellular carcinoma,HCC)。肝癌是世界上发病率及死亡率均较高的恶性肿瘤之一,全球每年新增约50~100万肝癌患者。在中国,HCC已经成为癌症患者的主要死因之一。近年来研究发现,鞘脂在代谢过程中产生的活性分子参与了肝癌的发生发展过程。通过对肝癌患者基因甲基化分析,发现鞘磷脂磷酸二酯酶3 (sphingomyelin phosphodiesterase 3,SMPD3) 是影响肿瘤侵袭和迁移的抑制性基因,能作为肝癌预后潜在的独立性诊断因子[41]。此外,使用区域假设分析肝癌细胞中鞘脂相关酶基因表达,发现神经酰胺从头合成途径相关酶基因表达未发生改变,但由鞘磷脂降解为神经酰胺代谢通路相关酶的基因表达下调,CDase及鞘氨醇激酶 (sphingsine kinase,SPHK) 活性升高[42]。许多细胞因子、抗肿瘤药物能通过影响神经酰胺从头合成途径或者鞘磷脂的降解增加内源性神经酰胺的含量,并抑制S-1-P的生成,从而引起肿瘤细胞凋亡,发挥抗肿瘤作用。如亚硝酸盐联合SPHK1抑制剂能显著增加肝癌细胞系Huh7细胞内ROS的产生及神经酰胺的含量,进而促进肝癌细胞凋亡,亚硝酸盐联合SPHK1抑制剂可能成为肝癌的潜在治疗方法[43]。此外,Radoslav等[44]研究表明,ASMase与索拉菲尼具有协同效应,使用ASMase辅助治疗肝癌,能显著降低肿瘤的大小及肿瘤血管的生成。提示鞘脂分子及相关酶类有望成为肿瘤治疗的新靶点。
2.5 鞘脂与其他肝脏疾病除病毒性肝炎、脂肪肝、肝脏缺血再灌注损伤及肝细胞癌外,鞘脂还参与了其他肝脏疾病。近年来研究发现,SM相关酶及代谢物参与了肝纤维化的发生发展过程,在二甲基二硝铵诱导的SD大鼠肝纤维化模型中,SMase及CDase活性显著变化[45]。体外小鼠肝星状细胞分化为纤维样细胞的过程中,可见ASMase活性升高,并伴随下游组织蛋白酶B、C的激活[46]。使用ASMase特异性抑制剂可明显降低四氯化碳诱导的小鼠肝纤维化的发生率[47]。并且,有研究显示SPHK/S1P/S1PR信号通路是肝纤维化发生发展过程中重要的环节[48]。此外,研究表明许多药物的肝保护作用机制是影响鞘脂代谢通路、降低肝细胞内神经酰胺堆积,如黄酮类化合物[49]、维生素E[50]等。
3 总结与前景展望鞘脂包括多种脂质分子,它们不仅仅是生物膜的重要组成部分,同时也具有多种生物活性,影响细胞功能。在众多鞘脂中,神经酰胺是复杂鞘脂合成的基本骨架,位于鞘脂代谢的中心环节,神经酰胺可以由SPT催化从头合成,也可以由鞘磷脂酶水解快速产生,还可以通过补救合成途径合成。研究发现神经酰胺是介导细胞死亡、炎症、氧化应激及胰岛素抵抗的重要第二信使,参与了肝脏疾病发生发展的多个环节 (图 3),特别是由ASMase介导的鞘磷脂水解为神经酰胺,能在细胞膜上形成神经酰胺的富集区域,增加肝细胞对各种刺激的敏感性,影响肝细胞凋亡、存活、增殖及细胞-细胞间的相互作用。除神经酰胺外,C-1-P和S-1-P也是被广泛研究具有生物活性的鞘脂分子,但与神经酰胺不同,S-1-P和C-1-P通常被认为具有抵抗凋亡的作用,能够促进细胞增殖。这些活性鞘脂分子均参与了NAFLD、ALD、病毒性肝炎、肝纤维化及肝细胞癌等多种肝病的发生发展过程,但研究多处于起步阶段,多个机制尚需进一步阐明。本实验室正在开展鞘脂代谢通路与肝病关系的相关研究。
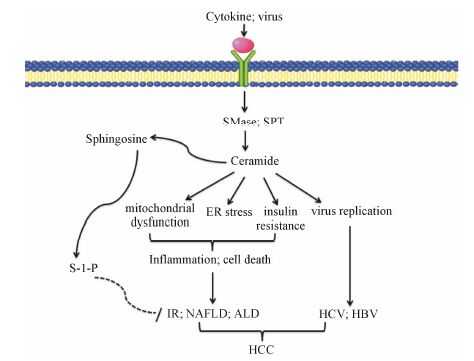
|
Figure 3 Role of sphingomyelin in liver disease. SMase: Sphingomyelinase; SPT: Serine palmitoyltransferase; IR: Ischemia reperfusion; NAFLD: Non-alcoholic fatty liver disease; ALD: Alcoholic liver disease; HCC: Hepatocellular carcinoma |
以鞘脂代谢过程中相关酶为靶点,设计药物用于治疗疾病已成为近年来关注的热点。其中最为成功的是于2010年被美国FDA批准上市的鞘氨醇结构类似物——芬戈莫德(fingolimod,FTY720),芬戈莫德在体内可被SK2磷酸化,是S-1-P受体激动剂。其是第一个被批准用于治疗多发性硬化症 (multiple sclerosis,MS) 的口服制剂,临床上还用于治疗肾脏移植排斥及再灌注损伤[51]。除芬戈莫德外,一些研究提示多个已经上市的药物能通过影响鞘脂代谢发挥治疗作用,如三环类抗抑郁药及二磷酸盐类具有抑制ASMase活性的作用[52]。鞘脂代谢通路及相关酶研究虽已获得了长足进展,但仍有很多问题有待解决,尤其是在肝病研究领域中,以鞘脂代谢为靶点的药物设计及研究均较少。进一步研究肝脏疾病中鞘脂代谢的变化及生物活性鞘脂分子在肝脏疾病发生发展中的作用,将有助于深入了解肝脏疾病的发病机制,针对病因设计更完善的诊疗方案。以鞘脂代谢通路及相关代谢酶为药物靶标研制肝脏疾病防治药物,值得开展。
| [1] | Zeidan YH, Hannun YA. Activation of acid sphingomyeli-nase by protein kinase C delta-mediated phosphorylation[J]. J Biol Chem, 2007, 282:11549-11561. |
| [2] | Wu BX, Clarke JC, Hannun YA. Mammalian neutral sphingomyelinases:regulation and roles in cell signaling responses[J]. Neuromolecular Med, 2010, 12:320-330. |
| [3] | Kitatani K, Idkowiak-Baldys J, Hannun YA. The sphingol-ipid salvage pathway in ceramide metabolism and signaling[J]. Cell Signal, 2008, 20:1010-1018. |
| [4] | Marí M1, Fernández-Checa JC. Sphingolipid signalling and liver diseases[J]. Liver Int, 2007, 27:1478-3223. |
| [5] | Adam-Klages S, Adam D, Wiegmann K, et al. FAN, a novel WD-repeat protein, couples the p55 TNF-receptor to neutral sphingomyelinase[J]. Cell, 1996, 86:937-947. |
| [6] | Neumeyer J, Hallas C, Merkel O, et al. TNF-receptor I defective in internalization allows for cell death through activation of neutral sphingomyelinase[J]. Exp Cell Res, 2006, 312:2142-2153. |
| [7] | García-Ruiz C, Colell A, Marí M, et al. Defective TNF-α-mediated hepatocellular apoptosis and liver damage in acidic sphingomyelinase knockout mice[J]. J Clin Invest, 2003, 111:197-208. |
| [8] | Heinrich M, Neumeyer J, Jakob M, et al. Cathepsin D links TNF-induced acid sphingomyelinase to Bid-mediated caspase-9 and-3 activation[J]. Cell Death Differ, 2004, 11:550-563. |
| [9] | Grassmé H, Jekle A, Riehle A, et al. CD95 signaling via ceramide-rich membrane rafts[J]. J Biol Chem, 2001, 276:20589-20596. |
| [10] | Grassmé H, Schwarz H, Gulbins E. Molecular mecha-nisms of ceramide-mediated CD95 clustering[J]. Biochem Biophys Res Commun, 2001, 284:1016-1030. |
| [11] | Osawa Y, Uchinami H, Bielawski J, et al. Roles for C16-ceramide and sphingosine 1-phosphate in regulating hepatocyte apoptosis in response to tumor necrosis factor[J]. J Biol Chem, 2005, 280:27879-27887. |
| [12] | Ullio C, Casas J, Brunk UT, et al. Sphingosine mediates TNF-induced lysosomal membrane permeabilization and ensuing programmed cell death in hepatoma cells[J]. J Lipid Res, 2012, 53:1134-1143. |
| [13] | Zhai ST, Liu GY, Xue F, et al. Changes of sphingolipids profiles after ischemia reperfusion injury in the rat liver[J]. Chin Med J, 2009, 122:3025-3031. |
| [14] | Shuh M, Bohorquez H, Loss GE Jr, et al. Tumor necrosis factor-α:life and death of hepatocytes during liver ische-mia/reperfusion injury[J]. Ochsner J, 2013, 13:119-130. |
| [15] | Llacuna L, Marí M, Garcia-Ruiz C, et al. Critical role of acidic sphingomyelinase in murine hepatic ischemia-reperfusion injury[J]. Hepatology, 2006, 44:561-572. |
| [16] | Day CP, James OF. Steatohepatitis:a tale of two "hits"?[J]. Gastroenterology, 1998, 11:842-845. |
| [17] | Browning JD, Horton JD. Molecular mediators of hepatic steatosis and liver injury[J]. J Clin Invest, 2004, 114:147-152. |
| [18] | Gaggini M, Morelli M, Buzzigoli E. Non-alcoholic fatty liver disease and its connection with insulin resistance, dyslipidemia, atherosclerosis and coronary heart disease[J]. Nutrients, 2013, 5:1544-1560. |
| [19] | García-Ruiz C, Baulies A, Mari M, et al. Mitochondrial dysfunction in non-alcoholic fatty liver disease and insulin resistance:cause or consequence?[J]. Free Radic Res, 2013, 47:854-868. |
| [20] | Ribaux PG, Iynedjian PB. Analysis of the role of protein kinase B(cAKT) in insulin-dependent induction of glu-cokinase and sterol regulatory element-binding protein 1(SREBP1) mRNAs in hepatocytes[J]. Biochem J, 2003, 376:697-705. |
| [21] | Teruel T, Hernandez R, Lorenzo M. Ceramide mediates insulin resistance by tumor necrosis factor-α in brown adipocytes by maintaining Akt in an inactive dephosphorylated state[J]. Diabetes, 2001, 50:2563-2571. |
| [22] | Yang G, Badeanlou L, Bielawski J, et al. Central role of ceramide biosynthesis in body weight regulation, energy metabolism, and the metabolic syndrome[J]. Am J Physiol Endocrinol Metab, 2009, 297:211-224. |
| [23] | Pagadala M, Kasumov T, McCullough AJ, et al. Role of ceramides in nonalcoholic fatty liver disease[J]. Trends Endocrinol Metab, 2012, 23:365-371. |
| [24] | Holland WL, Miller RA, Wang ZV, et al. Recep-tor-mediated activation of ceramidase activity initiates the pleiotropic actions of adiponectin[J]. Nat Med, 2011, 17:55-64. |
| [25] | Xia JY, Morley TS, Scherer PE. The adipokine ceramide axis:key aspects of insulin sensitization[J]. Biochimie, 2014, 96:130-139. |
| [26] | Altamirano J, Bataller R. Alcoholic liver disease:pathogenesis and new targets for therapy[J]. Nat Rev Gastroenterol Hepatol, 2011, 8:491-501. |
| [27] | Teli MR, Day CP, Burt AD. Determinants of progression to cirrhosis or fibrosis in pure alcoholic fatty liver[J]. Lancet, 1995, 346:987-990. |
| [28] | Orman ES, Odena G, Bataller R. Alcoholic liver disease:Pathogenesis, management, and novel targets for therapy[J]. Nat Rev Gastroenterol Hepatol, 2013, 28:77-84. |
| [29] | Fernandez A, Matias N, Fucho R, et al. ASMase is re-quired for chronic alcohol induced hepatic endoplasmic reticulum stress and mitochondrial cholesterol loading[J]. Hepatol, 2013, 59:805-813. |
| [30] | Tong M, Longato L, Ramirez T, et al. Therapeutic reversal of chronic alcohol-related steatohepatitis with the ceramide inhibitor myriocin[J]. Int J Exp Pathol, 2014, 95:49-63. |
| [31] | Liangpunsakul S, Sozio MS, Shin E, et al. Inhibitory effect of ethanol on AMPK phosphorylation is mediated in part through elevated ceramide levels[J]. Am J Physiol Gastrointest Liver Physiol, 2010, 298:G1004-G1012. |
| [32] | Ramirez T, Longato L, Dostalek M, et al. Insulin resis-tance, ceramide accumulation and endoplasmic reticulum stress in experimental chronic alcohol-induced steatohepatitis[J]. Alcohol Alcohol, 2013, 48:39-52. |
| [33] | Gower E, Estes C, Blach S, et al. Global epidemiology and genotype distribution of the hepatitis C virus infection[J]. Hepatol, 2014, 61:45-57. |
| [34] | Voisset C, Lavie M, Helle F. Ceramide enrichment of the plasma membrane induces CD81 internalization and inhibits hepatitis C virus entry[J]. Cell Microbiol, 2008, 10:606-617. |
| [35] | Sakamoto H, Okamoto K, Aoki M. Host sphingolipid biosynthesis as a target for hepatitis C virus therapy[J]. Nat Chem Biol, 2005, 1:333-337. |
| [36] | Umehara T, Sudoh M, Yasui F, et al. Serine palmitoyltrans-ferase inhibitor suppresses HCV replication in a mouse model[J]. Biochem Biophys Res Commun, 2006, 346:67-73. |
| [37] | Grammatikos G, Mühle C, Ferreiros N, et al. Serum acid sphingomyelinase is upregulated in chronic hepatitis C infection and non alcoholic fatty liver disease[J]. Biochim Biophys Acta, 2014, 1814:1012-1020. |
| [38] | Chen CJ, Yang HI. Natural history of chronic hepatitis B REVEALed[J]. J Gastroenterol Hepatol, 2011, 26:628-638. |
| [39] | Tatematsu K, Tanaka Y, Sugiyama M. Host sphingolipid biosynthesis is a promising therapeutic target for the inhibition of hepatitis B virus replication[J]. J Med Virol, 2011, 83:587-593. |
| [40] | Qu F, Zheng SJ, Liu S, et al. Serum sphingolipids reflect the severity of chronic HBV infection and predict the mortality of HBV-acute-on-chronic liver failure[J]. PLoS One, 2014, 9:e104988. |
| [41] | Revill K, Wang T, Lachenmayer A, et al. Genome-wide methylation analysis and epigenetic unmasking identify tumor suppressor genes in hepatocellular carcinoma[J]. Gastroen-terology, 2013, 145:1424-1435. |
| [42] | Pralhada Rao R, Vaidyanathan N, Rengasamy M, et al. Sphingolipid metabolic pathway:an overview of major roles played in human diseases[J]. J Lipids, 2013. doi:10.1155/2013/178910. |
| [43] | Chatzakos V, Rundlöf AK, Ahmed D, et al. Inhibition of sphingosine kinase 1 enhances cytotoxicity, ceramide levels and ROS formation in liver cancer cells treated with selenite[J]. Biochem Pharmacol, 2012, 84:712-721. |
| [44] | Savić R, He X, Fiel I, et al. Recombinant human acid sphingomyelinase as an adjuvant to sorafenib treatment of experimental liver cancer[J]. PLoS One, 2013, 8:e65620. |
| [45] | Sacket SJ, Dong-Soon IM. Acitivity change of sphingomyelin catabolic enzymes during dimethylnitrosamine-induced hepatic fibrosisi in rats[J]. Biomol Ther, 2008, 16:34-39. |
| [46] | Moles A, Tarrats N, Morales A, et al. Acidic sphingomyelinase controls hepatic stellate cell activation and in vivo liver fibrogenesis[J]. Am J Pathol, 2010, 177:1214-1224. |
| [47] | Quilin RC, Wilson GC, Nojima H, et al. Inhibition of acidic sphingomyelinase reduces established hepatic fibrosis in mice[J]. Hepatol Res, 2015, 45:305-314. |
| [48] | Li C, Zheng S, You H, et al. Sphingosine 1-phosphate(S1P)/S1P receptors are involved in human liver fibrosis by action on hepatic myofibroblasts motility[J]. J Hepatol, 2011, 54:1205-1213. |
| [49] | Babenko NA, Shakhova EG. Effects of flavonoids on sphingolipid turnover in the toxin-damaged liver and liver cells[J]. Lipids Health Dis, 2008, 7:180-188. |
| [50] | Babenko NA, Hassouneh LKh, Kharchenko VS. Vitamin E prevents the age-dependent and palmitate-induced distur-bances of sphingolipid turnover in liver cells[J]. Age(Dordr), 2012, 34:905-915. |
| [51] | Strader CR, Pearce CJ, Oberlies NH. Fingolimod(FTY720):a recently approved multiple sclerosis drug based on a fungal secondary metabolite[J]. J Nat Prod, 2011, 74:900-907. |
| [52] | Canals D, Perry DM, Jenkins RW, et al. Drug targeting of sphingolipid metabolism:sphingomyelinases and ceramidases[J]. Br J Pharmacol, 2011, 163:694-712. |
 2015, Vol. 50
2015, Vol. 50


