2. 南方医科大学广东省新药筛选重点实验室, 广东广州 510515;
3. 复旦大学基础医学院, 医学分子病毒学教育部/卫生部重点实验室, 上海 200032
2. New Drug Screening Key Lab of Guangdong Province, Southern Medical University, Guangzhou 510515, China;
3. Key Laboratory of Medical Molecular Virology of Ministries of Education and Health, Basic Medical College, Fudan University, Shanghai 200032, China
中东呼吸综合征冠状病毒 (Middle East respiratory syndrome-coronavirus,MERS-CoV) 是一种新型的冠状病毒。2012年6月,Zaki以及他的同事首次从一名死于严重肺炎伴随肾衰竭的60岁沙特阿拉伯男子中分离出一种新型的乙型冠状病毒[1]。自MERS-CoV发现以来,全球MERS发病范围已遍及26个国家和地区[2]。人感染MERS-CoV后,主要临床表现为严重的肺炎伴随急性呼吸道窘迫综合征。更为严重者常伴随多器官障碍,症状与感染SARS-CoV (severe acute respiratory syndrome-coronavirus) 后的症状非常相 似[3]。那些同时具有其他疾病的老年男性感染MERS- CoV后症状更为严重[4]。MERS病死率约35%[5],远高于SARS (死亡率约10%)[6],并且其相比于SARS,病情发展更为迅速[6]。虽然该病毒致死率较高,但是大多数MERS-CoV感染病例主要发生在中东地区,为一种地方性、低水平的公共卫生威胁[5]。而2015年春夏,MERS疫情在韩国严重爆发。此次疫情引起了国际社会对此强烈的关注。因此,研究开发防治MERS- CoV的有效药物无疑是对医药界提出的一大挑战。
当前,并无临床验证有效的抗MERS-CoV的药物。现处于研究阶段的抗MERS-CoV的药物主要有: 单克隆抗体、多肽和小分子化合物。其中最受关注的由中国复旦大学姜世勃团队研发的全人源单克隆抗体m336,据报道是目前针对MERS-CoV最好的候选药物之一,并且在动物试验中也具有较好的效果。相比于抗体生产周期长、价格昂贵,小分子化合物因其合成方便,价格低廉等优势更具有开发及大规模应用的前景。
1 MERS-CoV的基本结构及潜在药物靶点MERS-CoV是由一条正链RNA组成的具有包 膜的β型冠状病毒。其基因由30 119个核苷酸组成,其中包含10个以上的开放阅读区,编码复制酶、刺突糖蛋白 (spike protein,简称S蛋白)、小包膜糖蛋白 (envelope protein,简称E蛋白)、膜蛋白 (membrane protein,简称M蛋白)、核衣壳蛋白 (nucleocapsid protein,简称N蛋白) 等非结构及结构蛋白[7]。其中S蛋白具有与宿主细胞受体的结合位点,能介导病毒入侵宿主细胞[8]。
与其他冠状病毒相似,MERS-CoV进入细胞主 要通过内吞作用和膜融合两种途径。S蛋白属于Ⅰ型跨膜蛋白,以三聚体的形式嵌于病毒包膜上,见图 1。S蛋白在宿主细胞的细胞质中合成后以蛋白前体的形式存在,只有在被蛋白酶切割后才具有介导病毒进入宿主细胞的能力。S蛋白可被切割成S1、S2两个部分。其中S1的受体结合区域 (receptor binding domain,RBD) 与宿主细胞膜上的DPP4蛋白 (dipeptidy peptidase 4,DPP4,也被称为CD26) 受体结合,S2随之改变自身构象,暴露出具有穿膜功能的融合肽 (fusion peptide,FP),从而介导宿主细胞膜与病毒包膜发生融合或内吞作用[9, 10]。

|
图 1 MERS-CoV S蛋白推测结构模式图 |
在冠状病毒复制起始时,病毒基因直接被翻译成两种蛋白前体 (pp1a,pp1ab),随后即被病毒的蛋白水解酶切割成病毒的非结构蛋白[10]。因此,病毒的蛋白水解酶控制着病毒的复制活性。
MERS-CoV自身编码的蛋白和宿主细胞的蛋白在病毒感染复制的整个过程中发挥着重要的作用。因此,病毒感染复制周期中涉及的蛋白 (如S蛋白、病毒的蛋白水解酶、宿主细胞的蛋白酶等) 均可以作为抗MERS-CoV药物的靶点。
2 抗MERS-CoV小分子化合物的研究 2.1 作用于病毒靶标的抗MERS-CoV小分子化合物 2.1.1 作用于MERS-CoV3CLpro及PLpro的小分子化合物MERS-CoV的主要蛋白水解酶有3CL蛋白酶 (3C-like protease,3CLpro也称作Mpro,nsp5)和木瓜样蛋白酶(papain-like protease,PLpro,也称为nsp3)[11, 12, 13]。而且PLpro还可通过对干扰素调节因子3去泛素化从而抑制其核转移,导致干扰素的产生减少[14, 15],影响宿主的免疫功能。因此3CLpro和PLpro可作为抗MERS-CoV药物研发的靶点。
研究发现,MERS-CoV与SARS-CoV的3CLpro与PLpro的结构存在较大的相似性[16, 17]。其中Lei等[17]用X光散射技术分析发现MERS-CoV的PLpro与SARS-CoV的PLpro的结构具有30% 的结构一致性,50% 的序列相似性。因此,抑制SARS-CoV 3CLpro与PLpro活性的小分子结合物,有可能作为抗MERS-CoV小分子药物的筛选化合物库。
Kilianski等[12]构建了两种细胞系分别表达MERS-CoV 3CLpro和PLpro及相对应的切割底物RLKGG-荧光素酶和VRLQS-荧光素酶,通过检测药物作用后荧光值的变化进而评估两种水解酶的活性。在研究中发现具有抑制SARS-CoV 3CLpro活性的2-氯吡啶酯类化合物CE-5 (1) 呈浓度依赖性地抑制MERS-CoV 3CLpro的活性,其EC50约为12.5 μmol·L-1。在浓度为50 μmol·L-1下,与DMSO的对照组相比,3CLpro的水解活性降低70%。
Cheng等[14]首次报道了多个抑制MERS-CoV PLpro蛋白水解活性的小分子化合物 (图 2),包括同时具有抑制SARS-CoV的PLpro活性的巯基嘌呤类似物6-巯基嘌呤 (6-mercaptopurine,6-MP) (2) 和6-巯基鸟嘌呤 (6-thioguanine,6-TG) (3) 及免疫抑制剂霉酚酸 (mycophenolic acid,MPA) (4)。6-MP和6-TG除了具有抑制PLpro的活性外,还可以抑制其去泛素化的活性。此外,6-MP及MPA对其他病毒也具有抗病毒作用。研究还发现半胱氨酸酶抑制剂N-乙基顺丁烯二酰亚胺 (N-ethylmaleimide,NEM) (5) 也可抑制PLpro的活性,其IC50为45 μmol·L-1。Xia等[9]研究发现MPA可以强烈抑制MERS-CoV的复制,活性低至nmol·L-1水平,但是Cheng等[14]却发现MPA与MERS-CoV PLpro的结合力较低,推测其抑制PLpro的活性只是它抑制病毒复制的部分作用机制。

|
图 2 作用于病毒靶标的抗MERS-CoV的小分子化合物结构式 |
除了3CLpro、PLpro具有较大的相似性外,不同冠状病毒的解旋酶nsp13的结构也相对保守。但是该作用靶标的药物研究并不多。研究发现,解旋酶nsp13抑制剂SSYA10-001 (6) 与SARS-CoV和MERS- CoV nsp13的结合位点存在高度的相似性。进一步的体外药效学实验结果表明SSYA10-001不仅可以抑制SARS-CoV的复制,还可以抑制MERS-CoV的复 制。其对SARS-CoV和MERS-CoV的EC50分别约为7 μmol·L-1 (选择指数≥71) 和25 μmol·L-1 (选择指数≥20),并且在500 μmol·L-1的浓度时对Vero-E6细胞无明显的细胞毒性[18]。
2.2作用于宿主细胞靶标的抗MERS-CoV的小分子化合物 2.2.1 蛋白酶抑制剂MERS-CoV S蛋白是否被切割与病毒的感染力密切相关。S蛋白可被宿主细胞中的许多种蛋白酶切割,比如组织蛋白酶B/组织蛋白酶L,跨膜丝氨酸蛋白酶2 (TMPRSS2)、弗林蛋白酶[19, 20, 21]。靶向于这些宿主蛋白酶已经成为了抗MERS-CoV小分子化合物研发的热点之一。
组织蛋白酶B/L抑制剂MDL28170 (7)、组织蛋白酶B/H/L抑制剂E64D (8) (图 3) 在MERS重组假病毒模型中均对病毒感染具有抑制作用。其中,E64D对于MERS重组假病毒感染Vero-E6细胞的抑制率为96.7%,对LLCMK2细胞的感染抑制率为99.2%[8, 20]。Millet等[21]研究发现弗林蛋白酶抑制剂dec-RVKR- CMK (9) 在Huh7、MRC-5、WI-38、Vero细胞系中不仅可呈浓度依赖性地抑制重组假病毒的感染,还可显著抑制野生型病毒的感染。该抑制作用在正常人支气管上皮细胞中也得到了进一步的验证。其中,100 μmol·L-1 dec-RVKR-CMK可使野生型病毒对正常人支气管上皮细胞的感染率降至<5%。并且在研究中还发现弗林蛋白酶被抑制后可特异性抑制MERS-CoV S蛋白介导的病毒进入,而对流感病毒A/WSN HA假病毒没有抑制作用。另外,dec-RVKR-CMK与组织蛋白酶抑制剂或TMPRSS2抑制剂卡莫司他 (10) 合用后,均具有协同作用,提示不同类型蛋白酶抑制剂的合用对MERS-CoV的感染具有更为有效的作用。
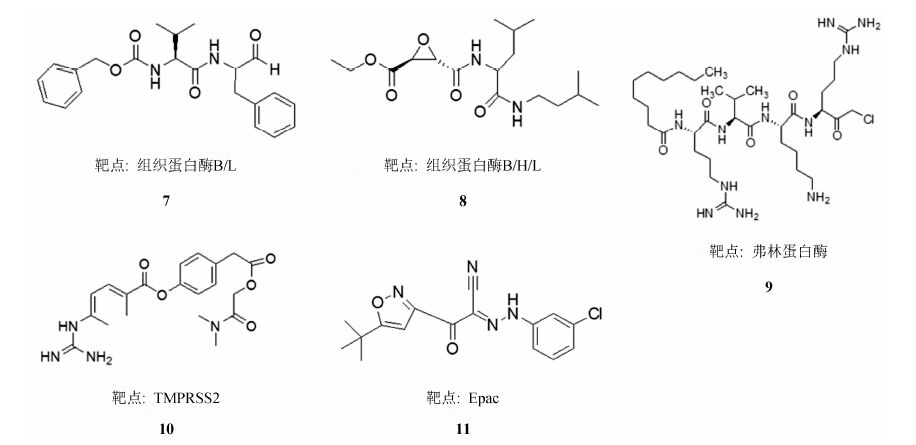
|
图 3 作用于宿主细胞靶标的抗MERS-CoV的小分子化合物结构式 |
环状AMP (cyclic AMP,cAMP) 在宿主抵御病原体感染中具有重要的作用[22]。cAMP直接激活的交换蛋白 (exchange protein directly activated by cAMP,Epac) 作为cAMP通路中的一个重要成分[23],在MERS-CoV感染过程中具有重要作用。但是以Epac为靶点的小分子化合物研究报道非常有限。Tao等[24]研究发现 Epac特异性抑制剂ESI-09 (11) 不仅可以抑制MERS-CoV在Calu-3细胞系的复制,还可以抑制在Vero-E6细胞系的复制。其中,Calu-3细胞在感染MERS-CoV (MOI = 0.1) 2 h前用5 μmol·L-1的ESI-09处理就可显著性降低病毒滴度。在病毒 (MOI = 0.1) 感染Calu-3细胞16甚至20 h后,或病毒 (MOI = 5) 感染12 h后,用10 μmol·L-1 ESI-19处理,病毒滴度均显著性降低。
2.3 作用靶标不明确的抗MERS-CoV小分子化合物高通量筛选作为一种以活性为导向快速发现活性化合物的有效方式,可筛选出具有抗MERS-CoV活性的化合物。但通常仅知道其作用于病毒生命周期的某一阶段,其具体的作用靶标尚不清楚。
2.3.1 具有体内抗MERS-CoV活性的小分子化合物Chan等[25]通过高通量筛选发现利巴韦林 (12,图 4) 具有较好的体外抑制MERS-CoV复制的活性。在Vero细胞病毒产生抑制试验中,利巴韦林的EC50为 (9.99 ± 2.97) μg·mL-1,选择指数 > 152.98。Falzarano等[26]在体外研究中发现利巴韦林与干扰素α2b合用具有良好的协同作用。体内实验表明,恒河猴在感染MERS- CoV 8 h后给予利巴韦林和干扰素α2b,与未给药组相比未见呼吸异常,影像学观察也未见或仅见轻微的肺炎病变,血清及肺组织仅见较低水平的炎症因子以及病毒基因载量[27],表明利巴韦林具有较好的体内抗MERS-CoV活性。临床回顾性研究中也发现,感染MERS-CoV后14天给予利巴韦林与干扰素α2b治疗的患者相比于只给予支持性治疗的患者,存活率明显提高[28]。但在28天后给药无效,死亡率依然为100%[29]。
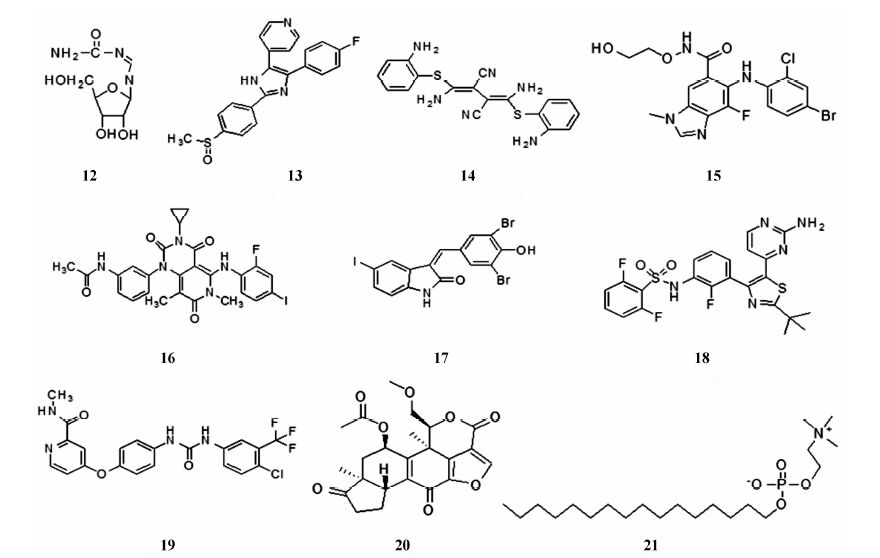
|
图 4 作用靶标不明确的抗MERS-CoV小分子化合物结构图 |
研究发现,ERK/MAPK通路、PI3K/AKT/mTOR通路均与MERS-CoV的感染有关。进一步研究发现,MAPK抑制剂SB203580 (13),MEK抑制剂U0126 (14),ERK/ MAPK抑制剂司美替尼 (15)、曲美替尼 (16),Raf抑制剂GW5074 (17)、达拉菲尼 (18)、索拉菲尼 (19),PI3K/AKT抑制剂渥曼青霉素 (20) 及AKT抑制剂米替福新 (21) 等均能不同程度地抑制MERS-CoV对Huh 7细胞的感染[30]。
2.3.3 其他具有体外抗MERS-CoV活性的小分子化合物文献[31, 32]报道通过高通量筛选得到的可阻止MERS-CoV进入靶细胞的小分子化合物还有氯喹、氯丙嗪、洛哌丁胺、洛匹那韦、甲磺酸伊马替尼、达沙替尼、枸缘酸托瑞米芬、诺考达唑等。研究表明,氯丙嗪可能是通过抑制病毒与宿主细胞膜发生内吞作用,从而抑制病毒进入宿主细胞,但是其具体的作用靶点仍未知[31]。另外Liu等[33]证明这些MERS- CoV进入抑制剂都不能与衍生于MERS-CoV S蛋白HR1区的多肽形成六聚体,也不能抑制MERS-CoV S蛋白介导的细胞-细胞融合,因此,它们的作用机制仍需进一步研究。
3 结论与展望自MERS-CoV发现以来,MERS-CoV感染疫情主要发生在中东地区,仅为一种地方性的公共威胁。这无疑导致了MERS-CoV基础研究进展相对缓慢,抗MERS-CoV药物的设计及开发速度也缓慢。然而,此次爆发的韩国疫情再次引起了世界的强烈关注,抗MERS-CoV化合物的研究与开发具有更加迫切的需求。小分子化合物具有合成方便、生产周期短、价格相对低廉、性质稳定、运输方便等优点,因此,在应对MERS-CoV感染疫情时更具有开发及大规模应用的前景。但到目前为止,许多抗MERS-CoV的小分子化合物的研究多限于临床前阶段。现有化合物中,只有利巴韦林与干扰素α2b进入动物体内实验和人体临床研究。在临床回顾性研究中发现患者的疗效与感染后给药的时间间隔具有密切相关性。所以,设计开发抗MERS-CoV的小分子化合物是对药学研究者提出的一大挑战。
现有小分子抗病毒化合物的设计策略多从抑制病毒进入宿主细胞、抑制病毒的复制等机制中入手。细胞病变效应抑制 (cytopathic effect inhibition,CPE) 试验、空斑减少/中和试验、病毒产生抑制试验、表达MERS-CoV S蛋白的重组假病毒体系等高通量筛选体系的发展,加快了小分子抗MERS-CoV化合物的研发。另外,鉴于MERS-CoV与SARS-CoV同属于β型冠状病毒,蛋白质的结构及其功能具有较大的相似性,使得抗SARS-CoV的小分子化合物库可成为潜在的抗MERS-CoV的筛选化合物库。研究发现,许多具有抗SARS-CoV活性的小分子化合物,也同时具有抗MERS-CoV的活性。研究中用于高通量筛选的化合物多为FDA批准或在其他地区使用的药物,其体内代谢及其可能的不良反应均已阐明。但是,由于缺乏成熟的小鼠、大鼠等小型动物模型,这些体外实验有效的小分子化合物在进一步研发时遇到了阻碍,很大程度上限制了抗MERS-CoV小分子化合物的发展。相信随着研究的不断深入,会有更理想的体内动物模型,从而加快小分子抗MERS-CoV化合物的研发进程。
| [1] | Zaki AM, van Boheemen S, Bestebroer TM, et al. Isola-tion of a novel coronavirus from a man with pneumonia in Saudi Arabia[J]. N Engl J Med, 2012, 367:1814-1820. |
| [2] | http://www.who.int/emergencies/mers-cov/en/. |
| [3] | Chan JF, Lau SK, To KK, et al. Middle East respiratory syndrome coronavirus:another zoonotic betacoronavirus causing SARS-like disease[J]. Clin Microbiol Rev, 2015, 28:465-522. |
| [4] | The WHO MERS-CoV Research Group. State of knowl-edge and data gaps of Middle East respiratory syndrome coronavirus(MERS-CoV) in humans[J]. PLoS Curr, 2013, Edition 1. doi:10.1371/currents.outbreaks. 0bf719e352e7478f8ad85fa301 27ddb8. |
| [5] | Zumla A, Hui DS, Perlman S. Middle East respiratory syndrome[J]. Lancet, 2015, 386:995-1007. |
| [6] | Banik GR, Khandaker G, Rashid H. Middle East respira-tory syndrome coronavirus "MERS-CoV":current knowledge gaps[J]. Paediatr Respir Rev, 2015, 16:197-202. |
| [7] | van Boheemen S, de Graaf M, Lauber C, et al. Genomic characterization of a newly discovered coronavirus associated with acute respiratory distress syndrome in humans[J]. MBio, 2012, 3:e00473-12. |
| [8] | Qian Z, Dominguez SR, Holmes KV. Role of the spike glycoprotein of human Middle East respiratory syndrome coronavirus(MERS-CoV) in virus entry and syncytia formation[J]. PLoS One, 2013, 8:e76469. |
| [9] | Xia S, Liu Q, Wang Q, et al. Middle East respiratory syn-drome coronavirus(MERS-CoV) entry inhibitors targeting spike protein[J]. Virus Res, 2014, 194:200-210. |
| [10] | Milne-Price S, Miazgowicz KL, Munster VJ. The emer-gence of the Middle East respiratory syndrome coronavirus[J]. Pathog Dis, 2014, 71:121-136. |
| [11] | St John SE, Tomar S, Stauffer SR, et al. Targeting zoonotic viruses:structure-based inhibition of the 3C-like protease from bat coronavirus HKU4-the likely reservoir host to the human coronavirus that causes Middle East respiratory syndrome(MERS)[J]. Bioorg Med Chem, 2015, 23:6036-6048. |
| [12] | Kilianski A, Mielech AM, Deng X, et al. Assessing activity and inhibition of Middle East respiratory syndrome coronavirus papain-like and 3C-like proteases using luciferase-based biosensors[J]. J Virol, 2013, 87:11955-11962. |
| [13] | Needle D, Lountos GT, Waugh DS. Structures of the Mid-dle East respiratory syndrome coronavirus 3C-like protease reveal insights into substrate specificity[J]. Acta Crystallogr D Biol Crystallogr, 2015, 71(Pt 5):1102-1111. |
| [14] | Cheng KW, Cheng SC, Chen WY, et al. Thiopurine analogs and mycophenolic acid synergistically inhibit the papain-like protease of Middle East respiratory syndrome coronavirus[J]. Antiviral Res, 2015, 115:9-16. |
| [15] | Yang X, Chen X, Bian G, et al. Proteolytic processing, deubiquitinase and interferon antagonist activities of Middle East respiratory syndrome coronavirus papain-like protease[J]. J Gen Virol, 2014, 95(Pt 3):614-626. |
| [16] | Ren Z, Yan L, Zhang N, et al. The newly emerged SARS-like coronavirus HCoV-EMC also has an "Achilles' heel":current effective inhibitor targeting a 3C-like protease[J]. Protein Cell, 2013, 4:248-250. |
| [17] | Lei J, Mesters JR, Drosten C, et al. Crystal structure of the papain-like protease of MERS coronavirus reveals unusual, potentially druggable active-site features[J]. Antiviral Res, 2014, 109:72-82. |
| [18] | Adedeji AO, Singh K, Kassim A, et al. Evaluation of SSYA10-001 as a replication inhibitor of severe acute respiratory syndrome, mouse hepatitis, and Middle East respiratory syndrome coronaviruses[J]. Antimicrob Agents Chemother, 2014, 58:4894-4898. |
| [19] | Millet JK, Whittaker GR. Host cell proteases:critical determinants of coronavirus tropism and pathogenesis[J]. Virus Res, 2015, 202:120-134. |
| [20] | Gierer S, Bertram S, Kaup F, et al. The spike protein of the emerging betacoronavirus EMC uses a novel coronavirus receptor for entry, can be activated by TMPRSS2, and is targeted by neutralizing antibodies[J]. J Virol, 2013, 87:5502-5511. |
| [21] | Millet JK, Whittaker GR. Host cell entry of Middle East respiratory syndrome coronavirus after two-step, furin-mediated activation of the spike protein[J]. Proc Natl Acad Sci USA, 2014, 111:15214-15219. |
| [22] | McDonough KA, Rodriguez A. The myriad roles of cyclic AMP in microbial pathogens:from signal to sword[J]. Nat Rev Microbiol, 2012, 10:27-38. |
| [23] | Schmidt M, Dekker FJ, Maarsingh H. Exchange protein directly activated by cAMP(epac):a multidomain cAMP mediator in the regulation of diverse biological functions[J]. Pharmacol Rev, 2013, 65:670-709. |
| [24] | Tao X, Mei F, Agrawal A, et al. Blocking of exchange pro-teins directly activated by cAMP leads to reduced replication of Middle East respiratory syndrome coronavirus[J]. J Virol, 2014, 88:3902-3910. |
| [25] | Chan JF, Chan KH, Kao RY, et al. Broad-spectrum antivi-rals for the emerging Middle East respiratory syndrome coronavirus[J]. J Infect, 2013, 67:606-616. |
| [26] | Falzarano D, de Wit E, Martellaro C, et al. Inhibition of novel beta coronavirus replication by a combination of interferon-alpha2b and ribavirin[J]. Sci Rep, 2013, 3:1686. |
| [27] | Falzarano D, de Wit E, Rasmussen AL, et al. Treatment with interferon-alpha2b and ribavirin improves outcome in MERS-CoV-infected rhesus macaques[J]. Nat Med, 2013, 19:1313-1317. |
| [28] | Omrani AS, Saad MM, Baig K, et al. Ribavirin and inter-feron alfa-2a for severe Middle East respiratory syndrome coronavirus infection:a retrospective cohort study[J]. Lancet Infect Dis, 2014, 14:1090-1095. |
| [29] | Al-Tawfiq JA, Momattin H, Dib J, et al. Ribavirin and interferon therapy in patients infected with the Middle East respiratory syndrome coronavirus:an observational study[J]. Int J Infect Dis, 2014, 20:42-46. |
| [30] | Kindrachuk J, Ork B, Hart BJ, et al. Antiviral potential of ERK/MAPK and PI3K/AKT/mTOR signaling modulation for Middle East respiratory syndrome coronavirus infection as identified by temporal kinome analysis[J]. Antimicrob Agents Chemother, 2015, 59:1088-1099. |
| [31] | de Wilde AH, Jochmans D, Posthuma CC, et al. Screening of an FDA-approved compound library identifies four small-molecule inhibitors of Middle East respiratory syndrome coronavirus replication in cell culture[J]. Antimicrob Agents Chemother, 2014, 58:4875-4884. |
| [32] | Dyall J, Coleman CM, Hart BJ, et al. Repurposing of clini-cally developed drugs for treatment of Middle East respiratory syndrome coronavirus infection[J]. Antimicrob Agents Chemother, 2014, 58:4885-4893. |
| [33] | Liu Q, Xia S, Sun Z, et al. Testing of Middle East respira-tory syndrome coronavirus replication inhibitors for the ability to block viral entry[J]. Antimicrob Agents Chemother, 2015, 59:742-744. |
 2015, Vol. 50
2015, Vol. 50


