随着电子化数据采集 (EDC) 的实施和普及,EDC已成为国内大型临床试验数据管理的首要选择[1]。近年CFDA发布的《临床试验数据管理工作技术指南》也明确提出鼓励国内制药企业和合同研究组织引入或开发应用符合规范的临床试验数据管理系统,同时对EDC系统提出了原则性要求和相应技术规范[2],促使传统的纸质数据管理模式不断向电子化数据管理模式转变。基于此,本文将传统纸质与电子化数据管理进行比较研究,以期全面展现电子化数据管理在临床试验中的各种优势。
资料与方法资料来源 选择本中心已完成的14个Ⅲ期临 床试验进行比较,其中采用纸质数据管理8个,采用EDC数据管理6个,总受试者样本量为7 280例,数据管理员28名。
定性比较方法 对14个项目中难以完全定量的指标,由研究者进行描述性评价,如数据管理流程、项目完成时间、临床决策过程等,部分结果以示意图表示。
定量比较方法 效率比较采用定量方法,对14个项目中具体工作指标进行量化呈现,不进行统计学检验。指标包括受试者的平均人工疑问数、数据缺失的疑问率、逻辑错误的疑问率、再次澄清的疑问率和无效数据的疑问率等。
结果 1 工作流程比较本部门的纸质与电子化数据管理流程见图 1,由此即可比较出两者的差异。纸质数据管理模式是在研究者完成所有受试者病例报告后产生,数据管理员处于“前期无任务,后期满负荷”的状态,使整个研究周期延长。纸质病例报告表 (CRF) 的收集、传递与交接等工作量增大。

|
图 1 EDC与纸质临床试验数据流程比较 |
而基于EDC的电子化数据管理过程,与试验过程呈平行关系,在数据采集同时就可进行数据清理核查。数据管理员可实时地进行在线数据管理,对有疑问的数据进行质疑和标注,监查员也可实时在线进行远程监查 (remote monitoring),申办方也可实时在线查阅临床研究进展,数据安全委员会亦可动态追踪安全性数据,从而保护受试者利益。
值得注意的是,我们的数据管理员并不认为EDC可使工作量减小,反而是增加,呈现“工作角色多、标准操作规程 (SOP) 多、培训多”等。但就临床研究质量来说,EDC显然优于传统临床试验的运行模式,不仅整个试验数据采集流程更为顺畅高效,而且各参与者同步平行参与整个数据管理过程。
2 效率比较对14个临床试验数据管理的比较发现,多数指标都是EDC明显优于纸质数据管理 (表 1)。例如,数据清理工作被EDC所替代而无需进行人工审核和数据筛选,受试者平均人工疑问数相比纸质大幅减少; 因疑问被修改数据的百分比明显减少,说明数据的质量得到提高; 由于EDC丰富的逻辑核查功能在第一时间就可发现各种缺失、超范围和无效数据等,比人工审核更能准确地发现问题,数据质量进一步提高。此外,在数据库锁定时间方面,EDC要比纸质临床试验提早1~3个月时间。
|
|
表 1 EDC和纸质数据管理质量比较。 注: 共14个Ⅲ期临床试验,涵盖受试者7 280例 |
本研究与国外同类研究结果完全吻合[3] (图 2),越是复杂的临床试验EDC节约的试验成本越高,其中II期和III期临床试验的研究成本至少减少60%以上。可见,电子化数据管理不仅提升研究效率、缩短试验周期,而且同时节约试验成本。
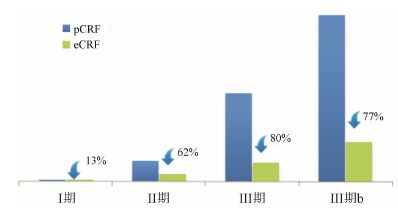
|
图 2 EDC与纸质临床试验费用比较 |
基于EDC的电子化数据管理过程是实时的数据采集,可以在临床研究过程中进行多阶段的数据分析,我们完全参照国外的流程操作[4] (图 3),可见基于EDC的临床试验其决策快速,易于进行组别样本分配比例调整、样本量重新估算、放弃或者改变某一试验组的决定等,特别适用于适应性试验设计。此外,EDC不良反应采集与报告也更快捷及时,可尽早采取相应措施更好地保护受试者权益。

|
图 3 EDC与纸质临床试验临床决策流程比较 |
基于EDC的数据管理模式转变同样需克服一些挑战。首先,试验数据流程的改变使得之前基于纸质数据管理的SOP需重新修订,试验中各角色涉及的交叉任务需重新分配培训。数据管理员必须在试验开始前就应完成数据核查计划及构建相应eCRF; 研究机构必须不断及时录入数据到EDC系统,并及时解决来自监查员、数据管理员和系统发出的各种疑问等。只有顺利完成相应角色转变才能使EDC发挥优势,流程脱节反而增加工作负荷。
此外,EDC是最为重要的平台工具,其顺利实施涉及到方方面面,包括硬件、软件和用户等多种因素和技术条件。硬件方面主要涉及数据中心,包括服务器、网络访问带宽等; 软件涉及系统自身应用成熟度、人性化界面设计、合规并经过严格认证; 用户方面包括相关培训和技术支持等。有研究对电子化数据管理过程中EDC系统的应用挑战做了问卷调查,结果显示其最大挑战在于临床研究基地的配合度。目前国内的临床研究环境存在同样的挑战: ① 各地研究者时间忙碌未能保证充分培训,缺乏对电子化数据管理整个流程的认识和配合; ② 实时的eCRF数据录入会增加基地的工作压力,若缺乏临床研究助理 (CRC) 问题更为突出; ③ 因EDC系统自身问题给研究基地带来额外的工作负荷,如系统的不友好和不稳定性导致数据存取问题,甚至有基地无基础条件支持EDC系统应用等。
虽然EDC系统应用存在一定的挑战,但与传统纸质数据管理相比,不仅可以优化试验数据流程、提升研究数据质量、及时做出临床风险决策,并且可提高试验效率、缩短试验周期、减少试验成本[5]。另外,传统的纸质数据管理已很难满足法规要求,而EDC系统具有一致性数据核查、数据库锁定及稽查痕迹等强大功能,可有效保证临床试验数据的质量和完整性,因此向电子化数据管理模式转变无疑是最好的解决方案。
| [1] | Chen JC, Zheng QS, Huang JH, et al. The current new technologies in e-clinical trials [J]. Chin J New Drugs (中国新药杂志), 2014, 23: 84−87. |
| [2] | Center of Drug Evaluation, CFDA. Technical Guidelines for Data Management in Clinical Trials (临床试验数据管理 工作技术指南) [S]. 2012.http://www.cde.org.cn/news.do? method=largeInfo&id=312673. |
| [3] | Green JA. The EDC value proposition to the pharmaceutical industry. A Detailed Comparison of EDC versus Paper Model Costs for Four Different Clinical Research Projects (Phase I - IIIb) [S]. Datatrak International, Inc., 2001. |
| [4] | Liu C. Clinical Trial Methodology of Medicinal Products (药物临床试验方法学) [M]. Beijing: Chemical Industry Press, 2011. |
| [5] | Chen JC, Liu HX, He YC, et al. The development of the electronic clinical trials and its future vision [J]. Chin J New Drugs (中国新药杂志), 2014, 23: 377−380. |
 2015, Vol. 50
2015, Vol. 50


