凝血过程是个复杂的级联反应,在这个过程中,因子Xa (FXa) 的活化至关重要。FXa属于丝氨酸蛋白酶,其功能是被内源或外源性因素刺激后而致活,将凝血酶原转变成凝血酶,后者具有多种凝血功能: 将纤维蛋白元转变为纤维蛋白,使血小板活化,以及反馈性的激活其他凝血因子,从而又放大FXa的自身生成。所以FXa抑制剂可降低凝血酶的放大性的生成,阻止凝血和血小板的活化,成为抗凝血药物的理想靶标。
研发FXa酶抑制剂的目标是非肽类的小分子药物,可口服吸收,最好每日一次,防止手术后深度静脉栓塞以及其他重要脏器的栓塞,同时应有较低的出血风险。
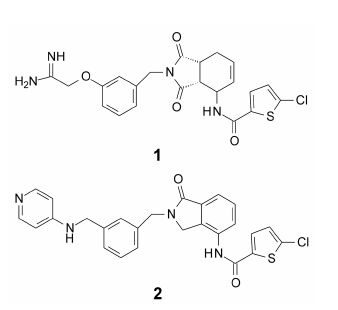
2 苗头化合物及其向先导物的过渡拜耳公司通过高通量筛选方法获得了苗头化合物1,对FXa酶的抑制活性IC50 = 120 nmol·L-1。在由苗头过渡到先导物 (hit-to-lead) 的操作中,研究者对1进行了三方面的变换: ① 用不同的连接基替换四氢苯二甲酰亚胺片段,其中之一是用二氢异吲哚酮替换 (骨架迁越: 保留了必要的功能基和连接基,易于合成); ② 降低脒基的碱性和离解性,变换成弱碱性或中性基团,以利于过膜吸收; ③ 变换氯代噻吩甲酰胺片段。在全结构的修饰中,发现化合物2的活性提高了15倍,IC50 = 8 nmol·L-1。说明碱性的脒基和连接基可以修饰改造,而氯代噻吩甲酰胺基是必要的药效团。然而2的生物利用度低,不能达到先导物的要求。
|
Figure 2 |
进一步进行高通量筛选,目标集中在含有噻吩甲酰胺基类型的化合物,只发现化合物3具有非常 弱的抑制活性,IC50 = 20 μmol·L-1,但结构中含有噁唑烷酮片段有可取之处,因为对溶解性有利。在噻吩环的5位加入氯原子,化合物4的活性为IC50 = 90 nmol·L-1,比化合物3强200倍,表明噻吩环的氯代很重要。化合物4不含有脒基或形成正离子的基团,纠正了以前认为正离子与S1腔结合是活性必需的观点。化合物4含有噁唑烷酮有助于溶解与吸收。由于这些有利的条件,将4定为先导物进入结构优化。4的手性中心为S构型,合成的R-对映体的抑制FXa的活性为IC50 = 2 300 nmol·L-1,显著低于S异构体。优化合成的化合物均为S构型。
|
Figure 3 |
在苗头过渡到先导物 (hit-to-lead) 的操作中已经确定了占优的结构因素: 简约的连接基噁唑烷酮有利于物化性质; 氯代噻吩甲酰胺是必需的药效团的特征之一 (但未探索环上的双取代); 手性中心为S构型。因而在优化活性和成药性的结构时,目标集中在先导物4的硫代吗啉和氟代苯的变换。
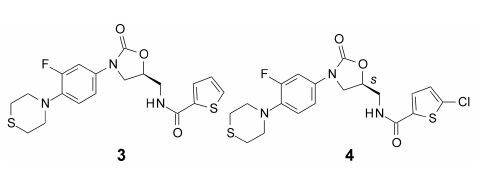
3.1 硫代吗啉的变换用吗啉置换硫代吗啉环,化合物5活性提高近2倍,IC50 = 32 nmol·L-1; 哌嗪环置换的活性显著降低,IC50 = 140 nmol·L-1; 用四氢吡咯替换,化合物6的IC50 = 40 nmol·L-1; 二甲胺基化合物活性降低到IC50 = 74 nmol·L-1; 吡咯烷酮化合物7的活性提高10倍,IC50 = 4 nmol·L-1。引入羰基有利于提高活性,羰基加到吗啉环上得到的化合物8活性显著提高,IC50 = 0.7 nmol·L-1。
3.2 苯环的取代基变换苯环上3位氟原子的有无对不同的化合物活性的影响没有规律性变化。例如化合物6若无F原子取代活性略高; 而化合物8的3-F取代化合物9活性略弱 (IC50 = 1.4 nmol·L-1),而且3位用氨基和三氟甲基取代活性亦略下降。然而苯环若有2位取代基则显著降低活性。化合物8的R对映体的IC50 = 2 300 nmol·L-1,再次证明S构型是优映体 (eutomer)。至此,化合物8是先导物优化中活性最强的化合物。
3.3 噻吩环的变换: 调整药代动力学性质化合物8的溶解性较低,结晶态的水溶解度为8 mg·L-1,脂水分配系数logP = 1.5,与血浆蛋白结合率为99.5% (Mueck W,Stampfuss J,Kubitza D,et al. Clin Pharmacokin Clin Pharmacodyn,2014,53: 1-16)。
从结构上分析影响脂溶性的主要片段是5-氯代噻吩,为了改善药代动力学性质,对该片段进行了广泛的改造,结果是除了5-Br代的活性基本不变外 (脂溶性强于5-Cl化合物),用甲基噻吩、氨基噻吩、氯代噻唑、氯代呋喃、氯代苯、氯代吡啶等置换的化合物活性都下降,表明变换5-氯代噻吩对活性影响较大,因此在化合物7、8和9中选择活性和药代性质综合效应最佳者作为候选药物 (Roehrig S,Straub A,Pohlmann J,et al. J Med Chem,2005,48: 5900-5908)。
4 化合物8的研发: 利伐沙班上市通过体外测定延长凝血酶原二倍时间所需化合物的浓度 (越低越好) 和麻醉大鼠体内动静脉分流模型测定半数有效剂量 (越小越好),比较了化合物7、8和9的药效学性质,表明化合物8优于7和9。大鼠和比格犬的药代性质,如口服生物利用度、血浆半衰期和清除率等8也优于7和9。化合物8对FXa有很高的选择性抑制作用,在20 μmol·L-1的高浓度下对其他丝氨酸蛋白酶,如凝血酶、胰蛋白酶、纤维蛋白溶酶、尿激酶以 及FVIIa、FIXa、FXIa等未显示抑制作用。综合上述优势,确定化合物8为候选药 物,定名为利伐沙班 (rivaroxaban),进入临床研究。经三期临床试验表明,口服利伐沙班在肠道吸收,一次给药后4 h后抑制FXa达到最大值,并持续8~ 12 h,24 h后FXa的活性复原,因而每日口服一次,用于预防髋关节和膝关节置换术后患者深静脉血栓 (DVT) 和肺栓塞 (PE) 的形成。于2011年经FDA批准在美国上市。
|
Figure 4 |
利伐沙班 (8) 的化学结构与抗菌药利奈唑胺 (10,linezolid) 有很大的相似性,例如都含有噁唑烷酮片段,而且两端相连的吗啉苯基与酰胺片段也很相似,甚至手性中心的构型都是相同的。但二者的作用机制和适应证完全不同。利奈唑胺抑制细菌蛋白质合成,通过选择性结合细菌50s亚单位的23s核糖体核糖核酸上的位点,抑制细菌核糖体的翻译过程,是抗革兰阳性菌药物。
研究表明,利伐沙班及其代谢产物没有抗菌作用,而且对线粒体的作用很弱,这与长期应用利奈唑胺可引起线粒体毒性是不同的。在药物化学中,相似的化学结构具有相似或相关的药理活性,这个一般原则在这里不存在。
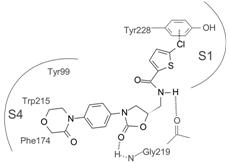
6 利伐沙班与FXa的结合模式利伐沙班是基于药物化学的理念和方法设计合成的,而并未借助酶的三维结构作理性设计。通过回顾性分析利伐沙班与FXa复合物的晶体结构,揭示了结构成功设计的合理性。在晶体结构中,S构型的噁唑烷酮采取了L-形状的构象,使得利伐沙班分子与Gly219形成两个重要的氢键: 噁唑烷酮的羰基与HN形成强氢键结合 (2.0Å),酰胺的NH与Gly219的羰基形成弱氢键结合 (3.3Å)。酶的S4疏水腔由Tyr99、Phe174和Trp215构成,吗啉酮环被夹在Tyr99和Phe174中间,酮基在S4腔中没有形成极性键结合,而是由于邻位效应使吗啉环垂直于苯环,从而提高了结合性能,因为没有酮基的化合物5吗啉与苯环的共面性,使得活性弱减60倍。氯代噻吩环结合于S1腔,氯原子与Tyr228的苯环发生卤素-π电子的相互作用,代替了其他抑制剂的脒基 (带正电荷) 与Asp189在S1腔中形成的静电相互作用。在药代行为上,卤素-π电子的相互作用显然优于正负电荷的结合作用。图 1是利伐沙班与FXa复合物结合的示意图。
|
Figure 1 利伐沙班与FXa结合的示意图: 与Gly219形成两个氢键结合; 氯代噻吩结合于S1腔,氯原子与Tyr228的苯环发生相互作用; 吗啉酮环垂直与苯环,插入到S4腔的Tyr99和Phe174环之间 |
 2015, Vol. 50
2015, Vol. 50


