2. 南方医科大学 南方医院, 广东 广州 510515
2. Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
氧化苦参碱 (oxymatrine,OMT) 是从豆科槐属植物苦豆子 (Sophora alopecuroides L.)、苦参 (Sophora flavescens Ait.) 和山豆根 (Sophora tonkinensis Gapnep.) 等植物中提取分离得到的一种喹诺里西啶类生物碱,主要来源于苦参,其中OMT和苦参碱 (matrine,MT) 含量最高[1]。现代药理学研究表明,氧化苦参碱具有抗肿瘤、抗病毒、抗炎抑菌、抗心律失常、免疫调节和治疗慢性肝炎等作用[2, 3, 4, 5, 6]。在国内,已有苦参素注射液、苦参素片、苦参素胶囊和苦参素分散片等制剂广泛用于临床[7]。
虽然OMT和MT是中药苦参、山豆根及苦豆子的主要活性成分,但同时也是毒性组分。已有研究表明,OMT和MT对昆明小鼠的LD50分别为214.216和83.206 mg·kg-1,提示OMT和MT对小鼠有一定的毒性,且其LD50相差数倍,OMT对小鼠的毒性明显弱于MT[8]。从结构分析来看,OMT为MT的N-氧化物,因此推测毒性差异可能与MT环上的叔胺结构被氧化成季胺有关。
在体内OMT可转化为MT,这是造成血中OMT浓度降低的主要原因,这种转换可以影响OMT与MT的疗效与毒性[9]。因此,了解OMT口服的生理特征对于药物研发和临床应用非常重要。而到目前为止,已有文献均围绕OMT的药理作用、毒性和药代动力学特征等方面开展研究,而其口服后在肠道的吸收与代谢特征尚不清楚。
肠道是口服药物吸收的必经部位和主要部位,但肠道构成复杂,存在多种阻碍药物吸收的复杂因素,因此其成为药物发挥药效的第一道屏障[10, 11]。大鼠在体肠灌流模型是研究口服药物在肠道处置过程的常用方法,其作为药代动力学中筛选药物吸收特征的方法已被美国FDA认可。目前,该模型已被广泛应用于药物吸收、排泄和代谢特征的研究。此外,也能用于研究药物在小肠的处置过程[12, 13]。
本研究采用大鼠在体肠灌流模型研究OMT在肠道的吸收与代谢特征,运用HPLC-ESI(+)-Q-TOF-MS对代谢物进行定性分析,利用UPLC对原型药物与代谢物进行定量分析,比较OMT在不同肠段吸收与代谢的差异,预测其吸收与代谢的机制。
材料与方法 药品与试剂OMT和MT对照品由美国Cato Research Chemicals有限公司提供,纯度98%; 睾酮、Hank’s balanced salts solution (HBSS) 粉末由美国Sigma-Aldrich公司提供; HEPES、碳酸氢钠、氯化钠、葡萄糖、乌拉坦和甲酸均购自阿拉丁; 乙腈、甲醇购自美国默克公司; 水为超纯水; 其他试剂均为分析纯。
动物健康SPF级SD大鼠,雄性,体重 (200 ± 20) g,由南方医科大学实验动物中心提供。实验动物生产许可证号: SCXK (粤) 2011-0015。
主要仪器超高效液相色谱仪 (美国Waters公司); 四级杆飞行时间串联质谱仪 (美国Bruker Daltonics公司) 与高效液相色谱 (美国Agilent公司) 联用,配备电喷雾正离子以及Bruker Compass Data Analysis 4.0数据处理软件。
色谱条件采用Waters ACQUITY UPLC BEH C18 (1.7 µm,100 mm × 2.1 mm) 色谱柱; 流动相A为乙腈,流动相B为0.1% 甲酸水溶液; 梯度洗脱程序: 0~1.6 min,2%~10% A; 1.6~2.3 min,20% A; 2.3~ 3 min,20%~60% A; 3~4.7 min,60%~98% A; 4.7~5 min,98%~2% A; 流速: 0.30 mL·min-1; 柱温: 40 ℃; 样品温度: 4 ℃; 进样量: 10 µL; 检测波长: 210 nm。
液质联用参数采用四级杆飞行时间串联质谱仪与高效液相色谱联用。
高效液相色谱条件色谱系统: Agilent HPLC; 色谱方法: 流动相A为0.1% 甲酸水溶液,流动相B为乙腈; 梯度洗脱程序: 0~5 min,2%~10% B; 5~10 min,10%~20% B; 10~15.5 min,20%~95% B; 15.5~16 min,95%~5% B; 16~20 min,5% B; 进样量: 50 μL; 流速: 1 mL·min-1。
质谱工作参数采用电喷雾正离子全扫描方式,毛细管电压: 3.8 kV; 干燥气温度: 180 ℃; End Plate Offset: -500 V; Collision Cell RF: 2 000.0 Vpp; 喷雾电压: 1.0 bar; 氮气流速: 6.0 L·min-1。
OMT标准品溶液的制备精密称取OMT标准品26.439 mg于1.5 mL离心管中,加入甲醇溶液1 mL,涡旋混匀,制备成100 mmol·L-1母液,置 -20 ℃保存备用。
内标溶液的制备精密称取睾丸酮标准品28.843 mg于15 mL离心管中,精密吸取乙腈10 mL加入离心管中,涡旋混匀,制备成10 mmol·L-1母液,置 -20 ℃保存备用。精密吸取适量母液于乙腈中配制成终浓度为400 μmol·L-1内标溶液,置 -20 ℃保存备用。
HBSS缓冲溶液的制备精密称取HBSS粉末5.88 g、碳酸氢钠0.223 2 g、葡萄糖2.103 6 g、HEPES 3.576 0 g和氯化钠0.698 4 g,加纯水定容至600 mL,混合均匀,调节pH至6.5,水系微孔滤膜直径0.22 µm过滤,于4 ℃冰箱保存备用。
在体肠灌流模型实验前大鼠禁食12 h,自由饮水。大鼠麻醉后固定,沿腹中线打开腹腔,在靠近十二指肠处插胆管,分别在十二指肠、空肠、回肠和结肠的两端插聚乙烯管,并用手术线固定。4段肠道分别用等渗生理盐水和空白HBSS缓冲溶液冲洗肠道。入口管分别与一个恒速多通道注射泵上的4个注射器相连,以恒速10 mL·h-1灌流药液,用恒温37 ℃的循环水浴维持药液温度。实验结束后,处死大鼠,剪下灌流的肠段,测量并记录各肠段的长度。
灌流样品的处理精确称重样品管,计算并记录样品净重。吸取灌流液200 µL于1.5 mL离心管中,加入内标溶液40 µL,涡旋混匀,离心30 min,转速为13 000 r·min-1,取上清液进行UPLC检测。剩余灌流样品保存于-80 ℃冰箱中备用。
计算公式:
\[{{G}_{\text{z}}}=\frac{\pi DL}{2Q}\]
\[{{P}_{\text{eff}}}=\frac{1-{{C}_{\text{in}}}/{{C}_{\text{out}}}}{4{{G}_{\text{z}}}}\]
\[{{P}_{\text{aq}}}=\frac{1}{A\cdot \sqrt[3]{{{G}_{\text{z}}}}}\]
\[{{P}_{\text{w}}}=\frac{{{P}_{\text{eff}}}}{1\text{-}{{P}_{\text{eff}}}/{{P}_{\text{aq}}}}\]
其中,Q是灌流速度,L是肠段的长度,D是扩散系数,Gz为测量因素校正因子,对流速、肠长度等因素进行校正; Cin和Cout分别为经校正的进出口灌流液中药物浓度,A为修正因子,Peff是反映总体渗透情况的有效渗透系数,Paq为药物在水层的扩散,Pw表明药物经肠黏膜实际渗透能力的肠渗透系数。
Mab = Qτ (Cin - Cout)
Mmet= QτCmet
吸收率= Mab/Mtotal × 100%
代谢率= Mmet/Mtotal × 100%
其中,τ为单一样品收集的时间段 (30 min),Mab是药物的吸收量,Mmet是代谢物被外排的量,Mtotal为30 min内灌流的药物总量。
统计学分析采用SPSS19.0软件,组间比较采用单因素方差分析 (One-way ANOVA),若方差齐性时,采用LSD法; 若方差不齐时,采用Dunnett’T3法。以显著性α = 0.05为标准,当P < 0.05时,可判断组间差异具有统计学意义。
结果 1 方法的专属性测定HBSS缓冲液和样品,考察杂质和代谢产物对药物吸收峰有无影响,以及药物和内标吸收峰之间有无影响。OMT和MT的UPLC图谱见图 1。
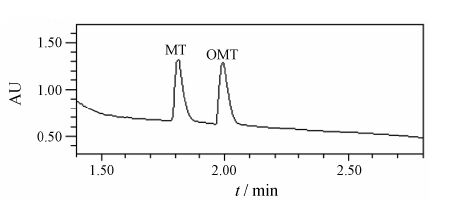
|
Figure 1 UPLC chromatogram of oxymatrine (OMT) and matrine (MT) |
液分别稀释至10、200和400 µmol·L-1,重复进样测定6次。求出其相对标准偏差RSD% 分别为0.8%、1.1% 和1.3%,可见该方法精密度良好。
2.2 准确度精密吸取OMT母液,用HBSS缓冲溶液稀释成10、200和400 µmol·L-1,每个浓度各重复测定6次,以峰面积求得相应的测定值。测得量与加入量比较,求得平均回收率为99.1%。
3 线性范围和标准曲线精密吸取OMT母液适量,以HBSS缓冲溶液为溶剂,用倍比稀释法将其稀释至终浓度分别为3.125、6.25、12.5、25、50、100、200和400 μmol·L-1的系列对照品溶液,进行UPLC检测,记录峰面积。以样品峰面积与内标峰面积之比对浓度进行回归分析,得回归方程为y = 0.003 6 x (R² = 0.999 9)。由此可知 ,OMT在3.125~400 μmol·L-1内线性关系良好。
4 稳定性考察精密吸取OMT母液适量,用HBSS缓冲液稀 释成终浓度分别为100、200和400 μmol·L-1的对照品溶液,常温放置; 分别于0、3和6 h取200 μL加入内标溶液40 μL,涡旋混匀,离心30 min,转速为13 000 r·min-1,取上清液进行UPLC检测。以药物峰面积与内标峰面积之比为纵坐标、浓度为横坐标作图。OMT的稳定性考察结果见图 2。结果表明,OMT在HBSS缓冲液中稳定性较好。
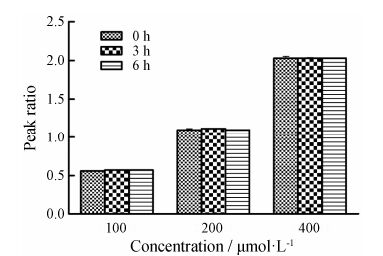
|
Figure 2 Stability of OMT in HBSS at different concentrations |
运用HPLC-ESI(+)-Q-TOF-MS,对比空白灌流液和含药灌流样品的数据,在含药灌流样品中发现OMT有两个代谢产物,分别是M1和M2。OMT及其代谢产物的UPLC色谱图和高分辨质谱图见图 3。从图可知,M1的保留时间是1.73 min,测得它的精确相对 分子质量是247.180 1,推测其分子式是C15H22N2O; M2的保留时间是1.81 min,精确相对分子质量是249.196 5,推测其分子式是C15H24N2O,即MT 。
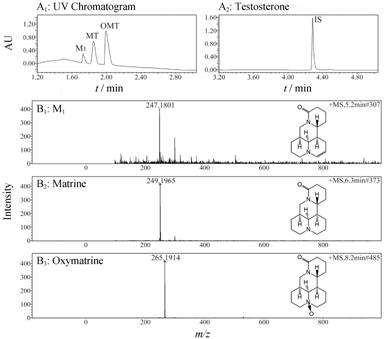
|
Figure 3 Identification of OMT and its metabolites (M1 and MT) in rat intestinal perfusate by UPLC and HPLC-ESI(+)-Q- TOF-MS. A1: UPLC chromatogram of M1,MT and OMT; A2: UPLC chromatogram of testosterone; B1: Mass spectrogram of M1; B2: Mass spectrogram of MT; B3: Mass spectrogram of OMT |
综合OMT的结构、高分辨质谱数据及文献数 据[14, 15],推测OMT在肠道酶及细菌的作用下,脱掉1个氧原子,形成MT; MT可再被氧化脱氢转化为M1。OMT的体内代谢过程见图 4。
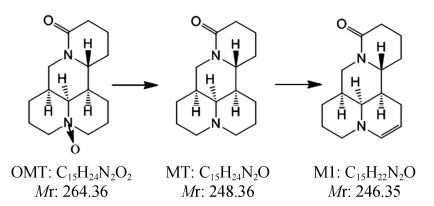
|
Figure 4 Proposed metabolic pathways of OMT in rats |
运用UPLC对3个浓度 (100,200,400 μmol·L-1) 的含药灌流样品进行检测,结果表明,OMT在4个 肠段的表观渗透系数和吸收率均无统计学意义 (P > 0.05),由此推测OMT在肠道属于被动吸收。而OMT在各肠段的吸收量存在显著性差异 (P < 0.05),其趋势为十二指肠 > 空肠> 回肠 > 结肠。不同浓度的OMT在各肠段的渗透率和吸收总量见图 5。
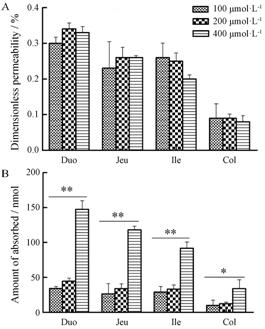
|
Figure 5 Effect of concentration differences on the permeability and absorption of OMT in rat intestinal perfusate. A: Permeability of OMT; B: Absorbed amount of OMT at different concentrations. Duo: Duodenum; Jeu: Jejunum; Ile: Ileum; Col: Colon. n= 3,x± s. P < 0.05,**P < 0.01 |
对比不同肠段代谢物的代谢率和代谢总量可发现,MT的代谢总量远大于M1,提示MT是OMT在肠道的主要活性代谢物。图 6为不同浓度的OMT在各肠段的代谢总量和代谢率。由图可见,十二指肠和空肠是OMT的主要代谢部位,M1和MT的代谢总量随浓度的增大而增大。

|
Figure 6 The excretion and excreted amount of oxymatrine metabolites (M1 and MT) at different concentrations. A1: Excretion rate of M1; A2: Excreted amount of M1; B1: Excretion rate of MT; A2: Excreted amount of MT. n = 3,x± s. P < 0.05 |
药物的吸收方式和特点常采用大鼠或小鼠等模型动物进行探究,大鼠与人体的吸收行为之间的相关性已被证实,其结果可用于推测人体的吸收行为。在体大鼠肠灌流模型能较好地保持大鼠生理状态,维持肠道中代谢酶的正常活力,且4个肠段同时进行灌流的方法,能较准确地预测药物在不同肠段的吸收与代谢特征。
由研究结果可知,OMT在肠道中属于被动吸收,这与利用Caco-2细胞模型进行体外实验证实OMT的转运机制为被动扩散结果一致[16]。另外,据文献[17]报道,对于20和40 mg·kg-1两种剂量,MT和OMT各自的药动学参数均无明显变化,表明它们的药动学性质为非剂量依赖性。
本研究发现OMT在肠道中可代谢为两种还原产物,推测是由肠道酶或细菌起作用。本课题组还利用大鼠肝微粒体酶和重组CYP450酶进行OMT的体外代谢实验,已证实OMT可经CYP3A4代谢为MT,由此猜测OMT在肠道中也可经CYP3A4代谢,下一步将以此为切入点,在灌流液中加入抑制剂或诱导剂进行调控,进一步探究OMT在肠道的代谢机制。
| [1] | Shi LJ, Shi L, Song GY. Study progress on pharmacological effects of oxymatrine in the liver [J]. Mod Tradit Chin Med Mater Med-World Sci Technol (世界科学技术: 中医药现代化), 2014, 16: 448-451. |
| [2] | Wang JX, Wang GJ. Pharmacological effects and clinical application of oxymatrine and matrine [J]. Chin Hepatol (肝脏), 2000, 5: 116-117. |
| [3] | Bao YX. Pharmacological effects and clinical application of oxymatrine [J]. World Latest Med (世界最新医学信息文摘, 2014, 14: 96-97. |
| [4] | Hu HB. Study progress on pharmacological effects and mechanisms of oxymatrine on cardiovascular system [J]. China Pharm (中国药业), 2012, 21: 110-112. |
| [5] | Yang YP, Sheng XC. Study progress on pharmacological effects of oxymatrine [J]. Chin J Hosp Pharm (中国医院药学杂志), 2009, 29: 405-407. |
| [6] | Wu S, Shi H, Xia SH. Pharmacology evolution of oxymatrine [J]. Acta Acade Med CPAPF (武警医学院学报), 2009, 18: 238-239, 244. |
| [7] | Zhang FL, Tang Y, Zhang JM. Advance in research into mechanism and pharmaceutics of matrine and kurarinone [J]. J Henan Univ Chin Med (河南中医学院学报), 2004, 19: 84-86. |
| [8] | Dai WH, Qian WL, Wang LL, et al. Toxicity studies in mice of matrine and oxymatrine [J]. Anhui Med Pharm J (安徽医药), 2012, 16: 904-905. |
| [9] | Wu XL, Hang TJ, Shen JP, et al. Determination and pharmacokinetic study of oxymatrine and its metabolite matrine in human plasma by liquid chromatography tandem mass spectrometry [J]. J Pharm Biomed Anal, 2006, 41: 918-924. |
| [10] | Estudante M, Morais JG, Soveral G, et al. Intestinal drug transporters: an overview [J]. Adv Drug Deliv Rev, 2013, 65: 1340-1356. |
| [11] | Ouyang H, Chen W, Andersen TE, et al. Factors that restrict intestinal cell permeation of cyclic prodrugs of an opioid peptide (DADLE): part II. Role of metabolic enzymes in the intestinal mucosa [J]. J Pharm Sci, 2009, 98: 349-361. |
| [12] | Nie SF, Pan WS, Yang XG, et al. Evaluation of gravimetry in the rat single-pass intestinal perfusion technique [J]. Chin J New Drugs (中国新药杂志), 2005, 14: 1176-1179. |
| [13] | Jeong EJ, Liu Y, Lin HM, et al. In Situ Single-Pass Perfused Rat Intestinal Model for Absorption and Metabolism [M] //Yan ZY, Caldwel GW. Optimization in Drug Discovery: In Vitro Methods. Clifton: Humana Press, 2004: 65-76. |
| [14] | Zhang L, Wang ZW, Lian JW, et al. Simultaneous determination of matrine, oxysophocarpin and oxymatrine in rat plasma by HPLC-MS and its application in the pharmacokinetic study [J]. Acta Pharm Sin (药学学报), 2008, 43: 843-847. |
| [15] | Chen Y, Chen HX, Du P, et al. HPLC-electrospray ionization ion trap tandem mass spectrometry analysis of oxymatrine and its metabolites in rat urine [J]. Acta Pharm Sin (药学学报), 2005, 40: 740-745. |
| [16] | Zhang L, Feng ZQ, Chen XJ, et al. Absorption characteristic of total alkaloids from Sophora flavescens and their monomers in Caco-2 cell model [J]. Chin Tradit Herb Drugs (中草药), 2012, 43: 2464-2467. |
| [17] | Wang XH, Huang SK. Pharmacokinetics and pharmacodynamics of matrine and oxymatrine [J]. Acta Pharm Sin (药学学报), 1992, 27: 572-576. |
 2015, Vol. 50
2015, Vol. 50


