2. 中国药科大学药物分析教研室, 江苏 南京 210009
2. Department of Pharmaceutical Analysis, China Pharmaceutical University, Nanjing 210009, China
活血通络粉针是由江苏康缘药业股份有限公司研制的新型中药制剂,该制剂将经典古方“桃红四物汤”简化成由桃仁 (君药、主要有效成分: 苦杏仁苷)、赤芍 (臣药、主要有效成分: 芍药苷)、川芎 (臣药、主要有效成分: 阿魏酸) 组成,将原方功效“滋养气血、活血化瘀” 化方为“活血化瘀、行气通络”,并制成静脉粉针与其汤药及“桃红四物注射液”进行对比研究。结果发现“活血通络粉针”比原方口服给药疗效更高,作用更快。且在降低脑水肿、抗血小板聚集等方面不差于“桃红四物注射液”。
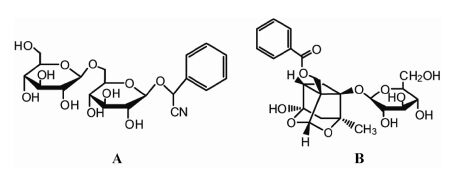
苦杏仁苷 (amygdalin,AD,图 1A) 和芍药苷 (paeoniflorin,PF,图 1B) 分别为活血通络粉针两种源药材桃仁和赤芍的主要活性成分。对于两种化学 成分的定量分析多局限于生药及药物制剂的含量测定[1, 2, 3, 4]、动物体内的含量测定[5, 6, 7, 8, 9, 10, 11],鲜见在人体尿液 样品中的两种成分的LC-MS/MS的定量分析方法的报道。
|
Figure 1 Chemical structures of amygdalin (AD,A) and paeoniflorin (PF,B) |
在本研究中,根据FDA和CFDA的指导原则[12, 13],建立了同时测定人尿液中苦杏仁苷和芍药苷的LC- MS/MS方法,并将之应用于活血通络粉针剂的尿药排泄研究,旨在为活血通络粉针剂临床应用提供参考。
材料与方法 药品与试剂苦杏仁苷对照品 (批号: 110820- 201004,含量: 93.6%)、芍药苷对照品 (批号: 110736- 201035,含量: 96.5%) 和栀子苷对照品 (批号: 110749- 201115,含量: 99.7%) 由中国食品药品检定研究院提供; 活血通络粉针 (江苏康缘药业有限公司,产品批号: 120802,规格: 6 g/瓶,其中苦杏仁苷含量为25.3 mg,芍药苷含量为35.8 mg)。
仪器 API4000质谱仪(美国应用生物系统公司) 配有Turbo-Ionspray电喷雾离子源及Analyst Software (1.5.2) 数据采集软件; 美国Agilent 1260高效液相色谱系统 (G1312B四元泵、G4225A真空脱气机、G1367E自动进样器、G1330B柱温箱)。
色谱条件色谱柱: Hedera ODS-2色谱柱 (2.1 mm × 150 mm,5 μm,江苏汉邦科技有限公司); 预柱: C18保护柱 (4.0 mm × 2.0 mm,5 μm,美国Phenomenex公司); 流动相: 乙腈-5 mmol·L-1醋酸铵水溶液 (含0.05% 甲酸) (20∶80); 流速: 0.3 mL·min-1; 柱温: 38 ℃; 进样量: 10 μL。
质谱条件离子检测方式为多反应监测 (MRM); 离子化方式为气动辅助电喷雾离子化 (ESI); 碰撞气 (CAD): 6 psi (1 psi ≈ 6.9 kPa); 气帘气 (CUR): 30 psi; 雾化气 (GS1): 70 psi; 辅助加热气 (GS2): 70 psi; 辅助加热温度为400 ℃; 用于定量分析监测离子对: 苦杏仁苷 [M+NH4]+ m/z 475.2 → 163.1; 芍药苷 [M+ NH4]+ m/z 498.2 → 179.1; 内标(栀子苷) [M+NH4]+ m/z 406.1 → 227.1。
对照品溶液的配制分别精密称取苦杏仁苷、芍药苷、内标 (栀子苷) 适量,置于10 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得浓度为1 mg·mL-1的各储备液。所有储备液置于4 ℃保存待用。
尿液样品的预处理于1.5 mL离心管中,加入尿液样品100 μL,精密加入栀子苷内标溶液 (10 μg·mL-1) 20 μL,涡旋混匀,加入甲醇900 μL沉淀,涡旋3 min,于15 600 r·min-1高速离心10 min,吸取上清液100 μL转移至另一1.5 mL离心管中,精密加入流动相900 μL稀释,涡旋混匀,转移至自动进样器样品瓶中,进样量10 μL,进行LC-MS/MS分析。
方法学考察
选择性 分别取来自6个不同个体的空白尿液100 μL,除不加内标外,其余按“尿液样品的预处理”项下操作,进行LC-MS/MS分析,获得空白尿液样品色谱图。将苦杏仁苷、芍药苷和内标对照品溶液分别加入空白尿液后,配制成含苦杏仁苷、芍药苷和内标的浓度分别为40、40和10 μg·mL-1的尿液样品,同法操作,得尿液样品色谱图; 取健康受试者给药后收集的尿液样品,同法操作,得健康受试者尿液样品色谱图。
残留效应分别制备空白尿液 (不加入内标溶液) 和含苦杏仁苷及芍药苷浓度为标准曲线定量上限 (ULOQ) 的尿液样品,按“尿液样品的预处理”项下操作处理尿液样品后,进行LC-MS/MS分析,在高浓度样品进样分析后,分析空白样品 (如ICO-1-BK),反复5次,记录色谱图。残留效应的评价标准: ULOQ尿液样品之后在空白尿液样品中,样品保留时间处残留的峰面积 (As) 小于定量下限 (LLOQ) 的20%,内标保留时间处残留的峰面积 (As') 小于内标的5%。
标准曲线和定量下限取1.5 mL离心管数支,分别精密加入不同浓度的苦杏仁苷、芍药苷对照品溶液20 μL后以氮气流吹干,加入空白尿液100 μL,旋涡混匀,配成含苦杏仁苷、芍药苷浓度分别为0.03、0.1、0.3、1、3、10、20和40 μg·mL-1的标准含药尿液,按“尿液样品的预处理”项下操作,制备标准曲线,并同时制备空白样品及空白加内标样品,进行LC-MS/MS分析,记录色谱图。以尿液中待测物的浓度为横坐标,待测物与内标的峰面积之比为纵坐标,用加权最小二乘法 (W = 1/X2)进行回归运算,得出标准曲线方程。
精密度与准确度制备含苦杏仁苷、芍药苷浓度分别为0.03、0.05、2和30 μg·mL-1的标准含药尿液样品,每个浓度平行配制5份,并配制一条标准曲线,按“尿液样品的预处理 ”项下操作,共配制3个分析批,记录色谱图,计算样品和内标峰面积的比值f,代入当批的标准曲线求得实测浓度及实测浓度准确度,计算批内和批间精密度。
基质效应、提取回收率按“尿液样品的预处理”项下分别制备6种不同来源的空白尿液上清液适量,加入适量苦杏仁苷和芍药苷对照品溶液及内标溶液,配制成含苦杏仁苷、芍药苷浓度为0.05、2和30 μg·mL-1的含药尿液样品,每个浓度平行配制6份进行LC-MS/MS分析,记录苦杏仁苷、芍药苷和内标峰面积 (A) 并分别计算苦杏仁苷、芍药苷峰面积和内标峰面积的平均值 (B); 以水代替空白尿液,其余操作同上,每个浓度平行配制3份进行LC-MS/MS分析,记录苦杏仁苷、芍药苷和内标峰面积并分别计算苦杏仁苷、芍药苷峰面积和内标峰面积的平均值 (C); 按“精密度和准确度”项下操作,配制含苦杏仁苷、芍药苷浓度为0.05、2和30 μg·mL-1的标准含药尿液样品,每种浓度配制5份进行LC-MS/MS分析,记录苦杏仁苷、芍药苷和内标峰面积 (D)。计算苦杏仁苷、芍药苷和内标 (栀子苷) 的介质效应的公式为ME (%)= A/C×100%; 计算苦杏仁苷、芍药苷和内标 (栀子苷) 的提取回收率的公式为R (%)= D/B×100%。
稳定性配制含苦杏仁苷、芍药苷浓度为0.05、2和30 μg·mL-1的标准含药尿液样品若干份,3份于配制好后按“尿液样品的预处理”项下操作处理并立即进行LC-MS/MS分析,并在测定完成后在进样器样品盘中放置8h后再次进样分析; 3份室温放置 8h后分析; 3份配制好后反复冻融3次后分析; 3份配制好后放入 -20 ℃冰箱中冰冻45天后,取出化冻再分析,记录色谱图。同时分别考察了苦杏仁苷、芍药苷和内标的甲醇储备液 (均为1 mg·mL-1) 分别在室温放置18 h、-20 ℃中冷冻保存128天条件下的稳定性 (n = 3)。
尿药排泄研究临床试验经 CFDA批准 (批准文号: 2004L01097),9名健康受试者,男性5名,女性4名,年龄23~28岁,男性体重61~73 kg,女性体重50~66 kg ,体质量指数BMI在19.1~23.9内,在签署知情同意书并经全面体检合格后纳入本次试验。试验前两周及实验期间未服用其他任何药物。受试者于上午6:30空腹静脉输注活血通络粉针 (剂量: 6 g),输液时间持续4 h (静脉输注,以适量氯化钠注射液充分溶解,再以氯化钠注射液250 mL稀释,采用输液泵恒速静脉输注,4 h输完)。给药过程中自由饮水,给药结束后2 h统一进食标准餐,进食时间不超过30分钟。收集给药前 (0 h) 及给药开始后0~2 h、2~4 h、4~6 h、6~8 h、8~12 h、12~24 h各时间段所有尿液并记录尿量,然后各取10 mL,置于 -80 ℃保存待测。各时间段原形药物的排泄量为该时间段尿药浓度与该时间段尿液体积相乘; 尿液中原形药物的累积排泄量为所有时段尿液中原形药物排泄量的总和,其与给药剂量相比即得尿液中原形药物的累积排泄率; 各时间段尿液中原形药物的排泄速率为该时间段尿液排泄量与该时间段持续时间之比。
结果 1 质谱分析在上述质谱条件下,苦杏仁苷、芍药苷和内标主要生成 [M+NH4]+ 准分子离子峰: 苦杏仁苷m/z 475.2、芍药苷m/z 498.2、栀子苷m/z 406.2。为使 [M+NH4]+前体离子产生稳定且丰度较高的产物离子,本试验采用温和的碰撞诱导解离条件,如低碰撞能量 (CE),低CAD,在此基础上进行产物离子扫描得到的各成分的产物离子为苦杏仁苷m/z 163.1、芍药苷m/z 179.1、栀子苷m/z 227.1。为得到最大的离子化效率,对CE和CAD进行了优化,CE优化范围为1~45 V,CAD范围为5~10 psi,结果显示在CAD为6 psi,苦杏仁苷的CE为23 V、芍药苷的CE为25 V、栀子苷的CE为13 V时,各待测物的丰度最大。
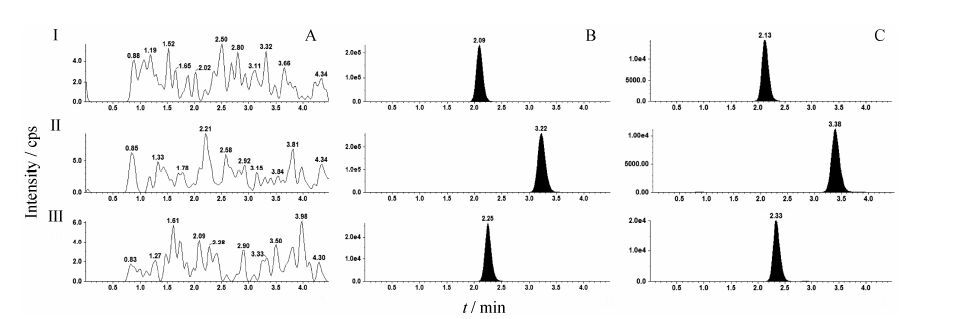
2 方法学确证 2.1 选择性结果表明,苦杏仁苷、芍药苷和内标 (栀子苷) 的保留时间分别为2.13、3.38和2.33 min,色谱峰峰形良好,无杂峰干扰测定,基线平稳。本方法选择性好,能准确测定尿液中苦杏仁苷和芍药苷的浓度,且灵敏度较高,典型色谱图见图 2。
|
Figure 2 Representative MRM chromatograms of AD (I),PF (II) and IS (jasminoidin,III). A: Blank urine sample; B: Blank urine sample spiked with the analytes and IS (AD: 40 μg·mL-1,PF: 40 μg·mL-1,IS: 10 μg·mL-1); C: A urine sample from a healthy Chinese volunteer after a single intravenous infusion administration of Huoxue-Tongluo lyophilized powder for injection (HTLPI,6 g) |
结果表明,尿液样品分析中苦杏仁苷、芍药苷和内标无残留效应。
2.3 标准曲线和定量下限尿液样品中苦杏仁苷的标准曲线的典型权重回归方程: f(AD) = -0.000 689 + 0.292 × C (r = 0.998 5),芍药苷的标准曲线的典型权重回归方程: f(PF) = -0.001 49 + 0.404 × C (r = 0.998 6)。结果显示,苦杏仁苷和芍药苷在0.03~40 μg·mL-1浓度内线性关系良好,定量下限均为0.03 μg·mL-1。
2.4 精密度与准确度苦杏仁苷的批内精密度均小于6.6%,批间精密度均小于7.4%,准确度在93.4%~108.9% 之间; 芍药苷的批内精密度小于4.1%,批间精密度小于3.3%,准确度在94.6%~108.5% 之间。结果表明,本方法的准确度与精密度的相对标准偏差 (RSD) 均小于15%,符合生物样品分析要求。
2.5 基质效应、提取回收率介质效应及提取回收率考察结果见表 1。结果表明,尿液样品中苦杏仁苷、芍药苷和内标的基质效应均在85%~115% 内,符合要求。不同浓度待测物的提取回收率恒定。
|
|
Table 1 Matrix effects and recovery data for the analysis of AD and PF in human urine. n = 3,x± s |
苦杏仁苷、芍药苷尿液样品在室温放置8 h、反复冻融3次及-20 ℃冰冻45天的条件下 均稳定性良好; 尿液样品处理后的上清液在进样器中放置8 h稳定性良好。同时,储备液稳定性结果表明,苦杏仁苷、芍药苷和内标的甲醇储备液 (均为1 mg·mL-1) 分别在室温放置18 h、-20 ℃中冷冻保存128天条件下稳定性良好,相对误差均小于 ± 2%。
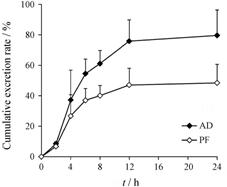
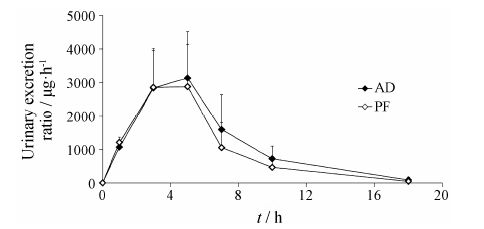
3 人尿中苦杏仁苷、芍药苷排泄研究9名健康受试者单次静脉滴注中剂量 (含苦杏仁苷25.3 mg,含芍药苷35.8 mg) 活血通络粉针后尿 液中苦杏仁苷和芍药苷的平均累积排泄量-时间曲线见图 3; 不同时间段平均尿药排泄速率-时间曲线见图 4。结果表明,单次静脉滴注中剂量活血通络粉针
|
Figure 3 Mean cumulative urinary excretion rate-time curves of AD and PF following a single intravenous infusion of 6 g HTLPI. n = 9,x± s后,苦杏仁苷和芍药苷均主要以原形经尿液排出体外,给药结束后2 h (即6 h) 达到最大排泄速率,24 h后基本排泄完全,24 h内的累计排泄率分别为 (79.6 ± 16.7) % 和 (48.4 ± 12.2) %。 |
|
Figure 4 Mean urinary excretion ratio-time curves of AD and PF following a single intravenous infusion of 6 g HTLPI. n = 9,x± s |
在正离子ESI全扫描模式下,苦杏仁苷未检测到质子化离子,芍药苷虽然检测到[M+H]+,但是其丰度过低,不能满足定量检测的需要。两个待测物的质谱图中的基峰均为 [M+Na]+ (苦杏仁苷: m/z 480.2; 芍药苷: m/z 503.2),为使[M+Na]+离子响应稳定,在流动注射液中加入适量的醋酸钠。但后续进行产物离子扫描时发现,当CE逐渐增大,[M+Na]+离子不易形成碎片离子,当CE超过40 V时,[M+Na]+丰度大幅降低,但其裂解成大量低丰度的碎片离子,并不能产生高丰度的且能够进行准确定量的产物离子碎片,所以尽管[M+Na]+离子为基峰,但其并不适合作为待测物的前体离子进行LC-MS/MS定量检测。有文献[14]报道,不同于[M+Na]+,[M+NH4]+是一种易碎的前体离子,且可以产生大量丰度较高的产物离子碎片。所以,本试验选择[M+NH4]+作为前体离子进行监测。在流动注射液中加入适量的醋酸铵,从而得到稳定且丰度较高的[M+NH4]+前体离子: 苦杏仁苷m/z 475.2、芍药苷m/z 498.2、栀子苷m/z 406.2。为避免易碎的[M+NH4]+前体离子在离子源内裂解,在选择性离子检测模式 (SIM) 下对去簇电压 (declustering potential,DP) 进行了优化,最终对于苦杏仁苷、芍药苷和栀子苷分别选择DP为55、51和50 V。
在液质联用分析中常常选择在流动相的水相中加入适量浓度的挥发性的缓冲盐和弱酸,形成缓冲体系,从而达到改善待测物的色谱行为、提高其质谱灵敏度的目的。在本实验中,由于选择的待测物的前体离子为加铵离子,流动相的水相中少量的铵阳离子的存在有利于形成稳定的 [M+NH4]+,从而提高待测物的质谱响应,所以本实验选择在流动相中加入醋酸铵,并对其在水相中的终浓度 (0、2、5和10 mmol·L-1) 进行了系统的优化,结果表明在流动相中的水相中加入5 mmol·L-1醋酸铵,此时的待测物的质谱响应灵敏度高,重现性好。此外,为改善色谱峰峰形,水相中还加入了0.05% 的甲酸,此时待测物色谱行为最优,分离度最好。最终的水相组成为5 mmol·L-1醋酸铵水溶液 (含0.05% 甲酸)。
尿液样品由于原形药物浓度含量较高,为防止质谱响应饱和,前处理时采用了沉淀后稀释的方法,即以尿液-甲醇 (1∶9),将尿液样品进行初步沉淀前处理,上清液亦按照以上比例加入9倍于上清液的溶样流动相进行稀释,经此前处理后的尿液样品不但峰形良好,且尿液中的大极性内源性杂质亦被除去,避免了介质效应。
通过尿排数据可知,在人体内,肾脏是静脉滴注活血通络粉针后苦杏仁苷和芍药苷的主要排泄器官,提示肾功能不全者需谨慎使用活血通络粉针剂。
| [1] | Quan QB, Li QH. HPLC analysis of paeoniflorin, berberine hydrochloride and glycyrrhizic acid in Weiyankang capsules [J]. Chin J Pharm Anal (药物分析杂志), 2012, 32: 120-122. |
| [2] | Huang X, Li GC, Yin L, et al. The effective parts of Liangxue Tongyu prescription on cooling-blood and activating- blood and analysis of chemical constituents by HPLC-MS and GC-MS [J]. Acta Pharm Sin (药学学报), 2015, 50: 86-93. |
| [3] | Jian ZY, Yu JB, Wang WQ. RP-HPLC determination of main chemical components in different parts and different harvest periods of Paeonia lactiflora [J]. Acta Pharm Sin (药学学报), 2010, 45: 489-493. |
| [4] | Yang L, Xu SJ, Tian RT, et al. HPLC fingerprinting of Radix Paeoniae Alba [J]. Acta Pharm Sin (药学学报), 2007, 42: 71-74. |
| [5] | Li T, Wang YW, Wang YL, et al. LC-MS quantification and pharmacokinetics of the multi-constituents of Huangqin Tang in rat plasma after different single oral doses [J]. Acta Pharm Sin (药学学报), 2013, 48: 917-924. |
| [6] | Wang XY, Ma XH, Li YW, et al. Simultaneous determination of five phenolic components and paeoniflorin in rat plasma by liquid chromatography-tandem mass spectrometry and pharmacokinetic study after oral administration of Cerebralcare granule [J]. J Pharm Biomed Anal, 2013, 86: 82-91. |
| [7] | Li XB, Liu CH, Zhang R, et al. Determination and pharmacokinetics of amygdalin in rats by LC-MS-MS [J]. J Chromatogr Sci, 2014, 52: 476-481. |
| [8] | Wen J, Qiao Y, Yang J, et al. UPLC-MS/MS determination of paeoniflorin, naringin, naringenin and glycyrrhetinic acid in rat plasma and its application to a pharmacokinetic study after oral administration of Si-Ni-San decoction [J]. J Pharm Biomed Anal, 2012, 66: 271-277. |
| [9] | Feng C, Liu M, Shi X, et al. Pharmacokinetic properties of paeoniflorin, albiflorin and oxypaeoniflorin after oral gavage of extracts of Radix Paeoniae Rubra and Radix Paeoniae Alba in rats [J]. J Ethnopharmacol, 2010, 130: 407-413. |
| [10] | Zhao X, Zang W, Zhao X, et al. HPLC with column switching coupled to APCI-MS for pharmacokinetic study of amygdalin in rabbit plasma [J]. Chromatographia, 2007, 65: 149-153. |
| [11] | Ge BY, Chen HX, Han FM, et al. Identification of amygdalin and its major metabolites in rat urine by LC-MS/MS [J]. J Chromatogr B, 2007, 857: 281-286. |
| [12] | FDA. Guidance for Industry: Bioanalytical Method Validation [S]. US Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER), Center for Veterinary Medicine (CV), 2001, http://www/fda.gov/cder/guidance/index.htm. |
| [13] | CFDA. Guidance on the Evaluation of the Pharmacokinetics of Chemical Drugs (化学药物临床药动学研究技术指导原 则) [S]. China Food and Drug Administration, Center for Drug Evaluation, 2005. http://www.cde.org.cn/zdyz.do?method= largePage&id=2070. |
| [14] | Guan F, Ishii A, Seno H, et al. Identification and quantification of cardiac glycosides in blood and urine samples by HPLC- MS/MS [J]. Anal Chem, 1999, 71: 4034-4043. |
 2015, Vol. 50
2015, Vol. 50


