2. 军事医学科学院放射与辐射医学研究所, 北京 100850;
3. 沃特世科技 上海 有限公司, 上海 201206;
4. 新奥集团新绎健康科技有限公司, 河北 廊坊 065001
2. Institute of Radiation Medicine, Academy of Military Medical Sciences, Beijing 100850, China;
3. Waters Corporation Shanghai, Shanghai 201206, China;
4. Ovation Health Science and Technology Co.Ltd., ENN Group, Langfang 065001, China
四物汤出自宋代《太平惠民和剂局方》,经熟地、白芍、当归、川芎四味药材按15∶10∶10∶6的比例配伍而成,主要功效为养血调经、补血活血,临床用于血虚症[1, 2]。前期研究表明,四物汤以60% 乙醇提取,经SP825大孔吸附树脂分离得到的乙醇洗脱部位具有较好的抗辐射效果,值得进一步进行化学组成分析。
中药,尤其是中药复方是一个极其复杂的物质体系,其药效物质基础的复杂性一直以来制约着中药现代化的进程。近年来,随着液质联用技术的发展,为解决这一难题提供了一种良好的技术手段。但目前常规的液质联用鉴定化合物的方法依然是手工提取每个色谱峰,根据色谱峰的精确分子质量、碎片离子峰、加合离子峰以及保留时间,结合对照品、网络数据库和相关文献,最终确定化合物的可能结构[3−5]。这种模式最大的局限性是耗时长、效率低,重现性差。
UNIFI天然产物整体解决方案以超高效液相色谱与四级杆飞行时间质谱为基础,对样品进行Continuum模式下非数据依赖的MSE采集,并将中药中已有的化合物信息录入UNIFI数据库,软件自动进行峰提取和分子式确定等数据处理过程并与数据库中化合物结构进行匹配,自动将软件计算的理论碎片与采集的二级离子进行匹配,给出碎片离子的可能结构,最终通过预设的工作流程模版自动显示所鉴定化合物的详细信息。
本实验首次利用UPLC/Q-TOF-MSE技术结合UNIFI天然产物解决方案进行了四物汤中化学成分的分析。人工确认了软件自动给出的结果中113个化合物的结构,并提供了另外14个未知成分的质谱信息。本研究利用新方法,更加快速全面地阐明了四物汤的化学成分组成,为中药的化学成分研究提供了一种新的技术手段。
材料与方法 仪器与药材 Waters ACQUITYTMUPLC I-Class超高效液相色谱系统 (Waters Corporation,Milford,MA,USA),Waters SYNAPTG2-SiMS质谱系统 (Waters Corporation,Manchester,UK),UNIFI 1.7软件系统。四物汤各药材饮片均购自北京同仁堂 (亳州) 饮片有限责任公司,经天津中医药大学张丽娟教授鉴定为玄参科植物地黄Rehmannia glutinosa Libosch.的炮制加工品,伞形科植物当归Angelica sinensis (Oliv.) Diels的干燥根,川芎Ligusticum chuanxiong Hort.的干燥根茎,毛茛科植物芍药Paeonia lactiflora Pall.的干燥根。
供试品溶液制备取熟地15 g、当归10 g、白芍10 g、川芎6 g,8倍量的60% 乙醇溶液回流提取1.5 h,趁热过滤,重复一次,合并滤液,减压浓缩后进行SP825大孔吸附树脂柱层析,水洗除杂后,收集95%乙醇洗脱部分,得四物汤醇提液 (SWTC),减压浓缩,取少量浓缩液稀释后经0.22 µm微孔滤膜过滤,取续滤液1 µL进样分析。
色谱条件色谱柱为ACQUITY HSS T3 (2.1 mm × 100 mm,1.8 μm),以0.1% 甲酸水溶液 (A) 和乙腈 (B) 为流动相,洗脱程序为0~0.5 min,5% B; 0.5~0.6 min,5%~20% B; 0.6~7.5 min,20%~35% B; 7.5~9.5 min,35%~45% B; 9.5~10 min,45%~50% B; 10~12 min,50%~52% B; 12~13 min,52%~55% B; 13~15.5 min,55%~60% B; 15.5~17.5 min,60%~85% B; 17.5~18 min,85%~95% B; 18~20.5 min,95% B; 20.5~21 min,95%~5% B; 21~23 min,5% B。柱温45 ℃; 流速0.5 mL·min−1。
质谱条件电喷雾电离离子源 (ESI),准确质量数用亮氨酸脑啡肽作校正液。离子化模式为正、负离子,离子源温度为120 ℃,脱溶剂气体为高纯度氮气,温度为450 ℃,流速为800 L·h−1,毛细管电压为3 kV,锥孔电压为30 V,扫描范围为m/z 50 ~1 200。低能量扫描时trap电压为6 eV,transfer电压为4 eV,高能量扫描时trap电压为45~60 eV,transfer电压为15 eV。
数据采集模式为Continuum模式下的3D数据采集。
数据处理 四物汤数据库的建立应用UNIFI 1.7软件的化合物库管理系统,录入软件自带中药库中有关四物汤四味单药的化学成分信息及补充文献已报道的部分信息,包括结构、化学式、平均摩尔质量等,构建四物汤化学成分专属数据库。
软件处理建立分析方法: 设定预期成分 (导入四物汤数据库) 后,设置3D峰检测参数的强度阈值 (高能量为30计数,低能量为200计数) 和加合离子峰的种类 (负离子模式为M-H、M+HCOO; 正离子模式为M+H、M+Na)。软件自动标识经处理后的可信数据,给出保留时间、化学式、质量数误差、同位素匹配偏差,标识的高能量碎片数目等信息。在负离子模式下共给出707个好的匹配结果 (依据工作流程显示在Good Match一栏),正离子模式下共给出435个好的匹配结果,包括同一分子量对应的多个异构体,软件无法区分则全部显示,以及母离子裂解产生的碎片离子经过匹配后也会成为待选结果,需要进行人工确认。此外,含量高的未知成分,显示在“No Match High”一栏。
人工确认SYNAPTG2-Si MS的高灵敏度可以得到较多药材中微量成分的信息,其中包括大量的同分异构体,根据保留时间、裂解碎片信息,结合相关文献,可以对同分异构体做出合理的判断和推测,并通过软件自动碎片匹配功能 (根据键能大小预测化合物裂解碎片的技术) 对结果进一步确证。未知 成分(预期成分中没有的结构) 的鉴定,依据精确分子量和同位素匹配得到可能的分子式,通过离线及在线数据库 (中药常用数据库: PubMed、PubChem、Natural Product Update、MassBank等) 的检索得到备选化合物,最后通过“Fragment match”对可能的结构进行验证。
结果应用UPLC/Q-TOF-MSE技术在正负离子模式下分别采集数据,在上述软件处理方法下对供试品溶液进行分析,可以得到SWTC的正、负基峰离子色谱图 (图 1),结合相关文献,共鉴定了其中113个化合物。当归、川芎中的苯酞类化合物在正离子模式下响应强度高,故在正离子模式下对此类成分进行鉴定,其余成分的鉴定在负离子模式下进行,鉴定结果见表 1,除个别化合物的质量误差大于1 mDa外,均在1 mDa范围内,得到的分子式准确可信,对于同分异构体的判断将进行详细叙述。

|
Figure 1 Base peak ion (BPI) chromatograms of Si-Wu Decoction. a:Negative scan; b: Positive scan |
|
|
Table 1 Compounds identified in SWTC by UPLC/Q-TOF-MSE coupled with UNIFI in both negative and positive scan. Compounds identified in positive scan,aFormula is determined by [M+HCOO]−,bCompounds identified in positive scan and their formula are determined by [M+H]+,cCompounds identified in positive scan and their formulae are determined by [M+Na]+ |
文献报道白芍中存在5个芍药苷异构体,依据母核结构不同分为3类: 环氧类包括芍药苷 (paeoniflorin)、异芍药苷 (isopaeoniflorin),内酯类包括白芍苷 (albiflorin)、白芍苷R2 (albiflorin R2),羰基类为白芍苷R1 (albiflorin R1),见图 2。峰7、12、15、21、23、35经软件数据分析,分子式均确定为C23H28O11,其中12、15、35含量较高 (表 1),结合文献,确定峰12、15分别为白芍苷、芍药苷,峰35与12 (白芍苷) 碎片相近,鉴定为与白芍苷结构类似的白芍苷R2[6, 7],峰23与15都有明显的m/z 449.145 [M−H−30]-环氧类结构特征碎片峰,推测峰23为异芍药苷[8]。峰7、21碎片离子峰相近,只显示[M+HCOO]-的加合离子峰而不显示[M−H]-的准分子离子峰,推测为白芍苷R1或其异构体[9]。具体裂解碎片信息见图 2、表 1。
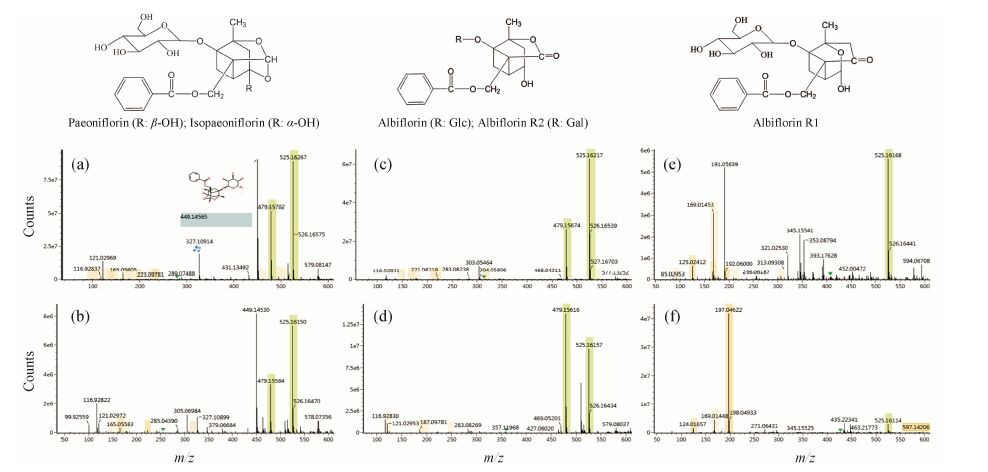
|
Figure 2 Structures of monoterpene glycosides (MW = 480) and negative ion MS spectrum low energy scan of (a) Peak 15,(b) Peak 23,(c) Peak 12,(d) Peak 35,(e) Peak 7 and (f) Peak 21 |
分子式确定为C30H32O15的峰有13、22、26、30、33、34、42,其中22含量最高,且有m/z 613.156 6 [M−H−H2O]-、491.119 8 [M−H−H2O-122]-等特征信 号,确定其为没食子酰芍药苷 (galloylpaeoniflorin),峰26、30裂解碎片一致,仅为丰度上的差别,都显示m/z 545.057 [M−H-86]-、469.052 [M−H-2×86]-的信 号,且m/z 601.082 [M−H−30]-说明两者结构与芍药苷相近,此外,峰33也显示m/z 449.146 4芍药苷的特征信号,文献报道白芍中还含有4-O-没食子酰芍药苷 (4-O-galloylalbiflorin)、4'-O-没食子酰芍药苷 (4'-O- galloylpaeoniflorin),则峰26、30、33为4'-O-没食子酰芍药苷或其异构体,峰13、34、42为4-O-没食子酰芍药苷或没食子酰芍药苷异构体[10−12]。
峰18、24、29分子式为C33H58O14,结合文献关于毛蕊花糖苷 (acteoside) 和异毛蕊花糖苷 (isoacteoside) 保留时间的报道,推测18为毛蕊花糖苷,24为异毛蕊花糖苷,29为毛蕊花糖苷的异构体[6, 13]。
此外,负离子模式下存在一系列来源于白芍的单萜糖苷类成分,分子式分别为C23H28O12 (峰5、17)、C30H32O13 (峰46、57、64、68)、C30H32O12 (峰49、61、62、74、77),根据文献报道的化合物种类、含量的高低以及各化合物在反相C18上的色谱行为,分别进行鉴定,结果见表 1[7, 8, 14, 15]。
2 正离子模式下苯酞类化合物的鉴定 2.1 苯酞单聚体的鉴定峰72、91、98、104、109均显示m/z 189.091 [M+H]+的准分子离子峰,提示分子式为C12H12O2,按照两种途径裂解,峰72、91先脱 去一分子水,出现m/z 171.080 [M+H−H2O]+的信号,峰98、104先脱去内酯环中的羰基,出现m/z 161.096 [M+H−CO]+的信号,此外,峰109还显示[M+Na]+的加合离子峰,其中峰91、104响应较高, 结合文献,依次鉴定为E-丁烯基苯酞 (E-butylidenephthalide)、Z-丁烯基苯酞 (Z-butylidenephthalide),其余为丁烯基苯酞 (butylidenephthalide) 的异构体[16]。
峰84、87、111分子式均为C16H22O4,其中峰111丰度较高,且m/z 149.023 3 [M+H-C8H16O]+、105.033 5 [M+H−C9H16O3]+等裂解碎片与邻苯二甲酸二丁酯 (dibutylphthalate) 的键能情况较相符,推测其为邻苯二甲酸二丁酯,峰84、87有相同的碎片离子峰m/z 233.153 [M+H−CH2O2]+,推测为洋川芎内酯M (senkyunolide M) 或洋川芎内酯Q (senkyunolide Q)[17, 18]。
峰90、94、107、114、119、120具有相同的准分子离子峰m/z 191.107 [M+H]+,提示分子式为C12H14O2,其中峰90、94、114响应较高,且都显示m/z 173.096 [M+H−H2O]+、145.101 [M+H−H2O−CO]+、117.069 [M+ H−H2O−CO−C2H6]+的碎片离子峰,结合文献,分别鉴定为丁苯酞 (butylphthalide)、E-藁本内酯 (E-ligustilide)、Z-藁本内酯 (Z-ligustilide),峰107、119、122为丁苯酞的异构体[16]。
此外,正离子模式下存在一系列苯酞类成分,分子式分别为C12H16O3 (峰25、70、73)、C12H18O4 (峰32、36)、C12H14O3 (峰38、75、82、89)、C12H14O4 (峰39、67)、C12H16O4 (峰43、50)、C12H12O3 (峰83、85、86)、C12H16O2 (峰88、95),根据裂解碎片类型、含量的高低,在反相C18上的色谱行为,结合文献分别进行鉴定,鉴定结果见表 1[16,17,19−22] 。
2.2 苯酞二聚体的鉴定峰113、116、117、122、123、124、125、126、127等9个化合物具有相同的准分子离子峰,分子式为C24H28O4,文献中报道过的此类结构,多为由藁本内酯 (ligustilide) 或其异构体通过环加成形成的二聚体,因单体成分、连接位点、立体构型以及成环类型不同,构成多种异构体[23]。峰117、123都以m/z 191.107 [M/2+H]+裂解碎片为主,同时存在m/z 173.096 [M/2+H−H2O]+、145.101 [M/2+ H−H2O−CO]+等裂解碎片,说明它们单体间由相对不稳定的四元环结构连接。峰113、116、124、126显示m/z 353.211 [M+H−CO]+、335.258 [M+H−H2O−CO]+等碎片,结构稳定,则它们单体间形成六元环结构,而峰122、125、127除m/z 191.107 [M/2+H]+外,还存在较明显的脱水信号。其中,峰117、122、123、124含量较高,依据文献中报道的此类化合物及色谱行为,推测四者依次为riligustilide、tokinolide B、3Z,3'Z-6.8',7.3'-diligustilide、levistolide A,又因为峰124与126裂解碎片相近,122与125、127裂解碎片相近,推测126为洋川芎内酯O (senkyunolide O),125、127为isotokinolide B或Z-ligustilide dimer E-232,而113、116为levistolide A的异构体[24−26]。
峰110、112、118、121是分子式均为C24H30O4的苯酞二聚体,一般由藁本内酯与洋川芎内酯A聚合而成,其中峰112、118同时存在脱水信号和藁本内酯与senkyunolide A的准分子离子峰及它们的一系列碎片离子,峰110、121则直接裂分为藁本内酯与洋川芎内酯A的单元,因此,推测峰112、118为聚合为六元环结构的洋川芎内酯P (senkyunolide P) 或3,8-dihydro-diligustilide,峰110、121为以四元环聚合的异构体[27, 28]。
3 未知成分的鉴定峰10、11分子式为C29H38O16,经ChemSpider在线数据库检索,存在一个芍药苷与葡萄糖的聚合物,文献报道,白芍经体内代谢后会产生未知的芍药苷或白芍苷与葡萄糖结合成的聚合物,在复方中其形成途径尚不明确[29]。
峰59分子式为C18H18O6,其裂解碎片193.050 9 [C10H10O4−H]-和135.045 2 [C8H8O2−H]-恰好是它的两个结构片段,通过Waters中药数据库检索得到化合物decursidate,其结构与裂解情况较符合,见图 3,所以推测峰59为decursidate或其异构体。

|
Figure 3 Negative ion MS spectra in low energy scan of peak 59 |
峰102分子式为C18H32O3,通过Waters中药数据库检索得到化合物coronaric acid和vemolic acid,推测峰102为coronaric acid或vemolic acid或其异构体。
其余未知化合物,通过离线及在线数据库检索,未能找到匹配的化合物,可能为煎煮过程中产生的新成分。
本文利用该方法对四物汤60% 乙醇提取液进行了快速分析和鉴定,表征了127个色谱峰,鉴定了其中113个化合物。对比应用传统液质分析方法得到 的结果 (表征了43个色谱峰和鉴定了25个化合物)[6],有了明显的进步,表明本方法对中药复杂体系的定性分析更加方便、快速,也可以得到更多成分的结构信息,更加全面了解其成分的组成。
讨论本实验采用UNIFI天然产物解决方案,全面高效地分析了四物汤中的化学成分,简化了数据处理过程,并利用软件的在线数据库检索、Massfragment等功能,对未知成分结构做了进一步分析及推测,表明此方法对中药复杂成分的研究很有帮助。与传统的研究模式相比较,UNIFI天然产物整体解决方案将大量的数据筛选工作,即从信息的海洋中寻找有用目标这项一直靠研究者手动操作的工作变成软件的自动化流程,大大减少了研究人员的工作量,同时极大降低了这项工作的盲目性,从而提高效率。建立好的化合物数据库及相关实验数据可以方便地进行查询、修订、应用、分享,从而更好地进行学术交流,通过实验得到的质谱数据可以加入到数据库中,不断扩充化合物信息,保证了研究的延续性,从而更好地推进中药研究的发展。
基于目前的结果,仍存在一些问题,有待进一步思考和解决。① 基于数据库中的化合物信息,软件可以自动确定化合物的分子式,并给出详细的相关数据,但进一步的确证,例如异构体的区分仍需要足够的文献信息及对对照品质谱裂解规律的研究。② Continuum模式下采集的3D数据,可以得到除保留时间、响应强度外的第三维精确质量数信息,通过3D色谱图查看,帮助观察化合物组成的整体轮廓及共流出情况,但需要调整合适的质谱条件,使在低能量扫描时尽量不产生碎片离子,从而避免干扰,尤其适用于同类化合物的分析。③ 通过对裂解碎片的分析可以判断在同一个保留时间下的不同质谱信息的归属,但较好的色谱分离,避免样品共流出仍是此类分析的基础。④ 对于尚未分离鉴定过的化合物,根据裂解情况,能合理地推测新化合物的大致结构,软件设置了多种便于新化合物鉴定的功能,在此方面,尚有较大的潜力待挖掘。⑤ Massfragment功能对于碎片离子的预测目前仅在简单裂解水平,对于存在的重排裂解无法提供更多有效的信息。
| [1] | Gao Y, Ma ZC, Tan HL, et al. Effects of Si-Wu-Tang and its extracts on medullary hematopoiesis in mice of blood deficency induced by 60Coγ irradiation [J]. Tianjin J Tradit Chin Med (天津中医药), 2003, 20: 47-51. |
| [2] | National Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China (中华人民共和国药典) [M]. Part 2. 2010 ed. Beijing: China Medical Science Press, 2010: 649. |
| [3] | Yan LL, Shi JW, Wang JF, et al. UPLC/Q-TOF-MSE based analysis of chemical composition of Banxia Xiexin decoction [J]. Acta Pharm Sin (药学学报), 2013, 48: 526-531. |
| [4] | Kang LP, Zhao Y, Pang X, et al. Characterization and identification of steroidal saponins from the seeds of Trigonella foenum-graecum by ultra high-performance liquid chromatography and hybrid time-of-flight mass spectrometry [J]. J Pharm Biomed Anal, 2013, 74: 257-267. |
| [5] | Zhao Y, Kang LP, Yu HS, et al. Structure characterization and identification of steroidal saponins from the rhizomes of Anemarrhena asphodeloides by ultra performance liquid chromatography and hybrid quadrupole time-of-flight mass spectrometry [J]. Int J Mass Spectrom, 2013, 341-342: 7-17. |
| [6] | Wang ZF, Zhao Y, Pang X, et al. Analysis and identification of chemical constituents in Si-Wu decoction by UPLC-Q-TOF/MSE [J]. China J Chin Mater Med (中国中药杂志), 2013, 38: 3702-3708. |
| [7] | Fu Q, Wang SB, Zhao SH, et al. Three new monoterpene glycosides from the roots of Paeonia lactiflora [J]. J Asian Nat Prod Res, 2013, 15: 697-702. |
| [8] | Braca A, Kiem PV, Yen PH, et al. New monoterpene glycosides from Paeonia lactiflora [J]. Fitoterapia, 2008, 79: 117-120. |
| [9] | Zhang XY, Gao CK, Wang JH, et al. A new monoterpene glycoside from Paeonia lactiflora Pall [J]. Acta Pharm Sin (药学学报), 2002, 37: 705-708. |
| [10] | Yang L, Xu SJ, Tian RT, et al. HPLC fingerprinting of Radix Paeoniae Alba [J]. Acta Pharm Sin (药学学报), 2007, 42: 71-74. |
| [11] | Washida K, Yamagaki T, Iwashita T, et al. Two new galloylated monoterpene glycosides, 4-O-galloylalbiflorin and 4-O-galloylpaeoniflorin, from the roots of Paeonia lactiflora (Paeoniae Radix) grown and processed in Nara Prefecture, Japan [J]. Chem Pharm Bull, 2009, 57: 1150-1152. |
| [12] | Tan JJ, Zhao QC, Yang L, et al. Chemical constituents in roots of Paeonia lactiflora [J]. Chin Tradit Herb Drugs (中草药), 2010, 41: 1245-1248. |
| [13] | Li L, Tsao R, Liu ZQ, et al. Isolation and purification of acteoside and isoacteoside from Plantago psyllium L. by high- speed counter-current chromatography [J]. J Chromatogr A, 2005, 1063: 161-169. |
| [14] | Dong HJ, Liu ZQ, Song FR, et al. Structural analysis of monoterpene glycosides extracted from Paeonia lactiflora Pall. using electrospray ionization Fourier transform ion cyclotron resonance mass spectrometry and high-performance liquid chromatography/electrospray ionization tandem mass spectrometry [J]. Rapid Commun Mass Spectrom, 2007, 21: 3193-3199. |
| [15] | Ren ML, Zhang X, Ding R, et al. Two New monoterpene glycosidesfrom the Paeonia lactiflora Pall. [J]. J Asian Nat Prod Res, 2009, 11: 670-674. |
| [16] | Zuo AH, Wang L, Xiao HB, et al. Identification of the absorbed components and metabolites in rat plasma after oral administration of Rhizoma Chuanxiong decoction by HPLC- ESI-MS/MS [J]. J Pharm Biomed Anal, 2011, 56: 1046-1056. |
| [17] | Kobayashi M, Mitsuhashi H. Studies on the constituents of Umbelliferae plants. XVII: Structures of three new ligustilide derivatives from Ligusticum wallichii [J]. Chem Pharm Bull. 1987, 35: 4789-4792. |
| [18] | Takashi N, Kazuaki N, Yukinobu I, et al. A phthalide and 2- famesyl-6-methyl benzoquinone from Ligusticum chuanxiong [J]. Phytochemistry, 1992, 31: 1787-1790. |
| [19] | Yang F, Xiao YS, Zhang FF, et al. High performance liquid chromatography-mass spectrometry analysis of Radix Angelica Sciensis [J]. Acta Pharm Sin (药学学报), 2006, 41: 1078-1083. |
| [20] | Huang J, Lu XQ, Zhang C, et al. Anti-inflammatory ligustilides from Ligusticum chuanxiong Hort. [J]. Fitoteropia, 2013, 91: 21-27. |
| [21] | Kobayashi M, Fujita M, Mitsuhashi H. Studies on the constituents of Umbelliferae plants. XV: constituents of Cnidium officinale: occurrence of pregnenolone coniferylferulate and hydroxyphthalides [J]. Chem Pharm Bull, 1987, 35: 1427-1433. |
| [22] | Naito T, Katsuhara T, Niitsu K, et al. Two phthalides from Ligusticum chuanxiong [J]. Phytochemistry, 1992, 31: 639-642. |
| [23] | Wei Q. Studies on the Chemical Constituents of the Aerial Parts of Ligusticum sinense Oliv. cv. Chaxiong (茶芎地上部位化学成分研究) [D]. Beijing: Peking Union Medical College, 2014. |
| [24] | Lu XH, Zhang JJ, Zhang XX, et al. Study on biligustilides from Angelica sinensis [J]. China J Chin Mater Med (中国中药杂志), 2008, 33: 2196-2200. |
| [25] | Li SL, Lin G, Zhong KS, et al. Study on fingerprint of rhizome Chuanxiong by HPLC-DAD-MS [J]. Acta Pharm Sin (药学学报) , 2004, 39: 621-626. |
| [26] | Yi LZ, Liang YZ, Wu H, et al. The analysis of Radix Angelicae Sinensis (Danggui) [J]. J Chromatogr A, 2009, 1216: 1991-2001. |
| [27] | Delgado G, Reza-Garduno RG, Toscano RA, et al. Secondary metabolites from the roots of Ligusticum porteri (Umbelliferae) [J]. Heterocycles, 1988, 27: 1305-1312. |
| [28] | Li WX, Tang YP, Chen YY, et al. Advances in the chemical analysis and biological activities of Chuanxiong [J]. Molecules, 2012, 17: 10614-10651. |
| [29] | Cao WL. Identification of Metabolites and Metabonomics of Total Glucosides of Paeony (白芍总苷基于代谢组学的保肝机理及体内代谢研究) [D]. Shijiazhuang: Hebei Medical University, 2014. |
 2015, Vol. 50
2015, Vol. 50


