2. 南京大学功能生物分子研究所, 江苏 南京 210046
2. Institute of Functional Biomolecules, Nanjing University, Nanjing 210046, China
黄花蒿 (Artemisia annua L.) 是著名传统抗疟药用植物,隶属于菊科 (Composiate) 蒿属 (Artemisia) 艾蒿组 (Sect. Abrotanum)。黄花蒿为世界广布种,具有很强的生态适应性,生长在寒温带、温带及亚热 带的多种气候条件下的路旁、荒地、山坡、草原、干河谷、半荒漠、砾质及盐渍土壤等处,抗病虫害及 逆境能力很强,特别耐贫脊。因此,其内生菌同样 具有特殊性。黄花蒿内生菌Leptosphaeria sp. IV403发酵产生两个新骨架化合物leptosphaeric acid[1]和leptosphaerone[2]。黄花蒿内生菌Colletotrichum sp. B501液体发酵产生吲哚乙酸、1个新的吲哚衍生物和一系列甾类化合物,它们具有不同程度的抑菌活性[3]。黄花蒿内生菌Myrothecium roridum IFB-E012液体发酵产生多个新的具有强细胞毒活性的单端孢霉烯大环内酯化合物[4, 5]。黄花蒿内生菌Paraphaeosphaeria nolinae IFB-E011发酵产生1个新骨架的xanthene类多环化合物,这是第一个xanthene类的次生代谢产物[6]。
M. roridumIFB-E091是从黄花蒿根部分离获得的一株内生真菌,前期实验已从其固体发酵产物粗浸膏中分离获得4个化合物: roritoxin E、(22E,24S)-啤酒甾醇、(22E,24R)-6β-甲氧基麦角甾-7,22-二烯-3β,5α-二醇和7,8-二甲基异咯嗪[7]。进一步对IFB-E091固体发酵产物进行分离纯化,又分离获得3个化合物: (S)-(−)-N-[2-(3-hydroxy-2-oxo-2,3-dihydro-1H-indol- 3-yl)-ethyl]-acetamide (1)、N-(4-hydroxyphenethyl) acetamide (2)[8]和asperfu moid (3)[9] (图 1),其中化合物1为一个新吲哚衍生物。
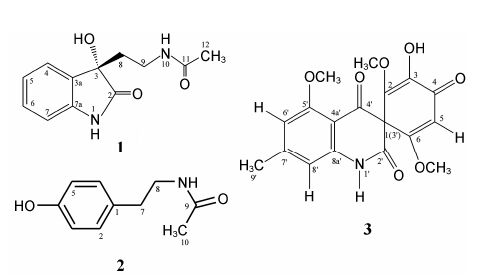
|
Figure 1 Structures of compounds 1−3 |
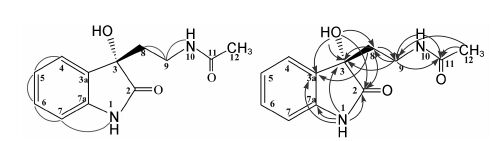
|
Figure 2 1H-1H COSY () and HMBC () correlations of compound 1 |
化合物1为无色固体,比旋光度为−23.7 (c 0.03,MeOH)。高分辨电喷雾质谱 (HR-ESI-MS) 显示m/z 257.091 0 [M+Na]+,说明其相对分子质量为234,分子式为C12H14N2O3 (C12H14N2O3Na,计算值: 257.090 2),不饱和度为7。1H NMR谱显示有14个氢信号 (表 1),其中4个芳环氢信号: δH-4 6.81 (d,J = 7.2 Hz)、δH-5 7.21 (td,J = 7.8,1.2 Hz)、δH-6 6.97 (td,J = 7.5,1.2 Hz) 和δH-7 7.26 (d,J = 7.2 Hz),这说明化合物1结构中含有1个邻位二取代的苯环。13C NMR谱显示有12个碳信号,其中6个双键碳信号和2个羰基碳信号,结合化合物1的不饱和度,可推测1结构中还含有1个环。进一步分析HSQC谱可知,化合物1含有3个活泼氢,即1个羟基氢和两个酰胺基氢。1H-1H COSY谱中H-7与1-NH相关,HMBC谱中3-OH与C-2、C-3、C-3a相关,1-NH与C-2、C-3、C-3a、C-7a相关,说明化合物1中含有3-hydroxy-2-oxo-2,3-dihydro-1H- indol结构片段。此外,1H-1H COSY谱中可以观察到H-8与H-9、H-9与10-NH相关; HMBC谱中可以观察到3-OH与C-8相关,H-8与C-2、C-3、C-3a、C-9相关,H-9与C-3、C-8、C-11相关,10-NH与C-9、C-11相关,H-12与C-9及C-11相关。综合上述信 息,推测化合物1的平面结构如图 1所示。CD谱 分析显示,化合物1与化合物 (S)-(−)-3-hydroxy-3- methyloxindole在211、238和262 nm处有相同的Cotton效应[10],这说明化合物1与化合物(S)-(−)-3- hydroxy-3-methyloxindole具有相同的C-3位绝对构型。化合物 (S)-(−)-3-hydroxy-3-methyloxindole的C-3位为S型 (其比旋度为−50),因此,化合物1被鉴定为 (S)-(−)-N-[2-(3-hydroxy-2-oxo-2,3-dihydro-1H-indol- 3-yl)-ethyl]-acetamide。
|
|
Table 1 1H NMR and 13C NMR data of compound 1 (600 MHz,DMSO-d6) |
采用MTT法检测化合物1对人肝癌细胞株SMMC-7721和人宫颈癌细胞株HeLa的体外细胞毒活性,结果发现,化合物1对上述两株肿瘤细胞均未表现出明显的抑制活性,在10 μg·mL−1时抑制率均只有10%; 而阳性对照顺铂对这两种肿瘤细胞株的IC50值分别为11.5和7.3 μg·mL−1。
实验部分Bruker AVANCE 600核磁共振仪; Bruker UHR- TOF maXis超高分辨飞行时间质谱仪; Agilent 6210 TOF液质联用仪; P200Ⅱ大连依利特高效液相色谱仪,UV200Ⅱ紫外可变检测器,P200Ⅱ高压恒流泵; Sinochrom ODS-AP柱 (5 μm,4.6 mm × 250 mm),Kromasil C18柱 (5 μm,4.6 mm × 250 mm); Jasco J-810圆二色谱仪; WZZ-2B自动旋光仪; Thermo Series Ⅱ CO2细胞培养箱; SW-CJ-1F超净工作台; Bio-Tek ELX800多功能酶标仪等。柱色谱硅胶 (200~300目) (青岛海洋化工厂分厂); 薄层色谱硅胶 (GF254) (青岛海浪硅胶干燥厂); Sephadex LH-20 (Pharmacia Biotech); 色谱纯甲醇(TEDIA公司); 氘代氯仿和氘代DMSO (Aldrich公司); 氘代甲醇(Cambridge Isotope Laboratories); RPMI-1640粉 (GIBCO公司); 胰蛋白酶(Solarbio公司); 新生牛血清(上海洛神生物技术有限公司); 四甲基偶氮唑盐 [3-(4,5-dimethylthiazol- 2-yl)-2,5-diphenyl trtrazolium bromide,MTT] 和DMSO (Amresco公司); 顺铂(江苏豪森药业股份有限公司); 其他试剂为分析纯。
菌株IFB-E091是2006年南京大学功能生物分 子研究所从南京郊外马群的黄花蒿根部分离获得的内生真菌。南京大学宋勇春副教授根据其形态学特征和18S rDNA序列 (GU074399) 比较,鉴定为露湿漆斑菌Myrothecium roridum[7]。该菌株现保存于南京大学功能生物分子研究所。
1 发酵产物的分离纯化菌株采用固体发酵法[4]。发酵产物粉碎、晒干后,采用氯仿−甲醇 (1∶1)混合溶剂浸提3次 (3×10 L),减压去除溶剂分别得粗浸膏38 g。粗浸膏经硅胶柱分离,梯度洗脱 (氯仿/甲醇v/v 100∶0 → 0∶100),获得8个极性组分Fr.1~Fr.8。Fr.5 (即100∶8极性组分,4.5 g) 经硅胶柱 (氯仿/甲醇梯度) 分离得到的组分Fr.5-3,经重结晶得到Fr.5-3-1和Fr.5-3-2。Fr.5-3-2经硅胶柱 (氯仿/甲醇梯度) 分离得到组分Fr.5-3-2-5,Fr.5-3-2-5经Sephadex LH-20凝胶柱 (氯仿/甲醇v/v 1∶1) 分离,再经HPLC (254 nm,甲醇∶水v/v = 3∶7,1 mL·min−1,tR = 7.8 min) 进一步纯化得到化合物1(9.2 mg)。Fr.5-2经Sephadex LH-20凝胶柱 (氯仿/甲醇v/v 1∶1) 分离得到Fr.5-2-2和Fr.5-2-3,Fr.5-2-2经HPLC (254 nm,甲醇∶水v/v = 4∶6,1 mL·min−1,tR = 4.5 min) 进一步纯化得到化合物2 (2.1 mg)。Fr.1 (即100∶0极性组分,3.5 g) 经硅胶柱 (石油醚/丙酮梯度) 分离得到组分Fr.1-2,Fr.1-2经Sephadex LH-20凝胶柱 (氯仿/甲醇v/v 1∶1) 分离,再经HPLC (254 nm,甲醇∶水v/v = 6∶4,0.9 mL·min−1,tR = 8.4 min) 进一步分离纯化得到化合物3(2.0 mg)。
2 结构鉴定化合物1 无色固体,分子式C12H14N2O3。HR- ESI-MS: m/z 257.091 0 [M+Na]+ (C12H14N2O3Na,计算: 257.090 2)。[α]= −23.7 (c 0.03,MeOH); UV (MeOH): λmax (logε) = 249.5 (3.49),286.5 (2.90) nm; CD (MeOH): λmax (Δε) = 211 (−13.42),238 (13.89),262 (−5.32) nm。1H和13C NMR数据见表 1。
化合物2 无色晶体,分子式C10H13NO2,HR- ESI-MS: m/z 180.106 7 [M+H]+,202.088 7 [M+Na]+ (C10H13NO2Na,计算: 202.084 4)。1H NMR (CD3OD,600 MHz) δ: 6.96 (2H,d,J = 8.4 Hz,H-2,H-6),6.64 (2H,d,J = 8.4 Hz,H-3,H-5),3.26 (2H,d,J = 7.8 Hz,H-8),2.61 (2H,d,J = 7.8 Hz,H-7),1.84 (3H,s,H-10)。
化合物3 淡黄色粉末,分子式C18H17NO7。HR- ESI-MS: m/z 360.107 6 [M+H]+,382.091 7 [M+Na]+和741.190 9 [2M+Na]+ (C18H17NO7Na,计算: 382.090 3)。1H NMR (CDCl3,600 MHz) δ: 7.94 (1H,s,H-1'),6.48 (1H,s,H-8'),6.32 (1H,s,H-6'),5.79 (1H,s,H-5),3.96 (3H,s,5'-OCH3),3.66 (3H,s,6-OCH3),3.43 (3H,s,2-OCH3),2.43 (3H,s,H-9')。13C NMR (CDCl3,150 MHz) δ: 85.3 (C-1),167.7 (C-2),148.2 (C-3),181.0 (C-4),102.2 (C-5),171.6 (C-6),173.8 (C-2'),194.2 (C-4'),157.7 (C-5'),104.4 (C-6'),151.4 (C-7'),105.4 (C-8'),23.1 (C-9'),109.3 (C-4a'),148.2 (C-8a'),51.2 (2-OMe),56.8 (6-OMe),56.0 (5'-OMe)。
3 体外细胞毒活性测定采用MTT法测定化合物体外细胞毒活性。肿瘤细胞在含10% 新生牛血清的RPMI 1640培养液中,于37 ℃、5% CO2的CO2培养箱内培养至对数生长期。收集对数生长期细胞,以每孔1×104个细胞接种于96孔板,常规贴壁培养24 h后,实验组分别加入2 μ L待测化合物 (少量DMSO助溶),阴性对照组和空白组分别加入等体积DMSO和培养液。培养48 h后,每孔加入20 μL MTT,继续培育4 h。然后弃去培养液,每孔滴加150 μL DMSO,37 ℃振荡10 min,使结晶充分溶解,酶标仪在波长490 nm处测定各孔吸光度值。
| [1] | Liu JY, Liu CH, Zou WX, et al. Leptosphaeric acid, a metabolite with a novel carbon skeleton from Leptosphaeria sp. IV403, an endophytic fungus in Artemisia annua [J]. Helv Chim Acta, 2003, 86: 657-660. |
| [2] | Liu JY, Liu CH, Zou WX, et al. Leptosphaerone, a metabolite with a novel skeleton from Leptosphaeria sp. IV403, an endophytic fungus in Artemisia annua [J]. Helv Chim Acta, 2002, 85: 2664-2667. |
| [3] | Lu H, Zou WX, Meng JC, et al. New bioactive metabolites produced by Colletotnchum sp., an endophytic fungus in Artemisia annua [J]. Plant Sci, 2000, 151: 67-73. |
| [4] | Shen L, Jiao RH, Ye YH, et al. Absolute configuration of new cytotoxic and other bioactive trichothecene macrolides [J]. Chem Eur J, 2006, 12: 5596-5602. |
| [5] | Shen L. Metabolites from Endophytic Fungi in Stress- acclimated Plants (适逆植物内生菌的次生代谢产物研究) [D]. Nanjing: Nanjing University, 2006. |
| [6] | Ge HM, Song YC, Chen JR, et al. Paranolin: a new xanthene- based metabolite from Paraphaeosphaeria nolinae [J]. Helv Chim Acta, 2006, 89: 502-506. |
| [7] | Shen L, Wang JS, Shen HJ, et al. A new cytotoxic trichothecene macrolide from the endophyte Myrothecium roridum [J]. Planta Med, 2010, 76: 1004-1006. |
| [8] | Lin ZJ, Lu XM, Zhu TJ, et al. GPR12 selections of the metabolites from an endophytic Streptomyces sp. associated with Cistanches deserticola [J]. Arch Pharm Res, 2008, 31: 1108-1114. |
| [9] | Liu JY, Song YC, Zhang Z, et al. Aspergillus fumigatus CY018, an endophytic fungus in Cynodon dactylon as a versatile producer of new and bioactive metabolites [J]. J Biotechnol, 2004, 114: 279-287. |
| [10] | Monde K, Taniguchi T, Miura N, et al. Preparation of cruciferous phytoalexin related metabolites, (-)-dioxibrassinin and (-)-3-cyanomethyl-3-hydroxyoxindole, and determination of their absolute configurations by vibrational circular dichroism (VCD) [J]. Tetrahedron Lett, 2003, 44: 6017-6020. |
 2015, Vol. 50
2015, Vol. 50


