2. 天津药物研究院释药技术与药代动力学国家重点实验室, 天津 300193
2. State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
高血压是一种临床常见病。治疗高血压病多用口服抗高血压药物,不能口服或口服药物效果不佳的患者,特别是必须接受手术的高血压患者期望有比较理想的、供静脉输注的药物[1, 2, 3, 4]。丁酸氯维地平是由Medicines公司研制的静脉注射用新型短效二氢吡啶钙通道拮抗剂,起效快、作用消除也快,用于治疗不宜口服或口服无效的高血压,也可用于治疗外科手术后急性血压升高。作为一种新型静脉注射用抗高血压药,丁酸氯维地平可以在危重病护理中快速、精确地控制血压[5, 6]。
丁酸氯维地平是降压的活性形式,降压的有效浓度在纳摩尔水平,PK/PD研究表明其血浆暴露水平与降压强度存在高度的时效性。此外,丁酸氯维地平的酯键极易水解而迅速代谢生成氯维地平酸,该反应主要由血液和血管外组织中的酯酶催化完成。体外研究发现其在全血中的消除半衰期仅几分钟[7]。虽然代谢物氯维地平酸无降压活性,但由于其消除速率低于原型,体内的系统暴露量远高于原形药物[8],因而有必要建立快速、灵敏的检测方法同时测定体循环中丁酸氯维地平及其代谢产物氯维地平酸的含量,并进行药代动力学研究。Fakt等[9]使用GC-MS法检测了全血样品中丁酸氯维地平及其代谢物氯维地平酸,但样品处理过程复杂,灵敏度较低,不能满足静脉输注给药后对丁酸氯维地平血药浓度进行快速、准确地测定。Zhou等[10]应用LC-MS/MS 法同时测定了丁酸氯维地平及其代谢物氯维地平酸在犬血浆中的含量,但未对全血离心过程进行方法学考察,难以真实反映原形在犬体内的浓度变化趋势。
本文建立了一种同时快速、灵敏检测全血中丁酸氯维地平及其代谢物氯维地平酸含量的LC-MS/MS方法,并成功地用于研究Beagle犬静脉输注丁酸氯维地平注射液后丁酸氯维地及其代谢物氯维地平酸的体内药动学特征,为临床药动学研究提供了有益参考。
材料与方法 试剂丁酸氯维地平标准品 (纯度: 99.60%,批号: 101212),氯维地平酸标准品 (纯度: 99.76%,批号: 101009),丁酸氯维地平注射液 (25 mg/50 mL,批号: 1312122131) (天津药物研究院); 乙氧苯柳胺 (纯度: 100%,批号: 100680-200901,中国食品药品检定研究院); 甲醇 (色谱纯,Fisher公司); 甲酸铵 (分析纯,批号: 20121213,天津市光复精细化工研究所); 抗坏血酸 (天津市光复科技发展有限公司,批号: 20130413); 去离子水 (≥18.2 MΩ,BM-40型纯水系统制备,北京中盛茂源科技发展有限公司)。
仪器美国Applied Biosystems公司Sciex TRIPLE QUADTM 5500型三重四极杆串联质谱仪,配有ESI源及Analyst 1.5.2数据处理软件; 高效液相色谱仪部分由日本Shimadzu公司Prominence 30A液相色谱仪 (LC-30AD二元梯度泵,CTO-30A柱温箱,DGU-20A5脱气机,SIL-30AC自动进样器) 组成; Sor vall Legend Micro 17R台式高速冷冻离心机 (美国Thermo Scientific公司)。
动物健康Beagle犬8只,普通级,体重10.5~11.7 kg,雌雄各半,由北京玛斯生物技术有限公司提供,许可证编号: SYXK (京) 2011-0003。实验动物由天津药物研究院新药评价有限公司动物室饲养,饲养室的温度保持在 (22 ± 1) ℃,湿度保持在 (60 ± 5) %,自由摄食进水。本研究的动物使用方案已获得天津药物研究院新药评价有限公司IACUC批准,IACUC号为2014020710。
色谱条件色谱柱为Ecosil C18 column (150 mm × 4.6 mm,5 µm); 流动相为A: 甲醇,B: 5 mmol·L-1甲酸铵水溶液; 流速: 0.5 mL·min-1; 柱温: 30 ℃; 梯度洗脱: 0~3.0 min,75%~100% A; 3.0~9.0 min,100% A; 9.0~9.1 min,100%~75% A; 9.1~13.0 min,75% A; 进样量: 10 µL,内标: 乙氧苯柳胺。
质谱条件离子源为ESI源; 喷雾电压-4 500 V; 加热毛细管温度500 ℃; 雾化气 (N2) 流速40 psi,辅助加热气 (N2) 流速50 psi,气帘气 (N2) 16 psi,碰撞气 (N2) 5 psi; 检测方式为负离子MRM; 用于定量分析监测的离子对为m/z 454.1 [M-H]- → m/z 234.1 (丁酸氯维地平),碰撞能量-20 V; m/z 354.0 [M-H]- → m/z 208.0(氯维地平酸),碰撞能量-14 V; m/z 256.1 [M-H]- → m/z 227.1 (乙氧苯柳胺,内标),碰撞能量-16 V; 运行时间: 13.0 min。
储备液、工作液及质量控制液的制备精密称 取丁酸氯维地平标准品5.02 mg和氯维地平酸标准 品5.01 mg,分别置于25 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,分别配制得到质量浓度为200 µg·mL-1的丁酸氯维地平和氯维地平酸储备液。精密量取丁酸氯维地平标准贮备液I (200 µg·mL-1) 0.25 mL及氯维地平酸标准贮备液I (200 µg·mL-1) 0.5 mL,于50 mL量瓶中,甲醇定容至刻度,即得丁酸氯维地平与氯维地平酸混合标准贮备液I (1/2 µg·mL-1)。随后用甲醇梯度稀释成丁酸氯维地平/氯维地平酸比例为0.5/1、1/2、2/4、5/10、20/40、50/100、100/200 ng·mL-1的系列混合标准工作 液。另外分别精密称取丁酸氯维地平和氯维地平酸适量,甲醇溶解,配成200 µg·mL-1丁酸氯维地平和氯维地平酸质控 (QC) 储备液,以犬空白全血稀释丁酸氯维地平和氯维地平酸储备液,获得丁酸氯维地平质量浓度为1、10和80 ng·mL-1的QC样品以及2、20和160 ng·mL-1的氯维地平 酸QC样品。取乙氧苯柳胺1.0 mg,精密称定,置于10 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,即得内标储备液I (100 µg·mL-1)。精密量取0.1 mL内标标准贮备液I,于10 mL量瓶中甲醇定容至刻度,得质量浓度为1 µg·mL-1内标标准贮备液II; 精密吸取内标储备液II 1.25 mL,置于250 mL量瓶中,加 甲醇稀释至刻度,配制5 ng·mL-1内标工作液。
全血样品预处理取全血100 µL,立即加入到含有800 µL甲醇溶液、10 µL 5% 抗坏血酸水溶液的Eppendorf管中,涡旋5 s,-80 ℃冰冻保存。血样检测时,上述样品加内标乙氧苯柳胺 (5 ng·mL-1) 100 µL,涡旋1 min,4 ℃、12 000 r·min-1离心10 min; 取上清液于内插管中,4 ℃、12 000 r·min-1离心10 min,进样10 µL进行LC-MS/MS定量分析。
药动学研究8只健康Beagle犬,雌雄各半,静脉输注丁酸氯维地平注射液。分别于静脉输注前 (0 min),静脉输注中5、10、15、20、30 min,停药后1、2、3、5、8、12、20、30 min、1、3、5 h不同时间点,从未给药侧的前肢头静脉采血,采血量约1.0 mL。立即取出100 µL,置于含有800 µL甲醇溶液、10 µL 5% 抗坏血酸水溶液的Eppendorf管中,涡旋5 s,置于-80 ℃保存待测。
数据分析采用DAS2.1.1软件 (中国药理学会数学药理专业委员会) 统计矩法计算药代动力学参数。其中AUC0-t、AUC0-∞采用梯形法计算,以血药浓度-时间作半对数曲线,取消除相后4个时间点进行线性拟合,求算t1/2,C2min、Cmax和tmax采用实测值。
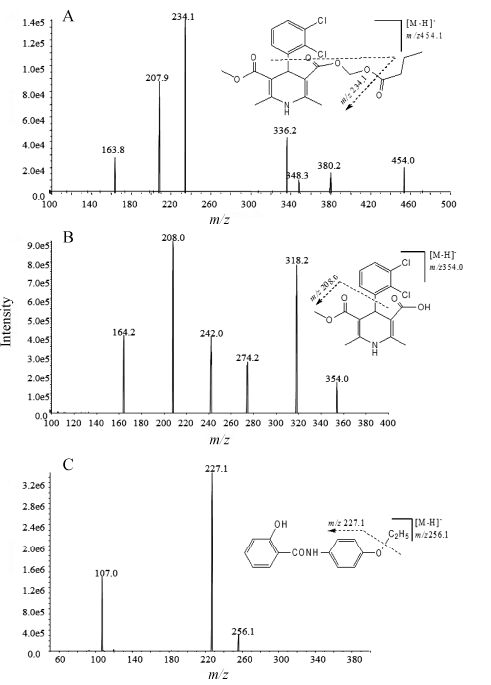
结果 1 质谱分析在上述质谱条件下,丁酸氯维地平、氯维地平酸和内标乙氧苯柳胺主要生成 [M-H]-准分子离子峰,分别为m/z 454.1、354. 0及256.1。选择性对相应的准分子离子进行CID二级质谱全扫描分析 (图 1),待测物丁酸氯维地平、氯维地平酸及内标的主要产物离子分别为m/z 234.1、208.0和227.1,进一步对源参数、碰撞参数优化后发现适宜作为MRM检测的反应离子对用于定量测定。
|
Figure 1 The chemical structures and product ion mass spectra of the [M-H]- ions of clevidipine butyrate (A),clevidipine acid (B) and elofesalamide (C,internal standard) |
分别取6个不同来源的犬空白全血100 µL,除不加内标溶液 (改加同体积甲醇溶液) 外,其余按“全血样品预处理”项下操作,空白全血色谱见图 2A; 将定量下限浓度的丁酸氯维地平与氯维地平酸对照品混合溶液和内标溶液加入空白全血中,依同法操作,得色谱图 2B,丁酸氯维地平、氯维地平酸及内标乙氧苯柳胺的保留时间分别在6.52、5.06和5.85 min左右; 取Beagle犬静脉输注停药后1 min的全血样品,依同法操作,得色谱图 2C。与空白全血样品的色谱图比较,结果表明,全血样品中内源性物质不干扰丁酸氯维地平、氯维地平酸和内标的测定,具有良好的专属性。

|
Figure 2 Representative MRM chromatograms clevidipine butyrate,clevidipine acid and elofesalamide (IS). A: A blank dog blood sample; B: A blank dog blood sample spiked with clevidipine butyrate (LLOQ,0.5 ng·mL-1),clevidipine acid (LLOQ,1.0 ng·mL-1) and IS (5 ng·mL-1); C: A dog blood sample collected at 1 min after the end of intravenous infusion (5 mg·h-1) spiked with IS. Peak I: Clevidipine butyrate; Peak II: Clevidipine acid; Peak III: IS |
取空白犬全血100 μL,加5% 抗坏血酸水溶液10 µL,分别依次加入各浓度混合标准工作溶液100 μL (含丁酸氯维地平及氯维地平酸),配制成相当于丁酸氯维地平和氯维地平酸全血质量浓度分别为0.5、1、2、5、20、50和100 ng·mL-1和1、2、4、10、40、100和200 ng·mL-1样品。按照“全血样品预处理”项下操作。以全血中待测物的浓度为横坐标,待测物与内标的峰面积之比为纵坐标,用加权最小二乘法 (W = 1/X2) 进行回归运算,所得的直线回归方程即为标准曲线。每天建立标准曲线,连续3天。丁酸氯维地平的典型回归方程为: y = 0.031 4 x + 0.003 06,r2 = 0.997 8。氯维地平酸的典型回归方程为y = 0.009 15 x + 0.001 70,r2 = 0.998 1。结果显示,丁酸氯维地平及氯维地平酸在0.5~100 ng·mL-1和1.0~200 ng·mL-1内线性良好,定量下限分别为0.5和1.0 ng·mL-1。
2.3 精密度与准确度取犬空白全血100 μL,配制定量下限 (丁酸氯维地平为0.5 ng·mL-1,氯维地平酸为1 ng·mL-1) 和低、中、高3个全血浓度 (丁酸氯维地平为1、10和80 ng·mL-1,氯维地平酸为2、20和160 ng·mL-1) 的QC样品,按照“全血样品预处理”项下操作,每个浓度进行6样本分析,连续测定3天,随行标准曲线,根据当日的标准曲线计算QC样品测得的浓度,结果进行方差分析,计算方法的准确度与精密度见表 1。结果表明,丁酸氯维地平和氯维地平酸的日内日间精密度 (RSD) 均小于15%,准确度 (RE) 在 ± 15% 之间。
|
|
Table 1 Precision,accuracy and LLOQ for clevidipine butyrate and clevidipine acid in dog blood. n = 6,x± s |
空白犬全血经甲醇沉淀蛋白后,取上清液吹干后加入低、中、高浓度的丁酸氯维地平和氯维地平酸的混合对照品溶液和内标溶液,涡旋混合后进样测定,获得相应峰面积SA,平行6份操作,以水代替空白全血,其余操作同上,获得相应峰面积SB。基质效应的计算公式为ME (%) = SA / SB × 100%。丁酸氯维地平在1、10、和80 ng·mL-1下的全血样品基质效应分别为 (99.8 ± 2.27) %、(95.2 ± 1.41) % 和 (94.3 ± 2.00) %; 氯维地平酸在2、20和160 ng·mL-1下的全血样品基质效应分别为 (93.9 ± 4.66) %、(88.6 ± 0.867) % 和(86.5 ± 0.971) %; 内标的基质效应为 (101 ± 1.32) %。结果表明,本方法可有效地避免基质对丁酸氯维地平和氯维地平酸测定的影响。
2.5 提取回收率取空白犬全血加入低、中、高3个质量浓度的丁酸氯维地平和氯维地平酸的混合对照品溶液和内标溶液,按照“全血样品预处理”项下操作,涡旋混合后,平行6份操作,获得相应峰面积为SC,提取回收率的计算: ER (extraction recovery) (%) = SC / SA × 100%。丁酸氯维地平在1、10、和80 ng·mL-1下的全血样品平均提取回收率分别为 (106 ± 1.80) %、(109 ± 2.54) % 和 (108 ± 1.90) %; 氯维地平酸在2、20和160 ng·mL-1下的全血样品平均提取回收率分别为 (102 ± 5.80) %、(103 ± 1.73) % 和 (98.6 ± 1.95) %; 内标的平均提取回收率为 (100 ± 1.79) %。
2.6 稳定性考察结果表明丁酸氯维地平和氯维地平酸的低、中、高3个质量浓度全血样品处理后进样器 (4 ℃) 放置24 h稳定; 丁酸氯维地平和氯维地平酸低、高2个质量浓度全血样品,加入甲醇溶液700 µL、5% 抗坏血酸水溶液10 µL于试验台放置1 h、经历3次冷冻-解冻循环和 -80 ℃放置1个月,达到各考察条件后,加内标乙氧苯柳胺 (5 ng·mL-1) 甲醇溶液100 µL,按照“全血样品预处理”项下操作,丁酸氯维地平和氯维地平酸在不同保存条件下均稳定; 同时丁酸氯维地平和氯维地平酸标准贮备液及低、高质控浓度水平工作液于 -20 ℃/4 ℃冰箱放置56天稳定。结果见表 2,RE和RSD均小于15%。
|
|
Table 2 Stability of clevidipine butyrate and clevidipine acid in dog blood. n = 6,x± s |
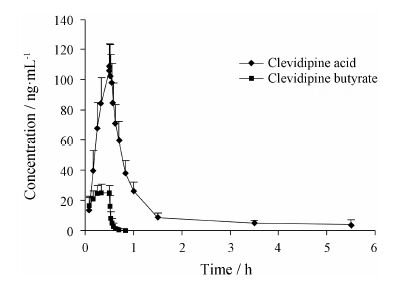
以5 mg·h-1的输注速率静脉输注丁酸氯维地平注射液30 min后,Beagle犬全血中各时间点丁酸氯维地平及氯维地平酸的平均浓度-时间曲线见图 3,相关药代动力学参数见表 3。结果表明,由于原形结构中的酯键极易被体内的酯酶水解,丁酸氯维地平的清除非常快,t1/2仅为3 min左右,明显快于代谢物氯维地平酸的清除 (t1/2约为1.5 h左右); 代谢物在犬体内的暴露量明显高于原形,Cmax为原形的4倍左右、AUC为原形的8倍左右。
|
Figure 3 Mean blood concentration-time profiles of clevidipine butyrate and clevidipine acid after intravenous infusion to dogs at a flow rate of 5 mg·h-1 for 0.5 h. n = 8,x± s |
|
|
Table 3 Mean pharmacokinetic parameters for clevidipine butyrate and clevidipine acidafter intravenous infusion to dogs at a flow rate of 5 mg·h-1 for 0.5 h. n = 8,x± s |
丁酸氯维地平的结构中酯键极易被酯酶水解生成相应的代谢物氯维地平酸,抑制酯酶的活性至关重要。尝试采用文献[9]报道的方法进行血样处理,但SDS属于表面活性剂会污染质谱的ESI源,抑制待测物的离子化效率。采用加入有机溶剂甲醇使酯酶变性,失去酶活性,实现中断丁酸氯维地平的水解反应,同时起到了沉淀血中蛋白的效果,同步完成血样预处理,操作更加简便快捷,也避免了SDS带来的干扰和抑制; 为抑制代谢物氯维地平酸的氧化,加入抗坏血酸水溶液。稳定性考察结果显示,本研究建立的处理方法,可确保待测物在保存、处理和分析过程中无明显水解或氧化降解。
本文分别考察了甲醇和乙腈作为流动相的色谱和质谱行为,发现选择甲醇作为有机相时待测物的离子化效率较高。流动相里添加甲酸,待测物峰形得到改善,但其离子化效率降低,加入甲酸铵能够兼顾色谱峰形和灵敏度。丁酸氯维地平与其代谢物氯维地平酸有一定的极性差异,难以在较短的时间内实现同时测定,因此本实验采用梯度洗脱,使两者在该梯度下获得良好的峰型和足够的响应。本实验比较了待测物在Ecosil C18 column (150 mm × 4.6 mm,5 µm),Diamonsil C18 column (100 mm × 4.6 mm,5 µm) 和Symmetry C8 column (100 mm × 4.6 mm,5 µm) 的保留行为,结果显示通过Ecosil C18 column (150 mm × 4.6 mm,5 µm) 色谱柱梯度洗脱,流动相中加入甲酸铵,待测物峰型较好,灵敏度较高,保留时间合适,实现同时测定。
在生物样品分析过程中,内标的选择对于保证测定结果的准确性很重要。乙氧苯柳胺为内标,其峰形好,提取回收率与丁酸氯维地平和氯维地平酸相似,且全血中内源性物质对其无干扰,适合作为本测定方法的内标。
本文建立了一种快速、灵敏、准确的同时定量检测丁酸氯维地平及其代谢物氯维地平酸在Beagle犬全血中含量的LC-MS/MS方法。每个时间点的采血量仅需100 µL,全血样品仅需一步甲醇沉淀蛋白,前处理操作简便快速。每个样品的分析时间仅需13.0 min,样品分析速度快。本方法专属性强,有良好的精密度与准确度,无基质效应,稳定性良好,表明此方法符合生物样品分析方法指导原则的要求[11, 12]。本研究通过观察丁酸氯维地平及氯维地平酸在Beagle犬体内的全血药物浓度-时间变化,从而获得原形药物和代谢产物的药代动力学参数,揭示丁酸氯维地平及其代谢产物在Beagle犬体内的代谢清除过程,考察氯维地平酸的暴露量,对阐明后期是否需要进行主要代谢产物的毒代动力学研究具有重要意义,为药物评价提供参考依据。
| [1] | Peacock WF, Angeles JE, Soto KM, et al. Parenteral clevidipine for the acute control of blood pressure in the critically ill patient: a review [J]. Ther Clin Risk Manag, 2009, 5: 627-634. |
| [2] | Ericsson H, Bredberg U, Eriksson U, et al. Pharmacokinetics and arteriovenous differences in clevidipine concentration following a short- and a long-term intravenous infusion in healthy volunteers [J]. Anesthesiology, 2000, 92: 993-1001. |
| [3] | Feldstein C. Management of hypertensive crises [J]. Am J Ther, 2007, 14: 135-139. |
| [4] | Varon J, Marik PE. Clinical review: the management of hypertensive crises [J]. Crit Care, 2003, 7: 374-384. |
| [5] | Nordlander M, Sjoquist PO, Ericsson H, et al. Pharmacodynamic, pharmacokinetic and clinical effects of clevidipine, an ultrashort-acting calcium antagonist for rapid blood pressure control [J]. Cardiovasc Drug Rev, 2004, 22: 227-250. |
| [6] | Singla N, Warltier DC, Gandhi SD, et al. Treatment of acute postoperative hypertension in cardiac surgery patients: an efficacy study of clevidipine assessing its postoperative antihypertensive effect in cardiac surgery-2 (ESCAPE-2), a randomized, double-blind, placebo-controlled trial [J]. Anesth Analg, 2008, 107: 59-67. |
| [7] | Ericsson H, Tholander B, Björkman JA, et al. Pharmacokinetics of new calcium channel antagonist clevidipine in the rat, rabbit, and dog and pharmacokinetic/pharmacodynamic relationship in anesthetized dogs [J]. Drug Metab Dispos, 1999, 27: 558-564. |
| [8] | Zhang JG, Dehal SS, Johnson J, et al. Human cytochrome p450 induction and inhibition potential of clevidipine and its primary metabolite h152/81 [J]. Drug Metab Dispos, 2006, 34: 734-737. |
| [9] | Fakt C, Stenhoff H. Determination of an ultrashort-acting antihypertensive dihydropyridine, clevidipine, in blood using capillary gas chromatography-mass spectrometry and of the primary metabolite using liquid chromatography and fluorescence detection [J]. J Chromatogr B Biomed Sci Appl, 1999, 723: 211-219. |
| [10] | Zhou Y, Li H, He X, et al. Simultaneous determination of clevidipine and its primary metabolite in dog plasma by liquid chromatography-tandem mass spectrometry: application to pharmacokinetic study [J]. J Pharm Biomed Anal, 2014, 100: 294-299. |
| [11] | FDA. Guidance for industry: bioanalytical method validation [EB/OL]. http://www.fda.gov/downloads/Drugs/GuidenceCom plianceRegulatoryInformation/Guidances/UCM070107.pdf 2001-05. |
| [12] | Li HZ. Biopharmaceutical Analysis (体内药物分析) [M]. Beijing: People's Medical Publishing House, 2008: 52. |
 2015, Vol. 50
2015, Vol. 50


