2. 中山大学药学院, 广东 广州 510006
2. School of Pharmaceutical Sciences, Sun Yat-sen University, Guangzhou 510006, China
探索安全、高效的肝癌靶向药物传递系统,实现化疗药物的有效传递,是目前肝癌靶向治疗的重要课题。主动靶向长循环脂质体是应用于肿瘤靶向药物传递的有效载体。该载体采用亲水性链段PEG修饰,可有效避免内皮网状系统的快速清除,显著延长脂质体在体循环时间; 同时借助实体瘤组织的高通透性和滞留效应 (EPR effect),增加化疗药物在肿瘤部位的蓄积性[1]。在长循环基础上,采用特异性配体修饰,可在受体介导的主动靶向作用下,提高脂质体对肿瘤细胞的选择性,增强药物对肿瘤细胞的杀伤能力[2]。
无唾液酸糖蛋白受体 (ASGPR) 是哺乳动物肝实质细胞特有的一种高效内吞受体,在肝癌细胞表面过度表达,是肝癌靶向治疗的重要靶点[3]。乳铁蛋白 (Lf) 是存在于哺乳动物体内的一种阳离子糖蛋白,与无唾液酸糖蛋白受体 (ASGPR) 具有较高亲和性 (Kd约80 nmol·L-1)[4],提示Lf是一个较好的ASGPR特异性配体。Oh等[5]采用Lf修饰基因载体,通过ASGPR介导的主动靶向,成功将目的基因导入肝实质细胞,进一步证明了Lf作为ASGPR靶向性配体的可行性。
本研究采用具有ASGPR靶向作用的Lf为配体,以香豆素-6为荧光探针,构建与表征具有长循环功能与主动靶向作用的乳铁蛋白修饰肝癌靶向脂质体 (Lf-PLS)。以未修饰的长循环脂质体 (PLS) 为阴性对照,以ASGPR高表达的HepG2为靶细胞,采用激光共聚焦显微镜 (CLSM) 和流式细胞术,评价Lf-PLS的体外肝癌靶向性,并对其靶向机制进行初步的探讨,为进一步探索Lf-PLS药物传递系统载药后的有效性与安全性研究提供实验基础。
材料与方法 药品与试剂香豆素-6 (Sigma-Alrich,美国); 牛血清白蛋白 (BSA),N-乙基-N '-(3-二甲氨基丙基) 碳二亚胺盐酸盐 (EDC),N-羟基硫代琥珀酰亚胺 (NHS),N-2-羟基哌嗪-N '-2-乙磺酸 (HEPES),4',6-二脒基-2-苯基吲哚 (4',6-diamidino-2-phenylindole,DAPI) (Sigma,美国); Sepharose CL-4B,Sephadex LH-20 (Health GE,瑞士); BCA试剂盒 (Pierce,美国); DMEM培养液基,胎牛血清,0.25% 胰酶,青霉素-链霉素溶液 (Gibco,美国); 多聚甲醛 (天津福晨化学试剂厂); 其他试剂为市售分析纯。
仪器EmulsiFlex-C3型高压均质机 (Avestin,加拿大); 旋转蒸发仪 (EYELA,日本); ELX800酶标仪 (BioTek,美国); LS55型荧光分光光度计 (Perkin- Elmer,美国); Nano ZS90激光散射粒度分析仪 (Malvern,英国); TU-1901双光束紫外-可见光分光光度计 (北京普析通用仪器公司); LSM 710激光共聚焦显微镜 (LSCM,Zessi,德国); FACScalibur流式细胞仪 (Becton-Dickenson needle,美国)。
人肝癌细胞HepG2的培养人肝癌细胞HepG2购买于中国科学院上海细胞库,由中山大学动物实验中心保种。用含10% 胎牛血清的高糖DMEM完全培养基,加入100 U·mL-1青霉素、100 μg·mL-1链霉素,置37 ℃、5% CO2培养箱中培养。
包载香豆素-6的Lf-PLS的制备采用薄膜分 散法制备香豆素-6脂质体[6]。精密称取处方量的香 豆素-6、磷脂和胆固醇 (PC∶CHOL = 3∶2,mol/mol),药脂质量比为0.002∶1,溶于混合溶剂中 (无水乙醇∶二氯甲烷 = 2∶1,v/v),在45 ℃条件下旋转蒸发除尽有机溶剂,使脂质在烧瓶内壁形成均匀的薄膜。加入HEPES缓冲溶液 (pH 7.4),置旋转蒸发仪上缓慢旋转水化30 min后,采用高压均质机1 000 bar (1 bar = 100 kPa) 压力下高压均质循环10次,即得香豆素-6普通脂质体。香豆素-6普通脂质体采用Sephadex LH-20除去游离的香豆素-6,得纯化的香豆素-6普通脂质体。
将长循环磷脂材料 (lipid∶DSPE-PEG2000∶DSPE- PEG2000-COOH = 95∶4.5∶0.5,mol/mol) 加入已纯化的香豆素-6脂质体混悬液中,水浴60 ℃孵育1 h,制得带-COOH活性基团的香豆素-6长循环脂质体PLS[7]。
将EDC与NHS (EDC∶NHS∶DSPE-PEG2000- COOH = 30∶30∶3,mol/mol) 加入香豆素-6长循环脂质体中,室温下搅拌10 min。加入Lf (Lf∶DSPE- PEG2000 = 1∶4,mol/mol),37 ℃水浴下孵育3 h[8]。用Sepharose CL-4B去除游离的香豆素-6与Lf,得纯化后的香豆素-6 Lf-PLS。
透射电镜形态观察取载香豆素-6的脂质体适量,滴加于铜网上,室温孵育5 min,1% 醋酸铀负染后,采用透射电镜 (transmission electron microscope,TEM) 观察其形态。
粒径与zeta电位的测定取载香豆素-6的脂质体适量,用纯水 (经0.22 μm过滤) 稀释250倍。采用粒径测定仪,测定其粒径与zeta电位。
包封率的测定精密吸取香豆素-6脂质体0.2 mL,上葡聚糖凝胶LH-20柱 (15 mm × 55 mm),用HEPES缓冲液洗脱15 mL,流速为1 mL·min-1。收集HEPES缓冲液洗脱,加甲醇超声破乳,并定容至25 mL。采用荧光分光光度计 (Ex = 465 nm,Em = 508 nm),测定脂质体中包载香豆素的含量 (W1)。另精密吸取香豆素-6脂质体0.2 mL,用甲醇稀释至25 mL。同法测定脂质体混悬液中香豆素-6的总量 (Wo)。按公式1计算脂质体的包封率。
EE (%) = W1 / Wo × 100% (1)
脂质体表面Lf接枝量的测定[9]采用蛋白提取方法对样品进行预处理。具体操作如下: 精密移取经稀释的脂质体0.3 mL,加入甲醇0.4 mL,涡旋30 s; 加氯仿0.2 mL,涡旋30 s; 加水0.1 mL,涡旋30 s,9 000×g离心1 min,去除上清液,得氯仿层。再加甲醇0.3 mL,涡旋30 s,9 000×g离心2 min,去除上清液,得白色沉淀颗粒,N2吹干,加入含2% SDS的HEPES缓冲溶液 (20 mmol·L-1 HEPES、140 mmol·L-1 NaCl、2% SDS) 100 μL,涡旋溶解,即得。采用BCA法测定预处理样品中的蛋白含量,取未经蛋白修饰的脂质体同法操作作为空白对照, 按标准曲线计算Lf的浓度。采用Stewart法测定磷脂的含量。脂质体混悬液适量稀释后,取25 μL于具塞试管中,分别加入氯仿,加显色剂2 mL (显色剂: 27.03 g FeCl3·6H2O和30.4 g NH4SCN于1 L量瓶中,加水溶解并稀释至刻度,即得),涡旋30 s,9 000×g离心5 min。取下层 (氯仿层) 溶液,以氯仿为空白溶剂,于485 nm处测定其吸收度,代入标准曲线,计算脂质体的磷脂含量。根据Lf浓度与磷脂含量计算Lf的接枝密度与连接效率。
激光共聚焦实验以ASGPR高表达的HepG2细胞为靶细胞,采用激光共聚焦显微镜,观察细胞对脂质体的摄取情况。HepG2以细胞数4×105个/孔分别接种于涂有多聚赖氨酸的盖玻片上,于6孔培养 板中培养24 h。去除培养液,分别加入包载香豆素-6的PLS和Lf-PL S培养液,香豆素-6质量浓度为 3 μg·mL-1,37 ℃孵育l h。吸去培养液,细胞用PBS冲洗3次,加入4% 多聚甲醛于室温固定15 min。吸去上清液,加入DAPI工作液,37 ℃避光孵育15 min染核,PBS漂洗3次,用荧光封片剂封片后,于激光共聚焦显微镜下观察。
流式细胞检测以ASGPR高表达的HepG2细胞为靶细胞,采用流式细胞术对细胞摄取进行定量分析。分别取对数生长期的HepG2细胞,以细胞数4×105个/孔接种到24孔培养板中培养24 h。吸去培养基后,分别进行实验。① 浓度与温度对细胞摄取的影响: 分别将不同浓度的香豆素-6 PLS和Lf-PLS供试液加入HepG2细胞中,在4 ℃、37 ℃下与细胞共同孵育1 h,考察HepG2细胞对不同香豆素-6浓度脂质体的摄取。② 时间对细胞摄取的影响: 分别将香豆素-6 PLS和Lf-PLS供试液加入HepG2细胞 中,37 ℃下分别孵育0.25、0.5、1、2和4 h,考察不同孵育时间条件下HepG2细胞对脂质体的摄取。③ 摄取抑制实验: 将游离的Lf加入Lf-PLS供试液中,使Lf的最终质量浓度为1 mg·mL-1。将其与HepG2细胞37 ℃下共同孵育1 h。以未加入游离蛋白的PLS和Lf-PLS的摄取为对照,探讨脂质体的摄取机制。
实验结束后,弃去脂质体溶液,加入4 ℃预冷的PBS终止摄取,再用PBS漂洗3次。用0.25% 胰酶消化收集细胞,离心去除上清液,加入4% 多聚甲醛固定15 min,再将细胞重悬。用流式细胞仪测定细胞的荧光强度,细胞上样量为1×104个。
统计学分析实验数据采用方差分析与t-检验进行统计学分析,P < 0.05具有显著性差异。
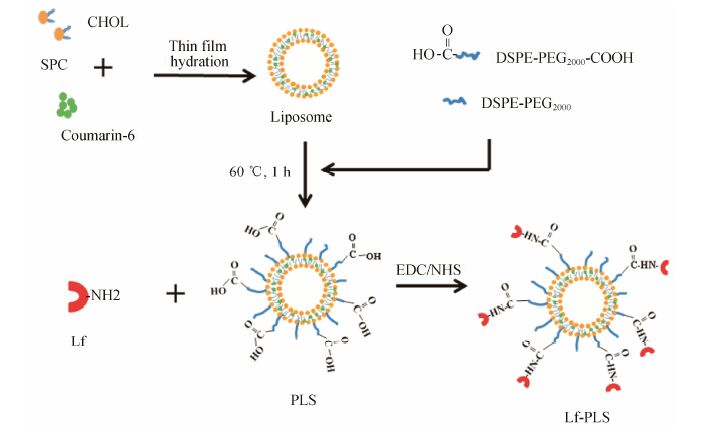
结果 1 包载香豆素-6的Lf-PLS的构建包载香豆素-6的Lf-PLS的制备原理如图 1所 示[9]。首先,以香豆素-6为荧光探针,磷脂、胆固醇为膜材,采用薄膜分散法制备包载香豆素-6的普通脂质体。然后,采用后插入法,制备长循环脂质体PLS。在EDC/NHS的催化条件下,PLS表面上聚乙 二醇(polyethylene glycol,PEG) 链段的活性基团-COOH与Lf上的 -NH2通过化学键合成酰胺,使 Lf附着于载体的表面。最后采用Sepharose CL-4B,去除体系中未包封的香豆素、游离的Lf及催化剂EDC/NHS,即制得纯化后的Lf-PLS给药系统。包载香豆素-6的Lf-PLS的制备为后期给药系统的表征与靶向性研究提供了坚实的物质基础。
|
Figure 1 Schematic illustration of coumarin-6 loaded lactoferrin modified PEGylated liposomes. SPC: Soybean phosphatidylcholine; CHOL: Cholesterol; PLS: PEGylated liposomes; Lf: Lactoferrin; Lf-PLS: Lactoferrin modified PEGylated liposomes |
脂质体的理化性质如图 2和表 1所示。TEM观察结果可见,包载香豆素-6的PLS与Lf-PLS呈圆形 或椭圆形的囊泡 (图 2)。包载香豆素-6的PLS粒径为 (120 ± 2) nm,PDI为0.220 ± 0.012,zeta电位为 (-34.0 ± 2.0) mV,包封率 (82.6 ± 3.1) %; 包载香豆素-6的Lf-PLS粒径为 (131 ± 1) nm,PDI为0.258 ± 0.029,zeta电位为 (-29.8 ± 1.0) mV,包封率 (80.4 ± 2.4) % (表 1)。研究结果表明,上述两种脂质体的粒径均 < 200 nm,有利于肿瘤部位的蓄积和肿瘤细胞的摄取。但与PLS相比,Lf修饰后脂质体的粒径有所增 加。此外,PLS与Lf-PLS的zeta电位亦有所不同。由于长循环磷脂材料DSPE-PEG2000带负电,制备所得的包载香豆素-6的PLS呈负电性[1, 7]。Lf的等电点为8.4[9, 10],在pH中性条件下呈正电性。采用Lf修饰PLS后,PLS表面的部分负电荷被中和。所以,Lf-PLS的zeta电位略高于PLS。结果亦表明,带正电的Lf已成功修饰于PLS的表面[9]。

|
Figure 1 TEM images of coumarin-6 loaded PLS (left) and Lf-PLS (right) |
|
|
Table 1 Physicochemical characteristics of coumarin-6 loaded liposomes. n = 3,x± s. PDI: Particle size distribution index; EE: Encapsulation effiency |
采用BCA法测定脂质体表面Lf的含量,Lf-PLS上Lf接枝量为 (35.82 ± 0.89) Lf/PL (μg·μmol-1),Lf接枝率约40%。采用荧光分光光度法测定脂质体的包封率,PLS的包封率为 (82.6 ± 3.1) %,Lf-PLS的包封率为 (80.4 ± 2.4) %,提示Lf的修饰对脂质体包封率的影响无显著性差异。
上述结果表明,制备的包载香豆素-6的Lf-PLS为圆形或椭圆形囊泡,粒径较小且分布均匀,包封率高,可用于细胞摄取和动物体内的示踪研究。
3 激光共聚焦显微镜观察细胞摄取为了考察Lf-PLS的体外靶向性,采用激光共聚焦显微镜,以非靶向载体PLS作为阴性对照,定性 观察ASGPR阳性细胞HepG2对包载香豆素-6的Lf-PLS摄取情况。HepG2细胞在37 ℃下与脂质体相互作用1 h的CLSM结果如图 3所示,经Lf-PLS作用的靶细胞HepG2,其绿色荧光强度均显著强于PLS组。CLSM结果表明,与PLS相比,ASGPR阳性细胞HepG2对Lf-PLS的摄取显著性增加,提示Lf可能增加了ASGPR阳性细胞HepG2对脂质体的摄取。

|
Figure 3 Confocal microscopy images of HepG2 cells treated with liposomal formulations. Cells were incubated with PLS (A) and Lf-PLS (B) at a final coumarin-6 concentration of 3 μg·mL-1 inserum-free medium for 1 h at 37 ℃,respectively. Cell nuclei were stained blue with DAPI. And coumarin-6 was shown as green fluorescence. 1. Dark field for courmarin-6; 2. Dark field for DAPI; 3. Bright field for cells; 4. Merged |
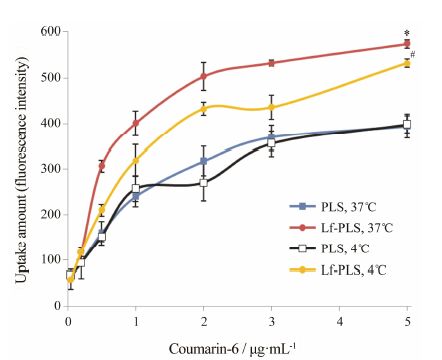
以包载香豆素-6的PLS为阴性对照,结合流式细胞术,分别定量地考察了ASGPR阳性细胞HepG2在4 ℃、37 ℃条件下 ,对不同香豆素-6浓度Lf-PLS的摄取,结果如图 4所示。
|
Figure 4 Flow cytometry of coumarin-6 loaded liposomes on HepG2 cells with different coumarin-6 concentrations at 4 ℃ or 37 ℃ for 1 h,respectively. n = 3,x± s. P < 0.05 vs PLS (37 ℃) group; #P < 0.05 vs Lf-PLS (37 ℃) group |
在37 ℃条件下,随着香豆素-6浓度的增加,HepG2细胞对PLS和Lf-PLS的摄取量逐渐增大,提示HepG2细胞对PLS和Lf-PLS的摄取呈浓度依赖性。当香豆素-6质量浓度为0.5~5 μg·mL-1时,HepG2对Lf-PLS的摄取量均显著高于PLS (P < 0.05)。而当香豆素-6浓度较低时,HepG2细胞对Lf-PLS和PLS的摄取无显著性差异。此现象的产生原因可能是: ASGPR与配体的相互作用具有浓度依赖性[11]。当香豆素-6浓度较低时,体系中Lf的含量亦较低,使得Lf介导的主动转运相对较少,与PLS相比不明显。而当香豆素-6浓度增加时 ,体系总Lf的含量增多,其介导的主动转运明显增强。所以,当香豆素-6浓度较高时,Lf-PLS的摄取显著高于PLS。结果提示,适当Lf的修饰可增加HepG2细胞对Lf-PLS的摄取。
在4 ℃条件下,HepG2细胞对PLS和Lf-PLS 的摄取亦呈浓度依赖性。在香豆素-6浓度为0.5~5 μg·mL-1时,HepG2细胞对Lf-PLS的摄取量亦显著高于PLS (P < 0.05); 但是,HepG2细胞对Lf-PLS的摄取量均显著低于在37 ℃条件下的相应 浓度 (P < 0.05),而PLS在两种温度下的摄取变化不明显。导致二者差异的原因可能在于,ASGPR与配体的相互作用具有温度依赖性[11]。在低温情况下,ASGPR与配体Lf的亲和力较弱,导致Lf受体介导的主动转运较差,而当温度升高时,ASGPR与配体Lf的作用力增强,Lf受体介导的主动转运能力较强,所以温度对Lf-PLS 摄取的影响较大。而PLS的摄取不受温度对受体与配体亲和力的影响,所以温度对PLS的摄取影响不明显。上述结果表明,在低温条件下,HepG2细胞对Lf-PLS的摄取显著性低于正常状态,证实Lf-PLS的摄取是能量消耗的过程[12]。
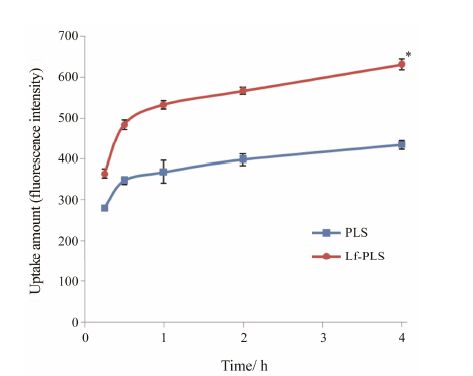
4.2 时间对细胞摄取的影响在香豆素-6质量浓度为3 μg·mL-1时,HepG2细胞对PLS与Lf-PLS的摄取呈时间依赖性,即HepG2细胞对PLS与Lf-PLS的摄取量随时间的增加而增加。在各时间点HepG2细胞对Lf-PLS的摄取量均显著高于PLS (P < 0.05)。在4 h时,HepG2细胞对Lf-PLS的摄取量是PLS的1.5倍。结果见图 5。
|
Figure 5 Flow cytometry of coumarin-6 loaded liposomes on HepG2 cells with a coumarin-6 concentration of 3 μg·mL-1 for different time of incubation at 37 ℃. n = 3,x± s. P < 0.05 vs PLS group |
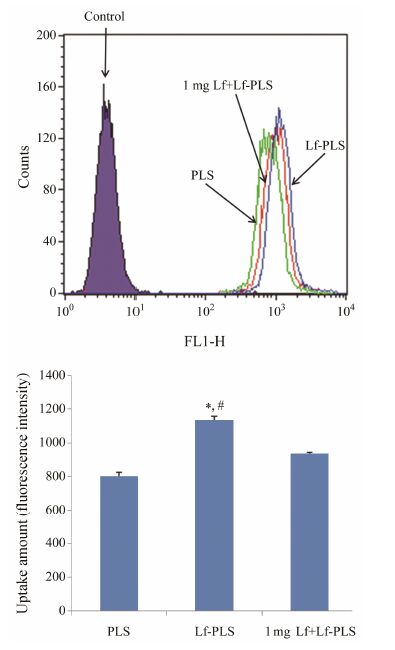
为了进一步证明Lf-PLS对ASGPR阳性细胞HepG2的靶向性及其靶向机制,本实验考察游离Lf对Lf-PLS细胞摄取的影响。图 6结果显示,37 ℃时HepG2细胞对Lf-PLS的摄取显著高于PLS。而当大量的游离Lf存在时,HepG2细胞 对Lf-PLS的摄取显著性降低。结果表明,过量Lf的加入可有效地抑制HepG2细胞对Lf-PLS的摄取。同时也进一步证实,HepG2对Lf-PLS的摄取是由Lf介导的细胞内吞机制。
|
Figure 6 Inhibition assays. HepG2 cells were incubated with coumarin-6 loaded PLS and Lf-PLS with excess free Lf preincubation for competition. n = 3,x± s. P < 0.05 vs PLS group; #P < 0.05 vs Lf+Lf-PLS group |
本研究旨在构建Lf修饰的长循环脂质体传递系统,并对其肝癌的体外靶向性进行评价。PLS是采用亲水链段PEG修饰的脂质双分子层囊泡,具长循环特性,可借助EPR效应增加其在肿瘤部位的蓄积[1, 2]。Lf与ASGPR具有较好的特异性结合能力,采用Lf修饰的长循环脂质体,可在ASGPR的介导下,增加肝癌细胞对药物的摄取[4, 5]。
脂质体PEG化的方法主要分为一步法和后插入法两种[13]。PEG化一步法 (co-dissolving technology) 是将长循环材料 (peglipid) 加入成膜材料中,与磷脂、胆固醇等膜材共同成膜,制得长循环脂质体; 后 插入法是一步法的改进,该方法首先制备普通脂质体,再将peglipid加入普通脂质体中孵育,由于peglipid中疏水的磷脂头基与脂质体膜表面磷脂的相互作用,使得peglipid的磷脂头基部分自组装插入脂质体的磷脂双分子层中,形成长循环脂质体[14]。研究表明,与一步法相比,后插入法制得的长循环脂质体具有更好的长循环特性,其主要原因在于,采用后插入法制备长循环脂质体,可使peglipid充分裸露在脂质体的表面; 一步法制备时,peglipid中一部分会朝向脂质体内水相,使得脂质体的表面PEG化程度下降,所以后插入法制得的长循环脂质体的长循环特性更好[15]。后插入法制得的长循环脂质体,其peglipid上的活性基团亦可充分暴露在脂质体的表面,有效地增加了PEG链段与靶向配体的偶联效率。此外,后插入法还可以根据靶向制剂用量和作用靶点的要求,适当调整靶向制剂制备的处方量,由此可见,采用后插入法制备长循环脂质体与主动靶向脂质体较为简单、方便和经济[16]。因此,本研究采用后插入法,构建PEG修饰的长循环脂质体PLS和具-COOH活性基团的靶向脂质体Lf-PLS。
在后插入法中,配体连接脂质体的方式可由以下两种方法实现[13]: ① 先采用带活性基团的长循环材料与靶向配体偶联,形成“配体-PEG2000-DSPE”偶联衍生物,然后将预制好的“配体-PEG2000- DSPE”插入脂质体中而得。该方法适合于结合位点明确的小分子量配体 (如多肽或单抗片段等) 与脂质体的连接。但是,该方法要求制得的“配体-PEG2000-DSPE”纯度较高,通常需要对“配体-PEG2000-DSPE”进行复杂的结构确证与繁琐的纯化处理。合成时所需投料量较大,易造成材料浪费或贮存时间过长引起的靶向材料不稳定等问题。② 先制备普通脂质体,然后采用后插入法,将长循环材料插入脂质体的磷脂膜中,再与靶向配体共价结合。该方法适合于结合位点不明确的大分子配体如蛋白、抗体等的连接。并且可采用一步去除游离药物和靶向蛋白,实现脂质体的纯化。与方法①相比,步骤更为简单方便。另外,可根据实际用量需求调整投料量,避免不必要的浪费或贮存时间过长引起的靶向材料不稳定等问题。因此,本研究选择在完成长循环脂质体的制备后,再采用催化剂EDC与NHS进行Lf的修饰。
在合成过程中,催化剂EDC与NHS亦不会出现被脂质体包封而造成残留的问题,因为反应催化剂EDC与NHS是水溶性物质。通常,脂质体包载水溶性药物的方法[17]主要有: ① 采用主动包封技术包载药物,如pH梯度法或硫酸铵梯度法。主动包封技术的应用与药物的结构密切相关,不能推广到任意结构的药物。② 采用薄膜分散法包载药物。即脂质成膜后,加入含有水溶性药物的缓冲液进行脂质体的制备。由此可见,简单的加入方法,无法实现脂质体对EDC与NHS的包裹。采用凝胶色谱法即可实现游离EDC与NHS的去除。
PEG的用量对脂质体的稳定具有非常重要的影响。当PEG-lipid衍生物的摩尔比为5%~7% 时,脂质体的热稳定性达到最佳状态,这可能是因为此时 PEG分子可从蘑菇状构象 (3.5 nm) 转变成毛刷状构象 (4.5 nm),PEG层几乎可完全覆盖膜表面,使其 空间保护作用增强,修饰效果较好[1]。因此,本研究PEG-lipid衍生物的用量为5% 摩尔比。在后插入法中,peglipid的孵育温度为60 ℃,条件较温和。Peglipid嵌入的速度和效率在很大程度上受后续插入工艺的溶液温度的控制。若孵育温度过低,peglipid的嵌入 速度较慢和嵌入效率较低; 随着温度升高,脂质体最终携带的peglipid也相应增加; 若孵育温度过高,则容易引起脂质体内容物的泄露[7]。
脂质体的粒径与zeta电位也是影响脂质体稳定性与靶向摄取的重要因素。研究表明,粒径 < 200 nm而带负电荷的脂质体,可增加给药系统的稳定性与肿瘤部位的蓄积性[18]。本研究制备的香豆素-6脂质体粒径约130 nm,zeta电位约 -30 mV。其粒径小与 荷负电的理化特性,为脂质体的肝癌细胞靶向提供了优越的条件。
香豆素-6是一种检测灵敏度很高的脂溶性荧光染料,常被包载于纳米粒中作为药物传递系统的荧光探针,用于药物传递系统的体内外示踪和相关机制研究[12]。HepG2细胞是一种人源的肝癌细胞株,已有实验证实HepG2细胞高表达ASGPR,常作为ASGPR靶细胞应用于肝癌靶向的研究[3, 4, 19]。本研究以香豆素-6作为荧光探针,标记肝癌靶向脂质体Lf- PLS。采用ASGPR高表达的HepG2细胞作为靶细胞,以未修饰的长循环脂质体PLS为对照,考察Lf-PLS对HepG2细胞的体外靶向作用,并初步探讨了Lf-PLS对HepG2细胞的靶向性机制。
以香豆素-6示踪脂质体的细胞摄取及其机制,前提是香豆素-6脂质体被细胞吞噬后,再释放荧光探针香豆素-6。细胞摄取游离药物时,游离药物必须以溶液形式存在于培养液中。而香豆素-6是一种脂溶性的探针,在水中不溶。若脂质体被摄取前释放香豆素-6,则以沉淀形式析出,难以实现游离香豆素-6的摄取。如脂质体在未进入细胞前释放香豆素-6,则不能完全示踪脂质体的摄取情况,亦失去了Lf-PLS作为药物载体的应用价值。为此,本研究尚未进行香豆素-6脂质体的释放研究,而直接用于香豆素-6示踪脂质体的细胞摄取机制。
激光共聚焦显微镜结果显示,HepG2细胞对Lf- PLS的摄取显著高于PLS,提示Lf能有效提高HepG2细胞对脂质体的摄取。流式细胞实验结果显示,HepG2细胞对Lf-PLS的摄取具有浓度、时间和温度依赖性,说明HepG2对Lf-PLS的摄取是一个主动转运过程[12]。并且Lf-PLS的摄取在不同浓度、时间和温度下均显著高于PLS,此结果进一步证实Lf-PLS对HepG2细胞具有较好的靶向性。当过量Lf存在时,HepG2细胞对Lf-PLS的摄取被显著性抑制,提示Lf- PLS的靶向机制可能在于: Lf靶向性识别HepG2细胞表面高表达的ASGPR,通过受体介导的主动转运,将Lf-PLS吞入HepG2细胞[20]。
本研究制备了包载香豆素-6的Lf-PLS,并证实 了Lf-PLS对体外肝癌细胞的靶向性,为进一步探索该脂质体在体内的肝癌靶向性、抗肿瘤活性和代谢规律提供了实验基础。在后续的工作中,将进一步考察DSPE-PEG2000-COOH用量与Lf接枝量对靶向效率的影响,对Lf-PLS处方进一步的优化,以提高Lf-PLS的靶向效率。另外,Lf-PLS载药后的体内靶向性与安全有效性,亦尚待进一步地研究与验证。
| [1] | Allen TM, Cullis PR. Liposomal drug delivery systems: from concept to clinical applications [J]. Adv Drug Deliv Rev, 2013, 65: 36-48. |
| [2] | Bozzuto G, Molinari A. Liposomes as nanomedical devices [J]. Int J Nanomed, 2015, 10: 975-999. |
| [3] | D'Souza AA, Devarajan PV. Asialoglycoprotein receptor mediated hepatocyte targeting -strategies and applications [J]. J Control Release, 2015, 203: 126-139. |
| [4] | McAbee DD, Bennatt DJ, Ling YY. Identification and analysis of a CA2+-dependent lactoferrin receptor in rat liver. Lactoferrin binds to the asialoglycoprotein receptor in a galactose-independent manner [J]. Adv Exp Med Biol, 1998, 443: 113-121. |
| [5] | Oh ST, Rih JK, Kwon HS, et al. Lactoferrin as a gene delivery vehicle to hepatocytes [J]. Exp Mol Med, 1997, 29: 111-116. |
| [6] | Tu LX, Xu YH, Tang CY, et al. In vivo imaging in tumor- bearing animals and pharmacokinetics of PEGylated liposomes modified with RGD cyclopeptide [J]. Acta Pharm Sin (药学学报), 2012, 47: 646-651. |
| [7] | Li SD, Huang L. Nanoparticles evading the reticuloendothelialsystem: role of the supported bilayer [J]. Biochim Biophys Acta, 2009, 1788: 2259-2266. |
| [8] | Ying X, Wen H, Lu WL, et al. Dual-targeting daunorubicin liposomes improve the therapeutic efficacy of brain glioma in animals [J]. J Control Release, 2010, 141: 183-192. |
| [9] | Wei M, Xu Y, Zou Q, et al. Hepatocellular carcinoma targeting effect of PEGylated liposomes modified with lactoferrin [J].Eur J Pharm Sci, 2012, 46: 131-141. |
| [10] | Chen H, Tang L, Qin Y, et al. Lactoferrin-modified procationic liposomes as a novel drug carrier for brain delivery [J]. Eur J Pharm Sci, 2010, 40: 94-102. |
| [11] | Wan D, Zhong G, Zhu J. Preparation of 125I-Ty-folate and investigation of its binding characteristic in vitro [J]. Fudan Univ J Med Sci (复旦学报 医学版), 2004, 31: 625-628. |
| [12] | Hu K, Li J, Shen Y, et al. Lactoferrin-conjugated PEG-PLA nanoparticles with improved brain delivery: in vitro and in vivo evaluations [J]. J Control Release, 2009, 134: 55-61. |
| [13] | Torchilin VP, Weissig V, Deng Y, et al. Liposome [M]. 2nd ed. Beijing: Chemical Industry Press, 2007: 100. |
| [14] | Gabizon A, Shmeeda H, Horowitz AT, et al. Tumor cell targeting of lipsome-entrapped drugs with phospholipid- anchored folic acid-PEG conjugates [J]. Adv Drug Deliv Rev, 2004, 56: 1177-1192. |
| [15] | Li CL, Cui JX, Wang CX, et al. Development of pegylated liposomal vinorelbine formulation using “post-insertion” technology [J]. Int J Pharm, 2010, 391: 230-236. |
| [16] | Uster PS, Allen TM, Daniel BE, et al. Insertion of poly (ethylene glycol) derivatized phospholipid into pre-formed liposomes results in prolonged in vivo circulation time [J]. FEBS Lett, 1996, 386: 243-246. |
| [17] | Lu B. New Techniques and New Dosage Forms of Drugs (药物新剂型与新技术) [M]. 2nd ed. Beijing: People's Health Press, 2005: 129. |
| [18] | Zhang D, Xu H, Hu M, et al. “PEG dilemma” for liposomes and its solving approaches [J]. Acta Pharm Sin (药学学报), 2015, 50: 252-260. |
| [19] | Chen X, Zang X, Li F, et al. Antitumor efficacy of irinotecan- loaded galactosyl modified lipid bilayer-coated mesoporous silica nanoparticles against hepatocellular carcinoma cells [J]. Acta Pharm Sin (药学学报), 2014, 49: 718-725. |
| [20] | Zu Y, Yuan S, Zhao X, et al. Preparation, activity and targeting ability evaluation in vitro on folate mediated epigallocatechin-3-gallate albumin nanoparticles [J]. Acta Pharm Sin (药学学报), 2009, 44: 525-531. |
 2015, Vol. 50
2015, Vol. 50


