甘草是一种甜味的豆科植物,具有抗菌、抗病毒、保肝和抗氧化等[1, 2, 3, 4]生物活性,最近还发现其具有保护心脏和克服糖皮质激素耐药等作用[5, 6]。甘草的主要有效成分是18β-甘草次酸 (18β-glycyrrhetinic acid,GA),属于五环三萜类别中的齐墩果烷型。研究表明,GA对肝癌、肺癌、乳腺癌和卵巢癌等恶性肿
瘤具有一定的抗肿瘤活性[7, 8, 9, 10],主要作用机制为诱导肿瘤细胞凋亡达到抑制肿瘤细胞增殖的目的[11, 12],另外GA也可以通过诱导肺癌肿瘤细胞发生G1期周期阻滞发挥抗肿瘤的作用[13]。但GA水溶性较差、抗肿瘤活性较弱,与目前临床上的抗肿瘤药物有一定差距,对GA的结构改造是必需的。本课题组长期从事对GA的结构修饰及抗肿瘤活性研究,改造位点主要在A环、11位羰基、C环和30位羧基4个位点。Liu等[14]设计并合成了3位烷氧基肟基取代衍生物,发现该类化合物抗增殖活性以及诱导细胞凋亡作用有所提升 (GA-1,图 1)。之后在A环引入2-氰基-3氧代-1-烯结构 (GA-2,图 1),其对肿瘤细胞的抗增殖作用有显著提升[15],11位脱氧化合物对活性提升贡献不大。Tang等[16]发现,在30位羧基通过酰胺键引入含氮杂环 (GA-3,图 1),Pravat等[17]通过酯键引入三唑环并使其糖基化 (GA-4,图 1),对活性有一定提升。Li等[18]考察C环结构,包括羰基位置及双键数目对活性的影响,对11位羰基及12、13位双键进行改造,设计了含不同C环结构的系列衍生物 (GA-5a~GA-5e,图 1),活性结果表明含9(11)-烯-12氧代结构的GA-5d和含9(11),12-二烯结构的GA-5e抗肿瘤活性有较显著的提升,进一步的机制研究表明该类化合物通过诱导细胞凋亡抑制肿瘤生长的同时,降低了抗凋亡蛋白c-FLIP的水平。在新型药物治疗的发展过程中,关于天然产物GA的开发及其在抗肿瘤等方面的研究仍具有重要意义。

|
Figure 1 18β-Glycyrrhetinic acid (GA) derivatives |
|
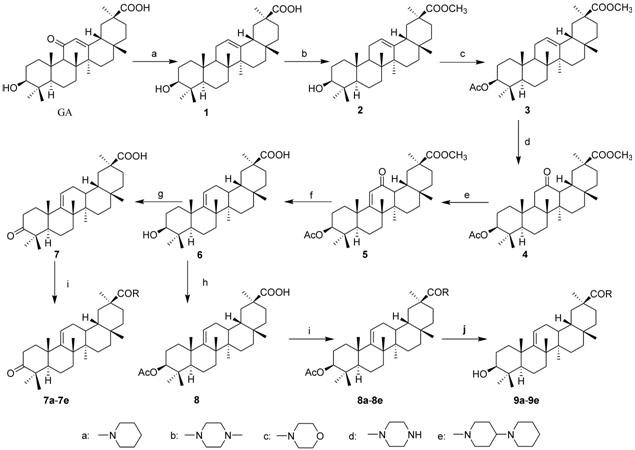
Scheme 1 The synthetic route to target compounds |
|
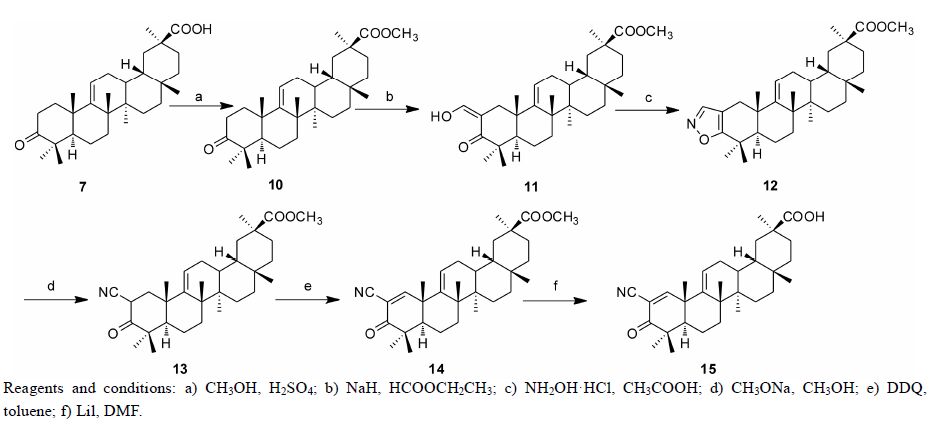
Scheme 2 The synthetic route to target compounds |
在前期对18β-甘草次酸结构修饰、构效关系的研究基础上,发现A环及C环结构修饰对化合物活性提升具有重要作用,30位羧基成酰胺或成甲酯活性优于游离羧酸。为了进一步考察C环双键位置对化合物活性的影响,本文以GA为先导化合物,设计并合成了新型C环含9(11)-烯结构的化合物,并以此C环骨架对A环及30位羧基进行结构修饰,共计24个化合物,分为3-羟基(乙酰氧基或氧代)-齐墩果烷- 9(11)-烯-30-酰胺类和2,3-双取代-齐墩果烷-9(11)-烯- 30-羧酸甲酯类,其中23个化合物未见文献报道,并对化合物进行了体外抗肿瘤活性的研究。
以18β-甘草次酸为原料,采用锌汞齐还原反应将11位羰基还原为亚甲基,然后对30位羧基及3位羟基进行保护,之后对C环进行氧化,再采用黄明龙还原反应得到含9(11)-烯结构关键中间体6。对6进行氧化得到7或乙酰化得到8,再与不同氨基侧链成酰胺,对乙酰基取代的化合物再脱去乙酰基,即可获得3-羟基(乙酰氧基或氧代)-齐墩果烷-9(11)-烯-3-酰胺类化合物7a~7e、8a~8e、9a~9e (合成路线1)。2,3-双取代-齐墩果烷-9(11)-烯-30-羧酸甲酯类化合物的合成如下: 对中间体6进行氧代后得到的7,使其30位羧酸成甲酯得到化合物10,在2位引入羟亚甲基得到11,再与盐酸羟胺在醋酸中反应生成异噁唑环得到化合物12,12在碱性条件下开环制得化合物13,再在A环羰基α位引入α,β-不饱和双键制得14,最后将14水解制得15 (合成路线2)。
结果与讨论 1 目标化合物的波谱特征以18β-甘草次酸为先导化合物合成的24个目标化合物的最后一步收率及理化性质见表 1。在红外图谱中,2 920~2 970 cm-1之间有一个由ν=C-H产生的峰,证明9,11位双键的存在; 1 620 cm-1左右存在1个由νC=O产生的峰,证明了30位酰胺键的存在。氢谱中,在高场区出现7个含有3个氢的单峰,证明母环上的7个甲基的存在; δ 5.4左右出现1个氢信号,这是11位上的氢信号,证明了9,11位双键的存在。30位连有不同含氮杂环时,杂环上的氢信号出现在不同的位置。IR、1H NMR及MS波谱数据见表 2。
|
|
Table 1 Physical property of target compounds |
|
|
Table 2 Spectral data of target compounds |
以GA为阳性对照,采用MTT实验法测定24 个目标化合物对人前列腺癌细胞PC-3的半数生长抑制浓度GI50。另外采用细胞计数法,测试了对PC-3细胞表现较强抑制活性的A环3位氧代及A环2,3-双取代系列的12个化合物在人急性早幼粒白细胞HL-60细胞中的生长抑制作用,相关实验结果见表 3。
|
|
Table 3 The antiproliferative effects of target compounds in PC-3 and HL-60 cells. nt: Not tested |
活性测试结果表明,合成的18-β甘草次酸类衍生物对肿瘤细胞显示不同程度的抑制活性,部分化合物的抑制活性优于母体GA。其中化合物14的抑制活性最强,对PC-3细胞及HL-60细胞的GI50值分别为4.48 μmol·L-1和1.2 μmol·L-1,特别在HL-60细胞中,化合物14比母体GA的活性提升了50倍以上,具有进一步深入研究的价值。化合物7b、7e、15同样具有较强的抑制活性,其对PC-3细胞的GI50值分别为16.16、14.73和5.58 μmol·L-1,小于20 μmol·L-1。化合物7b、11对HL-60细胞表现出较强抑制活性,其GI50值分别为6.7和6.1 μmol·L-1,小于10 μmol·L-1。可以看出,当C环引入9(11)-烯结构时活性明显增强,30位羧基成酰胺或成甲酯对活性有一定提升,A环进行结构修饰对抗肿瘤活性提升具有重要作用。
对C环含9(11)-烯结构的化合物的活性数据进行分析,初步得到以下构效关系: ① 相比于保留A环3位羟基或3位乙酰氧代,将3位羟基氧代有助于增强化合物抗肿瘤增殖活性; ② 30位羧基成酰胺对化合物活性提高有益,其中N-甲基哌嗪稍强于哌啶基哌啶和哌嗪,稍强于哌啶和吗啉。③ 对于2,3-双取代化合物,2位引入氰基对化合物的活性提升有利,再在1,2位引入双键有助于活性进一步提高; 2位为羟亚甲基结构或2,3位骈合异噁唑环时对活性提升贡献不 大; ④ 30位羧基成甲酯活性略优于游离羧酸。
实验部分熔点采用X-4数字显微熔点仪测定 (温度未经校正); NMR采用Bruker ARX-300型核磁共振波谱 仪测定,TMS为内标。IR用Bruker IR-FIS-55型色谱仪测定。LC-MS用美国Waters公司ACQUITY Ultra Performance LCTM超高效液相色谱仪,美国Waters公司Waters Quattro micro API三重四极杆串联质谱仪测定。所需试剂均为分析纯的市售商品,使用时根据实验需要进一步纯化。
1 化合物的合成 1.1 3-羟基-齐墩果烷-12(13)-烯-30-羧酸(1) 的合成将0.5 g(1.8 mmol) HgCl2加入30 mL 3% 的盐酸中,溶解后加入13.5 g (0.206 mol) 锌粉,搅拌20 min后,抽滤,以少量1,4-二氧六 环洗涤。将已活化的Zn粉加入到5.04 g (10.7 mmol) 甘草次酸/100 mL 1,4-二氧六环溶液中,外用冰水浴,保持温度不超过20 ℃,滴加1 mL浓盐酸,通入氯化氢气体3 h,TLC显示反应完全。静置,将反应瓶中的上清液倒入200 mL蒸馏水中,析出大量固体,抽滤,以水洗至中性,干燥。硅胶柱色谱分离 (三氯甲烷-甲醇,体积比为50∶1),得到白色纯品4.65 g,收率95.0%。mp 314~317 ℃。1H NMR (CDCl3) δ: 12.0 (s,1H,-OH),5.19 (t,1H,H-12),3.03 (m,1H,H-3),1.14,1.10,0.94,0.93,0.91,0.77,0.71 (s,CH3×7); 13C NMR (CDCl3) δ: 178.1 (C-3 0),144.5 (C-13),122.2 (C-12),76.9 (C-3),54.8 (C-5),47.9 (C-9),47.2 (C-18),43.3 (C-20),41.2 (C-19),40.4 (C-8),40.2 (C-4),39.9 (C-1),39.6 (C-22),39.3 (C-7),39.0 (C-17),38.8 (C-21),38.5 (C-2),38.2 (C-16),36.6 (C-28),31.7 (C-15),28.3 (C-27),27.1 (C-11),25.8 (C-23 and C-24),18.1 (C-29),16.7 (C-6),16.1 (C-26),15.4 (C-25)。
1.2 3-羟基-齐墩果烷-12(13)-烯-30-羧酸甲酯 (2) 的合成将16 g(0.035 mol) 1溶于1 L无水甲醇中,缓慢滴加浓硫酸20 mL,加热回流20 h,TLC显示反应完全,低温冷却后抽滤,滤饼以大量水洗至中性,干燥,得到白色纯品13.25 g,收率80.3%。mp 248~ 250 ℃。1H NMR (CDCl3) δ: 5.27 (t,1H,H-12),3.68 (s,3H,-COOCH3),3.22 (m,1H,H-3),1.14,1.13,1.00,0.96,0.94,0.79,0.78 (s,CH3×7); 13C NMR (CDCl3) δ: 177.7 (C-30),144.3 (C-13),122.6 (C -12),79.0 (C-3),54.8 (C-5),51.7 (-COOCH3),47.8 (C-9),47.2 (C-18),43.6 (C-20),42.1 (C-14),41.2 (C-19),40.4 (C-8),40.2 (C-4),39.9 (C-1),39.7 (C-10),39.3 (C-22),39.1 (C-7),38.8 (C-17),38.5 (C-21),38.4 (C-29),36.7 (C-2),36.5 (C-16),36.1 (C-28),31.7 (C-15),28.0 (C-27),26.6 (C-11),25.6 (C-23 and C-24),17.2 (C-6),16.0 (C-26),15.3 (C-25)。
1.3 3-乙酰氧基-齐墩果烷-12(13)-烯-30-羧酸甲酯 (3) 的合成将0.8 g(1.7 mmol) 2溶于12 mL吡啶中,外用冰盐浴,加入0.8 mL醋酸酐及催化量DMAP,加热回流3 h,冷却至室温。倒入10 mL 3% 盐酸,析出固体后抽滤,水洗至中性,干燥。以无水甲醇重结晶得到白色针状纯品0.719 g,收率82.6%。mp 263~265 ℃。1H NMR (CDCl3) δ: 5.27 (t,1H,H-12),4.53~4.48 (m,1H,H-3),3.68 (s,3H,-COOCH3),2.05 (s, 3H,-OOCCH3),1.15,1.13,1.00,0.96,0.88,0.87,0.78 (s,CH3×7); 13C NMR (CDCl3) δ: 177.6 (C-30),170.9 (-OOCCH3),144.3 (C-13),122.4 (C-12),80.8 (C-3),54.7 (C-5),51.9 (-COOCH3),47.9 (C-9),47.1 (C-18),43.4 (C-20),42.7 (C-14),42.3 (C-19),40.6 (C-8),40.0 (C-1),39.7 (C-4),39.4 (C-10),39.2 (C-22),39.1 (C-7),38.7 (C-17),38.4 (C-21),37.9 (C-29),36.7 (C-16),36.1 (C-28),32.5 (C-15),28.6 (C-27),28.3 (C-2),27.1 (C-11),26.4 (C-23 and C-24),22.5 (-OOCCH3),16.4 (C-6),16.1 (C-26),15.5 (C-25)。
1.4 3-乙酰氧基-12-氧代-齐墩果烷-30-羧酸甲酯 (4) 的合成将2.5 g(4.9 mmol) 3溶于200 mL冰醋酸 中,加入30% H2O2 10 mL,100 ℃下反应2 h,TLC显示反应完全。倒入冰水里,析出大量固体 。抽滤,水洗至中性,干燥,以甲醇重结晶,得到白色晶体2.002 g,收率77.7%。mp 299~301 ℃。1H NMR (CDCl3) δ: 4.48 (m,1H,H-3),3.72 (s,3H,-COOCH3),2.76 (d,1H,H-13),2.57 ( m,1H,H-18),2.04 (s,3H,-OOCCH3),1.14,1.13,0.93,0.90,0.87,0.86,0.85 (s,CH3×7); 13C NMR (CDCl3) δ: 212.2 (C-12),177.6 (C-30),170.9 (-OOCCH3),80.8 (C-3),54.6 (C-5),51.9 (-COOCH3),50.9 (C-9),49.6 (C-13),44.3 (C-14),41.8 (C-18),41.4 (C-8),40.9 (C-29),39.8 (C-11),39.5 (C-1),38.6 (C-4),37.9 (C-10),37.5 (C-16),36.4 (C-22),35.6 (C-7),35.3 (C-19),34.1 (C-17),33.5 (C-29),32.8 (C-21),29.7 (C-15),28.9 (C-2),26.1 (C-23 and C-24),23.1 (-OOCCH3),22.6 (C-28),19.4 (C-26),19.1 (C-6),18. 3 (C-27),15.9 (C-25)。
1.5 3-乙酰氧基-12-氧代-齐墩果烷-9(11)-烯-30-羧酸甲酯 (5) 的合成将2.5 g(4.7 mmol) 4溶于220 mL冰醋酸中,加入数滴40% 的HBr醋酸溶液。将0.3 mL Br2溶于13 mL冰醋酸中,在室温下,滴加到上述溶液中。将混合液加热到40 ℃保持15 min,然后室温搅拌30 h反应完全,倒入冰水中,析出白色固体。抽滤,水洗至中性,干燥,无水甲醇重结晶,得到白色晶体2.315 g,收率88.2%。mp 288~290 ℃。1H NMR (CDCl3) δ: 5.79 (s,1H,H-11),4.53~4.48 (m,1H,H-3),3.75 (s,3H,-COOCH3),2.97 (m,1H,C-13),2.05 (s,3H,-OOCCH3),1.38,1.22,1.10,0.97,0.92,0.91,0.91 (s,CH3×7); 13C NMR (CDCl3) δ: 201.4 (C-12),177.8 (C-30),177.4 (C-11),170.8 (-OOCCH3),123.0 (C-9),79.6 (C-3),57.8 (C-13),52.7 (-COOCH3),52.4 (C-5),43.2 (C-18),42.5 (C-20),41.9 (C-7),39.6 (C-10),38.7 (C-4),38.1 (C-16),37.3 (C-1),36.4 (C-22),35.9 (C-19),34.7 (C-14),33.8 (C-17),33.0 (C-7),32.6 (C-29),31.2 (C-21),29.1 (C-15),27.5 (C-26),26.3 (C-2),25.8 (C-23 and C-24),22.4 (-OOCCH3),21.3 (C-28),20.2 (C-25),17.5 (C-27)。
1.6 3-羟基-齐墩果烷-9(11)-烯-30-羧酸 (6) 的合成将2.27 g (4.1 mmol) 5,22 g KOH和13 mL 80% 的 水合肼,加入到200 mL一缩二乙二醇中,165 ℃搅拌 1 h,将温度升至225 ℃蒸出过量的水合肼和生成的水。蒸完后,将混合物在225 ℃下反应5 h,TLC显示反应完全。将反应液倒入500 mL水中,用浓盐酸调pH = 2~3,用三氯甲烷萃取3次,将合并的有机层用饱和的NaHCO3和NaCl溶液分别洗涤3次,加入无水硫酸镁干燥过夜,过滤,减压蒸干溶剂。硅胶柱色谱分离 (石油醚-乙酸乙酯,体积比为7∶1),得到白色纯品1.500 g。
1.7 3-氧代-齐墩果烷-9(11)-烯-30-羧酸 (7) 的合成将0.15 g (0.3 mmol) 6溶于14 mL丙酮中,缓慢滴 加适量琼斯试剂 (滴加后,溶液不会立即变绿,而是呈棕黄色,搅拌10 min后才慢慢变绿即可)。减压蒸干丙酮,加入水,以二氯甲烷-乙醚,体积比为1∶2的混合溶剂萃取3次,所得有机层用饱和碳酸氢钠、氯化钠溶液各洗3次,用无水硫酸镁干燥过夜,过滤,蒸干溶剂,得到7的粗品。硅胶柱色谱分离 (石油醚-乙酸乙酯,体积比为6∶1),得到白色纯品0.123 g。
1.8 3-乙酰氧基-齐墩果烷-9(11)-烯-30-羧酸 (8) 的合成将0.8 g (1.8 mmol) 6溶于12 mL吡啶中,外 用冰盐浴,加入0.8 mL醋酸酐及催化量DMAP,加 热回流3 h,冷却至室温。倒入10 mL 3% HCl中,析出固体,抽滤,水洗至中性,干燥。硅胶柱色谱分离 (石油醚-乙酸乙酯,体积比为8∶1),得到白色纯品0.572 g。
1.9 N-[3-乙酰氧基-齐墩果烷-9(11)-烯-30-酰基]哌啶 (8a) 的合成将0.2 g(0.4 mmol) 8溶于10 mL氯仿中,然后加入0.2 mL草酰氯,室温搅拌过夜。减压蒸干溶剂,加入两次环己烷,每次20 mL,减压蒸干,得到酰氯。再加入10 mL氯仿,溶解后,加入1 mmol哌啶,室温搅拌2 min后,停止反应,减压蒸干溶剂。硅胶柱色谱分离 (石油醚-乙酸乙酯,体积比为15∶1),得到白色纯品0.118 g。
按照8a的合成方法,以8和相应含氮杂环为原料,得到8b~8e。
1.10 N-[3-氧代-齐墩果烷-9(11)-烯-30-酰基]哌啶 (7a) 的合成以7和哌啶为原料,按照8a的合成方法,硅胶柱色谱分离 (石油醚-乙酸乙酯,体积比为10∶1),得到白色纯品0.122 g。
按照7a的合成方法,以7和相应含氮杂环为原料,得到化合物7b~7e。
1.11 N-[3-羟基-齐墩果烷-9(11)-烯-30-酰基]哌啶 (9a) 的合成将0.2 g(0.4 mmol) 8a加入到0.4 gKOH/4 mL甲醇溶液中,回流30 min,将产物倒入冰水中,析出白色固体,抽滤,滤饼水洗至中性。硅胶柱色谱分离 (石油醚-乙酸乙酯,体积比为8∶1),得到白色纯品0.125 g。
按照9a的合成方法,以8b~8e为原料,得到化合物9b~9e。
1.12 3-氧代-齐墩果烷-9(11)-烯-30-羧酸甲酯 (10) 的合成将1.6 g(0.35 mmol) 7溶于100 mL无水甲醇中,滴加浓硫酸2 mL,加热回流20 h,放入冰箱中冷却,析出白色固体。抽滤,滤饼以水洗至中性,干燥。硅胶柱色谱分离 (石油醚-乙酸乙酯,体积比为25∶1),得到白色纯品1.340 g。
1.13 2-羟亚甲基-3-氧代-齐墩果烷-9(11)-烯-30-羧酸甲酯 (11) 的合成将1.1 g(0.23 mmol) 10溶于20 mL甲酸乙酯中,加入0.5 g氢化钠,反应约10 min,TLC显示反应完全。加入无水甲醇直到无气泡产生,然后再加入适量的水,以浓盐酸调pH = 1~2。以三氯甲烷萃取3次,将有机层合并,用饱和NaCl溶液洗3次,无水硫酸镁干燥过夜,过滤,减压蒸干溶剂,得到11的粗品。硅胶柱色谱分离 (石油醚-乙酸乙酯,体积比为25∶1),得到白色纯品0.978 g。
1.14 异噁唑[2,3-d]-齐墩果烷-9(11)-烯-30-羧酸甲酯 (12) 的合成将4.55 g (9.16 mmol) 11、2.21 g盐酸羟胺和0.25 g无水乙酸钠加入到20 mL冰醋酸中,回流45 min,倒入冰水中,析出固体。抽滤,滤饼用水洗至中性。硅胶柱色谱分离 (石油醚-乙酸乙酯,体积比为20∶1),得到白色纯品3.804 g。
1.15 2-氰基-3-氧代-齐墩果烷-9(11)-烯-30-羧酸甲酯 (13) 的合成将2.81 g ( 5.7 mmol) 12加入到35 mL 无水乙醚中,搅拌溶解后,加入1.4 g甲醇钠/30 mL甲醇溶液,室温搅拌约24 h,TLC显示反应完全。加入25 mL水萃取醚层,以10% KOH洗涤乙醚层3次,合并水层,用浓盐酸调pH = 1~2。再以乙醚萃取水层3次,以无水硫酸镁干燥过夜,过滤,减压蒸干溶剂,得到粗品。硅胶柱色谱分离 (石油醚-乙酸乙酯,体积比为12.5∶1),得到白色纯品2.420 g。
1.16 2-氰基-3-氧代-齐墩果烷-1,9-双烯-30-羧酸甲酯 (14) 的合成将0.171 g (0.35 mmol) 13和0.106 g DDQ (2,3-二氯-5,6-二氰基-1,4-苯醌)加入到10.388 mL的甲苯中,回流40 min,TLC显示反应完全。放冷,过滤,减压蒸干溶剂。硅胶柱色谱分离 (石油醚-乙酸乙酯,体积比为13∶1),得到白色纯品0.110 g。
1.17 2-氰基-3-氧代-齐墩果烷-1,9-双烯-30-羧酸 (15) 的合成将0.478 g (0.001 mol) 的14溶于10 mL 干燥的DMF中,快速加入干燥的LiI 2.5 g (0.018 8 mol),N2保护下回流4 h,TLC显示反应完全。待反应液冷却后,倒入100 mL水中,用3% 盐酸调pH = 2~3,析出固体。抽滤,滤饼水洗至中性,干燥。硅胶柱色谱分离 (石油醚-乙酸乙酯,体积比为7∶1),得到白色纯品0.239 g。
2 目标化合物的抗肿瘤活性实验以GA为阳性对照,采用MTT实验法测定目标化合物对人前列腺癌细胞PC-3的半数生长抑制浓 度; 采用细胞计数法测定了部分化合物对HL-60细胞的生长抑制作用。
将PC-3细胞稀释至每毫升2×104个,吹匀后于96孔板中每孔加入细胞悬液100 μL,置培养箱中孵育1天使其贴壁。待细胞贴壁后加药; 配制药物母液,以DMSO为溶剂,将母液用培养液稀释成各个不同浓度后每孔加入100 μL,每个浓度3个平行孔,与细胞共同孵育4天。取2 μg·mL-1 MTT溶液,每孔加入50 μL,置培养箱中孵育3.5 h。使外源性的MTT被活细胞线粒体中的琥珀酸脱氢酶还原为难溶性的蓝紫色结晶物并沉积在细胞中。甩板,倒扣于滤纸上充分吸干残留液体后,每孔加入200 μL DMSO于振荡器振荡10 min,使蓝紫色结晶物溶解。使用酶标仪测定570 nm处吸光度值,间接反映活细胞数量。设A1 (含200 μL DMSO) 为空白对照孔。依公式求得细胞生长抑制率,并根据药物浓度的对数值与细胞存活率线性回归,求得半数生长抑制浓度GI50。
细胞生长抑制率 (%) = (1 - 加药孔吸光度值 / 对照孔吸光度值) × 100%
将HL-60细胞培养于含有10% (v/v) 胎牛血清、100 U·mL-1青霉素、100 μg·mL-1链霉素的2 g·L-1 NaHCO3的1640培养液中; 并置于5% CO2、饱和湿度、37 ℃培养箱内培养。将药物溶于二甲基亚砜配成16 mmol·L-1储存溶液,用无水乙醇和培养液稀释至适当浓度与HL-60细胞共同孵育72 h。经药物处理的细胞悬液,用血球计数板计总细胞数。按下式计算细胞生长抑制率,并根据药物浓度的对数值与细胞存活率线性回归,求得半数生长抑制浓度GI50。
细胞生长抑制率 (%) = (1 - 加药孔细胞总数 / 对照孔细胞总数) × 100%
| [1] | Behrad D, Saeed M, Golnaz K, et al. Preparation and antibacterial activity evaluation of 18-β-glycyrrhetinic acid loaded PLGA nanoparticles [J]. Iran J Pharm Res, 2015, 14: 373-383. |
| [2] | Masound SG, Avid M, Sohayla S, et al. The effect of aqueous extract of glycyrrhiza glabra on herpes simplex virus 1 [J]. Jundishapur J Microbiol, 2014, 7: e11616. |
| [3] | Han FM, Peng ZH, Wang JJ, et al. In vitro effct of triptolide combined with glycyrrhetinic acid on rat cytochrome P450 enzymes [J]. Acta Pharm Sin (药学学报), 2013, 48: 1136-1141. |
| [4] | Abulizi M, Kasimu R, Mao XM, et al. Synthesis and in vitro antioxidant activity of homo- and heterocyclic diene derivatives of glycyrrhetol [J]. Acta Pharm Sin (药学学报), 2008, 43: 719-723. |
| [5] | Wu HJ, Yang JY, Jin M, et al. Glycyrrhetinic acid protects the heart from ischemia/reperfusion injury by attenuating the susceptibility and incidence of fatal ventricular arrhythmia during the reperfusion period in the rat hearts [J]. Cell Physiol Biochem, 2015, 36: 741-752. |
| [6] | Kao TC, Wu CH, Yen GC. Glycyrrhizic acid and 18-glycyrrhetinic acid recover glucocorticoid resistance via PI3K- induced AP1, CRE and NFAT activation [J]. Phytomedicine, 2013, 20: 295-302. |
| [7] | Qi WW, Yu HY, Guo H, et al. Doxorubicin-loaded glycyrrhetinic acid modified recombinant human serum albumin nanoparticles for targeting liver tumor chemotherapy [J]. Mol Pharm, 2015, 12: 675-683. |
| [8] | Huang RY, Chu YL, Huang QC, et al. 18β-glycyrrhetinic acid suppresses cell proliferation through inhibiting thromboxane synthase in non-small cell lung cancer [J]. PLoS One, 2014, 9: e 93690. |
| [9] | Wang XF, Zhou QM, Lu YY, et al. Glycyrrhetinic acid potently suppresses breast cancer invasion and metastasis by impairing the p38 MAPK-AP1 signaling axis [J]. Expert Opin Ther Targets, 2015, 19: 577-587. |
| [10] | Lee CS, Yang JC, Kim YJ, et al. 18β-glycyrrhetinic acid potentiates apoptotic effect of trichostatin A on human epithelial ovarian carcinoma cell lines [J]. Eur J Pharmacol, 2010, 649: 354-361. |
| [11] | Venus H, Shohreh F, Sako M, et al. Glycyrrhetinic acid inhibits cell growth and induces opoptosis in ovarian cancer A2780 cells [J]. Adv Pharm Bull, 2014, 4: 437-441. |
| [12] | Yang JC, Myung SC, Kim WY, et al. 18β-glycyrrhetinic acid potentiates Hsp90 inhibition-induced apoptosis in human epithelial ovarian carcinoma cells via activation of death receptor and mitochondrial pathway [J]. Mol Cell Biochem, 2012, 370: 209-219. |
| [13] | Zhu J, Chen MJ, Chen N. Glycyrrhetinic acid induces G1- phase cell cycle arrest in human non-small cell lung cancer cells through endoplasmic reticulum stress pathway [J]. Int J Oncol, 2015, 46: 981-988. |
| [14] | Liu D, Song DD, Guo G, et al. The synthesis of 18β- glycyrrhetinic acid derivatives which have increased antiproliferative and apoptotic effects in leukemia cells [J]. Bioorg Med Chem, 2007, 15: 5432-5439. |
| [15] | Liu D, Kou LY, Cui TX, et al. The synthesis and apoptosis effect of 18β-glycyrrhetinic acid derivatives in human leukemia cells [J]. Chin J Med Chem (中国药物化学杂志), 2010, 20: 84-89. |
| [16] | Tang BD, Li XJ, Zhou QT, et al. The synthesis and antiproliferative effects of 2-substituted-3-oxo-olean-12-en-30-oic amide derivatives in human prostate cells [J]. Chin J Med Chem (中国药物化学杂志), 2014 24: 257-264. |
| [17] | Pravat KP, Abhijit S, Tamashree G. Synthesis and evaluation of triazole linked glycosylated 18β-glycyrrhetinic acid derivatives as anticancer agents [J]. Bioorg Med Chem Lett, 2014, 24: 3865-3868. |
| [18] | Li XJ, Wang YT, Gao Y, et al. Synthesis of methyl 2- cyano-3,12-dioxo-18β-olean-1,9(11)-dien-30-oate analogues to determine the active groups of inhibiting cell growth and inducing apoptosis in leukemia cells [J]. Org Biomol Chem, 2014, 01: 43-52. |
 2015, Vol. 50
2015, Vol. 50


