2. 江苏省苏北人民医院, 江苏 扬州 225001;
3. 扬州大学医学院, 江苏 扬州 225001
2. Subei People's Hospital of Jiangsu Province, Yangzhou 225001, China;
3. School of Medicine, Yangzhou University, Yangzhou 225001, China
结肠癌是最为常见的恶性肿瘤之一,发病率处于恶性肿瘤的第3位[1]。在我国,随着饮食习惯的改变,结肠癌的发病率呈快速上升态势。结肠癌现有的治疗手段效果不佳且不良反应较大,患者5年生存 率不足50%[1]。因此,寻找一种高效低毒的新型结肠癌药物治疗方案已成为国内外研究的重要领域。肿 瘤坏死因子相关凋亡诱导配体 (tumor necrosis factor related apoptosis inducing ligand,TRAIL) 能够选择性地诱导肿瘤细胞凋亡而对正常细胞无毒性作用,具有极大的临床应用前景。然而,包括人结肠癌细胞HT-29在内的相当多的肿瘤细胞对TRAIL耐药阻碍了TRAIL的应用[2]。虽然目前有文献[3]报道多种化疗药物能克服TRAIL的耐药问题,但寻找与低价高效、毒副作用小的药物联合进行抗癌非常迫切和重要。
藤黄酸 (gambognic acid,GA) 是中药藤黄的主要活性成分,作为一种具有广谱抗肿瘤的天然药物备受关注[4, 5]。实验证实GA能选择性抑制多种癌细胞的增殖,而对正常组织损伤较小,尤其是对造血系统和免疫系统的安全性高[4, 5]。近年研究发现GA抑制多种肿瘤的机制是通过诱导活性氧自由基 (reactive oxygen species,ROS) 升高而激活肿瘤细胞的凋亡[6, 7]。而多种药物联 合TRAIL诱导肿瘤细胞凋亡与ROS增多密切相关[8, 9]。因此猜想GA能增敏TRAIL诱导人结肠癌HT-29细胞凋亡,而国内外尚无相关文献报道。为此,本文将探讨GA联合TRAIL对人结肠癌细胞HT-29的影响,并分析其作用机制,为寻找新的治疗人结肠癌的有效方式提供实验依据。
材料与方法材料 人结肠癌细胞HT-29购自中国科学院上海细胞库。Human TRAIL蛋白购于Millipore公司。GA单体购自Biomol公司,纯度98%。McCoy’s 5A培养基购于Gibco公司。小牛血清购于杭州四季青公司。MTT和二甲基亚砜 (dimethyl sulphoxide,DMSO) 购于Amresco公司。N-乙酰半胱氨酸 (N-acetyl cysteine,NAC) 购于Calbiochem公司。DNA ladder提取试剂盒购自北京普利莱基因技术有限公司。Annexin V-FITC/PI试剂盒购自德国BM公司。c-FLIP、CHOP、DR4和DR5抗体购自Cell Signaling Technology公司。流式细胞仪为BIO-RAD公司产品。Caspase-3、-8、-9活性检测试剂盒购自碧云天公司。
细胞培养和处理HT-29细胞用含10% 小牛血清的McCoy’s 5A培养液,在37 ℃、5% CO2饱和湿度下培养。设未用任何药物处理的空白对照组、40 ng·mL-1 TRAIL单药组、1 µg·mL-1 GA单药组、40 ng·mL-1 TRAIL + 1 µg·mL-1 GA联合组、10 mmol·L-1 NAC + 40 ng·mL-1 TRAIL + 1 µg·mL-1 GA联合组。当药物处理细胞时,换含2% 小牛血清的培养液进行培养。
MTT法检测细胞生长取对数生长期细胞接种于24孔板,每孔1 mL,细胞数为每毫升2×105个,待细胞贴壁后换含2% 小牛血清的培养液培养10~12 h。分组处理细胞12 h,每组设3个平行孔。实验终止前4 h每孔加入0.5 mg·mL-1 MTT 300 μL,培养结束时倾去培养液 ,加入DMSO 500 μL。完全显色后,转移至96孔板,以酶联免疫检测仪在570/630 nm波长测光密度OD值 (OD值代表相对活细胞数)。并按下列公式计算细胞生长抑制率:
生长抑制率 (%) = (1 - OD实验组平均值/OD对照组平均值) × 100
琼脂糖凝胶电泳和AnnexinV-FITC/PI检测细胞凋亡取对数生长期细胞接种于6孔板,细胞数为 每毫升2×105个,每孔2 mL,待细胞贴壁后换含2% 小牛血清的培养液培养10~12 h,分组处理细胞12 h。一部分细胞按DNA ladder提取试剂盒说明书提取DNA。取所制的样品20 μL上样进行1% 琼脂糖凝胶电泳40 min,紫外灯下观察、摄影。一部分细胞按Annexin V-FITC/PI试剂盒说明书处理,FACS Calibur流式细胞仪检测凋亡率。
流式细胞仪测定胞内ROS水平分组处理细胞12 h,0.25% 胰蛋白酶消化,1 500 r·min-1离心5 min,收集细胞,磷酸盐缓冲液 (PBS) 洗涤2次,加PBS 200 μL重悬细胞,用DCFH-DA (终浓度为5 μmol·L-1)对胞浆内的ROS进行标记,流式细胞仪检测荧光 (激发光波长为488 nm,发射光波长为530 nm)。
Western blot检测c-FLIP、CHOP、DR4和DR5收集分组处理12 h后的各组细胞,PBS洗涤2次。按常规方法提取蛋白质,恒压进行SDS电泳分离,然后电转到PVDF膜上,分别与兔抗人c-FLIP、CHOP、DR 4和DR 5单抗4 ℃孵育过夜,再加入羊抗兔IgG- HRP室温孵育1 h,将膜洗涤干净后,加TMB显色液显色、摄影。图像分析仪对显色条带进行灰度分析。计算条带的积分吸光度值并与内参作对比。
分光光度法检测Caspase-3、-8、-9蛋白活性分组处理细胞12 h,具体操作步骤和方法按照Caspase-3、-8、-9活性检测试剂盒说明书进行。参考Chemicon公司的Caspase-3、-8、-9酶活力单位的定义,计算样品中所含有酶活力单位。
统计与分析应用Sigma Plot 12.0及Excel 2003统计软件,所有实验重复3次,结果以x± s表示,两样本差异显著性分析采用t检验,检验水准α = 0.05。
结果1 GA联合TRAIL对HT-29细胞增殖的抑制作用
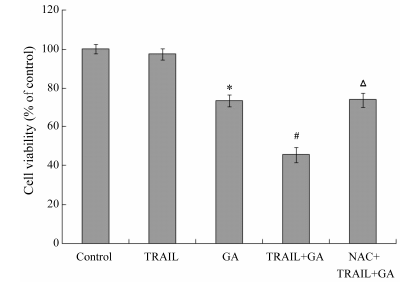
MTT结果显示 (图 1),GA与TRAIL合用对HT-29细胞增殖的抑制作用较单药更为明显,且细胞存活率显著低于单独GA作用组 (P < 0.05)。表明GA能增敏TRAIL对结肠癌HT-29细胞的生长抑制作用。而NAC明显逆转两药联合引起的细胞增殖抑制作用。
|
Figure 1 The inhibitory effect of gambognic acid (GA) combined with tumor necrosis factor related apoptosis inducing ligand (TRAIL) on viability of human colon cancer HT-29 cells was detected by MTT assay. HT-29 cells were treated with 40 ng·mL-1 TRAIL,1 µg·mL-1 GA,40 ng·mL-1 TRAIL + 1 µg·mL-1 GA or 10 mmol·L-1 NAC (N-acetyl cysteine) + 40 ng·mL-1 TRAIL + 1 µg·mL-1 GA for 12 h,respectively. Cell viabilities were calculated as the percentage of living cells in drug-treated groups compared to those in the control group (untreated with any drugs). P < 0.05 vs the control group; #P < 0.05 vs GA group; △P < 0.05 vs TRAIL + GA group; n = 3,x± s |
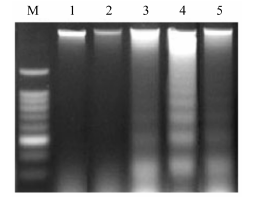
HT-29细胞经GA处理12 h后,出现了约180~200 bp间距的凋亡细胞所特有的DNA ladder现象 (图 2)。TRAIL + GA处理组条带更加清晰,说明GA能增敏TRAIL诱导的HT-29细胞凋亡作用。而NAC明显减弱GA联合TRAIL所引起的DNA损伤作用。
|
Figure 2 Agarose-gel electrophoresis for detecting DNA fragmentation in human colon cancer HT-29 cells treated for 12 h in the following groups. Lane M: DNA size marker; Lane 1: Control; Lane 2: 40 ng·mL-1 TRAIL; Lane 3: 1 µg·mL-1 GA; Lane 4: 40 ng·mL-1 TRAIL + 1 µg·mL-1 GA; Lane 5: 10 mmol·L-1 NAC + 40 ng·mL-1 TRAIL + 1 µg·mL-1 GA |
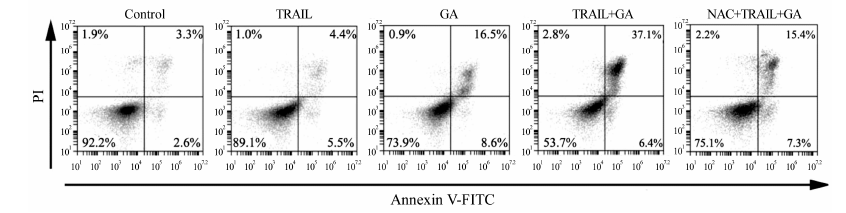
图 3中第三象限 (Annexin V-/PI- cells)、第四象限 (Annexin V+/PI-)、第一象限 (Annexin V+/PI+) 和第二象限 (Annexin V-/PI+) 分别代表活细胞、早期凋亡、晚期凋亡和坏死细胞的百分率。检测结果显示,对照组、TRAIL组、GA组HT-29细胞凋亡率分别为 (5.2 ± 1.1) %、(7.3 ± 1.9) % 和 (23.5 ± 3.4) %,GA联合TRAIL能明显促进HT-29细胞的凋亡,凋亡率达到 (45.5 ± 4.9) %。与对照组及GA单药组相比,均有统计学意义 (P < 0.05)。而NAC能明显减少GA联合TRAIL所引起的细胞凋亡,凋亡率降至 (21.8 ± 2.6) %。由此表明,GA能有效地诱导HT-29细胞的凋亡,并且两者联用可以显著提高HT-29细胞的凋亡率 (图 3)。
|
Figure 3 The apoptosis rates of human colon cancer HT-29 cells treated with 40 ng·mL-1 TRAIL or 1 µg·mL-1 GA alone or in combination or 10 mmol·L-1 NAC + 40 ng·mL-1 TRAIL + 1 µg·mL-1 GA for 12 h were detected by flow cytometry. Control: Treated without any drug |
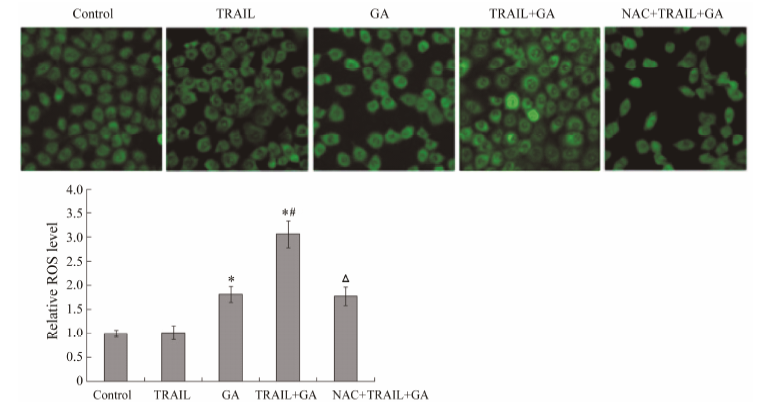
DCFH-DA进入细胞后被酯酶水解为DCFH,该物质被氧化后生成DCF,DCF发射的绿色荧光强度值可以代表细胞内ROS水平。图 4结果显示,对照组和单独TRAIL处理组的细胞胞浆荧光均较弱,经GA处理后荧光增强,TRAIL + GA组的细胞荧光最强。表明GA能诱导细胞内ROS的产生,且能增敏TRAIL诱导ROS的升高。而NAC明显拮抗两者联合所引起的ROS升高。
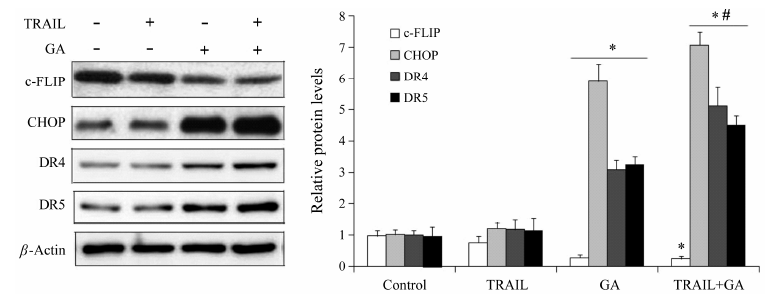
5 GA联合TRAIL引起HT-29细胞c-FLIP、CHOP、DR4和DR5蛋白表达量的变化图 5显示,与对照组相比,1 µg·mL-1 GA作用12 h后能明显下调c-FLIP的表达,显著提高CHOP、DR4和DR5的表达。40 ng·mL-1 TRAIL联合1 µg·mL-1 GA作用后能进一步下调c-FLIP表达至对照组的 (0.22 ± 0.08) 倍; 显著提高CHOP、DR4和DR5的 表达,分别是对照组的 (7.38 ± 0.41)、(5.41 ± 0.60)、(4.85 ± 0.31) 倍。而单独TRAIL对各蛋白的表达影响很弱。
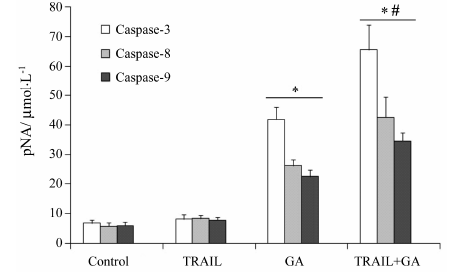
6 GA联合TRAIL引起HT-29细胞Caspase-3、-8、-9活性的变化通过比色法测定生成的对硝基苯胺 (pNA) 含量反映蛋白活性的高低。由图 6可知,在GA单独作用下,HT-29细胞的Caspase-3、-8、-9活性都有明显提高,而GA联合TRAIL组细胞Caspase-3、-8、-9活性升高更为显著,与对照组及单独用药组相比有显著性差异 (P < 0.05)。提示GA能增敏TRAIL提高Caspase-3、-8、-9的活性。
|
Figure 4 The ROS levels of human colon cancer HT-29 cells treated with 40 ng·mL-1 TRAIL or 1 µg·mL-1 GA alone or in combination or 10 mmol·L-1 NAC + 40 ng·mL-1 TRAIL + 1 µg·mL-1 GA for 12 h were detected by flow cytometry (×400). P < 0.05 vs control group; #P < 0.05 vs GA group; △P < 0.05 vs TRAIL + GA group; n = 3,x± s |
|
Figure 5 The expressions of c-FLIP,CHOP,DR4 and DR5 in human colon cancer HT-29 cells treated with 40 ng·mL-1 TRAIL or 1 µg·mL-1 GA alone or in combination for 12 h were detected by Western blotting. P < 0.05 vs control group; #P < 0.05 vs GA group; n = 3,x± s |
|
Figure 6 The relative enzyme activities of Caspase-3,-8,-9 in human colon cancer HT-29 cells treated with 40 ng·mL-1 TRAIL or 1 µg·mL-1 GA alone or in combination for 12 h were detected by colorimetric assay. P < 0.05 vs control group; #P < 0.05 vs GA group; n = 3,x± s |
TRAIL又称凋亡素2配体 (Apo-2 ligand,Apo2L),能选择性诱导肿瘤细胞凋亡,成为肿瘤治疗的研究热点。但多种肿瘤细胞株能抵抗TRAIL诱导的凋亡[2],抵抗TRAIL的机制包括死亡受体 (DR4和DR5) 表达减少、诱骗受体 (DR1和DR2) 表达增加、抑 制促凋亡因子的表达 (Caspase-3、Caspase-8、FADD、Caspase-9、Bax、Smac和细胞色素C等),上调抗凋亡因子水平 (c-Flip、NF-κB和XIAP等)[3]。针对这些机制来选择与TRAIL联合应用的药物,成为提高TRAIL疗效的重要策略。传统的化疗药物往往会产生不良反应,特别是对造血系统和免疫系统极易造成不可逆的损伤, 影响整体治疗效果。寻找安全有效、增强TRAIL抗癌效果的药物是将TRAIL投入临床应用的一个重要课题[3]。大量研究表明,天然中草药藤黄的活性成分GA是一种多靶点的抗肿瘤药物,主要通过诱导ROS升高、上调促凋亡蛋白 (Bax、P53、DIO-1和SRC-3)、下调抗凋亡蛋白 (Bcl-2、NF-κB和survivin) 及转铁蛋白受体诱导细胞发生凋亡[5, 6, 7]。藤黄酸能否增敏TRAIL诱导耐药肿瘤细胞凋亡却未见报道。本实验结果显示GA能明显增敏TRAIL对结肠癌HT-29细胞的生长抑制作用; 能促使对TRAIL耐药的HT-29细胞发生明显的细胞凋亡,与单独GA组比较,GA与TRAIL联用后凋亡细胞特有的DNA ladder现象明显增强,细胞凋亡率由 (23.5 ± 3.4) % 上升到 (45.5 ± 4.9) %。图 1~3结果显示,ROS清除剂NAC能明显减弱GA增敏TRAIL所引起的细胞生长抑制作用和细胞凋亡效应,进一步实验结果表明GA联合TRAIL作用后细胞内ROS水平明显升高,而NAC能明显逆转此过程,提示ROS的升高可能在GA增敏TRAIL抑制HT-29细胞生长和诱导凋亡中起重要作用。
近年来,国内外研究发现在TRAIL诱导多种肿瘤细胞的凋亡过程中,ROS升高会引起内质网应激 (endoplasmic reticulum stress,ERS),ERS上调其特异转录因子C/EBP同源蛋白 (C/EBP homologous protein,CHOP),而DR5是CHOP调控的重要靶基因,因此CHOP可通过上调死亡受体DR5激活Caspase蛋白酶解级联反应进而发生细胞凋亡[10, 11]。TRAIL作用的主要途径是与死亡受体DR4和DR5结合,招募FADD (Fas-associated death domain protein),并进一步激活Caspase-8,形成死亡诱导信号复合物,最后将活化信号传递并激活Caspase-3,从而发挥诱导细胞凋亡的生物学功能,这是TRAIL诱导凋亡的非线粒体途径[12, 13, 14]。本实验结果显示GA联合TRAIL能显著提高CHOP、DR4和DR5的表达,使细胞内Caspase-3、-8、-9活性显著升高。提示ROS升高激活的ERS凋亡途径和死亡受体途径在GA增敏TRAIL诱导HT-29细胞凋亡中起重要作用,与Cao[10]和Trivedi[11]等报道一致。
c-FLIP是一种凋亡抑制蛋白,可与Caspase-8竞争性结合FADD,抑制非线粒体凋亡途径的激活而抑制细胞凋亡。既往的研究发现c-FLIP的过表达与肺癌、结肠癌等肿瘤细胞对TRAIL耐药密切相关,下调c-FLIP是增强结肠癌等肿瘤细胞对TRAIL敏感性的重要措施之一[15]。本研究发现HT-29细胞内有较高的c-FLIP表达,GA联合TRAIL作用后能下调c-FLIP水平,提示c-FLIP的下调可能是GA增强TRAIL诱导HT-29细胞凋亡的机制之一。
综上所述,GA可能通过ROS升高激活ERS凋亡途径、上调DR4、DR5的表达和下调c-FLIP蛋白水平来增强人结肠癌HT-29细胞对TRAIL诱导凋亡的敏感性,提示GA可能是TRAIL良好的增敏剂,这为今后两者的联合应用治疗结肠癌提供了实验依据。后续的研究工作在阐明GA增强TRAIL抑癌分子机制的同时,将开展体内动物实验研究,为TRAIL用于临床肿瘤治疗提供更多的可靠依据。
| [1] | Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014 [J]. CA Cancer J Clin, 2014, 64: 9-29. |
| [2] | Park MH, Kim SY, Kim YJ, et al. ALS2CR7 (CDK15) attenuates TRAIL induced apoptosis by inducing phosphorylation of survivin Thr34 [J]. Biochem Biophys Res Commun, 2014, 450: 129-134. |
| [3] | Dimberg LY, Anderson CK, Camidge R, et al. On the TRAIL to successful cancer therapy? Predicting and counteracting resistance against TRAIL-based therapeutics [J]. Oncogene, 2013, 32: 1341-1350. |
| [4] | Prasad S, Pandey MK, Yadav VR, et al. Gambogic acid inhibits STAT3 phosphorylation through activation of protein tyrosine phosphatase SHP-1: potential role in proliferation and apoptosis [J]. Cancer Prev Res, 2011, 4: 1084-1094. |
| [5] | Yang LJ, Chen Y. New targets for the antitumor activity of gambogic acid in hematologic malignancies [J]. Acta Pharmacol Sin, 2013, 34: 191-198. |
| [6] | Yang LJ, Chen Y, He J, et al. Effects of gambogic acid on the activation of caspase-3 and downregulation of SIRT1 in RPMI-8226 multiple myeloma cells via the accumulation of ROS [J]. Oncol Lett, 2012, 3: 1159-1165. |
| [7] | Ishaq M, Khan MA, Sharma K, et al. Gambogic acid induced oxidative stress dependent caspase activation regulates both apoptosis and autophagy by targeting various key molecules (NF-κB, Beclin-1, p62 and NBR1) in human bladder cancer cells [J]. Biochim Biophys Acta, 2014, 1840: 3374-3384. |
| [8] | Han MA, Woo SM, Min KJ, et al. 6-Shogaol enhances renal carcinoma Caki cells to TRAIL-induced apoptosis through reactive oxygen species-mediated cytochrome c release and down-regulation of c-FLIP (L) expression [J]. Chem Biol Interact, 2015, 228: 69-78. |
| [9] | Jin HO, Lee YH, Park JA, et al. Piperlongumine induces cell death through ROS-mediated CHOP activation and potentiates TRAIL-induced cell death in breast cancer cells [J]. J Cancer Res Clin Oncol, 2014, 140: 2039-2046. |
| [10] | Cao WQ, Li XL, Zheng SY, et al. Selenocysteine derivative overcomes TRAIL resistance in melanoma cells: evidence for ROS-dependent synergism and signaling crosstalk [J]. Oncotarget, 2014, 5: 7431-7445. |
| [11] | Trivedi R, Maurya R, Mishra DP. Medicarpin, a legume phytoalexin sensitizes myeloid leukemia cells to TRAIL- induced apoptosis through the induction of DR5 and activation of the ROS-JNK-CHOP pathway [J]. Cell Death Dis, 2014, 5: e1465. |
| [12] | Sessler T, Healy S, Samali A, et al. Structural determinants of DISC function: new insights into death receptor-mediated apoptosis signaling [J]. Pharmacol Ther, 2013, 140: 186-199. |
| [13] | Azijli K, Weyhenmeyer B, Peters GJ, et al. Non-canonical kinase signaling by the death ligand TRAIL in cancer cells: discord in the death receptor family [J]. Cell Death Differ, 2013, 20: 858-868. |
| [14] | Sun T, Niu ZS, Liu XY, et al. The synergism and mechanism of action of rClone30-hDR5 in combination with TRAIL on HCC [J]. Acta Pharm Sin (药学学报), 2014, 49: 985-992. |
| [15] | Shirley S, Micheau O. Targeting c-FLIP in cancer [J]. Cancer Lett, 2013, 332: 141-150. |
 2015, Vol. 50
2015, Vol. 50


