2. 扬州大学临床医学院 妇产科, 江苏 扬州 225001;
3. 扬州大学医学院临床医学系, 江苏 扬州 225001;
4. 江苏省中西医结合老年病防治重点实验室, 江苏 扬州 225001
2. Department of Gynaecology and Obstetrics, Clinical Medical College, Yangzhou University, Yangzhou 225001, China;
3. Department of Clinical Medicine, School of Medicine, Yangzhou University, Yangzhou 225001, China;
4. Jiangsu Key Laboratory of Integrated Traditional Chinese and Western Medicine for Prevention and Treatment of Senile Diseases, Yangzhou 225001, China
前列腺癌 (prostate cancer,PCa) 是男性最常见的恶性肿瘤之一,在美国男性癌症致死原因中居 于第二位[1],在我国其发病率和死亡率呈明显上升态势[2]。雷公藤内酯醇 (triptolide,TP) 是中药雷公藤 (Tripterygium wilfordii) 的主要活性成分,在肿瘤治疗方面的活性近年来倍受关注,其前药PG490-88 (TP的14-琥珀酰钠盐) 作为抗实体瘤药物曾进入临床I期试验[3]。TP的抗肿瘤活性涉及多种细胞信号通路及蛋白调控过程,如NF-κB、PI3K和HSP70等[4],且已在乳腺癌[5]和胰腺癌[6]等细胞实验及肿瘤异种移殖实验中得到证实。作者前期研究及一些文献也发现,TP对前列腺癌细胞的生长有强烈的抑制作用[7, 8, 9],该作用不依赖于p53和MAPK,其具体机制仍不完全明确,有待进一步探索。
雄激素信号通过雄激素受体 (AR) 在前列腺癌的发生和发展中发挥关键作用,二者结合后形成AR二聚体并转移至核内,结合于DNA作为转录因子参与多种雄激素依赖基因 (如PSA基因) 表达的调节,从而调控包括前列腺在内的多种组织生长及发育[10]。雄激素阻断治疗 (androgen deprivation therapy,ADT) 是当前最常用的前列腺癌治疗方法[11],此法可通过降低体循环中睾酮浓度迅速抑制激素依赖性前列腺癌细胞,但最终会导致几乎全部的患者发展为去势抵抗性前列腺癌 (castrate resistant prostate cancer,CRPC)[11, 12]。CRPC预后很差,目前尚缺乏有效的治疗手段。据报道,细胞内AR活性上调是CRPC细胞增殖的关键原因,恩扎鲁胺 (enzalutamide) 作为AR的不可逆阻断剂,已于2012年被FDA批准上市用于CRPC的治疗[13]。因此,抑制AR活性已经成为治疗CRPC的靶点[11]。
目前针对AR的调控研究也成为抗前列腺癌尤其是抗CRPC研究的热点[14]。NF-κB在前列腺癌细胞内表达上调,其机制可能与前列腺癌中常见的PTEN缺失造成的PI3K/AKT通路的过度活化有关。NF-κB的过表达可能是AR转录活性增强的重要原因[15]。尽管有报道称TP可抑制多发性骨髓瘤细胞中NF-κB的表达[16],然而,TP是否可抑制PTEN缺失的前列腺癌中NF-κB过表达,进而抑制AR的转录活性,尚未见报道。
因此,本研究拟通过观察TP对人雄激素依赖性前列腺癌细胞株LNCaP内AR表达、转录活性及PI3K/AKT/NF-κB通路的影响,旨在探讨TP抑制前列腺癌细胞增长的可能机制。本研究发现TP显著抑制LNCaP细胞中AR的活性,且该抑制作用至少部分是通过转录调控实现的,PI3K/AKT/NF-κB通路活性的下调可能是TP对AR活性抑制的机制。
材料与方法 主要试剂LNCaP细胞购自中国科学院典型培养物保藏委员会细胞库; 雷公藤内酯醇 (纯度 > 98%,四川维克奇生物科技有限公司); 胎牛血清 (Clark公司); RPMI-1640培养基 (Hyclone公司); opti-MEM培养基 (Gibco公司); 小量胶回收试剂盒 (Axygen公司); 反转录试剂盒 (宝生物公司); Sybr Green实时定量试剂盒 (罗氏公司); Trizol试剂 (Invitrogen公司); DNAiso试剂盒、PrimeSTAR®HS DNA聚合酶、感受态大肠杆菌DH5α及taq DNA聚合酶 (Takara公司); FuGene®HD试剂、细胞裂解液及双荧光素酶活性检测试剂盒 (Promega公司); NF-κB抑制剂 (BAY 11-7082)、BCA蛋白浓度测定试剂盒及抗NF-κB抗体 (碧云 天公司); 抗AR抗体、抗PTEN抗体及抗PI3K抗体(Cell Signaling Technology公司); 抗pAKT (Ser473和Thr308) 抗体 (Abgent公司); 抗GAPDH抗体购自康成生物公司; 抗β-actin抗体、HRP-山羊抗兔二抗和HRP-山羊抗小鼠二抗 (中杉金桥公司)。
仪器7500实时定量PCR仪 (ABI公司); Synergy 2荧光定量酶标仪 (BioTech公司); FluorChem FC2 (Alpha Innotech公司)。
细胞培养LNCaP细胞培养于含10% 胎牛血清的RPMI-1640培养基,在37 ℃、5% CO2的饱和湿度环境下培养。
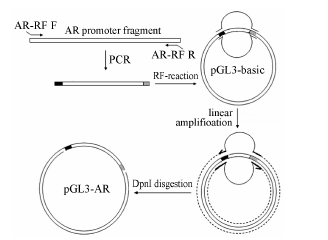
启动子报告基因载体的构建及双荧光素酶报告基因实验采用RF克隆法 (restriction-free cloning) 将AR基因启动子片段克隆至pGL3-basic质粒来构建报告基因载体 (图 1)。以人前列腺癌LNCaP细胞的基因组DNA为模板,分别以AR-RF F0、AR-RF F1和AR-RF F2为上游引物,AR-RF R为共同下游引物(引物序列见表 1,引物各含有25 bp的底物片段序列和25 bp pGL3-basic质粒待插入序列,大写字母为载体互补序列,小写字母为AR启动子互补序列),扩增出三段不同长度的AR基因启动子片段,PCR产物电泳后进行胶回收纯化。采用此产物作为RF克隆引物并进行RF克隆。热激法将RF克隆产物转化至感受态大肠杆菌DH5α中,使用Promega公司提供的引物序列 (RV3和GL2) 进行菌落PCR鉴定,对阳性菌落进行测序后,培养阳性菌落并提取质粒。含不同长度AR 5'端非翻译区的质粒分别命名为pGL3-AR(-1767/+265)、pGL3-AR(-1378/+265) 和pGL3-AR(-965/+265)。
|
Figure 1 The flow chat of built pGL3-AR using restriction-free (RF) cloning method. Step 1: Using LNCaP genomic DNA as a template,AR-RF F (AR-RF F0,AR-RF F1 and AR-RF F2) and AR-RF R as primers,to amplify the product with pGL3-basic sequence at both of the end,which will act as primers of RF cloning. Step 2: Primers of RF cloning combine with pGL3- basic and conduct linear amplification. Step 3: Degradate the methylated female plasmid using DpnI,and obtain the recombinant plasmid pGL3-AR [pGL3-AR(-1767/+265),pGL3-AR(-1378/+265) and pGL3-AR(-965/+265)] |
|
|
Table 1 Primers and sequence |
更换LNCaP细胞培养基为opti-MEM培养基后,转染质粒至LNCaP细胞中。于37 ℃孵箱培养6 h后换RPMI-1640 (含10% FBS) 培养基,孵箱培养过夜,用TP (0、10、30和50 nmol·L-1) 处理24 h后裂解细胞,并检测其荧光素酶活性,计算荧火虫荧光素酶的化学发光值与内参海肾荧光素酶化学发光值的比值 (F/R)。
实时定量PCR提取TP (0、10、30和50 nmol·L-1,n = 3) 处理48 h的LNCaP细胞总RNA,反转录后用Sybr Green法进行qRT-PCR检测AR、PART1和PSA的mRNA表达量。所用引物序列见表 1。
Western blot分析收集分别用TP (0、10、30和50 nmol·L-1,n = 3) 或TP加NF-κB抑制剂处理48 h后的LNCaP细胞,提取细胞总蛋白,采用BCA法定量蛋白浓度,以30 μg上样于10% SDS/PAGE凝胶并电泳,转移蛋白至PVDP膜,5% 脱脂奶粉封闭1 h; 按照抗体说明书建议稀释一抗后4 ℃摇床孵育过夜,以GAPDH抗体或β-actin作为内参,TBST洗膜10 min×3次; 加 入对应的二抗室温摇床孵育l h,ECL显色,用化学发光凝胶成像系统成像。
统计学分析数据统计分析采用GraphPad Prism 5统计软件,检测结果以均数 ± 标准差表示,组内比较采用One-way ANOVA检测,P < 0.05为差异有统计学意义。
结果 1 TP抑制LNCaP细胞中的AR信号活性TP处理LNCaP细胞48 h后,qRT-PCR结果显 示AR的mRNA水平出现剂量依赖的显著下调 (图 2A)。Western blot结果显示,处理LNCaP细胞48 h后,TP对AR的蛋白表达也表现出剂量依赖的抑制作用 (图 2B)。PART1和PSA均是AR信号的下游靶分子[17],TP处理48 h后PART1和PSA的mRNA水平也出现了明显下调 (图 2C和2D)。这些结果提示,TP作用于LNCaP细胞后,细胞内AR表达显著下降,该作用可能是通过对AR的mRNA水平的影响实现的。

|
Figure 2 Effect of triptolide (TP) on the expression of androgen receptor (AR) and its target gene. After 48 h of treating LNCaP cells with triptolide (0-50 nmol·L-1),the changes of mRNA level of AR (A),protein level of AR (B),mRNA level of AR target gene PART1 (C),and mRNA level of prostate specific antigen (PSA) (D). n = 3,± s. P < 0.05,**P < 0.01,***P < 0.001 vs 0 nmol·L-1 group |
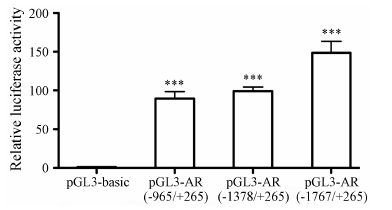
转录水平调控是影响mRNA水平的主要原因。为明确TP对AR的调控作用机制,本研究采用启动子报告基因载体,研究TP作用后AR的转录水平的变化。采用RF克隆法构建了系列AR启动子报告基因载体,经菌落PCR和测序鉴定,插入序列正确且无突变 (结果未显示)。将上述启动子报告基因转染至LNCaP细胞内,培养36 h后检测荧光素酶活性,结果表明这些启动子片段均有活性 (图 3)。
|
Figure 3 The relative luciferase activity of AR series promoter reporter plasmids. AR series promoter reporter plasmids [pGL3-AR (-1767/+265),pGL3-AR(-1378/+265) and pGL3-AR (-965/+265)] were trasnfected into LNCaP cells. After 36-hour incubation,the relative luciferase activity changes of cell lysates. n = 3,x± s. ***P < 0.001 vs pGL3-basic group |
TP处理转染启动子报告基因载体的LNCaP细胞24 h后,裂解细胞并检测荧光素酶的活性,结果如图 4所示。随着TP浓度增加,荧光素酶的活性逐渐下降,表明雷公藤内酯醇能在转录水平下调AR的表达。在构建的系列启动子报告基因中,pGL3-AR(-1767/+265)、pGL3-AR(-1378/+265) 和pG L3-AR(-965/+265) 在TP的作用下荧光下调倍数接近 (~50%),提示参与TP调控AR转录活性的作用位点分布在-965/+265 pb内。
3 TP可能通过NF-κB途径抑制AR转录活性TP处理48 h后,Western blot检测结果表明,LNCaP细胞中 NF-κB (图 5) 表达下调,该作用呈剂量依赖性。同时检测了NF-κB上游的PTEN、PI3K和pAKT的表达情况。在有或无TP处理的条件下,LNCaP中均检测不到PTEN的表达 (图 5),这与LNCaP细胞中PTEN缺失的报道相一致[18]。TP对PI3K、pAKT Ser 473和pAKT Thr 308的表达表现了剂量依赖的抑制作用 (图 5),该结果提示,TP对PI3K和pAKT的抑制作用可能导致NF-κB下调,进而下调了AR的转录活性。使用NF-κB抑制剂作用于T P处理的LNCaP细胞后,Western blot结果 (图 6) 表明,在NF-κB抑制剂存在情况下TP对AR的表达无影响,说明TP是通过NF-κB途径抑制AR转录活性的。

|
Figure 4 Efect of TP on the relative luciferase activity of AR series promoter reporter plasmids. After 24 h treatment by TP,the relative luciferase activity of lysates belong to LNCaP cell transfected pGL3-basic,pGL3-AR(-1767/+265),pGL3-AR(-1378/ +265) and pGL3-AR(-965/+265),separately. n = 3,x± s. ***P < 0.001 vs 0 nmol·L-1 group |

|
Figure 5 Changes of protein levels of NF-κB,PI3K and pAKT after treating LNCaP cells for 48 h with TP |

|
Figure 6 Expression of AR after treated by TP and/or NF-κB inhibitor. LNCaP cells were treated with TP and/or BAY 11-7082 for 48 h. The changes of AR were analyzed by Western blot assay |
TP是从雷公藤中提取出的主要活性成分之一,具有免疫抑制、抗炎、抗生育等生物活性。AR与前列腺癌的发生及发展密切相关,CRPC细胞增殖的关键原因是AR的过度表达[11],因此AR是前列腺癌治疗的关键靶点。本研究表明,AR的下游分子PART1的mRNA水平在TP的作用下下调,提示了AR的活性可能受TP的抑制。对AR的表达水平研究发现,TP在mRNA和蛋白水平均抑制AR。这些结果提示,TP对AR mRNA水平的调节至少参与对AR活性的抑制作用。鉴于转录调控是影响mRNA水平的关键因素,本研究从转录调控的水平对TP的作用机制进行了进一步研究。
为研究TP是否从转录水平调控AR,本研究构建了系列AR启动子报告基因。酶切连接法是构建启动子报告基因最常用的方法,但目的片段限制性内切酶的作用位点限制了该方法的应用。本研究采用RF克隆法[19, 20],并在传统的RF克隆法上进行了改进,在两步PCR反应中的第二步采用了touch down PCR方法,提高了扩增片段的特异性,成功获得了pGL3- AR(-1767/+265)、pGL3-AR(-1378/+265) 和pGL3-AR (-965/+265) 质粒。双荧光素酶报告基因实验表明TP显著下调了AR启动子的活性,该结果提示,TP对AR转录活性的抑制作用是下调AR的机制之一。在30 nmol·L-1 TP作用下,pGL3-AR(-1767/+265)、pGL3-AR (-1378/+265) 和pGL3-AR(-965/+265) 的相对荧光素酶活性并无显著性差异 (P > 0.05),提示-965/+265 pb内可能是TP对AR转录转录活性调控的关键区域。
NF-κB与前列腺癌的发展有密切关系,其过表达与前列腺癌细胞在去除雄激素条件下增殖有关[15]。Zhang等[15]研究表明前列腺癌中NF-κB的表达与AR的表达呈相关性,NF-κB通过结合于AR 5' 端非编码区上调AR的转录活性。NF-κB受其上游的PI3K/AKT通路调控,前列腺癌细胞中常见的PTEN缺失导致了PI3K/AKT通路的持续激活[21]。研究表明PI3K/AKT通路抑制剂能有效减少前列腺癌细胞AR基因表达[22]。本实验结果显示TP可显著下调PI3K、pAKT和NF- κB的蛋白水平,提示TP可能通过对PI3K的蛋白表达和AKT的磷酸化活化的抑制作用导致了NF-κB的下调。同时,在使用NF-κB抑制剂作用于LNCaP细胞后的结果表明,TP是通过NF-κB途径抑制AR转 录活性的。但现有报道尚未证实NF-κB在AR启动子上的确切结合位点。研究结果发现,TP对pGL3-AR (-965/+265) 的抑制作用强,提示调控AR转录活性的作用位点分布在 -965/+265 bp内。Zhang等[15]染色体免疫共沉淀结果显示AR 5' 端非编码区可结合NF- κB,其启动子分析计算结果提示-965/+265 bp内可能存在4个NF-κB的结合位点。
值得注意的是,除NF-κB外,还有多种转录因子参与了AR的调控,其中包括p53、CREB、Myc、c-Jun和Sp1等[23]。作为胞内重要的抑癌基因,p53结合于AR启动子-488/-469 bp,其作用范围在pGL3-AR (-965/+265) 内。尽管作者前期研究表明,在p53阳性的LNCaP和p53阴性的PC-3细胞中,TP均表现出对肿瘤生长的抑制作用,提示TP抑制肿瘤的生长可能不完全依赖于p53[7],但对LNCaP细胞AR的调控作用中,p53是否发挥相关作用仍需进一步研究。
综上所述,本研究结果表明TP在转录水平下调前列腺癌细胞AR表达,其作用机制可能与PI3K/ AKT/NF-κB通路有关,但其对AR的调控作用在其抑制前列腺癌细胞生长活性中的效果仍需进一步研究。本研究为进一步探索TP抗前列腺癌的作用机制和开发前列腺癌治疗方法奠定了实验基础。
| [1] | Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014 [J]. CA Cancer J Clin, 2014, 64: 9-29. |
| [2] | Bi XG, Han RQ, Zhou JY, et al. An analysis on incidence and mortality of prostate cancer in China, 2009 [J]. China Cancer (中国肿瘤), 2013, 22: 417-422. |
| [3] | Fidler JM, Li K, Chung C, et al. PG490-88, a derivative of triptolide, causes tumor regression and sensitizes tumors to chemotherapy [J]. Mol Cancer Ther, 2003, 2: 855-862. |
| [4] | Liu Q. Triptolide and its expanding multiple pharmacological functions [J]. Int Immunopharmacol, 2011, 11: 377-383. |
| [5] | Li J, Liu R, Yang Y, et al. Triptolide-induced in vitro and in vivo cytotoxicity in human breast cancer stem cells and primary breast cancer cells [J]. Oncol Rep, 2014, 31: 2181-2186. |
| [6] | Zhang T, Hamza A, Cao X, et al. A novel Fsp90 inhibitor to disrupt Hsp90/Cdc37 complex against pancreatic cancer cells [J]. Mol Cancer Ther, 2008, 7: 162-170. |
| [7] | Li W, Liu Y, Li XX, et al. MAPKs are not involved in triptolide-induced cell growth inhibition and apoptosis in prostate cancer cell lines with different p53 status [J]. Planta Med, 2011, 77: 27-31. |
| [8] | Tamgue O, Chai C. Triptolide inhibits histone methyltransferase EZH2 and modulates the expression of its target genes in prostate cancer cells [J]. Asian Pac J Cancer Prev, 2013, 14: 5663-5669. |
| [9] | Huang W, He T, Chai C, et al. Triptolide inhibits the proliferation of prostate cancer cell and downregulates SUMO-specific protease 1 expression [J]. PLoS One, 2012, 7: e37693. |
| [10] | Koochekpour S. Androgen receptor signaling and mutations in prostate cancer [J]. Asian J Androl, 2010, 12: 639-657. |
| [11] | Sharifi N. Mechanisms of androgen receptor activation in castration-resistant prostate cancer [J]. Endocrinology, 2013, 154: 4010-4017. |
| [12] | Tilki D, Evans CP. The changing landscape of advanced and castration resistant prostate cancer: latest science and revised definitions [J]. Canadian J Urol, 2014, 21: 7-13. |
| [13] | El-Amm J, Patel N, Freeman A, et al. Metastatic castration- resistant prostate cancer: critical review of enzalutamide [J]. Clin Med Insights Oncol, 2013, 7: 235-245. |
| [14] | Mitchell T, Ramos-Montoya A, Di Antonio M, et al. Downregulation of androgen receptor transcription by promoter G-Quadruplex stabilization as a potential alternative treatment for castrate-resistant Prostate cancer [J]. Biochemistry, 2013, 52: 1429-1436. |
| [15] | Zhang L, Altuwaijri S, Deng F, et al. NF-kappa B regulates androgen receptor expression and prostate cancer growth [J]. Am J Pathol, 2009, 175: 489-499. |
| [16] | Yinjun L, Jie J, Yungui W. Triptolide inhibits transcription factor NF-kappaB and induces apoptosis of multiple myeloma cells [J]. Leuk Res, 2005, 29: 99-105. |
| [17] | Lin B, White JT, Ferguson C, et al. PART-1: a novel human prostate-specific, androgen-regulated gene that maps to chromosome 5q12 [J]. Cancer Res, 2000, 60: 858-863. |
| [18] | Calastretti A, Gatti G, Quaresmini C, et al. Down-modulation of Bcl-2 sensitizes PTEN-mutated prostate cancer cells to starvation and taxanes [J]. Prostate, 2014, 74: 1411-1422. |
| [19] | van den Ent F, Löwe J. RF cloning: a restriction-free method for inserting target genes into plasmids [J]. J Biochem Biophys Methods, 2006, 67: 67-74. |
| [20] | Yang F, Zhang S, Tang W, et al. Identification of the orotidine- 5'-monophosphate decarboxylase gene of the oleaginous yeast Rhodosporidium toruloides [J]. Yeast, 2008, 25: 623-630. |
| [21] | Marques RB, Aghai A, de Ridder CM, et al. High efficacy of combination therapy using PI3K/AKT inhibitors with androgen deprivation in prostate cancer preclinical models [J]. Eur Urol, 2015, 67: 1177-1185. |
| [22] | Liu L, Dong X. Complex impacts of PI3K/AKT inhibitors to androgen receptor gene expression in prostate cancer cells [J]. PLoS One, 2014, 9: e108780. |
| [23] | Shiota M, Yokomizo A, Naito S. Increased androgen receptor transcription: a cause of castration-resistant prostate cancer and a possible therapeutic target [J]. J Mol Endocrinol, 2011, 47: R25-R41. |
 2015, Vol. 50
2015, Vol. 50


