2. 中国医学科学院、北京协和医学院药物研究所, 国家药物筛选中心, 北京 100050
2. National Centre for Pharmaceutical Screening, Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
紫杉醇 (paclitaxel,PTX) 是从红豆杉科植物红豆杉的干燥根、枝叶及树皮中提取的一种二萜类生物碱。大量研究表明,紫杉醇对多种恶性肿瘤有明显的抗癌活性,主要适用于卵巢癌、乳腺癌、肺癌、食道癌、黑色素瘤、淋巴瘤和脑瘤等治疗,对晚期卵巢癌的效果最好[1, 2, 3, 4]。
紫杉醇在水中的溶解度极低,为了增加其溶解性,便于临床给药,以聚氧乙烯蓖麻油 (Cremophor EL,CrEL) 与乙醇等体积比作为溶剂制成临床使用的紫杉醇注射剂[5, 6]。但CrEL会引起严重的过敏反应和神经毒性等不良反应,还会浸出聚氯乙烯输液器中的增塑剂而引起毒性,这些缺点大大降低了紫杉醇的作用疗效,缩小了其应用范围[7, 8]。因此,研发紫杉醇的新型载药体系和剂型,减轻因溶剂引起的毒副作用,对于临床用药具有非常重要的意义。含腙键类聚合物载药胶束具有水溶性好、灵敏度高和选择性强的优势[9],用于载紫杉醇pH敏感聚合物胶束国内外尚未见报道。
本课题组前期将紫杉醇载入以主链含腙键的聚乙二醇-聚己内酯 [poly(ethylene glycol)-poly(caprolactone),mPEG-PCL]嵌段的共聚物胶束中,制备pH敏感聚合物胶束mPEG-PCL-PTX。通过对mPEG-PCL-PTX粒径及其分布、临界胶束浓度、载药量、体外药物释放等性质的研究已经证实,该紫杉醇pH敏感聚合物胶束符合药用要求。在此基础上通过体外细胞实验研究空白聚合物胶束的体外毒性,以及该载药胶束mPEG- PCL-PTX对人肺癌A549细胞增殖和凋亡的影响,为其应用于临床抗肿瘤提供理论基础。
材料与方法 材料肺癌A549细胞由中国医学科学院药物 研究所国家药物筛选中心提供; 紫杉醇 (大连美仑生物技术有限公司,批号: 7164,纯度> 99%); 紫杉醇载药胶束 (mPEG-PCL-PTX) 由河南大学药学院药物制剂教研室宋仕永老师制备并提供,mPEG-PCL-PTX平均粒径为 (109.92 ± 2.3) nm,分布较为均匀 (PDI为0.099 ± 0.007),临界胶束质量浓度为2.88×10-4 mg·mL-1,载药量为 (2.7 ± 0.2) %,符合制剂学要求。
DMEM高糖培养基、0.25% 胰蛋白酶 (美国Gibcol公司); 新生牛血清 (杭州四季青生物工程公司); MTT (美国Amresco公司); TransZol裂解液,逆转录试剂盒 (北京全式金生物公司); PCR扩增试剂盒,BCA蛋白定量试剂盒 (北京索莱宝科技有限公司)。兔抗鼠Bax、Bcl-2、β-actin抗体、辣根过氧化物酶 (HRP) 标记羊抗兔IgG (美国Cell Signaling Technology公司)。
细胞培养取A549细胞,培养于含10% 胎牛血清的高糖DMEM培养液中,于37 ℃,5% CO2的培养箱中培养,3天传代1次,取对数生长期细胞进行实验。
实验分组与给药实验分6组,分别是空白对 照组、材料对照组 (mPEG-PCL)、阳性对照组 (PTX 1 500 μg·L-1)、mPEG-PCL-PTX实验组 (1 500、15、0.15 μg·L-1)。取对数生长期A549细胞,调节细胞数为5×104个/mL,接种于6孔或96孔细胞培养板中,37 ℃、5% CO2培养箱中培养24 h,实验组更换含mPEG-PCL-PTX分别为1 500、15、0.15 μg·L-1的培养液,阳性对照组更换含PTX为1 500 μg·L-1的培养液,材料对照组每孔加入终质量浓度为1 500 μg·L-1 的mPEG-PCL,空白对照组换完全培养液。
倒置显微镜观察细胞形态加药后培养48 h,于倒置显微镜下观察细胞形态。
MTT法检测mPEG-PCL-PTX对A549细胞生长的影响取对数生长期A549细胞,调节细胞数为5×104个/mL,接种于96孔细胞培养板,每孔100 μL,在37 ℃、5% CO2培养箱中培养24 h后,各组分别经加药处理培养48 h,每孔加入MTT 10 μL,继续培 养4 h。弃去上清液,每孔加入DMSO 100 mL,振荡10 min后,使用酶标仪在570 nm处检测吸光度 (OD),计算细胞抑制率。
流式细胞仪检测细胞周期取对数生长期A549细胞,调节细胞数为5×104个/mL,接种于6孔细胞培养板,37 ℃、5% CO2培养箱中培养24 h后,更换相应浓度药物处理,48 h后收集细胞,弃上清液后加入PBS混合均匀后滴入预冷的75% 乙醇中,4 ℃固定过夜。将固定液离心后弃上清,加入PI混合染液500 μL,染色15 min,过300目筛网后上机检测。
Hoechst 33342/PI双染检测细胞凋亡 取对数生长期的细胞消化后制成细胞悬液,调节细胞数为5×104个/mL,接种于96孔板中,每孔100 μL。细胞经加药处理48 h后弃去上清液,加入预先配制好的双染试剂100 μL,4 ℃孵育30 min。染色后用PBS洗涤1次,于荧光显微镜下观察。
RT-PCR检测Bcl-2、Bax和Caspase-3 mRNA取A549细胞,经相应药物处理48 h后,收集细胞,应用Trizol试剂提取细胞总RNA。利用RT-PCR试剂盒扩增Bcl-2、Bax和Caspase-3 mRNA: Bcl-2- forward primer: 5'-ACGAGTGGGATGCGGGAGA-3',reverse primer: 5'-CCAGGAGAAATCAAACAGAGG C-3',产物长度为560 bp; Bax-forward primer: 5'-GG ATGCGTCCACCAAGAA-3',reverse primer: 5'-TGT CCCGAAGGAGGTTTATT-3',产物长度为545 bp; Caspase-3-forward primer: 5'-TTGTGGAATTGATGC GTGAT-3',reverse primer: 5'-TTCTGTTGCCACCTTT CG-3',产物长度为452 bp。β-actin为内参,forward primer: 5'-TGACGTGGACATCCGCAAAG-3',reverse primer: 5'-CTGGAAGGTGGACAGCGAGG-3',产物长度为317 bp。
扩增条件Bcl-2: 94 ℃ 5 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,38个循环,72 ℃ 10 min; Bax: 94 ℃ 5 min,94 ℃ 30 s,53 ℃ 30 s,72 ℃ 30 s,38个循环,72 ℃ 10 min; Caspase-3: 94 ℃ 5 min,94 ℃ 30 s,51 ℃ 30 s,72 ℃ 30 s,38个循环,72 ℃ 10 min; β-actin: 94 ℃ 5 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,38个循环,72 ℃ 10 min。
Western blot检测Bcl-2、Bax蛋白表达收集相应处理后的A549细胞,加入RIPA细胞裂解液,冰上裂解2 h,超声匀浆提取细胞总蛋白。总蛋白经10% SDS-PAGE电泳分离后,转移至PVDF膜上,室温下5% 脱脂牛奶封闭2 h,加入一抗4 ℃孵育过夜; TBST漂洗7次后,加入二抗,室温孵育2 h,TBST漂洗7次,通过ECL试剂盒进行显影检测。用多色荧光化学发光仪器分析。
统计学处理所有数据均采用SPSS17.0应用软件进行统计学分析。计量资料数据用x± s表示,组间计量资料的比较均采用单因素方差分析,以P < 0.05为差异有统计学意义。
结果 1 mPEG-PCL-PTX对肺癌A549细胞生长增殖的影响倒置显微镜下显示,空白对照组和材料对照组细胞生长状态良好,细胞光晕明显、立体感强,细胞向四周伸展。紫杉醇阳性对照组和mPEG-PCL-PTX各组细胞生长状态不佳,细胞收缩变圆,光晕基本消失,细胞量明显减少,呈现出明显的细胞增殖抑制和细胞凋亡作用 (图 1A)。
MTT结果显示,材料对照组细胞存活率与空白对照组相比无差异,说明共聚物mPEG-PCL无细胞毒性。mPEG-PCL-PTX可剂量依赖性地抑制A549细 胞生长,与材料对照组相比,差异有统计学意义 (图 1B)。
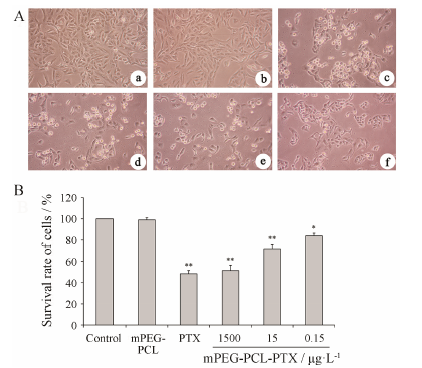
|
Figure 1 Cell growth and proliferation analysis. A: The effects of mPEG-PCL-PTX on morphology of A549 cells. a: Control group; b: mPEG-PCL group; c: PTX group; d: mPEG-PCL-PTX 1 500 μg·L-1; e: mPEG-PCL-PTX 15 μg·L-1; f: mPEG-PCL-PTX 0.15 μg·L-1. Magnification,200×; B: Effect of mPEG-PCL- PTX on cell proliferation. Cells were treated with different concentrations of mPEG-PCL-PTX and inhibitory ability of cells was detected by MTT assay. n = 3,x± s. P < 0.05,**P < 0.01 vs mPEG-PCL group |
细胞周期结果显示,材料对照组与空白对照组各期细胞分布相一致; mPEG-PCL-PTX作用48 h,可以影响A549细胞周期分布,与材料对照组相比,随着药物浓度的增加,G2/M期细胞比例占总细胞的比例增加,G1期细胞比例下降,S期比例未发生明显改变,其中,mPEG-PCL-PTX 高剂量组和PTX阳性对照组变化明显,差异显著 (P < 0.05),提示A549细胞被阻滞于G2/M期。见表 1。
|
|
Table 1 Effect of mPEG-PCL-PTX on cell cycles distribution in A549 cells deteced by flow cytometry. n = 3,x± s. P < 0.05 vs mPEG-PCL group |
Hoechst 33342可以穿透细胞膜,染色后凋亡细胞荧光会比正常细胞明显增强。碘化丙啶不能穿透细胞膜,对于具有完整细胞膜的正常细胞或凋亡细胞不能染色。故经过Hoechst 33342/PI双染后,正常细胞为弱红色荧光+弱蓝色荧光,凋亡细胞为弱红色荧光+强蓝色荧光。Hoechst/PI染色结果显示,空白对照组和材料对照组细胞呈均匀的淡蓝色荧光和淡红色荧光; PTX阳性对照组和mPEG-PCL-PTX各组细胞呈强蓝色荧光和弱红色荧光,且蓝色荧光随着药物浓度的增加而加强。见图 2。
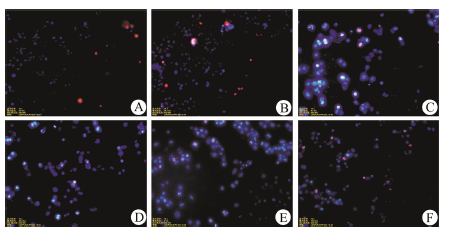
|
Figure 2 Figure 2 The effect of mPEG-PCL-PTX on the apoptosis. The scanning images show the morphology of cell apoptosis by staining with Hoechst 33342/PI. A: Control group; B: mPEG- PCL group; C: PTX group; D:mPEG-PCL-PTX 1 500 μg·L-1; E: mPEG-PCL-PTX 15 μg·L-1; F: mPEG-PCL-PTX 0.15 μg·L-1 |
实验结果显示,材料对照组与空白对照组Caspase-3 mRNA的表达较低,两组无明显差异; 紫杉醇载药胶束mPEG-PCL-PTX可明显增加Caspase-3 mRNA的表达并呈浓度依赖性,与材料对照组比较,差异有统计学意义 (P < 0.01)。其中,mPEG-PCL-PTX高剂量组Caspase-3 mRNA表达较PTX阳性药对照组增加更明显,此结果提示该载药胶束可能较紫杉醇本身对肺癌细胞具有更明显的促凋亡作用。见图 3。

|
Figure 3 Effect of mPEG-PCL-PTX on expression of Caspase-3 mRNA detected by RT-PCR. 1: Control group; 2: mPEG-PCL group; 3: PTX group; 4: mPEG-PCL-PTX 1 500 μg·L-1; 5: mPEG-PCL-PTX 15 μg·L-1; 6: mPEG-PCL-PTX 0.15 μg·L-1. n = 3,x± s. **P < 0.01 vs mPEG-PCL group |
实验结果显示,mPEG-PCL-PTX可明显增加促凋亡基因Bax mRNA和蛋白表达,明显减少抑凋亡基因Bcl-2 mRNA和蛋白的表达,提示载药胶束mPEG- PCL-PTX呈现出抑制A549细胞增殖,促进A549细胞凋亡的作用。见图 4。
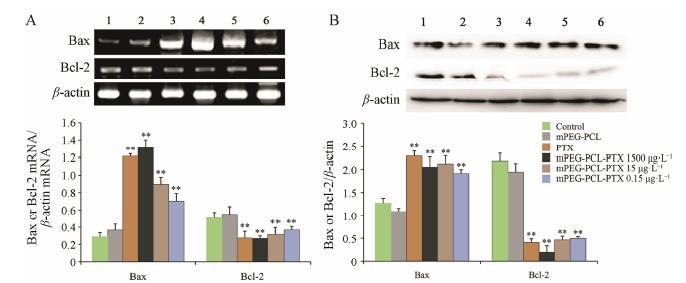
|
Figure 4 Effect of mPEG-PCL-PTX on expression of Bax and Bcl-2 mRNA and protein. A: Effect of mPEG-PCL-PTX on Bax and Bcl-2 mRNA detected by RT-PCR; B: Effect of mPEG-PCL-PTX on Bax and Bcl-2 protein measured by Western blot. 1: Control group; 2: mPEG-PCL group; 3: PTX group; 4: mPEG-PCL-PTX 1 500 μg·L-1; 5: mPEG-PCL-PTX 15 μg·L-1; 6: mPEG-PCL-PTX 0.15 μg·L-1. n = 3. **P < 0.01 vs mPEG-PCL group |
临床常用的抗肿瘤药物紫杉醇溶解性能差、毒副作用高[10, 11],为了增强紫杉醇的溶解性,减少毒副作用,提高药效,人们提出了很多解决的方法。其中,聚合物胶束在增溶疏水性药物的应用方面具有显著的优势,近年来受到广泛重视[12],亲水性的外壳增强了其在水中的溶解性[13],良好的热力学、动力学稳定性使得胶束在体内能够稳定存在从而实现药物在体内的长循环; 另外,聚合物胶束较小的体积不但可以有效避免被网状内皮细胞 (reticulo-endothelial system,RES) 吸收,以及肝、肾、脾等器官的排泄,而且还可以通过被动扩散作用蓄积于血管渗透性较高的肿瘤组织部位,提高药物作用率[14, 15, 16]。
本研究将临床上已经证实的抗肿瘤药物紫杉醇载入以主链含腙键的聚乙二醇-聚己内酯嵌段的共聚物中制备成紫杉醇pH敏感载药胶束mPEG-PCL- PTX。人体血液的pH值为7.4左右,而肿瘤、炎症等病变组织周围的pH值一般低于正常的人体组织 (通常pH 5~6)。紫杉醇pH敏感载药胶束在pH为7.4的环境中比较稳定; 在酸性条件下胶束腙键发生水解使主链断裂,胶束结构被破坏。因此,当载药胶束进入人体后,在人体血液系统循环时药物很少释放,一旦载药胶束通过被动靶向作用到达肿瘤等病变组织部位,使其选择性地富集于病灶组织,药物就会迅速地释放出来,能够降低药物的毒副作用,实现靶向给药,达到提高药物疗效的目的[17]。
本研究针对此pH敏感载药胶束,观察其对肺癌A549细胞增殖和凋亡的影响。细胞形态学和MTT实验结果表明,聚合物胶束体外基本无毒性,载药胶束对人肺癌A549细胞的增殖有抑制作用。细胞周期检测结果显示,mPEG-PCL-PTX可使肺癌A549细胞发生G2/M期的阻滞,此结果与Schiff等[18, 19]证实的紫杉醇抗癌机制相符,说明紫杉醇载药后对细胞周期的影响并未发生改变。本研究相关凋亡实验结果显示,mPEG-PCL-PTX具有促进肺癌A549细胞凋亡的作用,可以上调Caspase-3基因表达,增加Bax基因和蛋白的表达量,抑制Bcl-2的表达。上述结果表明,紫杉醇载药胶束的抗肿瘤机制与诱导细胞凋亡有极大的关系; 而且,紫杉醇载药胶束较紫杉醇在促进Caspase-3基因表达方面具有更明显的作用,提示mPEG-PCL-PTX对肺癌细胞的促凋亡作用可能优于单纯的紫杉醇制剂,但其具体机制仍需进一步深入研究。
综上所述,本课题组制备的pH敏感性紫杉醇载药胶束mPEG-PCL-PTX对人肺癌A549细胞的增殖有抑制作用,对细胞的凋亡有促进作用,同时,pH敏感性载药胶束可以实现肿瘤部位的靶向给药,提高抗肿瘤药物作用的选择性,提示该紫杉醇载药胶束有望成为抗癌药物紫杉醇的一种良好新剂型。
| [1] | Hershberger PA, Yu W, Modzelewski RA, et al. Calcitriol (1,25-dihydroxycholecalciferol) enhances paclitaxel antitumor activity in vitro and in vivo and accelerates paclitaxel-induced apoptosis [J]. Clin Cancer Res, 2001, 7: 1043-1051. |
| [2] | Park S, Byun H, Kim B, et al. Tumor suppressor BLU promotes paclitaxel antitumor activity by inducing apoptosis through the down-regulation of Bcl-2 expression in tumorigenesis [J]. Biochem Biophys Res Commun, 2013, 435: 153-159. |
| [3] | Patel K, Patil A, Mehta M, et al. Oral delivery of paclitaxel nanocrystal (PNC) with a dual Pgp-CYP3A4 inhibitor: preparation, characterization and antitumor activity [J]. Int J Pharm, 2014, 472: 214-223. |
| [4] | Li YZ, Hu W, Zhou L. Natureal antitumor compounds with activity of promoting microtubule assembly [J]. Acta Pharm Sin (药学学报), 2001, 36: 155-160. |
| [5] | Huang Y, Chen X, Zhao B, et al. Antiangiogenic activity of sterically stabilized liposomes containing paclitaxel (SSL- PTX): in vitro and in vivo [J]. AAPS PharmSciTech, 2010, 11: 752-759. |
| [6] | Wang W, Yang Y, Zhen XD, et al. The advance in synthetic biology: towards a microbe-derived paclitaxel intermediates [J]. Acta Pharm Sin (药学学报), 2013, 48: 187-192. |
| [7] | Cai H, Wang Y, Cheng K. Analysis of risk factors of paclitaxel injection-induced allergic reactions [J]. China Pharmacy (中国药房), 2014, 25: 3012-3014. |
| [8] | Campos FC, Victorino VJ, Martins-Pinge MC, et al. Systemic toxicity induced by paclitaxel in vivo is associated with the solvent cremophor EL through oxidative stress-driven mechanisms [J]. Food Chem Toxicol, 2014, 68: 78-86. |
| [9] | Huh KM, Lee SC, Cho YW, et al. Hydrotropic polymer micelle system for delivery of paclitaxel [J]. J Control Release, 2005, 101: 59-68. |
| [10] | Mura S, Zouhiri F, Lerondel S, et al. Novel isoprenoyl nanoassembled prodrug for paclitaxel delivery [J]. Bioconjug Chem, 2013, 24: 1840-1849. |
| [11] | Ehinger KHJ, Hansson MJ, Sjövall F, et al. Bioequivalence and tolerability assessment of a novel intravenous ciclosporin lipid emulsion compared to branded ciclosporin in Cremophor® EL [J]. Clin Drug Invest, 2013, 33: 25-34. |
| [12] | Yu Q, Pan SR, Du Z. Preparation and properties of self- assemble paclitaxel-loaded core-shell type nano-micelles [J]. Acta Pharm Sin (药学学报), 2008, 43: 408-414. |
| [13] | Kataoka K, Harada A, Nagasaki Y. Block copolymer micelles for drug delivery: design, characterization and biological significance [J]. Adv Drug Deliv Rev, 2001, 47: 113-131. |
| [14] | Adams ML, Lavasanifar A, Kwon GS. Amphiphilic block copolymers for drug delivery [J]. J Pharm Sci, 2003, 92: 1343-1355. |
| [15] | Fang J, Nakamura H, Maeda H. The EPR effect: unique features of tumor blood vessels for drug delivery, factors involved, and limitations and augmentation of the effect [J]. Adv Drug Deliv Rev, 2010, 63: 136-151. |
| [16] | Gou M, Men K, Shi H, et al. Curcumin-loaded biodegradable polymeric micelles for colon cancer therapy in vitro and in vivo [J]. Nanoscale, 2011, 3: 1558-1567. |
| [17] | Felber AE, Dufresne MH, Leroux JC. pH-sensitive vesicles, polymeric micelles, and nanospheres prepared with polycarboxylates [J]. Adv Drug Deliv Rev, 2011, 64: 979-992. |
| [18] | Kim JH, Yoon EK, Chung H, et al. p53 acetylation enhances Taxol-induced apoptosis in human cancer cells [J]. Apoptosis, 2013, 18: 110-120. |
| [19] | Schiff P. Taxol stabilizes microtubules in mouse fibroblast cells [J]. Proc Nat Acad Sci, 1980, 77: 1561-1565. |
 2015, Vol. 50
2015, Vol. 50


