2. 苏州市药代动力学与药效学工程技术研究中心, 江苏 苏州 215104
2. Suzhou Engineering Research Center of Pharmacokinetics and Pharmacodynamics, Suzhou 215104, China
目前,抗体偶联药物 (antibody-drug conjugate,ADC) 已在药物科学界和商业界受到极大关注。ADC是一类通过化学偶联子将单克隆抗体和小分子细胞毒素 (效应分子) 偶联起来的药物。ADC分子进入体内后,可通过单克隆抗体的导向作用与靶细胞表面的抗原结合,并进一步转入靶细胞内 (internalization)。进入细胞内 (主要在溶酶体内) 的ADC分子可以通过化学和/或酶促作用释放出效应分子以“杀灭”靶细胞[1]。这一类药物结合了单克隆抗体的高度靶向性和小分子毒素的强细胞毒性,被誉为“精确制导炸弹”。
在新药研发过程中,药代动力学研究具有极其重要的意义。单从传统的单克隆抗体药物和小分子药物来说,它们的药代动力学特征、内在机制和研究方法是显著不同的。而作为将两者结合起来的ADC药物,其药代动力学研究无疑具有独特的挑战性。本文对ADC药物的药代动力学特征和内在机制、研究策略及数据解释等进行了综合归纳和阐述。
1 ADC药代动力学特征及其内在机制从分子量大小和空间体积来讲,抗体构成了ADC结构上的主体。抗体本身的主要药动学特征及作用机制如受体介导的酶降解、非特异性蛋白酶降解及新生儿Fc受体循环等[2,3,4]在ADC的抗体部分同样存在,因而对ADC的药动学行为会有直接的影响。作为整体,ADC表现出诸多与抗体本身类似的药动学特征,如较低的清除率、较长的半衰期、较低的表观分布容积、极差的口服生物利用度、免疫原性、以及非线性分布和消除等特征[4]。但ADC药物的药代动力学又表现出某些与裸抗体药物明显不同的特征。首先,ADC药物是多种分子组成的混合物,这些分子可能需要被同时测定; 其次,ADC分子上的两个构成部分 (即抗体与效应分子) 在体内分解后,每个部分的存在和分布需要被同时研究。
1.1 ADC分子的多样性ADC分子的多样性是影响其药代动力学特征的重要因素之一。ADC药物中存在多种不同的ADC分子,这些分子的不同之处在于抗体上所结合效应分子的个数即药物-抗体比 (drug antibody ratio,DAR) 和/或两者结合的位点[5, 6]。抗体上的半胱氨酸和赖氨酸残基较易发生化学反应而被修饰,因此常作为与效应分子结合的位点[5]。一般抗体上具有8个可用的半胱氨酸残基和约80个赖氨酸残基[6,7],在制备过程中多少不一的效应分子与不同位点的氨基酸残基进行结合而形成多样性的ADC分子。另外,ADC药物进入体内后,效应分子可通过酶解或化学反应从ADC上逐渐解离下来,进一步增加了其在体内的多样性。这种不断变化的多样性为ADC的药代动力学研究带来了极大的困难,科学家们也一直在为减少ADC的多样性而努力[8,9,10,11]。
1.2 ADC分布与裸抗体相似,ADC的表观分布容积通常都比较低 (< 0.3 L·kg-1),主要是由于ADC与裸抗体均难以穿过血管上皮细胞到达组织间隙液。如T-[3H]DM1和[3H]SGN-75在所有组织中的放射性信号都比血液低,证实ADC的组织分布程度低[12,13]。T-[3H]DM1和[3H]SGN-75在血流量大的组织如肝、肾、肺、脾和心脏中的分布程度更高[12,13],间接证明ADC在血液中的分布程度非常高。另外一个与裸抗体的相似之处在于ADC的分布也同样会受到目标抗原分布的影响[14]。一些实体肿瘤细胞或正常组织细胞可能会流入循环系统中。如果ADC的目标抗原在这些细胞上存在,ADC就会与这些细胞进行结合而影响其自身的分布[15,16]。而且,ADC和这些抗原形成的复合物可被肝脏摄取并清除,过程中效应分子可在肝脏部位被释放出来造成肝脏毒性[16,17]。
与裸抗体不同的是,与效应分子的结合可能会影响到ADC分子的分布。如Boswell等[14]发现一种STEAP1抗体连接上MMAE之后在大鼠肝脏的摄 取增加,而Scott和Herbertson等[18,19]也发现将抗体hu3S193连接上卡奇霉素后在肝脏的分布增加,且在正常组织和肿瘤组织的分布减少。Alley等[13]将ADC上的抗体和效应分子均进行标记,将这两部分的组织分布进行比较研究后发现,在除了肝脏之外的其他组织中抗体和效应分子的分布相似,而在肝脏中效应分子的浓度则明显大于抗体的浓度。研究者认为肝脏中的浓度差异是由于肝脏的代谢而释放更多效应分子的结果所致[13]。
1.3 ADC代谢ADC的代谢形式较为复杂,既有大分子的酶降解,也有小分子的化学性修饰。抗体的主要代谢形式包括受体介导的酶降解和非特异性蛋白酶降解两种[4],形成不具备活性的多肽和氨基酸。ADC的抗体部分也会经由这两种途径加工,但ADC由此生成的代谢产物除了无活性的多肽和氨基酸外,还包括一些效应分子的结构类似物 (即带有氨基酸残基和/或偶联子的效应分子),而后一类代谢物可能仍具有相当高的活性。另外,可裂解型偶联子也可以通过受体介导的化学和/或酶裂解方式而使ADC直接释放出效应分子。
归纳起来,ADC生成活性物质的方式主要有两种 (图 1): ① 偶联子的裂解,这种方式下抗体部分不受影响,产生游离的效应分子; ② 抗体的降解,这种方式下抗体解体,产生带有氨基酸残基和/或偶联子的效应分子。这两种方式在体内同时进行,若为裂解型偶联子,可能就以第一种方式为主; 若为非裂解型偶联子,可能就以第二种方式为主。例如,采用裂解型偶联子的huC242-SPDB-DM4和huC242 -SPP-DM1主要是通过偶联子的裂解释放出游离的效应分子[20,21],而采用非裂解型偶联子的T-DM1和huC242-SMCC- DM1则主要形成带有氨基酸残基和/或偶联子的效应分子[12,20,21,22,23]。由ADC生成的游离效应分子及其结构类似物在体内可能继续经受药物代谢酶 (如CYP酶等) 介导的生物转化 (图 1)。
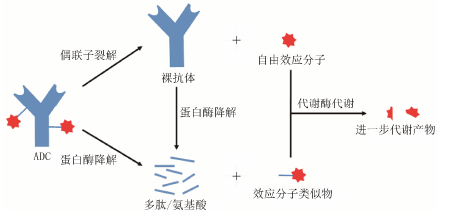
|
图 1 ADC代谢方式示意图 |
以肾小球滤过膜允许通过的物质分子质量 (一般不超过60~80 kD) 来看,完整的ADC或裸抗体分子不可能通过肾小球滤过排泄,但是ADC的代谢产物包括抗体部分的降解产物、游离的效应分子以及保留效应分子结构的多肽和氨基酸则有可能。另外,这些代谢产物也有可能通过转运体的介导而被排泄至粪便中。目前,较少文献对ADC的排泄做出研究,但对那些具有活性/毒性的ADC代谢产物 (游离的效应分子及其结构类似物) 进行排泄的研究仍然是有必要的。
1.5 ADC的免疫原性如其他大分子药物一样,ADC也可能会诱发免疫反应从而使机体产生针对药物本身的抗体 (anti-therapeutic antibody,ATA)。理论上,效应分子与抗体的结合物相比于裸抗体会进一步增大ADC诱发免疫反应的风险。免疫反应发生后,体内产生的ATA会对ADC形成中和作用,被视为ADC的一种清除途径,也增大了机体对ADC本身和裸抗体的清除率[3, 22]。
2 ADC药代动力学研究ADC药物的药代动力学 (PK) 研究中需要监测多种分析物,主要包括: 结合型抗体 (即ADC)、总抗体、结合型效应分子、游离效应分子及其结构类似物。不同分析物的PK行为及其差异性具有不同的意义,它们从整体上构成了ADC药物在体内的PK全貌。
2.1 结合型抗体结合型抗体即ADC,作为“原药”,是ADC的PK研究中最重要的分析物,其浓度变化取决于两个过程: ① 抗体部分通过酶降解等方式解体; ② 效应分子从抗体上完全解离 (即DAR变为0)。这两个过程在体内可以同时进行,但需注意第2个过程仅发生在具有裂解型偶联子的情况下; 同时也需注意ADC分子的药理活性不仅与其本身浓度相关,也与其DAR相关。
2.2 总抗体总抗体浓度就是结合型抗体和裸抗体浓度的总和,其动力学行为反映了ADC分子上抗体组分相关的动力学特征。
效应分子与抗体的连接可以影响抗体本身的清除速率,其机制尚未完全明了,猜想ADC免疫原性的增强是可能原因之一[6,14,18,19]。将ADC和对应的裸抗体分别给药后测得的总抗体PK进行比较,就可以衡量效应分子连接到抗体后对抗体清除速率的影响 (图 2)。
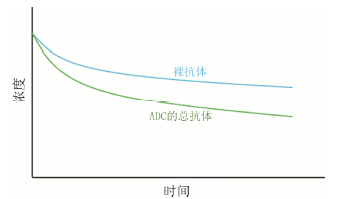
|
图 2 裸抗体和ADC给药后的总抗体药动学示意图 |
如前所述,ADC的浓度变化取决于两个同时进行的过程,而总抗体的浓度变化则只取决于其中的一个过程。将ADC给药后总抗体与结合型抗体的PK进行比较,观察到的差异反映了效应分子从ADC上完全解离的速率 (图 3)。
2.3 结合型效应分子作为未从抗体上释放出来的效应分子,与结合型抗体类似,结合型效应分子的浓度变化亦取决于两个同时进行的过程: ① 抗体部分通过酶降解等方式解体; ② 效应分子从抗体上逐渐解离 (即DAR逐渐变为0)。需注意,在第一个过程中,抗体解体后其上的效应分子可能仍然连接在抗体的碎片上,但这时已不能算作结合型效应分子 (即仅指结合在完整抗体分子上的效应分子)。
由上可知,结合型效应分子与总抗体在PK上的差异反映了结合型效应分子从抗体上逐渐解离下来的速率 (图 3)。在相同的时间点上测得的结合型效应分子与总抗体的浓度的比值为平均DAR。ADC给药后,平均DAR将逐渐降低至零,DAR的变化速率可以反映效应分子从抗体上逐渐解离下来的速率。
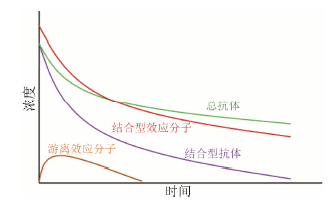
|
图 3 ADC给药后各分析物药动学示意图 |
ADC分子在体内生成游离的效应分子和/或保留效应分子结构的活性代谢产物。这些物质的活性表现在它们的细胞毒 性上,因此它们的浓度和/或暴露量是ADC毒性评价的物质基础。一般情况下,具有可裂解型偶联子的ADC可以通过偶联子的裂解高效地生成游离效应分子,而具有稳定型偶联子的ADC则通过酶降解的方式生成一些活性代谢产物 (如T-DM1生成Lys-MCC- DM1)。需要注意的是,有些主要代谢物是没有活性的,只有选择具有活性的代谢物进行检测才有意义。
2.5 其他可能的分析物裸抗体浓度可以通过测得的总抗体和结合型抗体浓度的差值来计算; 而总效应分子浓度理论上可以通过结合型效应分子和游离效应分子及其相关代谢物的总和来估算。目前认为两者在药动学、药效学和安全性评价中都不具有特殊的意义,一般不作考察。
ATA的生成标志着免疫原性的产生,它意味着ADC的清除速率会因此而加快。但ATA一般并不直接作为大分子药物的PK研究对象。
3 ADC药代动力学研究中生物分析的策略及考虑ADC药代动力学研究中涉及到多种分析物,这需要生物分析工作者运用多种手段来完成它们的定量分析。对于总抗体和结合型抗体多采用配体结合法 (LBA,如ELISA),而对于结合型效应分子、游离效应分子及其相关代谢物则多采用基于液质联用 (LC-MS/MS) 的方法,需考察定量性能参数如精确性、准确性、专属性和定量范围等。而ADC的特殊性使其在方法学上多了一些特殊的要求,如ADC药代动力学研究中的分析物不仅具有多样性,而且这种多样性也具有动态变化性 (如DAR在不同时间点的样品中不一样); 另外,ADC生物分析中所用的标准品的组成具有不均一性,与真实样品中的组成也不同。因此,在方法学上就需要对真实样品和标准品中成分的不一致性和变化性所带来的定量可靠性问题进行考察。
3.1 结合型抗体对于结合型抗体,通常以针对效应分子的抗体开发出的LBA方法进行分析 (图 4)。理想状况下,采用的LBA方法对DAR的变化应不具有敏感性,但实际情况并非如此[24]。可以认为,与ADC标准品的DAR相差程度越大的样品,其测得值的准确性越差。因此,在测量真实样品之前,需要考察DAR的变化对定量的影响。这一考察最好是采用一系列具有均一性DAR的ADC (即每个ADC分子都具有同样的DAR) 来完成。但从生产工艺的角度来讲,目前还无法制备出均一性DAR的ADC。AAPS和Genentech的科学家们建议可以采用一系列具有不同平均DAR的ADC产品来制备质量控制样品以完成考察,接受标准就是测得的浓度值 (一般以给药的ADC药物作为标准品) 与其默认值的差别不超过±20%[24, 25]。
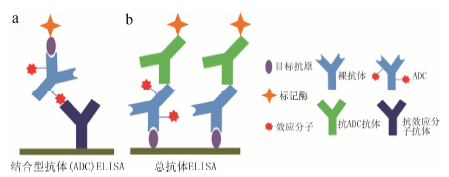
|
图 4 结合型抗体 (ADC) 及总抗体ELISA方法原理示意图 |
对于总抗体,通常以针对原抗体开发出来的LBA方法进行分析 (图 4)。该类LBA方法通常情况下也对DAR的变化具有一定的敏感性。AAPS建议的考察方法就是采用裸抗体和一系列具有不同平均DAR的ADC产品制备成质量控制样品,要求测得的浓度值与其默认值的差别不超过±20%[25]。一般情况下以给药的ADC药物作为标准品,但在经过考察认为合适后,也可以直接采用裸抗体作为标准品进行定量[24, 25]。
3.3 结合型效应分子典型的结合型效应分子的检测方法通常包含3步,① 首先将ADC以某种方式 (如固相化金葡菌蛋白A) 捕获并与游离的效应分子分离; ② 其次以某种方法 (化学反应或酶裂解) 将效应分子从抗体上解离下来; ③ 最后利用LC-MS/MS方法对解离下来的小分子进行定量。此方法将ADC药物采取同样的样品处理步骤获取游离效应分子用于LC-MS/MS检测和标准曲线的建立。采用如金葡菌蛋白A等对抗体亲和力极强的物质作为捕获剂的优点是可以极大地降低实验体系对DAR变化的敏感性。尽管如此,AAPS仍然建议在一定程度上考察DAR对定量的影响,考察的方法与结合型抗体考察方法类似[25]。
3.4 游离效应分子及其相关代谢物对于游离的效应分子及其相关代谢物,可以利用LC-MS/MS或LBA方法进行定量。通常认为LC-MS/MS更合适,因其方法开发更简单,对这些结构类似的待测物特异性更强。值得注意的是,如采用LC-MS/MS方法,须利用待测物本身而不是ADC药物作为标准品。因此,研究者们需要预先鉴定出活性代谢产物并制备出其标准品用于定量分析[12]。另外,在方法学上还需要特别注意ADC所具有的一些特殊问题: ① 储存过程中,ADC在目标基质中仍然可能由于化学和/或酶介导的不稳定性而继续释放出效应分子[25]; ② 一些常规的小分子样品处理方法可能导致效应分子的极快释放,如酸性沉淀剂的加入可使酸裂解型偶联子迅速断裂; ③ 一些效应分子含有反应性基团而引起其本身的不稳定性 (如DM1上巯基的存在可导致其自身二聚化或其与血浆蛋白的共价结合),需采取一些特殊的处理步骤[26]。
3.5 ATA对于ATA的检测,多采用LBA方法如ELISA和电化学发光免疫法 (ECLA) 等[27]。鉴于ATA一般不直接作为PK研究对象,本文也不对其分析方法作进一步阐述。
4 人体ADC药代动力学预测临床前药代动力学研究的目的是进行人体药代动力学的预测以支持临床剂量和给药方式的设计以及临床安全性的评估。ADC的人体药代动力学预测鲜有报道,反映了目前学界在这一领域的经验相当缺乏。
一般情况下,灵长类动物如猴与人类的靶标抗原具有高度的同源性,对同样的单克隆抗体或ADC具有相似的亲和力,因此猴比较适合用来模拟受体介导的清除途径[28]。而在其他的非受体介导的清除途径 (如非特异性酶降解) 及相关机制 (如保护性的新生儿Fc受体循环) 方面,猴也与人类相仿[28]。综合来看,猴似乎是用于预测ADC人体药代动力学的最合适的种属。Kedan建议可以直接采用单克隆抗 体人体清除率预测的常用方法来进行ADC抗体部分(总抗体和结合型抗体) 人体清除率的预测,如异率指数为0.85的种属间异率放大模型法[29,30]。需要注意,Kedan的建议并没有考虑到效应分子结合到抗体上对抗体本身清除率的影响。
与ADC抗体部分的人体药动学预测相比,效应分子的药动学预测难度则更大。ADC在体内生成活性小分子的机制、途径和速率以及生成物的种类在不同的物种间如果具有较大的差异,就不可能在不同的物种间进行有意义的比较和预测。如研究者们利用食蟹猴对Adcetris的效应分子MMAE在人体内暴露水平的预测就远低于实际水平[31]。
5 临床前ADC药代动力学研究内容建议临床前ADC药物的药代动力学研究服务于以下目的: ① ADC的优化,包括效应分子连接方式 (即结合位点和偶联子) 的选择和最优DAR的确定; ② 安全性及药效评价动物模型的选择; ③ 临床剂量和给药方式的设计以及临床安全性的评估。从这些目的出发,并结合现有的文献报道,本文作者总结了如下需要进行的一系列临床前药代动力学实验内容。
5.1 体外偶联子稳定性研究ADC分子必须在血液循环系统中具有足够的稳定性,否则效应分子的过早释放会带来安全性问题。因此,科学家们需在不同种属的血浆/血清中进行偶联子的稳定性研究[32,33,34]。这一研究一般在ADC的筛选和优化阶段进行,用以支持效应分子连接方式的选择,也可用于支持临床前安全性评价。
5.2 效应分子释放速率及途径研究ADC分子必须在目标细胞内高效地释放出效应分子以“杀灭”细胞,目前用于研究效应分子释放速率的体外模型有肿瘤细胞、溶酶体提取物和提纯酶。若辅以内吞通路抑制剂、溶酶体抑制剂和半胱氨酸蛋白酶抑制剂等,则可以进行效应分子释放途径的研究[32,34]。这些研 究可以用于支持临床前安全性评价。
5.3 体外代谢产物研究如前所述,代谢产物具有安全性评价方面的重要意义。利用肿瘤细胞、溶酶体提取物和/或提纯酶进行体外代谢产物鉴定及代谢产物的体外活性研究,有助于发现并鉴定具有活性/毒性的体内代谢产物[32,35]。而将包括人在内的各种属 的活性代谢产物谱进行种属间的比较,可以用于评价各种属作为安全性评价模型的适用性。
5.4 体内代谢产物研究对动物的体内代谢产物如循环系统、排泄物和重要组织如肝脏中的代谢产物进行鉴定和检测,有助于进一步进行ADC的安全性评价[12, 23, 35]。将各动物种属的体内代谢产物和体外代谢产物进行体内-体外相关性研究,可以为临床前安全性动物种属的选择提供进一步的依据。
5.5 体内PK研究ADC临床前药代动力学研究 的一项重要内容就是采用安全性评价和药效动物种属进行体内PK研究,了解给药后各分析物的PK特征[33, 35, 36]; 另外需要单独进行裸抗体给药后的总抗体PK研究。这些研究可以解释ADC所具有的各种动力学特征及其意义,如ADC本身的PK参数、效应分子从抗体上的解离速率、效应分子与抗体的结合对ADC清除速率的影响、效应分子在体内引起的安全性问题等。
5.6 组织分布研究ADC分子及其释放出来的游离效应分子在体内的组织分布特征无疑也具有安全性方面的重要意义[12, 23, 32, 36]。该研究可以采用安全性评价和药效动物种属来进行,并且尤其需要注意特定组织如肝脏和肿瘤等部位的游离效应分子浓度。
5.7 效应分子体外药物相互作用研究作为小分子物质,效应分子可能会在体内引起CYP和/或转运体介导的药物相互作用,从而引起安全性隐患。利用体外模型如人肝微粒体和肿瘤细胞模型等进行CYP抑制、CYP代谢酶鉴定及转运特性等的研究可以为毒素分子的选择和安全性评价提供指导[32, 37, 38, 39, 40]。
6 结语ADC药物的药代动力学研究面临着诸多挑战,主要体现在生物分析及数据解释两方面。ADC分子本身具有不均一性,其在体内又可以进一步生成其他具有活性和/或毒性的分子。这些分子不仅种类繁多,在性质上的差别也非常大,单一的分析手段不可能完成所有的检测任务,而开发出定量性能可靠的各式分析方法并非易事。在这种情况下,分析手段的进步显得尤为重要,如一种新型的ECLA仪器 (由Meso Scale diagnostics公司开发的高灵敏度分析仪 器) 可以帮助分析工作者更高效地完成高灵敏度LBA方法的开发。与小分子相比,ADC在药动学数 据的解释上更为复杂。不同分析物的药动学行为及其差异性具有不同的意义,它们从整体上构成了ADC体内药动学的全貌。另外,鉴于ADC分析物的多样性及其互相关联性,人体ADC药代动力学的预测及PK-PD的建模也十分困难。目前,这一方面的报道并不多,科学家们仍需要付出更多的努力。
| [1] | Zhu GD, Fu YX. Design of next generation antibody drug conjugates [J]. Acta Pharm Sin (药学学报), 2013, 48: 1053-1070. |
| [2] | Wang W, Wang EQ, Balthasar JP. Monoclonal antibody pharmacokinetics and pharmacodynamics [J]. Clin Pharmacol Ther, 2008, 84: 548-558. |
| [3] | Deng R, Jin F, Prabhu S, et al. Monoclonal antibodies: what are the pharmacokinetic and pharmacodynamics considerations for drug development [J]. Expert Opin Drug Metab Toxicol, 2012, 8: 141-160. |
| [4] | Lobo ED, Hansen RJ, Balthasar JP. Antibody pharmacokinetics and pharmacodynamics [J]. J Pharm Sci, 2004, 93: 2645-2668. |
| [5] | Singh R, Erickson HK. Antibody-cytotoxic agent conjugates: preparation and characterization [J]. Methods Mol Biol, 2009, 525: 445-467. |
| [6] | Hamblett KJ, Senter PD, Chace DF, et al. Effects of drug loading on the antitumor activity of a monoclonal antibody drug conjugate [J]. Clin Cancer Res, 2004, 10: 7063-7070. |
| [7] | Yu CF, Li M, Guo W, et al. Determination of drug antibody ratio in an antibody-drug conjugate [J]. Acta Pharm Sin (药学学报), 2014, 49: 363-367. |
| [8] | McDonagh CF, Kim KM, Turcott E, et al. Engineered anti-CD70 antibody drug conjugate with increased therapeutic index [J]. Mol Cancer Ther, 2008, 7: 2913-2923. |
| [9] | Junutula JR, Bhakta S, Raab H, et al. Rapid identification of reactive cysteine residues for site-specific labeling of antibody- Fabs [J]. J Immunol Methods, 2008, 332: 41-52. |
| [10] | Dornan D, Bennett F, Chen Y, et al. Therapeutic potential of an anti-CD79b antibody-drug conjugate, anti-CD79b-vc- MMAE, for the treatment of non-Hodgkin lymphoma [J]. Blood, 2009, 114: 2721-2729. |
| [11] | Kudirka R, Barfield RM, McFarland J, et al. Generating site-specifically modified proteins via a versatile and stable nucleophilic carbon ligation [J]. Chem Biol, 2015, 22: 293-298. |
| [12] | Shen BQ, Bumbaca D, Saad O, et al. Catabolic fate and pharmacokinetic characterization of trastuzumab emtansine (T-DM1): an emphasis on preclinical and clinical catabolism [J]. Curr Drug Metab, 2012, 13: 901-910. |
| [13] | Alley SC, Zhang X, Okeley NM, et al. The pharmacologic basis for antibody-auristatin conjugate activity [J]. J Pharmacol Exp Ther, 2009, 330: 932-938. |
| [14] | Boswell CA, Mundo EE, Zhang C, et al. Impact of drug conjugation on pharmacokinetics and tissue distribution of anti-STEAP1 antibody-drug conjugates in rats [J]. Bioconjug Chem, 2011, 22: 1994-2004. |
| [15] | Tolcher AW, Ochoa L, Hammond LA, et al. Cantuzumab mertansine, a maytansinoid immunoconjugate directed to the CanAg antigen: a phase I, pharmacokinetic, and biologic correlative study [J]. J Clin Oncol, 2003, 21: 211-222. |
| [16] | Pastuskovas CV, Mallet W, Clark S, et al. Effect of immune complex formation on the distribution of a novel antibody to the ovarian tumor antigen CA125 [J]. Drug Metab Dispos, 2010, 38: 2309-2319. |
| [17] | Lovdal T, Andersen E, Brech A, et al. Fc receptor mediated endocytosis of small soluble immunoglobulin G immune complexesin Kupffer and endothelial cells from rat liver [J]. J Cell Sci, 2000, 113: 3255-3266. |
| [18] | Scott AM, Tebbutt N, Lee FT, et al. A phase I biodistribution and pharmacokinetic trial of humanized monoclonal antibody Hu3s193 in patients with advanced epithelial cancers that express the Lewis-Y antigen [J]. Clin Cancer Res, 2007, 13: 3286-3292. |
| [19] | Herbertson RA, Tebbutt NC, Lee FT, et al. Phase I biodistribution and pharmacokinetic study of Lewis Y-targeting immunoconjugate CMD-193 in patients with advanced epithelial cancers [J]. Clin Cancer Res, 2009, 15: 6709-6715. |
| [20] | Erickson HK, Park PU, Widdison WC, et al. Antibody- maytansinoid conjugates are activated in targeted cancer cells by lysosomal degradation and linker-dependent intracellular processing [J]. Cancer Res, 2006, 66: 4426-4433. |
| [21] | Erickson HK, Widdison WC, Mayo MF, et al. Tumor delivery and in vivo processing of disulfide-linked and thioether-linked antibody-maytansinoid conjugates [J]. Bioconjug Chem, 2010, 21: 84-92. |
| [22] | Girish S, Gupta M, Wang B, et al. Clinical pharmacology of trastuzumab emtansine (T-DM1): an antibody-drug conjugate in development for the treatment of HER2-positive cancer [J]. Cancer Chemother Pharmacol, 2012, 69: 1229-1240. |
| [23] | Erickson HK, Lambert JM. ADME of antibody-maytansinoid conjugates [J]. AAPS J, 2012, 14: 799-805. |
| [24] | Kaur S, Xu K, Saad OM, et al. Bioanalytical assay strategies for the development of antibody-drug conjugate biotherapeutics [J]. Bioanalysis, 2013, 5: 201-226. |
| [25] | Gorovits B, Alley SC, Bilic S, et al. Bioanalysis of antibody- drug conjugates: American association of pharmaceutical scientists antibody-drug conjugate working group position paper [J]. Bioanalysis, 2013, 5: 997-1006. |
| [26] | Dere R, Yi JH, Lei C, et al. PK assays for antibody-drug conjugates: case study with ado-trastuzumab emtansine [J]. Bioanalysis, 2013, 5: 1025-1040. |
| [27] | Stephan JP, Kozak KR, Wong WL. Challenges in developing bioanalytical assays for characterization of antibody-drug conjugates [J]. Bioanalysis, 2011, 3: 677-700. |
| [28] | Lin JH. Pharmacokinetics of biotech drugs: peptides, proteins and monoclonal antibodies [J]. Curr Drug Metab, 2009, 10: 661-991. |
| [29] | Lin K, Tibbitts J. Pharmacokinetic considerations for antibody drug conjugates [J]. Pharm Res, 2012, 29: 2354-2366. |
| [30] | Ling J, Zhou H, Jiao Q, et al. Interspecies scaling of therapeutic monoclonal antibodies: initial look [J]. J Clin Pharmacol, 2009, 49: 1382-1402. |
| [31] | Drug Approval Package ADCEREIS (brentuximabvedotin). http://www.accessdata.fda.gov/drugsatfda_docs/nda/2011/125388_adcetris_toc.cfm. 2011. |
| [32] | Kamath AV, Iyer S. Preclinical pharmacokinetic considerations for the development of antibody drug conjugates [J]. Pharm Res, 2014, doi:10.1007/s11095-014-1584-z. |
| [33] | Elgersma R, Coumans R, Huijbregts T, et al. Design, synthesis, and evaluation of linker-duocarmycin payloads: towards selection of HER2-targeting antibody-drug conjugate SYD985 [J]. Mol Pharm, 2015, doi: 10.1021/mp500781a. |
| [34] | Chen X, Soma LA, Fromm JR. Targeted therapy for Hodgkin lymphoma and systemic anaplastic large cell lymphoma: focus on brentuximab vedotin [J]. Onco Targets Ther, 2013, 7: 45-56. |
| [35] | Erickson HK, Lewis Phillips GD, Leipold DD, et al. The effect of different linkers on target cell catabolism and pharmacokinetics/pharmacodynamics of trastuzumab maytansinoid conjugates [J]. Mol Cancer Ther, 2012, 11: 1133-1142. |
| [36] | Govindan SV, Cardillo TM, Rossi EA, et al. Improving the therapeutic index in cancer therapy by using antibody-drug conjugates designed with a moderately cytotoxic drug [J]. Mol Pharm, 2014, 12: 1836-1847. |
| [37] | Kovtun YV, Audette CA, Mayo MF, et al. Antibody- maytansinoid conjugates designed to bypass multidrug resistance [J]. Cancer Res, 2010, 70: 2528-2537. |
| [38] | Davis JA, Rock DA, Wienkers LC, et al. In vitro characterization of the drug-drug interaction potential of catabolites of antibody-maytansinoid conjugates [J]. Drug Metab Dispos, 2012, 40: 1927-1934. |
| [39] | Cianfriglia M. The biology of MDR1-P-glycoprotein (MDR1-Pgp) in designing functional antibody drug conjugates (ADCs): the experience of gemtuzumab ozogamicin [J]. Ann Ist Super Sanità, 2013, 49: 150-168. |
| [40] | Loganzo F, Tan X, Sung M, et al. Tumor cells chronically treated with a trastuzumab-maytansinoid antibody-drug conjugate develop varied resistance mechanisms but respond to alternate treatments [J]. Mol Cancer Ther, 2015, 14: 952-963. |
 2015, Vol. 50
2015, Vol. 50


