·新药发现与研究实例简析·
新药创制是复杂的智力活动,涉及科学研究、技术创造、产品开发和医疗效果等多维科技活动。每个药物都有自身的研发轨迹,而构建化学结构是最重要的环节,因为它涵盖了药效、药代、安全性和生物药剂学等性质。本栏目以药物化学视角,对有代表性的药物的成功构建,加以剖析和解读。
将一个含有32个手性碳原子、相对分子质量超过1000的复杂天然活性物质改造成为仍含有19个手性碳、相对分子质量729的抗肿瘤药物艾日布林,在分子设计和化学合成两个层面上遇到巨大的挑战。研制过程、临床试验乃至生产销售所用的样品和药品,都是用有机合成的方法由简单的原料制备的,成为迄今全球用纯化学合成方法研发和生产的最复杂的药物,可得性是研发艾日布林成药性的一个极其重要维度。从1985年开始研究到2010年批准上市的25年,彰显了研制的艰巨性。(编者按)
1 源自海绵的软海绵素B1985年Uemura等从日本稀缺的海绵Halichondria okadai中分离出一种聚醚大环内脂,是只含C、H和O的天然产物,命名为软海绵素B(1,halichondrin B)(Uemura D,Takahashi K,Yamamoto T et al. J Am Chem Soc,1985,107: 4796−4798),生物实验表明1对小鼠体内外癌细胞具有强效抑制作用(Hirata Y,Uemura D. Pure Appl Chem,1986,58: 701−710)。后来发现在常见的海绵如Axinella、Phakellia和Lissodendoryx科中也含有软海绵素B,缓解了深入研究抗癌机制所需的样品源。

|
Scheme 1 1 |
美国国家肿瘤研究所(NCI)在60个癌细胞系做了系统的活性评价,发现1的抗细胞增殖作用类似于已知的抗微管蛋白药物,但生化机制不同。表现在: ① 抑制β微管蛋白βs内链的交联作用以及增加β*的生成,但对长春碱同微管蛋白结合所产生的解聚作用没有竞争性抑制,提示1与微管蛋白的结合位点与长春碱不同; ② 对于秋水仙碱与微管蛋白的结合没有增稳作用,也没有抑制作用; ③ 可提高双-5,5'-[8-(N-苯基)-氨基-1-萘磺酸]与微管蛋白的结合能力; ④ 不影响碘代乙酰胺对微管蛋白巯基发生的烷化作用。这些生化实验说明软海绵素B抑制微管蛋 白的解聚作用,同其他抑制剂的结合位点和作用机制不同,预示其抗肿瘤作用与已有的作用于微管蛋白的药物较少产生交叉耐药作用(Bai RL,Paull KD,Herald CL et al. J Biol Chem,1991,266: 15882− 15889)。由于软海绵素B的极强活性和独特的作用机制,引起学术界和企业界的关注。然而由于自然界提供的样品量有限,研发进展较慢。
3 软海绵素B的结构特征软海绵素B是由聚醚与大环内酯两部分结构组成,分子式C61H88O36,相对分子质量为1 109.36,含有32个手性碳原子,聚醚片段有18个,大环内酯有14个。聚醚与大环内酯相连于C29和C30,是共用两个键连的碳原子形成并环结构。在连接节点C30是内酯基团,当发生水解作用,环被打开,构象发生改变,功能基的空间位置发生改变。
4 软海绵素B和简化物的合成哈佛大学的Kishi等系统地研究了软海绵素B的全合成(Aicher TD,Buszek KR,Fang FG et al. J Am Chem Soc,1992,114: 3162−3164),由于结构的复杂性,他们采取了由简到繁的合成策略,将软海绵素B化解成几个片段,片段上预留出功能基,以备连接成目标分子,本文中软海绵素B与片段结构中碳原子的标号沿用了原研者的编号,便于理解各片段在目标分子中的位置和连接位点。一些片段还作了结构变换或简化,以合成改构物或简化物(Duan JJW,Kishi Y. Tetrahedron Lett,1993,34: 7541−7544; Stamos,DP,Kishi Y. Tetrahedron Lett,1996,37: 8643; Stamos DP,Sean SC,Kishi Y. J Org Chem,1997,62: 7552)。合成策略可用图 1简化示之。

|
图 1 软海绵素B 及其简化物合成的策略图 |
|
Scheme 2 2,3 |
艾日布林的成功研制得益于软海绵素B的全合成研究。最初的合成路线只能合成微克级的样品,Eisei公司研究所Yu等优化了合成方法,使得重要 的中间体和简化物能够以g级量制备,得以提供必 要的样品量进行药理研究,工艺研究实现了临床研究和艾日布林上市后的规模生产,这些完全是由小分子化合物经有机合成制备的(Yu MJ,Zheng WJ,Seletsky MB. Nat Prod Rep,2013,30: 1158−1164)。
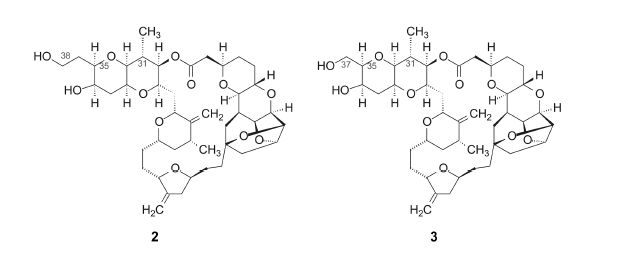
4.1 保留内酯结构的C1−C38和C1−C37化合物从药物化学的视角分析软海绵素B的结构,“右边的”内酯片段比“左边的”聚醚更可能是抗癌活性的载体,因为含有多样的功能基,而聚醚的结构单调。因而去除大部分聚醚单元,应是简化物合成的切入点。为此,合成了包含C1−C38和C1−C37的化合物2和3(Stamos DP,Sean SC,Kishi Y et al. J Org Chem,1997,62: 7552),这是两个最先简化的并仍保持抗癌活性的类似物,对DLD-1人结肠癌细胞IC50分别为4.6和3.4 nmol·L−1,与软海绵素B的活性(IC50 = 0.74 nmol·L−1)相近。
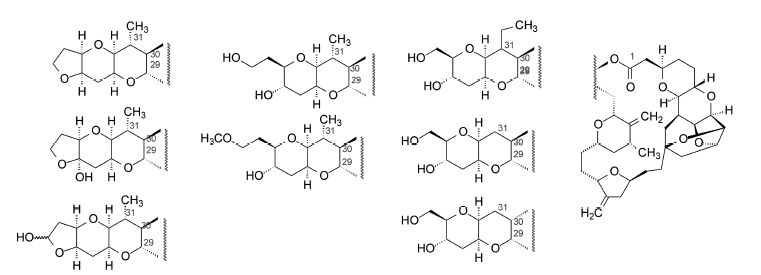
4.2 C1−C38和C1−C37的类似物修饰化合物2的C38的羟基成甲氧基,或环合成并环的四氢呋喃,或将C31的甲基变换为乙基或氢原子,或将化合物3的C31甲基变换为乙基或氢,如图 2所示的结构变换,这些化合物仍保持体外抗癌活性,与2和3的活性没有显著差异。以上结果提示,由C31相连的聚醚简化成二氧杂十氢萘,仍然保持了抗癌活性(Wang Y,Habgood GJ,William JW et al. Bioorg Med Chem Lett,2000,10: 1029−1032)。
|
图 2 软海绵素B的C29和C30连接片段的变换 |
酯键在体内具有不稳定性。改变内酯的结构,避免水解作用以增加化合物的稳定性。例如用醚键、酰胺键或亚甲基酮等替换酯键。与此同时,再删除剩余的环醚片段,以减小分子尺寸(Littlefield BA,Palme MH,Seletsky BM et al. U. S. Patent Application 09/334 488,1999)。
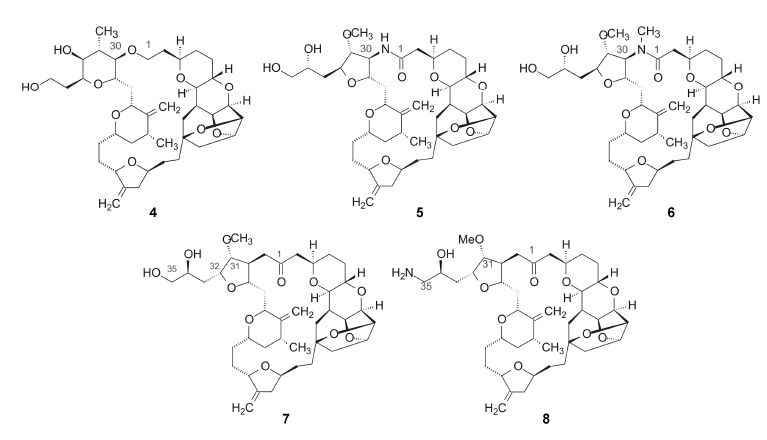
4.3.1 C30−C1形成醚键和酰胺键的大环用醚键替换酯键合成了化合物4,酰胺键代替酯键合成了化合物5和6,在药物化学中虽然这些二价连接基与酯键互为电子等排,但化合物4、5和6的变换对活性影响显著。它们抑制微管蛋白的活性降低了两个数量 级,是环的构象发生了改变的缘故。X-射线分析,去甲软海绵素A的内酯键的两面角为163°,气相分子动力学计算表明化合物4、5和6的两面角为180°,导致环构象的变化,不利于同微管蛋白结合(Yu MJ,Zheng WJ,Seletsky BM. Annu Rep Med Chem,2011,46: 227−241)。
4.3.2 C30−C1以亚甲基酮连接的大环用亚甲基酮连接C30−C1形成的大环化合物中,化合物7(ER-076349)和8(ER-086526)表现了突出优良的活性−稳定性−溶解性等属性。7和8的结构特点是: ① 将C1的酯基变换为甲酮基,这种电子等排的置换,没有改变大环体系的构象,但提高了对水解的稳定性; ② 将C29−C38并合的三环系统简化为四氢呋喃单环,降低了分子尺寸; ③ 从C32引出丙二醇或氨基丙醇的极性侧链,改善了物化性质。7和8的相对分子质量分别为728.92和727.94,比天然物软海绵素B减少了35%。化合物8的侧链上含有伯氨基,可与酸形成盐,提高了溶解与吸收性。7和8的活性与软海绵素B相近,计算亚甲基酮的两面角为90°,推论环的活性构象在90~163°范围内。
5 ER-076349和ER-086526的药效学 5.1 体外抑制肿瘤细胞的活性用多种瘤株评价了化合物7和8的抑瘤活性,结果表明其体外活性均强于长春碱和紫杉醇(表 1)。
|
|
表 1 化合物7和8以及长春碱和紫杉醇的体外抑瘤活性 |
用小鼠脑微管蛋白评价7和8的抑制聚合作用,IC50分别为5 μmol·L−1和6 μmol·L−1,低于长春碱对微管蛋白的抑制活性(IC50 = 2 μmol·L−1)。
5.3 对接种人癌细胞的裸鼠的体内活性对多种人癌细胞移植的裸鼠模型进行体内活性实验,表明在0.05~1 mg·kg−1剂量下,两个化合物都有显著的抑制作用,尤其是化合物8的活性更加明显。停药后肿瘤的复发率低于紫杉醇,也优于化合物7,8的治疗窗口也明显比7宽(Towle MJ,Salvato KA,Budrow J et al. Cancer Res,2001,61: 1013−1021)。
|
Scheme 3 4,5,6,7,8 |
化合物8与甲磺酸形成盐,定名为甲磺酸艾日布林(eribulin methylayte),在pH 3~7环境下可任意溶于水,对野生小鼠的口服生物利用度为7%,平均分布容积为43~114 L·m−2,半衰期t1/2 = 40 h。经III期临 床研究,可有效地治疗转移性乳腺癌,于2010年FDA批准在美国上市。
6 艾日布林的全合成艾日布林是迄今用纯化学合成的方法研制并生产的结构最复杂的药物,分子中含有19个手性碳原子,是由简单的工业原料经62步反应合成的。深入的工艺研究将最初哈佛大学的Kishi的微克级的合成,提高到制备数十克水平的艾日布林,在合成180多个目标化合物的过程中,合成方法和工艺过程不断改进。此外,也由于转化医学的推动,产(Eisei公司)学(哈佛大学)研(NCI)的结合,很好地处理了时间、投入与风险的关系。下面简要地列出合成艾日布林的反应式,展示其复杂性。
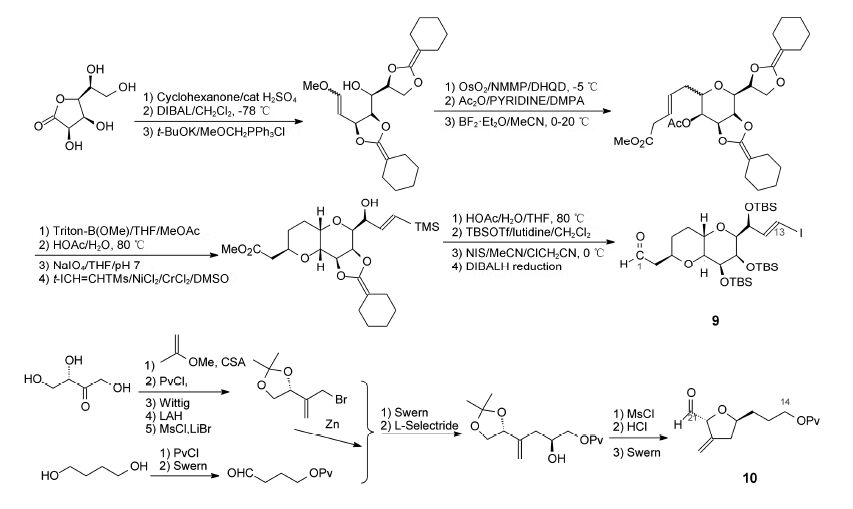
6.1 C1−C13的合成由L-甘露糖酸-γ-内酯经手性配体诱导发生C-烯丙基化、麦克尔加成环合、以及立体选择性地Ni(II)/ Cr(II)诱导乙烯三甲基硅烷加成等多步合成,最后经二异丁基铝氢还原C1的羧酸甲酯成醛基,合成了C1− C13片段(9)(Stamos DP,Kishi Y. Tetrahedron Lett,1996,37: 8643−8646)。
6.2 C14−C21片段的合成由L-(+)-赤藓酮糖经5步反应转变成羟基保护的溴丙烯化合物,后者在锌粉存在下,与醛缩合成仲醇,经Swern氧化和立体选择性还原,再经过3步反应得到C14−C21四氢呋喃甲醛的片段(10)。
6.3 C22−C26片段的合成
由羟甲基丁内酯经Kishi合成的多步反应,生成了提供C22−C26片段的酮基膦酸酯(11)。
6.4 C14−C26片段的合成将包含C14−C21片段的四氢呋喃甲醛化合物(10)与包含C22−C26片段的酮基膦酸酯(11)经Kishi合成的多步反应,生成含有C14−C26片段的中间体(12)。
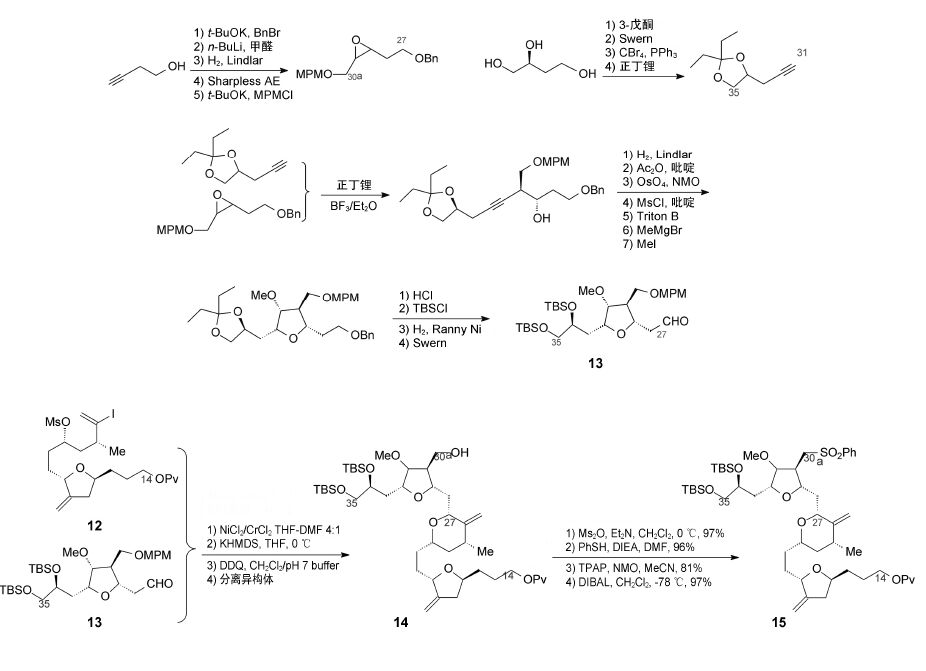
6.5 C27−C35片段的合成含有9个碳原子的C27−C35片段是从两个简单的原料制备: 用丁炔醇经5步反应生成含有C27−C30a片段的待开环的环氧化合物; 由丁三醇经4步反应合成含有C31−C35片段的戊炔二醇。这两个片段经正丁锂活化、Lewis酸催化偶联得到炔醇,炔键经部分氢化还原,生成的顺式双键用四氧化锇双羟基化,再经甲烷磺酰化,关环得到羟基被保护的C27−C35四氢呋喃乙醛化合物(13)。
|
Scheme 4 9,10 |

|
Scheme 5 11,12 |
6.6 C14−C35片段的合成C14−C26片段的碘代乙烯化合物(12)与C27−C35四氢呋喃乙醛化合物(13)在Nozaki-Hiyama-Kishi条件下发生偶联反应,生成14为差向异构体混合物,C27的构型比例是3∶1,以所希望的构型占优,经简单柱色谱分离后,收率为57%。将C30a的羟基转变为苯磺酰基,除去C14的新戊酰保护基,得到含有C14− C35片段的中间体(15)。从各个原料算起,合成15需要59步反应,最长为26步线性接续反应。
|
Scheme 6 13,14,15 |
C14−C35片段的中间体(15)与C1−C13片段的中间体(9)经过三步反应生成C1−C35、C13处为碘乙烯基、C14为醛基的化合物(16),在Nozaki-Hiyama-Kishi反应条件下,发生大环合环,收率95%,将丙烯醇氧化成烯酮,再发生迈克尔加成,形成笼状结构的二醇(17),17用甲磺酸酐酯化,氢氧化铵处理得到C35为氨基的最终目标物(8),与甲磺酸形成盐,得到甲磺酸艾日布林(Yu MJ,Zheng WJ,Seletsky MB. Nat Prod Rep,2013,30: 1158−1164)。

|
Scheme 7 16,17 |
 2015, Vol. 50
2015, Vol. 50
