孕烷X受体(pregnane X receptor,PXR) 属于核受体 (nuclear receptors,NRs) 超家族的一员,是一个配体依赖性的转录调节因子[1]。配体激活后的PXR进入细胞核,与视黄醛X受体 (retinoid X receptor,RXR) 形成异二聚体,随后结合到靶基因的PXR反应元件上,进而介导该基因的转录表达。PXR下游靶基因的表达产物主要是一类与外源性药物及内源性物质代谢转运相关的酶及蛋白,包括I相代谢酶如细胞色素P450同工酶家族中的CYP3A、CYP2B和CYP2C,II相代谢酶如尿苷二磷酸葡萄糖醛酸转移酶基因 (UGT) 和谷胱甘肽S转移酶 (GST),III相药物转运蛋白如P-糖蛋白 (P-gp)、多药耐药相关蛋白 (MRP) 和乳腺癌耐药蛋白 (BCRP) 等[2]。作为ATP结合盒 (ATP-binding cassette,ABC) 转运蛋白超家族的一员,MDR1 (P-gp的编码基因) 是PXR最重要的靶基因之一。P-gp在药动学与肿瘤耐药机制方面发挥了重要作用。一方面,它可影响药物的药动学过程,其介导了某些口服药物的肠肝循环,提高了药物的生物利用度; 另一方面,P-gp的高表达是临床上常见肿瘤多药耐药性产生比较经典的机制。因此,研究P-gp的诱导或抑制具有重要临床意义。
小类泛素修饰蛋白 (small ubiquitin-related modifier,SUMO) 是一类蛋白质翻译后修饰分子,包括SUMO1、SUMO2、SUMO3和SUMO4四种亚型。SUMO化修饰是指一个或多个SUMO分子与底物蛋白通过共价连接形成复合物,而SUMO分子在复合物发挥相应的功能后可以从靶蛋白上游离出来,实现去SUMO化[3]。在这个动态可逆的过程中,SUMO蛋白酶 (SUMO-specific proteases,SENPs) 发挥了 重要的作用。一方面,催化SUMO前体的成熟,启 动SUMO化修饰的第一步; 另一方面,催化底物去SUMO化,维持SUMO化与去SUMO化的平衡。尽管哺乳动物细胞中SUMO的底物非常广泛,但是至今发现的SENPs仅有6种,分别为SENP1、SENP2、SENP3、SENP5、SENP6和SENP7。研究表明,SENPs在基因转录、细胞周期及癌症发生发展等方面发挥了重要的调控作用。
核受体超家族中RXR、PPARγ、PPARα和LXR等成员均可以被SUMO修饰[4, 5, 6, 7]。SUMO化修饰通过影响NRs的核内再定位、异二聚体形成及与靶基因反应元件结合等方面,调节了NRs的转录功能。而SENPs作为SUMO化与去SUMO化平衡的杠杆,亦对NRs的转录调节通路产生重要作用。SENPs在对雄激素受体 (androgen receptor,AR)、雌激素 (estrogen receptor,ER) 和维生素D受体 (vitamin D receptor,VDR) 等核受体进行催化去SUMO化的同时,亦对其转录活性及下游相关靶基因的表达具有调控作用。已有研究表明,PXR可以被SUMO化,并抑制TNF-α诱导的炎症反应[8]。但是SENPs对PXR及其下游基因的影响仍不清楚。因此,本研究旨在探讨SENP1是否影响hPXR调控的P-gp基因 (MDR1) 转录活性及其下游基因MDR1的mRNA表达。
材料与方法 细胞与质粒HepG2细胞 (人肝癌细胞) 和LS174T细胞 (人结肠癌细胞) 购自中国科学院上海生命科学研究院细胞资源中心。pCMV-hPXR表达质粒由美国堪萨斯大学Jeff Staudinger教授惠赠; tk- MDR1-Luc报告基因质粒由美国匹兹堡大学Xie Wen教授惠赠; pFlag-hSENP1和pFlag-hSENP1m (SENP1酶活性位点突变质粒) 表达质粒由美国安德森癌症中心Edward T. H.Yeh教授惠赠; pRL-TK内参质粒购自Promega公司。
药物与试剂Dimethylsulfoxide (DMSO) 购自美国MP公司; 利福平 (rifampicin,RIF) 购自美国Sigma公司; 高糖DMEM培养基、胎牛血清、0.25%胰酶、PBS、Lipofectamine 2000、OPTI-MEM培养基及Trizol购自美国Life公司; 双荧光素酶报告基因试剂盒购自美国Promega公司; RT-PCR试剂盒及Real- time PCR荧光染料购自日本Takara公司; GAPDH、MDR1引物由美国Invitrogen公司设计合成。
主要仪器SW-CJ-2FD超净台,苏州苏净集团安泰公司; 311型CO2培养箱,美国Thermo公司; XSZ-D2显微镜,重庆光学仪器厂; ThermoMultiskan MK3酶标仪,美国Thermo公司; Infinite F500多标记分析仪,瑞士Tecan公司; 普通PCR仪,日本Takara公司; ABI 7500荧光定量PCR仪,美国Life公司。
细胞培养HepG2细胞和LS174T细胞置于含10% 胎牛血清、100 u∙mL-1青霉素和100 μg∙mL-1链霉素的高糖DMEM培养基中,37 ℃、5% CO2常规培养。
转染及给药待对数生长期HepG2和LS174T细胞长满80%~90%时,0.25%胰酶消化后以每孔0.8×104~1×104或2×105~3×105个细胞接种于96孔板或12孔板,12 h后用Lipofectamine 2000瞬时转染法将质粒转入细胞中。检测双荧光报告基因活性时,每孔各加入tk-MDR1-Luc (75 ng) 和pRL-TK (5 ng)。其中空白对照组为Empty Vector 60 ng; 单质粒组分别为pCMV-hPXR、pFlag-hSENP1或pFlag-hSENP1m各60 ng; 共转染组分别为pCMV-hPXR和pFlag-hSENP1或pFlag-hSENP1m各60 ng。质粒混合后与0.5 μL Lipofectamine 2000室温孵育20 min,加至96孔板中。检测基因表达水平时,各表达质粒用量调整为0.8 μg,按以上分组用4 μL Lipofectamine 2000转 入12孔板。转染后5~6 h,更换为含药DMEM完 全培养基,0.1% DMSO为空白对照组,RIF为阳性诱导组。
报告基因活性检测HepG2和LS174T细胞给药24 h后,弃去培养基,用PBS清洗1次,每孔加入 20 μL 1×被动裂解液 (Passive Lysis Buffer,PLB),室温下振荡15 min后置于Infinite F500多标记分析仪中。设置程序为自动加样,先加入Luciferase Assay Substrate 20 μL,检测萤火虫荧光素酶活性,再加入Stop&Glo Reagent 20 μL,检测海肾荧光素酶活性。计算时,以海肾荧光素酶活性值为内参进行校正,每孔荧光素酶活性值=萤火虫荧光素酶活性值/海肾荧光素酶活性值。0.1% DMSO作为对照组,将RIF处理组的荧光素酶活性值与之相比,以倍数表示活性值高低。
实时PCRHepG2和LS174T细胞给药24 h 后,弃去培养基,用PBS清洗1次,Trizol提取细胞 总RNA。超微量分光光度计测定RNA浓度,取1 μg逆转录成cDNA后进行实时荧光定量PCR检测。引物序列为: GAPDH上游引物: 5'-GGATTTGGTCGTA TTGGG-3',下游引物: 5'-GGAAGATGGTGATGGGA TT-3'; MDR1上游引物: 5'-CCATAGCTCGTGCCCTT GTTAGA-3',下游引物: 5'-CGGTGAGCAATCACAA TGCAG-3'。扩增条件为: 94 ℃×30 min → 95 ℃×5 s,60 ℃×34 s (40个循环) → 95 ℃×15 s → 60 ℃×1 min,95 ℃×15 s (融解曲线)。实验所得数据按2-ΔΔCt法进行计算分析,即首先利用ABI 7500数据分析软件对样品的荧光定量PCR反应结果进行分析并自动计算出Ct值,将各个样品中MDR1的Ct值减去内参GAPDH的Ct值得到ΔCt值。然后计算各个样品重复3次实验的平均ΔCt值,再将RIF组的平均ΔCt值减去DMSO组的平均ΔCt值,得到ΔΔCt值。最后按2-ΔΔCt计算基因表达倍数。
统计学方法各组实验均设有至少3次独立水平的重复实验,数据均以Mean ± SD表示,采用SPSS 20.0软件进行两独立样本t检验分析比较各组间差异。p < 0.05认为具有统计学差异。
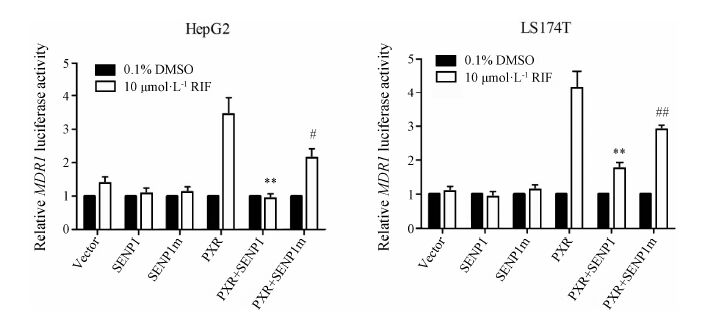
结果 1 SENP1对hPXR介导的MDR1报告基因活性的影响如图 1所示,在转染了空白、SENP1及SENP1m质粒后,利福平对HepG2及LS174T细胞中MDR1报告基因的活性均无明显影响。高表达hPXR后,利福平对上述两种细胞系中MDR1报告基因活性分别诱导至 (3.46 ± 0.84) 倍和 (4.17 ± 0.81) 倍。共转染SENP1后利福平的诱导作用明显下降,分别为 (0.95 ± 0.21) 倍和 (1.76 ± 0.31) 倍。而共转染SENP1m后利福平的诱导作用可升高至(2.49 ± 0.44) 倍和 (2.91 ± 0.21) 倍。结果均具有统计学意义 (p < 0.05)。因此,SENP1可以下调hPXR介导的MDR1报告基因活性。
|
Figure 1 RIF-induced MDR1 reporter activity in HepG2 and LS174T cells. **P < 0.01 vs PXR group; #p < 0.05,##p < 0.01 vs PXR+SENP1 group. RIF: Rifampicin; PXR: Pregnane X receptor; SENP1: SUMO-specific protease 1 |
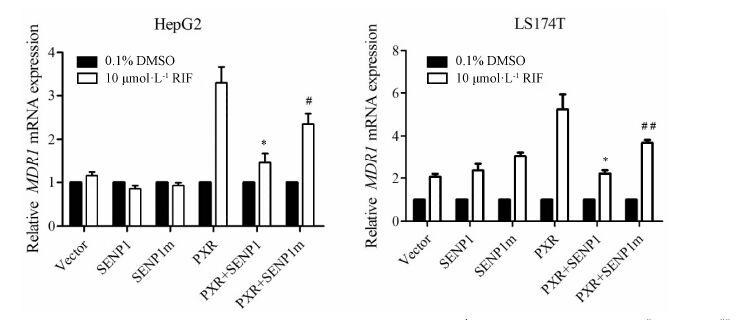
如图 2所示,利福平对转染了空白、SENP1及 SENP1m质粒的HepG2及LS174T细胞中MDR1 mRNA表达均无明显影响。高表达hPXR后,利福平对上述两种细胞系中MDR1 mRNA表达分别诱导至 (3.31 ± 0.62) 倍和 (5.23 ± 1.21) 倍。共转染SENP1后利福平的诱导作用明显下降,分别为 (1.45 ± 0.38)倍和 (2.21 ± 0.27) 倍。而共转染SENP1m后利福平的诱导作用可升高至 (2.35 ± 0.40) 倍和 (3.68 ± 0.23)倍。结果均具有统计学意义 (P < 0.05)。因此,SENP1可以下调hPXR介导的MDR1 mRNA的表达。
|
Figure 2 RIF-induced MDR1 mRNA expression in HepG2 and LS174T cells. P < 0.05 vs PXR group,#P < 0.05,##P < 0.01 vs PXR+SENP1 group |
近年来发现,SENPs在体内参与调控了细胞周期、生长发育、核糖体生成、基因转录及肿瘤新生血管的形成等过程。作为一个新型的基因转录调控分子,SENPs对核受体家族的转录调控主要通过以下3种方式进行: ① SENPs直接催化NRs去SUMO化,影响NRs二聚体形成及与靶基因反应元件结合。这是迄今发现的最普遍的调控方式。SUSP1 (SENP6) 催化RXRα-SUMO1去SUMO化,增强RXRα转录活 性[9]; SENP2催化PPARγ去SUMO化,增加其下游脂肪生成相关基因的表达[10]; SENP1及SENP2均可催化VDR-SUMO2去SUMO化,且SENP1能提高VDR对维生素D的敏感性,增加下游基因CYP24A1的表达[11]。② SENPs催化NRs相关的转录激活因子或阻遏因子如SRC-1、GRIP1和HDAC1等去SUMO化,间接影响NRs介导的转录过程。SENP1对HDAC1去SUMO化,从而增强AR的转录活性[12]。③ SENPs直接与NRs相互作用,影响其转录活性。SENP2可作为共调节分子抑制ER转录活性,从而抑制雌激素依赖性与非依赖性乳腺肿瘤细胞的增殖,SENP2对ER的这种转录调节并不依赖其去SUMO化酶活性,而是与其氨基末端的一个转录阻遏功能域相关[13]。
本实验室前期研究发现,PXR可被SUMO2和SUMO3修饰,且SENP1可以催化PXR去SUMO化,但SENP1对PXR的转录调控却未见国内外相关报道。因此,本研究采用了人肝癌细胞系HepG2及人结肠癌细胞系LS174T,通过双荧光素酶报告基因及实时荧光定量PCR两种方法,探讨SENP1对PXR的转录活性及其下游基因MDR1 mRNA表达的影响。研究结果显示,与空白质粒组相比,高表达SENP1组及SENP1m组利福平对MDR1报告基因活性及mRNA表达的诱导均无显著差异,表明SENP1或SENP1m对MDR1转录及基因表达没有直接影响; 而高表达PXR组利福平的诱导作用可达到3~6倍,由此证明PXR高表达模型构建成功。通过比较高表达PXR、高表达PXR+SENP1、高表达PXR+SENP1m的HepG2及LS174T细胞中利福平对MDR1的诱导作用,发现SENP1可以显著下调hPXR介导的MDR1转录活性及基因表达水平,且这种调节依赖于SENP1的酶活性。另外实验中观察到,无论是报告基因水平还是基因表达水平,LS174T细胞中利福平对高表达hPXR组的诱导作用以及SENP1对MDR1的下调程度均明显高于HepG2细胞,这与已知的LS174T细胞中P-gp表达较多有关。
P-gp过表达是肿瘤化疗失败、产生多药耐药的主要原因。临床上超过50% 抗肿瘤药物,如紫杉醇和长春新碱等,既是PXR的配体,又是P-gp的转运底物,因此导致化疗的不敏感性。本研究首次报道了SENP1可以下调hPXR介导的MDR1转录活性及其mRNA表达水平,但这仅仅是在转录及基因表达水平证实,下一步还需从蛋白层面观察SENP1对P-gp蛋白表达的影响,并进一步探讨SENP1调控MDR1表达的具体分子机制,为临床上抑制或逆转肿瘤的多药耐药提供新思路。
| [1] | Kliewer SA, Moore JT, Wade L, et al. An orphan nuclear receptor activated by pregnanes defines a novel steroid signaling pathway [J]. Cell, 1998, 92: 73-82. |
| [2] | Xu C, Li CY, Kong AN. Induction of phase I, II and III drug metabolism/transport by xenobiotics [J]. Arch Pharm Res, 2005, 28: 249-268. |
| [3] | Hannoun Z, Greenhough S, Jaffray E, et al. Post-translational modification by SUMO [J]. Toxicology, 2010, 278: 288-293. |
| [4] | Schneider Aguirre R, Karpen SJ. Inflammatory mediators increase SUMOylation of retinoid X receptor α in c-Jun N-terminal kinase-dependent manner in human hepatocellular carcinoma cells [J]. Mol Pharmacol, 2013, 84: 218-226. |
| [5] | Yamashita D, Yamaguchi T, Shimizu M, et al. The transactivating function of peroxisome proliferator-activated receptor γ is negatively regulated by SUMO conjugation in the amino-terminal domain [J]. Genes Cells, 2004, 9: 1017-1029. |
| [6] | Pourcet B, Pineda-Torra I, Derudas B, et al. SUMOylation of human peroxisome proliferator-activated receptor α inhibits its trans-activity through the recruitment of the nuclear corepressor NCoR [J]. J Biol Chem, 2010, 285: 5983-5992. |
| [7] | Lee JH, Park SM, Kim OS, et al. Differential SUMOylation of LXRα and LXRβ mediates transrepression of STAT1 inflammatory signaling in IFN-γ-stimulated brain astrocytes [J]. Mol Cell, 2009, 35: 806-817. |
| [8] | Hu G, Xu C, Staudinger JL. Pregnane X receptor is SUMOylated to repress the inflammatory response [J]. J Pharmacol Exp Ther, 2010, 335: 342-350. |
| [9] | Choi SJ, Chung SS, Rho EJ, et al. Negative modulation of RXRα transcriptional activity by small ubiquitin-related modifier (SUMO) modification and its reversal by SUMO- specific protease SUSP1 [J]. J Biol Chem, 2006, 281: 30669-30677. |
| [10] | Chung SS, Ahn BY, Kim M, et al. SUMO modification selectively regulates transcriptional activity of peroxisome- proliferator-activated receptor γ in C2C12 myotubes [J]. Biochem J, 2011, 433: 155-161. |
| [11] | Lee WP, Jena S, Doherty D, et al. Sentrin/SUMO specific proteases as novel tissue-selective modulators of vitamin D receptor-mediated signaling [J]. PLoS One, 2014, 9: e89506. |
| [12] | Cheng J, Wang D, Wang Z, et al. SENP1 enhances androgen receptor-dependent transcription through desumoylation of histone deacetylase 1 [J]. Mol Cell Biol, 2004, 24: 6021-6028. |
| [13] | Nait Achour T, Sentis S, Teyssier C, et al. Transcriptional repression of estrogen receptor α signaling by SENP2 in breast cancer cells [J]. Mol Endocrinol, 2014, 28: 183-196. |
 2015, Vol. 50
2015, Vol. 50


