小G蛋白是真核生物的1个超基因家族,分为Ras、Rho、Rab、Sar/Arf和Ran 5个亚家族,小GTPase是真核生物中成员数量较多的一类信号转导蛋白,分别参与细胞骨架组装、基因表达、细胞壁合成、囊泡运输、核质运输、微管形成及细胞极性生长等诸多生命体活动过程[1]。Ras家族调控基因的表达; Rho家族调控细胞骨架重组、基因表达、细胞壁合成、H2O2产生、细胞周期、MAPK激酶信号的转导、真核生物细胞分化和氧化还原反应等; Rab家族和Sar/Arf家族调控囊泡运输和笼形蛋白的形成; Ran家族调控核质运输、微管形成、有丝分裂的纺锤体形成及细胞分裂后核膜的组装[2]。
菌核是菌丝遭遇环境胁迫纽结而成的休眠结构,Ras蛋白已经被发现能够调控MAPK信号途径,诱导核盘菌菌核的形成[3]。然而,目前对其他小G蛋白在菌丝形成菌核过程中的调控机制研究尚属空白。
猪苓菌核具有利水渗湿之药效[4],是我国重要的中药资源。现代中药化学证明其具有抗癌、抗菌、抗炎、促进头发生长等药理活性[5]。随着其药用范围及需求量不断扩大,猪苓菌核的野生资源正面临枯竭。人工培养猪苓菌丝形成菌核是解决猪苓资源问题的有效途径之一,然而,对猪苓菌丝形成菌核的分子机制研究仍处初期。本研究以猪苓菌丝经人工培养形成的菌核为对象,采用RACE技术克隆4种小GTPase基因,进行生物信息学、系统进化及猪苓菌丝形成菌核过程中表达模式等特征分析,旨在为深入研究该4种基因在猪苓菌丝形成菌核过程中的分子调控作用提供科学理论基础。
材料与方法 材料猪苓纯培养菌株由中国医学科学院药用植物研究所真菌室提供。 猪苓菌核的培养
依据本实验室先前研究的方法[6],将猪苓菌丝放入人工培养基中进行培养。分别取初期菌核、发育菌核 (SI、SD) 和生长时期未形成菌核的菌丝 (HI、HD) 作为材料,用液氮预冷处理并放入−80 ℃冰箱中保存,用以备提RNA。
总RNA提取及检测依据CTAB法[7]提取总RNA,NanoDropTM 2000分光光度计 (Thermo Fisher Scientific,USA) 检测RNA的浓度与质量,1.2% 的琼脂糖凝胶电泳检测RNA的完整性。
RACE-PCR和基因克隆为了得到完整的小GTPase基因cDNA,采用RACE-PCR来获取基因全长。根据已知的EST序列,利用Primer 6软件分别设计5'-RACE和3'-RACE引物 (表 1)。
|
|
Table 1 Primer sequences of the four small GTPase genes |
使用BD PowerScriptTM Reverse Transcriptase (Clotech,USA) 试剂盒获取3'-RACE-Ready cDNA及5'-RACE-Ready cDNA。总反应体积为25 µL,包括: 2.5 µL 10×Advantage® 2 PCR buffer、0.5 µL dNTPs (10 mmol·L−1)、0.5 µL 5'-RACE或3'-RACE引物 (10 µmol·L−1)、0.5 µL 10×UPM (Universal Primer A Mix)、1 µL 5'-RACE-Ready cDNA或3'-RACE-Ready cDNA、0.5 µL 50×Advatange® 2 Polymerase Mix (5 U·L−1) 和18.5 µL ddH2O。扩增反应条件为: 94 ℃ 30 s,72 ℃ 3 min,5个循环; 94 ℃ 30 s,70 ℃ 30 s,72 ℃ 3 min,5个循环; 94 ℃ 30 s,68 ℃ 30 s,72 ℃ 3 min,20个循环; 72 ℃延伸7 min。用1.2% 的琼脂糖凝胶电泳分离得到目的条带,经切胶回收后克隆到pGEM-T载体 (Promega,USA),然后经转化到E. coli JM109细胞 (TaKaRa,China) 中。经PCR检测后,北京金唯智生物科技有限公司对阳性克隆进行测序。
生物信息学分析利用以下在线生物信息分析工具对获得的全长cDNA进行序列分析,BLAST (http:// www.ncbi.nlm.nih.gov/blast/),ORF Finder (http://www. ncbi.nlh.nih.gov/gorf/gorf.html)。利用PrePS软件分析异戊二烯化位点,应用Bioeditor 7.5进行多序列比对,用MEGA 6.0软件对其进行系统发育分析和进化树的构建。
实时荧光定量PCR分析使用MMLV Reverse Transcriptase (Promega,USA) 试剂盒对样本SI、SD、HI、HD进行反转录。利用Primer 6软件设计引物 (表 2),利用实时荧光定量PCR方法分析不同样本中猪苓4种小GTPase基因的表达量变化,qPCR分析以猪 苓18S rRNA基因作为内参基因。使用SYBR® Premix ExTaqTM试剂盒 (TaKaRa,China) 进行qPCR反应,其体系为15 µL,其中包括7.5 μL 2×SYBR® Premix ExTaqTM Master Mix、0.5 μL引物 (10 μmol·L−1)、0.5 μL ROX Reference Dye、2 μL cDNA模板以及4 μL ddH2O。反应程序设定如下: 预变性95 ℃ 30 s; 95 ℃ 5 s,60 ℃ 34 s,40个循环,同时绘制熔解曲线。ABI PRISM 7500软件自动生成Ct (cycle threshold) 值,∆∆CT法计算相对表达量[8]。
|
|
Table 2 qPCR primer sequences of the four small GTPase genes |
1 猪苓小GTPase基因的克隆
利用3'-RACE PCR技术分别以3'-RACE GCTTG TCATTGTCGGTGATGGTGC、3'-RACE TCCTCCCA CCCTCCTTGTTTCTTCTC为引物克隆片段,分别克隆、测序得到356 bp及425 bp的两个序列,拼接后得到698 bp及837 bp的猪苓两个小GTPase全长cDNA,BlastX比对分析结果显示这两个序列与Piriformospa indica的GTPase Rho1蛋白的一致性分别为85%和84%,同源性均为92%。因此定名为PuRhoA1 (GenBank登录号为JX035917) 及PuRhoA2 (GenBank登录号为JX035918)。PuRhoA1全长698 bp,ORF区共585 bp,编码194个氨基酸,推测分子量为21.75 kD,理论等电点为6.44。PuRhoA2全长837 bp,ORF区共585 bp,编码194个氨基酸,推测分子量为21.75 kD,理论等电点为6.33。
利用5'-RACE反应,以GTCTTGCTTGTTGCTC CGTTTCGC为引物,扩增产生长度约为370 bp的目标条带,克隆、测序获得355 bp的序列,拼接分析获得了一条896 bp的cDNA。BlastX比对分析结果显示其与灰盖鬼伞 (Coprinopsis cinerea) 的小GTPase ypt1蛋白一致性为93%,同源性为95%,因此定名为Puypt1 (GenBank登录号为JX035919)。该猪苓小GTPase基因的ORF区共615 bp,编码204个氨基酸,推测分子量为22.556 kD,理论等电点为5.75。
利用5',3' RACE PCR技术以5'-RACE GCGG TGTCGAGAACGTCGAGGAGA及3'-RACE GTCTA CTCAATCACCTCCCGCAACTCG为引物克隆片段。PCR克隆所得片段与原始的EST序列进行聚类拼接后得到了803 bp的猪苓小GTPase全长cDNA。经BlastX比对分析,其与Tremetes hirsuta的RAS蛋白具有90% 同源性,因此定名为PuRas (GenBank登录号为JX035920)。该猪苓小GTPase基因的ORF区共639 bp,编码212个氨基酸,推测分子量为23.821 kD,理论等电点为5.2。
2 猪苓小GTPase基因编码蛋白的序列分析2.1 小GTPase基因编码蛋白的结构域预测
小GTPase家族的氨基酸序列高度同源,结构域高度保守。包含4个 (Ⅰ、Ⅱ、Ⅲ和Ⅳ) 保守的GTP结合结构域以及1个与下游效应分子结合的效应区E,GTP结合结构域又分5个保守模体 (motif),还存在GTP/Mg2+结合位点。Rab、Ras和Rho亚家族蛋白质的C末端呈现异戊二烯化的结构,能够被脂质化修饰。BlastP分析PuRas克隆得到的小GTPase全长cDNA,该序列与Trametes hirsuta的RAS蛋白一致性为82%,同源性为90%; 与灰盖鬼伞的RAS蛋白的一致性为81%,同源性为88%。PRS-BLAST分析氨基酸的保守结构域,该序列具有Ras的完整保守结构域。结果表明,克隆得到的全长PuRas为一新的编 码Ras GTPase的基因。PrePS软件分析PuRas的异戊二烯化位点,PuRas具有法尼酰转移酶催化位点 (FT-CaaX)。
BlastP分析Puypt1克隆得到的小GTPase全长cDNA,该序列与灰盖鬼伞的小GTPase ypt1蛋白一致性为93%,同源性为95%; 与丝黑穗菌 (Sporisorium reilianum) 的GTP-binding protein ypt1的一致性为87%,同源性为92%。PRS-BLAST分析氨基酸的保守结构域,该序列具有小GTPase家族中Rab1-Ypt1的完整保守结构域。结果表明,克隆得到的全长Puypt1为一新的编码GTPase ypt1的基因Puypt1。PrePS软件分析Puypt1的异戊二烯化位点,Puypt1具有香叶烯基转移酶催化位点 (GGT2-Rab)。
BlastP分析PuRhoA1和PuRhoA2克隆得到的 小GTPase全长cDNA,两个序列与Piriformospora indica的GTPase Rho1蛋白的一致性分别为85% 和84%,同源性均为92%; 与丝黑穗菌的GTP结合蛋白ypt1的一致性分别为83% 和81%,同源性为90% 和91%。PRS-BLAST分析氨基酸的保守结构域,两个序列均具有小GTPase家族中RhoA的完整保守结构域。结果表明,克隆得到的全长PuRhoA1和PuRhoA2为新的编码GTPase RhoA的基因。PrePS软件分析PuRhoA1和PuRhoA2的异戊二烯化位点,PuRhoA1具有法尼酰转移酶催化位点 (FT-CaaX) 和香叶烯基转移酶催化位点 (GGT1-CaaX),而PuRhoA2仅具有香叶烯基转移酶催化位点 (GGT1-CaaX)。
2.2 小GTPase基因编码的蛋白聚类比对分析通过NCBI检索选取高等真菌中的小GTPase序列利用MEGA 6.0构建了包括PuRas、Puypt1、PuRhoA1及PuRhoA2在内共33个小GTPase的系统进化树 (图 1)。序列包括Trametes hirsuta、Pisolithus sp、Lentinula edodes、Coprinopsis cinerea、Suillus bovinus、Cryptococcus neofomans、Mucor circinellaides、Sclerotinia sclerotiorum、Schizosaccharomyces pombe、Hypocrea jecorina、Sciaenops ocellatus、Mus musculus、Capsaspora owczarzaki、Puccinia graminis、Candida orthopsilosis、Verticillium dahliae、Grosmannia clavigera、Rhizopus oryzae、Sporisorium reilianum、Schizophyllum commune、Serpula lacrymans、Amylomyces rouxii、Aspergillus awamori、Blumeria graminis、Cordyceps militaris。进化树分为两大群系: Ras类和Rho类,PuRas和Puypt1属于Ras群系,PuRhoA属 于Rho群系。Ras群系又分为两个姊妹群,PuRas和Puypt1分别属于这两个群系,且都在各自群系的担子菌分支中。PuRas同其他担子菌相比与香菇在进化关系上更近,属于同一分支。Rho群系中担子菌类和子囊菌类为一单系群,同酵母类平行分支。在这一单系群中丝黑穗菌与担子菌类和子囊菌类平行分支,PuRhoA属于担子菌单系群,但PuRhoA1、PuRhoA2并没聚在同一分支形成猪苓单系群,而是各自同其他担子菌平行分支。表明PuRhoA1、PuRhoA2在进化上是Rho类的两个类群。
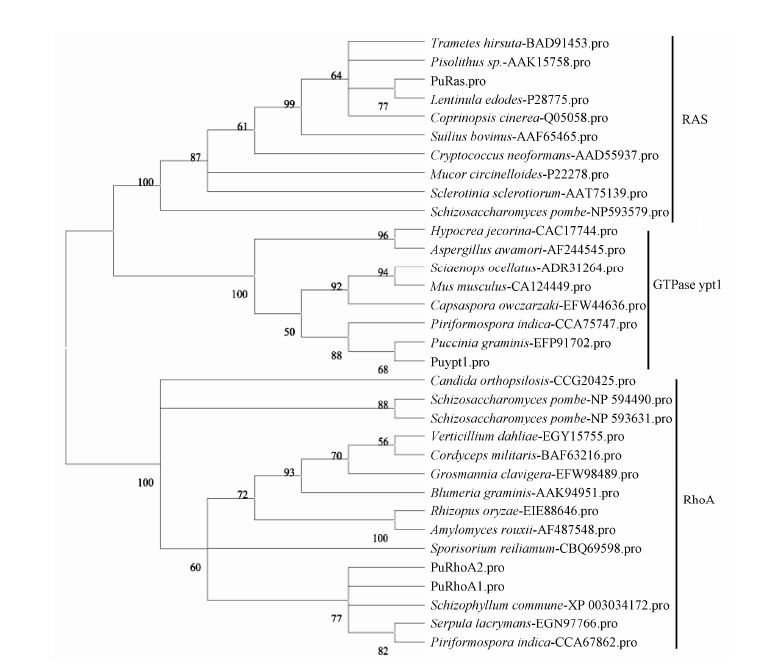
|
Figure 1 Phylogenetic tree of related fungi inferred from small GTPase proteins |
取原基期 (SI) 的菌核和未形成菌核的菌丝体 (HI) 总RNA,利用荧光定量PCR方法测定mRNA的表达量。以菌丝样本为对照组,检测了猪苓PuRas(Pu0013)、Puypt1 (Pu616)、PuRhoA (Pu838、Pu1343) 在菌核形成初期菌核和菌丝组织间的转录水平差异(图 2)。在菌核形成初期,Puypt1、PuRas、PuRhoA1在菌核中表达量高于菌丝,分别为5.112倍、9.01倍和7.863倍,而PuRhoA2在菌核中的表达量低于菌丝,仅为0.096倍。结果表明在猪苓菌核形成初期,菌核中的小GTP蛋白基因表达量与菌丝组织间存在显著差异,其中Ras、Ypt1和Rho一类型在菌核中特异高水平转录,而另一类型Rho在未形成菌核的菌丝中特异高水平转录。
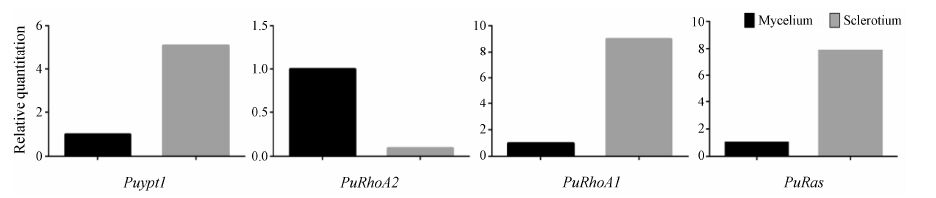
|
Figure 2 Differential expression analysis of small GTPase gene during sclerotial growth |
小G蛋白家族 (small GTPase) 是普遍存在于真核细胞中的一类GTP结合蛋白家族,小GTP结合蛋白分子量大约在20~30 kD之间,以单体形式存在。Ras是第一个被发现的小G蛋白基因,是肉瘤病毒的致癌基因,刺激细胞的增值和分化。研究发现,Ras能够调控NADPH氧化酶,增加细胞内的ROS[9]。有趣的是,在猪苓菌核形成初期,其细胞内的ROS也会增加[10],这个结果提示Ras可能参加了ROS的调控过程。
酵母中发现的第一个小G蛋白基因YPT1,是连接肌动蛋白与微管蛋白之间的一个开放阅读框编码基因。Arf作为小G蛋白起初被认为是ADP-核糖糖基化的激活辅因子。研究证明YPT1在细胞囊泡运输过程中扮演着重要的角色。在酵母细胞的内质网、高尔基体、胞体小泡的间隔以及液泡上,均有YPT1蛋白分布[11]。跨膜蛋白、分泌蛋白和可融性蛋白通过囊泡运输到相应的细胞器。YPT1在供体膜上囊泡的萌发、接受体膜确定目标囊泡、囊泡与接受体膜粘附和接受体膜与囊泡锚定融合这4个囊泡运输过程中均起到了调控作用[12]。菌核形成过程中会有大量菌丝不断的分化,菌丝顶端泡囊在菌丝分分化过程中起着非常重要的作用[13]。依据以上理论推测,YPT1可能在菌丝泡囊的形成过程中起到了调控作用,参加了菌核形态发生过程。
Rho家族由Rac、Rho、Cdc42组成,植物中存在着与Rho同源的Rop。Rho在酵母细胞和哺乳动物 细胞中的调控功能类似,调控细胞骨架重组、细胞 壁合成、细胞周期、细胞分化和氧化还原反应等[14]。在哺乳动物中研究发现了一种依赖Rac蛋白来调节NADPH氧化酶的系统[15]。植物中也鉴定了1个类似哺乳动物的NADPH氧化酶调控系统,然而不同之处在于植物以Rop来调控NADPH氧化酶活性[16],Rop的调控方式是作为NADPH氧化酶的调节亚基来激活其活性。在酵母中发现,Rho同样具有抗氧化作用,通过与谷胱甘肽相结合应对细胞内的氧化应激反 应[17]。如前文所述,猪苓菌核形成时其细胞内的ROS会增加,过量的ROS会导致细胞死亡,细胞会产生与氧化应激相关的酶以减少ROS对细胞造成的损 伤[18]。在猪苓菌核发生的过程中,Rho可能通过结合谷胱甘肽应对氧化应激对细胞造成的损伤。
本研究在猪苓中克隆得到4个小G蛋白基因,分别属于3类小G蛋白,PuRas、PuRab、PuRhoA1和PuRhoA2。这些基因在菌核形成初期时在菌核组织和未形成菌核的菌丝组织间差异表达,其中PuRas、PuRab、PuRhoA2在菌核中特异高表达,研究发现菌核分化与氧化应激相关连,氧化应激启动了Sclerotinia rolfsii的菌丝进行分化产生菌核[19]。PuRas的高表达可能增加了细胞内的ROS; PuRhoA2在菌核中特异高表达在细胞中可起到抗氧化作用,因而对猪苓细胞起到保护作用。PuRhoA1在菌丝中特异高 表达,Rho两个基因表达模式的差异性可能与其不同的修饰化位点相关。Ras蛋白已经被发现能够调控MAPK信号途径,诱导核盘菌菌核的形成[3]。小G蛋
白在猪苓菌丝形成菌核过程中,尤其是形成初期具有表达特异性,表明其可能参与了猪苓菌核的形态发育,具体功能鉴定有待进一步研究。
| [1] | Wennerberg K, Rossman KL, Der CJ. The Ras superfamily at a glance [J]. J Cell Sci, 2005, 118: 843-846. |
| [2] | Takai Y, Sasaki T, Matozaki T. Small GTP-binding proteins [J]. Physiol Rev, 2001, 81: 153−208. |
| [3] | Chen C, Dickman MB. cAMP blocks MAPK activation and sclerotial development via Rap-1 in a PKA-independent manner in Sclerotinia sclerotiorum [J]. Mol Microbiol, 2005, 55: 299-311. |
| [4] | Xing YM, Zhang LC, Liang HQ, et al. Sclerotial formation of Polyporus umbellatus by low temperature treatment under artificial conditions [J]. PLoS One, 2013, 8: e56190. |
| [5] | Zhao Y, Xie RM, Chao X, et al. Bioactivity-directed isolation, identification of diuretic compounds from Polyporus umbellatus [J]. J Ethnopharmacol, 2009, 126: 184-187. |
| [6] | Liu YY, Guo SX. Nutritional factors determining sclerotial formation of Polyporus umbellatus [J]. Lett Appl Microbiol, 2009, 49: 283-288. |
| [7] | Logemann J, Schell J, Willmitzer L. Improved method for the isolation of RNA from plant tissues [J]. Anal Biochem, 1987, 163: 16-20. |
| [8] | Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR [J]. Nucleic Acids Res, 2001, 29: e45. |
| [9] | Madaule P, Axel R. A novel ras-related gene family [J]. Cell, 1985, 41: 31-40. |
| [10] | Xing YM, Chen J, Song C, et al. Nox gene expression and cytochemical localization of hydrogen peroxide in Polyporus umbellatus sclerotial formation [J]. Int J Mol Sci, 2013, 14: 22967-22981. |
| [11] | Hall A. Rho GTPases and the control of cell behaviour [J]. Biochem Soc Trans, 2005, 33: 891-895. |
| [12] | Park J, Choi HJ, Lee S, et al. Rac-related GTP-binding protein in elicitor-induced reactive oxygen generation by suspension-cultured soybean cells [J]. Plant Physiol, 2000, 124: 725-732. |
| [13] | Bolton MD, Thomma BPHJ, Nelson BD. Sclerotinia sclerotiorum (Lib.) de Bary: biology and molecular traits of a cosmopolitan pathogen [J]. Mol Plant Pathol, 2006, 7: 1-16. |
| [14] | Jones MA, Raymond MJ, Yang Z, et al. NADPH oxidase- dependent reactive oxygen species formation required for root hair growth depends on ROP GTPase [J]. J Exp Bot, 2007, 58: 1261-1270. |
| [15] | Lee ME, Singh K, Snider J, et al. The Rho1 GTPase acts together with a vacuolar glutathione S-conjugate transporter to protect yeast cells from oxidative stress [J]. Genetics, 2011, 188: 859-870. |
| [16] | Weyemi U, Lagente-Chevallier O, Boufraqech M, et al. ROS-generating NADPH oxidase NOX4 is a critical mediator in oncogenic H-Ras-induced DNA damage and subsequent senescence [J]. Oncogene, 2012, 31: 1117-1129. |
| [17] | Adachi Y, Shibai Y, Mitsushita J, et al. Oncogenic Ras upregulates NADPH oxidase 1 gene expression through MEK- ERK-dependent phosphorylation of GATA-6 [J]. Oncogene, 2008, 27: 4921-4932. |
| [18] | Li H, Yao W, Fu Y, et al. De Novo assembly and discovery of genes that are involved in drought tolerance in tibetan Sophora moorcroftiana [J]. PLoS One, 2015, 10: e111054. |
| [19] | Kim HJ, Chen C, Kabbage M, et al. Identification and characterization of Sclerotinia sclerotiorum NADPH oxidases [J]. Appl Environ Microbiol, 2011, 77: 7721-7729. |
 2015, Vol. 50
2015, Vol. 50


