2. Global Chemical and Pharmaceutical Development, Research Center Wuppertal-Aprath, Bayer Pharma AG, Wuppertal 42096, Germany
2. Global Chemical and Pharmaceutical Development, Research Center Wuppertal-Aprath, Bayer Pharma AG, Wuppertal 42096, Germany
布地奈德为一种强效的糖皮质激素,是抗哮喘的常用药,一般以肺部吸入的方式发挥作用,基于病情严重程度的不同,每天吸入剂量在160~640 μg之间。然而,布地奈德的长期频繁给药,会产生许多不良反应,如生长抑制、皮肤变薄、骨密度下降和白内障[1]。因此需要制备具有缓释作用的布地奈德肺部吸入制剂,延长作用时间,降低吸入次数,减少不良反应的发生。壳聚糖是药剂学领域使用最广泛的天然聚合物之一,具有生物相容性、生物可降解性、对人体的毒性及免疫原性均较低的特点,是能广泛开发应用的新一代辅料[2, 3]。以壳聚糖为载体材料制备而成的制剂能控制药物释放,吸入壳聚糖粒子后,其生物黏附性可能有助于增强药物的吸收[4],因此壳聚糖用于肺部吸入载体的报道较多[5, 6, 7, 8]。壳聚糖还能提高喷雾干燥所得粉末的分散性,提高其肺部沉积率[9]。
最适于肺部吸入的药物粒子,其空气动力学粒径应在1~5 μm之间,过大的粒子会由于惯性碰撞过早沉积在口咽部或支气管处,过小的粒子会因为质量太轻而呈悬浮状态,容易被患者呼出[10]。然而,处于该粒径范围内的粒子黏结性较强,流动性和可雾化性都很差,容易导致给药时定量不准确。为了提高吸入性粉末的流动性和可分散性,加入α-乳糖一水合物,进行充分混合,使粉末黏附在乳糖粗颗粒上,形成一种具有相互作用的物理混合物[11]。在制备生产以乳糖为药物载体的干粉吸入剂中,粉末混合是最关键的操作步骤之一,因为最终产品的雾化性能不仅取决于混合过程中混合速度、混合时间和混合比例等参数的优化,也取决于药物粒子在载体表面的分布情况[12]。药物粒子与乳糖载体之间的作用力必须适中,作用力太弱会使前者在混合及后续分装等操作步骤中受力,与乳糖分离,导致产品含量均匀度较差; 作用力太强又会使药物粒子随气流进入人体后不易与乳糖载体分离而沉积在口咽部,难以进入细支气管及肺深部发挥疗效。
本研究中,以抗哮喘药布地奈德为模型药物、壳聚糖为载体材料,结合高压匀质和喷雾干燥法制备了高载药量的布地奈德缓释微粒,通过加入乳糖改善处方的流动性,考察混合速度、混合时间及乳糖用量对布地奈德缓释微粒性质的影响。
材料与方法 仪器AH 100D高压匀质机 (ATS工业系统有限公司); SD-1000型喷雾干燥机 (日本东京理化器械株式会社); 马尔文激光粒度仪Nano-ZS90; 马尔文激光粒度仪Mastersizer 2000; VORTEX GENIUS 3漩涡混合器 (IKA集团); Agilent 1100型高效液相色谱仪 (安捷伦科技有限公司)。
材料布地奈德原料药 (湖北葛店人福药业有限公司); Tween 80 (南京威尔化工有限公司); 壳聚糖 (相对分子质量200 kDa,脱乙酰度≥85%,济南海得贝海洋生物工程有限公司); 冰醋酸 (天津科密欧化学试剂有限公司); 乳糖 (Lactohale® 200,DFE Pharma公司); 色谱纯甲醇 (山东禹王实业有限公司化工分公司)。
布地奈德微粒的制备将布地奈德粗粉末 (0.5%,w/v) 在适度搅拌下分散于浓度为0.1% Tween 80溶液中,粗混悬液经高压匀质机先在150 bar (1 bar= 100 kPa) 低压力下匀质20个循环,然后分别在300、600及900 bar的压力条件下进行3个循环匀化,最后在1 200 bar压力条件下匀质15个循环即得到布地奈德的纳米混悬液。
称取一定量的壳聚糖,加入1.0%(v/v) 醋酸水溶液搅拌使其溶解并控制其浓度为0.6% (w/v),该溶液经0.8 μm微孔滤膜滤过后,加入一定量的含药纳米混悬液,使理论载药量达到20.0%(w/w)。喷雾干燥机参数设置如下: 喷嘴直径0.5 mm、进口温度110 ℃、气流速度0.7 m3·min−1、进料速度3.0 mL·min−1、雾化压力200 kPa,收集所得微粒。
粒径及含药量的测定制备的纳米混悬液经水稀释至一定浓度后用马尔文激光粒度仪Nano-ZS90测定其粒径分布以及多分散指数,以保证样品的分散均匀性。
壳聚糖微粒粒径及其分布由马尔文激光粒度仪Mastersizer 2000进行测定,用体积平均粒径D(4,3)作为粒子几何直径的衡量参数,用跨距作为粒子粒径分布的衡量参数,跨距计算公式如下:
| Span = (D0.9 − D0.1) / D0.5 | (1) |
式中,D0.1、D0.5和D0.9分别表示在粒径累积分布图 (以累积频率为纵坐标、以粒径为横坐标绘得的曲线) 中相应于频率10%、50% 和90% 处粒径。每个样品的粒径平行测定3份。
载药量的测定方法如下: 称取一定量的布地奈德微粒,加入少量1.0% (v/v) 醋酸水溶液使其溶解充分,用甲醇稀释定量后离心取上清液采用标准品对照法用高效液相色谱法进行分析。色谱条件如下: 色谱柱: ZORBAX SB-C18分析柱 (150 mm × 4.6 mm,5 μm); 流动相: 甲醇−水72∶28 (v/v); 流速: 1 mL·min−1; 检测波长: 248 nm; 进样量: 10 μL; 柱温: 40 ℃。载药量 (DL) 通过以下公式计算:
| \[DL\% = \frac{{Weight{\rm{ of drug contained}}}}{{Whole{\rm{ weight of the mircoparticle}}}} \times 100\% \] | (2) |
精确称取适量 (相当于药物约210 μg) 载药粉末分别分散于5.0 mL含0.5% (w/v)、1.0% 和1.5% Tween 80磷酸盐缓冲液
(10 mmol·L−1,pH 7.25~7.30) 中,并置于恒温振荡器中 [80 r·min−1,(37 ± 1) ℃] 连续振摇孵化。在既定时间点取出样品于4 000 r·min−1条件下离心5 min后,从上层取1.0 mL溶出介质,于10 000r·min−1再离心10 min,最后取少量上层溶出介质用高效液相色谱法测定药物含量。同时,及时补入新的1.0 mL溶出介质于原样品中重新分散并置于溶出条件下继续振摇考察,每个浓度点平行测定3份。
布地奈德微粒/乳糖混合物的制备称取一定 量的布地奈德微粒粉末,按药粉∶乳糖质量比1∶1、1∶5、1∶10和1∶20进行混合。参照文献[13]报道,以“三文治”的方式将药粉置于两层乳糖中,漩涡混合器调至500 r·min−1先预混合15 min,将混合物过125 μm筛网以除去大的聚集粒子,再按一定振动强度混合。每种混合物都按200 mg的量制备。
药物含量均匀度每种混合物的含量均匀度通过测定其中布地奈德的含量来评价。从每种混合物中随机抽取10 mg样品10份并溶解于一定量1.0% (v/v) 醋酸水溶液中,用甲醇稀释定容后离心取上清液,用高效液相色谱法测定其实际含药量。回收率以实际含药量与理论含药量的百分比表示,混合物的药物含量均匀度以回收率的相对标准偏差表示。
粉末流动性松密度 (bulk density,ρb) 和振实密度 (tap density,ρt) 是干粉吸入处方的重要性质。将一定量已知质量的粉末 (约100 mg) 装入定制的10 mL (± 0.05 mL) 带刻度细长小量筒内并记录初始体积。然后人工敲击量筒约500次,直到内部粉体压缩到体积最终恒定并记录终末的粉体体积。未经敲击时粉体的密度为松密度,敲击完成后粉体的密度为振实密度。卡尔指数 (Carr’s index,CI) 和豪斯纳比 (Hausner ratio,HR) 通过以下公式计算:
| \[CI\% = \frac{{{\rho _t} - {\rho _b}}}{{{\rho _b}}} \times 100\% \] | (3) |
| \[HR=\frac{{{\rho }_{t}}}{{{\rho }_{b}}}\] | (4) |
当卡尔指数小于25% 并且豪斯纳比小于1.25时,表明粉体的流动性能较好。
体外沉积分布干粉吸入剂的体外空气动力学沉积分布可通过新一代药用撞击器 (next generation impactor,NGI) 进行测定。在测定前NGI的收集盘内需要涂布一层薄膜以减少粒子的夹带现象造成的损失与分布测定误差。具体操作: 在每个盘内加入预先配好的10% Tween 20 (w/v) 乙醇溶液并放入通风橱内约30 min,挥发乙醇。根据美国药典和欧洲药典要求,对干粉吸入剂的体外空气动力学沉积分布进行评价时,气流速度应足以使吸入装置内产生4 kPa的压力差。本研究中采用的吸入装置Cyclohaler® (荷兰Teva Pharmaceuticals公司),阻力较小,必须在高流速 (100 mL·min−1) 条件下才能满足该要求,具体操作步骤如下。
采用3号羟丙甲纤维素胶囊装载处方粉末。平均每个胶囊装量20 mg,若干个胶囊根据累计测定作为一组测定值 (依处方含药量的不同胶囊数在2~30个不等)。将胶囊装入吸入装置Cyclohaler®中刺破,通过适配器 (Adaptor) 连接到NGI上。以100 mL·min−1气流速度进行粉末的喷发,当胶囊累积激发分散沉积后,首先使用1.0%(v/v) 醋酸水溶液清洗浸泡NGI每个组成部件里收集粒子。待粒子充分溶解后,加入甲醇充分溶解药物并移到量瓶定容至刻度。回收的粉末剂量 (recovered dose,RD) 即为各组件回收剂量之和 (胶囊、吸入器、适配器、人工喉、预分离器及所有分级)。回收率为回收剂量与理论递送剂量之比 (公式5)。可吸入组分百分比 (fine particle fraction%,FPF%) 及几何标准偏差值 (geometric standard deviation,GSD) 的计算见公式6和7,质量中值空气动力学直径 (mass median aerodynamic diameter,MMAD,M) 为粒子质量空气动力学粒径的中位数。上述参数亦可直接由NGI配备软件计算得到。所测处方每个样品平行测定3份。
| \[Recovery\% = \frac{{{\mathop{\rm Re}\nolimits} {\mathop{\rm cover}\nolimits} {\rm{ dose}}}}{{Inital{\rm{ deliverd dose}}}} \times 100\% \] | (5) |
| \[FPF\% = \frac{{{M_{Stape{\rm{ }}1 - 5}}}}{{{\mathop{\rm Re}\nolimits} {\mathop{\rm cov}} erd{\rm{ }}does}} \times 100\% \] | (6) |
| $$GSD = \sqrt {\frac{{{D_{84.14\% }}}}{{{D_{15.87\% }}}}} $$ | (7) |
本文实验数据以平均值±标准差的形式表示。两组数据之间显著性差异用单因素方差分析进行,P < 0.05表示有统计学差异。
结果 1 布地奈德壳聚糖微粒的性质布地奈德纳米混悬液制备后加入壳聚糖溶液 中通过喷雾干燥制备的微粒体积中值直径为 (7.97 ± 0.04) μm,跨距为1.31 ± 0.022,虽然微粒的几何粒径大于5 μm,但所得粉末的振实密度只有0.146 g·mL−1 (表 1),通过NGI测得其质量中值空气动力学直径为4.458 μm (表 2),可吸入组分百分比达46.0%。
|
|
Table 1 Micromeritic properties of the physical mixture of budesonide loaded chitosan microparticle with lactose |
|
|
Table 2 Next generation impactor test results of the physical mixture of budesonide loaded chitosan microparticle with different lactose ratio. MMAD: Experimental mass median aerodynamic diameter; GSD: Geometric standard deviation |
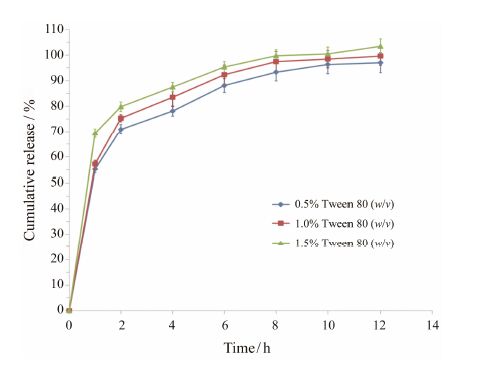
近年来大量关于肺部吸入制剂体外释放方法的报道,如桨法、流通池法和扩散池法,但美国药典委员会认为,上述方法并没有运用到各种肺部吸入制剂中,由于肺液量极小,肺表面活性剂等体内特征难以模拟等原因,制定一套法定方法的任务有困难[14]。而在本研究中,作者用5.0 mL磷酸盐缓冲液 (pH 7.25~7.30) 模拟肺液,通过控制加入Tween 80的量在非漏槽和漏槽条件下分别考察了药物的体外释放行为。在非漏槽条件下 (0.5% 和1.0% Tween 80),药物在1 h时的突释量为56.2%,无显著性差异,12 h时药物释放完全 (图 1); 在漏槽条件下 (1.5% Tween 80),药物在1 h时的突释量高达69.4%,12 h时药物释放度为103.4%。
|
Figure 1 Invitro dissolution profiles of budesonide-loaded chitosan microparticle in phosphate buffer solution (pH 7.25− 7.30) with different Tween 80 concentrations (n = 3) |
制备所得微粒几何粒径较小,在实际操作中凝聚性较强容易引起团聚,因此加入乳糖混合以改善其流动性。粉末的混合需要混合容器的旋转运动或粉末内部叶轮的运动来提供动能。在工业生产应用中,制备以粗颗粒 (大多数是乳糖) 为药物载体的干粉吸入剂,其混合操作一般采用两种不同的混合器,一种是V型混合器如Turbula,另一种是高速叶轮混合器[12]。在本研究中,参照Heng等[13]报道,涡旋混合器能提供混合容器的旋转运动,可以作为一种实验室小试的混合装置制备干粉吸入剂。
固定微粒与乳糖质量比1∶20,混合时间15 min,分别考察了混合速度为500、1 000、1 500和2 000r·min−1时对混合均匀性的影响,结果见表 3。从表 3处方1~4数据可见,混合速度对药物的回收率没有显著影响。当混合速度从500r·min−1提高到1 000 r·min−1时,药物含量均匀度有所提高,但混合速度从1 000 r·min−1升至1 500或2 000r·min−1时,均匀度无显著变化,说明1 000 r·min−1的混合速度足以达到较好的含量均匀度。
|
|
Table 3 Influence of mixing process parameters on drug recovery rate and homogeneity of the physical mixture of budesonide loaded chitosan microparticle with lactose. Ratio: Weight ratio between budesonide loaded chitosan microparticles and lactose |
固定微粒与乳糖质量比1∶20,混合速度为1 000 r·min−1,考察混合时间的影响。从表 3中处方5、6、2、7、8可见,混合时间对药物的回收率无显著影响。一定程度上增加混合时间有利于提高处方的药物含量均匀度 (处方5、6、2),但过长的混合时间也没有进一步提高处方的药物含量均匀度 (处方2、7、8)。因此,从含量均匀度和操作简便省时的角度考虑,后续实验中混合时间都固定为15 min。
5 混合比例对药物回收率和含量均匀度的影响固定混合速度为1 000 r·min−1,混合时间为15 min,考察微粒与乳糖的质量比的影响。从表 3处方 9、10、11、2可见,混合比例由1∶1降至1∶5时,药物的回收率无显著变化; 由1∶5降至1∶10时,回收率有轻微下降,最后降至1∶20时,回收率显著降低 (P < 0.05),这可能与混合比例降低时微粒用量减少 (混合物总量固定) 导致微粒损失比例增大有关。含量均匀度随着混合比例的变化有所差异,但相对标准偏差值都小于3.5%。
6 乳糖用量对粉末流动性的影响微粒中加入乳糖进行混合以改善其流动性,通过松密度及振实密度的测定来评价粉末的粉体学性质,结果见表 1。未加乳糖时,粉末的流动性非常差 (卡尔指数为35.21,豪斯纳比为1.54); 加入等量乳糖进行混合后,粉末的黏着力依然较强,流动性不好 (卡尔指数30.33,豪斯纳比为1.44); 加入5倍量乳糖进行混合后,粉末的流动性已经有较大改善 (卡尔指数19.82,豪斯纳比为1.25); 继续增大乳糖用量,混合后的粉末流动性变化不大。
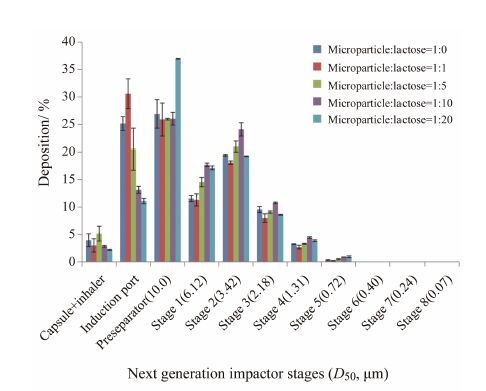
7 乳糖用量对粒子体外沉积分布的影响NGI能在较大气流速度范围内按空气动力学粒径大小将粒子进行分级,为粒子在体内的沉积分布提供参考[15]。从图 2和表 2可见,微粒中加入等质量乳糖进行混合,微粒在人工喉沉积较多,可吸入组分百分比有所降低。当微粒与乳糖比例减小至1∶5和1∶10时,与纯微粒相比,人工喉的截留作用减弱,因此可吸入组分百分比得以提高; 当微粒与乳糖比例从1∶10减少至1∶20时,微粒在预分离器中的沉积明显增大,使可吸入组分百分比显著降低 (P < 0.05),但与纯微粒相比,可吸入组分百分比依然有所提高。综上所述,加入10倍量的乳糖与微粒进行混合时,微粒与乳糖的混合物中各种粒子相互作用达到一个最佳状态,使得处方的可吸入组分百分比最高。
|
Figure 2 Detailed deposition of budesonide-loaded chitosan microparticle with different microparticle to lactose ratios in next generation impactor (n = 3) |
本研究中纳米混悬液的制备主要是为了保证药物在微粒中的分散均匀性。当稳定剂用量不足时,纳米粒表面因没有被稳定剂完全覆盖而容易发生聚集,粒径变大[16]; 当用量过大时,稳定剂分子之间的吸引力又会大于其与药物粒子的吸引力,同样会导致粒径增大,稳定性不好[17]。因此,作者最终采用了0.1% (w/v) Tween 80制备布地奈德纳米混悬液。
高压匀质联合喷雾干燥法制备所得的布地奈德微粒几何粒径较小,分布较均匀,密度较低,适于肺部吸入且达到一定的体外缓释要求。通过加入乳糖以涡旋混合器混合的方式来改善处方的流动性,一定程度上提高混合速度有利于提高含量均匀度,因为要想将凝聚性较强的细粉粒子与粗粉载体混合成一种均匀混合物,需要较高的能量使团聚的细粉粒子分开,使其与载体之间的作用力大于粒子之间的凝聚力[18]。一定程度上提高混合时间也有利于提高含量均匀度,这可能是因为混合时间过低时微粒并没有与乳糖载体充分结合。混合时间过长时,微粒与乳糖粒子大小、粒子形状或密度大小的不同导致两者分离的作用可能会增强[19],微粒之间及微粒与容器内壁之间的不断摩擦生电也有可能起到一定的负面作用[20, 21],不利于含量均匀度。
加入等质量乳糖与载药微粒进行混合时,可能因为微粒与乳糖比例过大,混合过程中微粒之间碰撞机会增大形成较多聚集体粒子[22],使得可吸入组分百分比低于未加乳糖时。进一步提高乳糖用量,乳糖表面活性较强的位点被微粒占据并饱和,许多微粒以较弱的结合力与乳糖载体结合,粒子在气流作用下很容易脱离,进入肺深部[23],因此可吸入组分百分比高于未加乳糖时。但乳糖用量过大时,微粒相对用量较少,与乳糖表面活性较强位点结合未饱和,在气流作用下不易分离,因此被截留在口咽部。同时,也可能因为乳糖用量过大,乳糖细粉相对含量增大,与微粒之间形成的聚集体难以进入肺深部[24],因此可吸入组分百分比相对乳糖用量适中时偏低。
通过高压匀质联合喷雾干燥法制备了载布地奈德的壳聚糖微粒,在非漏槽和漏槽条件下研究了其体外释放行为,药物可缓慢从壳聚糖微粒中释放。但微粒粒径较小,易引起团聚,流动性差,通过在壳聚糖微粒中加入乳糖以改善其流动性。采用涡旋混合器,以药物回收率和含量均匀度为指标优化了混合速度、混合时间和乳糖比例,在此基础上进一步考察了乳糖用量对粉体流动性和可吸入组分比例的影响。当加入10倍量乳糖时,药物回收率和含量均匀度均符合要求,流动性较好,可吸入组分百分比从46.0% 提高至59.6%。涡旋混合法简单方便,操作可行性较高,可用于实验室小批量制备以乳糖为药物载体的干粉吸入剂。
| [1] | Dahl R. Systemic side effects of inhaled corticosteroids in patients with asthma [J]. Respir Med, 2006, 100: 1307-1317. |
| [2] | Hu LM, Sun Y, Wu Y. Advances in chitosan-based drug delivery vehicles [J]. Nanoscale, 2013, 5: 3103-3111. |
| [3] | Liang Z L, Ni R, Zhou JY, et al. Recent advances in controlled pulmonary drug delivery [J]. Drug Discov Today, 2015, 20: 380-389. |
| [4] | Pilcer G, Amighi K. Formulation strategy and use of excipients in pulmonary drug delivery [J]. Int J Pharm, 2010, 392: 1-19. |
| [5] | Learoyd TP, Burrows JL, French E, et al. Sustained drug delivery from chitosan-based respirable spraydried powders [J]. Respir Drug Deliv, 2006, 2: 441−443. |
| [6] | Learoyd TP, Burrows JL, French E, et al. Chitosan-based spray-dried respirable powders for sustained delivery of terbutaline sulfate [J]. Eur J Pharm Biopharm, 2008, 68: 224-234. |
| [7] | Learoyd TP, Burrows JL, French E, et al. Sustained delivery by leucine-modified chitosan spray-dried respirable powders [J]. Int J Pharm, 2009, 372: 97-104. |
| [8] | Pourshahab PS, Gilani K, Moazeni E, et al. Preparation and characterization of spray dried inhalable powders containing chitosan nanoparticles for pulmonary delivery of isoniazid [J]. J Microencapsul, 2011, 28: 605-613. |
| [9] | Li HY, Birchall J. Chitosan-modified dry powder formulations for pulmonary gene delivery [J]. Pharm Res, 2006, 23: 941-950. |
| [10] | Zhou JY, Zhang L, Mao SR. Recent progress on dry powder inhalation of proteins and peptides [J]. Acta Pharm Sin (药学学报), 2015, 50: 814-823. |
| [11] | Steckel H, Markefka P, TeWierik H, et al. Functionality testing of inhalation grade lactose [J]. Eur J Pharm Biopharm, 2004, 57: 495-505. |
| [12] | de Boer AH, Chan HK, Price R. A critical view on lactose- based drug formulation and device studies for dry powder inhalation: which are relevant and what interactions to expect- [J]. Adv Drug Deliv Rev, 2012, 64: 257-274. |
| [13] | Heng PWS, Chan LW, Lim LT. Quantification of the surface morphologies of lactose carriers and their effect on the in vitro deposition of salbutamol sulphate [J]. Chem Pharm Bull, 2000, 48: 393-398. |
| [14] | Riley T, Christopher D, Arp J, et al. Challenges with developing in vitro dissolution tests for orally inhaled products (OIPs) [J]. AAPS PharmSciTech, 2012, 13: 978-989. |
| [15] | Marple VA, Roberts DL, Romay FJ, et al. Next generation pharmaceutical impactor (a new impactor for pharmaceutical inhaler testing). Part I: design [J]. J Aerosol Med, 2003, 16: 283−299. |
| [16] | Zhang X, Guan J, Ni R, et al. Preparation and solidification of redispersible nanosuspensions [J]. J Pharm Sci, 2014, 103: 2166-2176. |
| [17] | Zhang X, Li LC, Mao SR. Nanosuspensions of poorly water soluble drugs prepared by top-down technologies [J]. Curr Pharm Design, 2014, 20: 388-407. |
| [18] | Sebti T, Vanderbist F, Amighi K. Evaluation of the content homogeneity and dispersion properties of fluticasone DPI compositions [J]. J Drug Deliv Sci Tech, 2007, 17: 223-229. |
| [19] | Vachon MG, Chulia D. The use of particle characteristics to elucidate mix homogeneity in binary powder blends [J]. Drug Dev Ind Pharm, 1998, 24: 961-971. |
| [20] | Le VNP, Thi THH, Robins E, et al. Dry powder inhalers: study of the parameters influencing adhesion and dispersion of fluticasone propionate [J]. AAPS PharmSciTech, 2012, 13: 477-484. |
| [21] | Kulvanich P, Stewart PJ. The effect of blending time on particle adhesion in a model interactive system [J]. J Pharm Pharmacol, 1987, 39: 732-733. |
| [22] | Clarke MJ, Tobyn MJ, Staniforth JN. The formulation of powder inhalation systems containing a high mass of nedocromil sodium trihydrate [J]. J Pharm Sci, 2001, 90: 213-223. |
| [23] | Dickhoff BHJ, de Boer AH, Lambregts D, et al. The effect of carrier surface and bulk properties on drug particle detachment from crystalline lactose carrier particles during inhalation, as function of carrier payload and mixing time [J]. Eur J Pharm Biopharm, 2003, 56: 291-302. |
| [24] | Guchardi R, Frei M, John E, et al. Influence of fine lactose and magnesium stearate on low dose dry powder inhaler formulations [J]. Int J Pharm, 2008, 348: 10-17. |
 2015, Vol. 50
2015, Vol. 50


