2. 中国科学院上海药物研究所, 上海 201203
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China
环糊精包合是改善药物水溶性、稳定性的重要制剂技术之一[1, 2, 3],在环糊精 (cyclodextrin,CD) 超分子给药系统中,药物与环糊精能发生可逆性结合、解离,其结合速率常数与解离速率常数能够直接影响药物的释放与吸收。目前有关药物与大分子相互作用的研究方法分为动态法和静态法[4],其中静态法无法体现药物与大分子的动态规律。动态法中表面等离 子共振技术应用较广泛,研究中等~较强相互作用 (结合常数K > 105 L·mol−1) 时,准确度和重现性较好。但由于其是直接检测生物传感器表面的小分子,不适合研究低浓度或难溶性小分子、以及较弱~中等强 度相互作用[5, 6]。定量亲和色谱 (quantitative high performance affinity chromatography) 将可逆结合的溶质与配体中的一方,与固相载体偶联后填充、制备亲和柱,当溶质随流动相流经亲和柱时,会与固定相发生选择性相互作用,据此计算热力学和动力学参数。由于可通过多种检测器进行色谱峰的检测,其在低浓度、难溶性溶质,以及较弱~中等强度相互作用,尤其是解离速率常数的测定方面独具优势。[7, 8, 9]
美洛昔康与对乙酰氨基酚是临床常用的抗炎与解热镇痛药物,对乙酰氨基酚与β-CD包合后,溶解性增大,并起到缓释作用从而降低毒性[10]; 美洛昔康水溶性差、生物利用度低的缺点限制了其应用,与β-CD形成包合物可以提高药物的溶解度和稳定性 (已有市售包合物),增强其生物利用度[11]。
本文以与环糊精相互作用动力学性质较清楚的对乙酰氨基酚为参照,在前期以紫外检测器检测药物测定其与β-环糊精相互作用的表观解离速率常数 (koff,app) 基础上[12, 13],利用质谱作检测器,建立基于塔板高度校正技术的定量亲和色谱−质谱法,获得美洛昔康与β-环糊精的koff,app,再结合平衡常数K计算获得表观结合速率常数kon,app,评价药物与β-环糊精的相互作用动力学。
基本理论环糊精及其衍生物可以与多种客分子形成包合物,在环糊精包合物体系中,药物 (D) 与环糊精 (CD) 及包合物 (D-CD) 三者之间存在结合与解离的动态平衡[14]。
| \[\text{D}+\text{CD}\underset{{{k}_{\text{off}}}}{\overset{{{k}_{\text{on}}}}{\longleftrightarrow}}\text{D}-\text{CD}\] | (1) |
| \[K=\frac{{{k}_{on}}}{{{k}_{off}}}\] | (2) |
其中,结合平衡常数 (K) 是衡量结合程度的热力学参数,结合速率常数 (kon)、解离速率常数 (koff) 是反映包合物形成、解离的动力学参数。
峰轮廓 (peak profiling) 法测定koff,app的定量亲和色谱理论 峰轮廓法是以常规溶剂为流动相,对低浓度、小体积的溶质,采用线性洗脱,测定溶质的洗脱时间和峰宽[7, 8, 9],前者反映了主分子与客分子结合的强弱,后者与相互作用的动力学过程相关,具有进样量少 (pmoL~nmoL水平) 和易实现高通量测定的特点。根据van Deemter方程[15, 16],导致色谱峰展宽的因素包括涡流扩散 (A项)、纵向扩散 (B项) 和传质阻抗 (C项)。
| \[H=A+\frac{B}{u}+C\cdot u\] | (3) |
H为塔板高度,u为线速度,A项与色谱柱的填充均匀程度和填料的粒径大小有关,B项主要由待测物质的分子扩散系数决定,C项表示由待测物质与固定相间相互作用而导致的色谱峰展宽,是静态流动相传质阻抗 (Csm) 和固定相传质阻抗 (Cs) 之和。根据Denizot和Delaage[17]的色谱统计理论 ,在实验条件 (即流动相、色谱柱等) 相同的情况下,对于溶质和不保留物质,色谱峰展宽因素中A项、B项和Csm相近; 此外,由于理论不保留物质与固定相间不存在相互作用,故按照公式 (3) 其固定相传质阻抗为零 (Cs为零),C项为Csm。溶质和不保留物质的塔板高度中,仅固定相传质Cs不同,对于给定的亲和柱,有如下公式[8, 18, 19]:
| \[{{H}_{R}}-{{H}_{\text{M}}}=C{}_{S}\cdot u=\frac{2uk}{{{k}_{off,app}}{{(1+k)}^{2}}}\] | (4) |
HR为溶质的塔板高度,HM为不保留物质的塔板高度,k为溶质的保留因子。(HR-HM) 对uk/(1+k)2作图,由线性斜率即可求得koff,app。
理论不保留物质塔板高度的计算 按照公式 (4),由于理论不保留物质不与固定相作用,Cs为零,故其van Deemter方程应为:
| \[{{H}_{M,T}}={{A}_{T}}+\frac{{{B}_{T}}}{u}+{{C}_{sm,T}}\cdot u\] | (5) |
HM,T为理论不保留物质的塔板高度; AT与BT为理论不保留物质的A项与B项; Csm,T为理论不保留物质的静态流动相传质阻抗。但实际测定中,常规不保留物质如硝酸钠、亚硝酸钠和尿嘧啶等,均会与固定相环糊精发生相互作用,而且由于其分子尺寸较待测物质小,故其B项也 不同于待测物质。因此,Denizot和Delaage[17]理论中的“与待测物质B项相近且不与固定相作用”的不保留物质,仅是“理论”上的,实际不存在。因此,实际测定中常规不保留物质的van Deemter方程为:
| \[{{H}_{M,C}}={{A}_{C}}+\frac{{{B}_{C}}}{u}+({{C}_{sm,C}}+{{C}_{s,C}})\cdot u\] | (6) |
HM,C为常规不保留物质的塔板高度,AC和BC分别为常规不保留物质的A项与B项,Csm,C和Cs,C分别为常规不保留物质的静态流动相和固定相传质阻抗。
通过实验,只能测得公式 (6) 中的HM,C,公式(5) 中的HM,T不能够直接通过实验测定,只能根据HM,C计算得到。对于同一根色谱柱,公式 (5) 中的AT与公式 (6) 中的Ac相同,因此对于公式 (5) 只需要计算BT与Csm,T。
前期工作中,本文在已有色谱理论基础上,根据药物和不保留物质的扩散系数差异与静态流动相传质阻抗,对常规不保留物质的塔板高度HM,C进行校正,可获得理论不保留物质的HM,T,即将公式 (5) 转化为公式 (7):
| \[{{H}_{M,T}}={{A}_{C}}+\frac{{{B}_{C}}}{\lambda \cdot u}+{{C}_{sm,T}}\cdot u\] | (7) |
具体而言,通过拟合常规不保留物质的van Deemter方程,可以得到AC和BC,再根据药物和不保留物质扩散系数的差异可计算得到校正因子λ。根据色谱柱填料的粒径、保留因子及扩散系数等计算Csm,T,将AC、BT及Csm,T代入公式 (7),即可计算HM,T (详细过程参见文献[12, 13,20, 21, 22])。
材料与方法 仪器和试剂
Agilent 1260液相色谱仪,包括G1312C型二元输液泵、G1367E型自动进样器、G1316A型柱温箱、G1322A型脱气机 (美国Agilent公司); G6460A型三重四极杆串联质谱仪,配备电喷雾电离源 (ESI源) 以及MassHunter B.03.01数据采集软件 (美国Agilent公司); Micro 21R离心机 (美国Thermo Fisher公司); β-环糊精柱 (50 mm × 2.1 mm,5 μm) 由中国科学院大连化学物理研究所提供; 美洛昔康、对乙酰氨基酚和尿嘧啶 (纯度 > 99%) 购自大连美仑生物技术有限公司。
美洛昔康供试品溶液取美洛昔康对照品适量,加甲醇制成约0.2 mg·mL−1美洛昔康储备溶液。取该储备溶液适量,用流动相稀释成约2.0 μg·mL−1,作为美洛昔康供试品溶液。
对乙酰氨基酚供试品溶液取对乙酰氨基酚对照品适量,加甲醇制成约1.0 mg·mL−1对乙酰氨基酚储备溶液。取该储备溶液适量,用流动相稀释成约0.5 μg·mL−1,作为对乙酰氨基酚供试品溶液。
尿嘧啶取尿嘧啶对照品适量,加水制成约1.0 mg·mL−1尿嘧啶储备溶液。取该储备溶液适量,用流动相稀释成约0.1 μg·mL−1,作为尿嘧啶供试品溶液。
色谱条件色谱柱为β-环糊精柱 (50 mm × 2.1 mm,5 μm); 流动相为10 mmol·L−1 NH4Ac (pH 6.80)−乙腈 (83∶17); 流速为0.3、0.4、0.5 和0.6 mL·min−1; 进样量为5 μL; 柱温为25 ℃。
质谱条件采用电喷雾离子源 (ESI源),离子检测方式为多反应监测 (MRM),干燥气 (N2) 流速为8 L·min−1,干燥气温度为300 ℃; 鞘气 (N2) 流速为10 L·min−1,鞘气温度为350 ℃; 雾化气压力为310 kPa; 碎裂电压和碰撞能量分别为110 V和4 eV (美洛昔康)、122 V和16 eV (对乙酰氨基酚) 和80 V和13 eV (尿嘧啶); 用于定 量分析的离子反应分别为m/z 350 → 286 (美洛昔康)、m/z 152 → 110(对乙酰氨基酚) 和m/z 111.1 → 42 (尿嘧啶)。
koff,app的测定以美洛昔康为测定药物,对乙酰氨基酚为对照药物,尿嘧啶为常规不保留物质,分别于不同流速 (0.3、0.4、0.5和0.6 mL·min−1) 下进样分析,采集其在β-环糊精柱上的色谱峰 (n = 3)。采用Peakfit 4.12软件,按照指数修正的高斯分布 (EMG) 函数,对色谱峰进行拟合 (拟合相关系数 > 0.99),得到保留时间和半峰宽,计算对应的塔板高度。采用Origin 8SR4软件,根据van Deemter方程,对尿嘧啶的线速度u与塔板高度HM,C的关系进行拟合,得到BC和(Csm,C+Cs,C)。由Wilke-Chang方程可知,色谱条件相同 (即溶剂相同) 时,λ为药物与尿嘧啶正常沸点摩尔体积2/3次幂 (V2/3) 的比值[12, 13]。再根据β-环糊精柱填料粒径dp (5 μm),得到Csm,T (详见参考文献[12, 13]),进而由公式 (7) 计算得到HM,T。最后,以uk/(1+k)2为横坐标,HR-HM,T为纵坐标,进行线性回归,斜率即为2/koff,app。
结果与讨论 1 理论不保留物质塔板高度HM,T的计算药物−环糊精超分子系统中,环糊精与小分子的作用弱 (K < 105 L·mol−1)、结合范围广、特异性相对较差,主要体现在环糊精与常规色谱不保留物质均有相互作用[23],导致实际色谱测定中难以找到与环糊精不发生相互作用的不保留物质,仅是理论存在的。因此,本文对常规定量亲和色谱法进行改进,通过测定常规不保留物质的塔板高度,对其进行校正,获得理论不保留物质的塔板高度,使定量亲和色谱法可以应用于药物环糊精超分子体系的koff,app测定。
通过色谱测定、色谱峰拟合获得了不同流速条件下 (0.3、0.4、0.5、0.6 mL·min−1) 美洛昔康的塔板高度 (HR) 与尿嘧啶的塔板高度 (HM,C)。图 1为塔板高度H与线速度u的关系图。对于美洛昔康,随着线速度u的增加,其塔板高度HR由0.028 3 cm增加到0.055 0 cm,且HR与u线性关系良好 (r = 0.994),表明固定相传质阻抗是导致色谱峰展宽的主要因素。但 不保留物质尿嘧啶的塔板高度HM,C明显小于美洛昔康的HR,且随着线速度u的增加,HM,C虽有增加,但 幅度不大 (在0.009 0~0.015 0 cm内),HM,C与u之间线性关系相对较差 (r = 0.980)。根据公式 (3)[15, 16],美洛昔康与β-环糊精柱的相互作用明显强于不保留物质尿嘧啶。
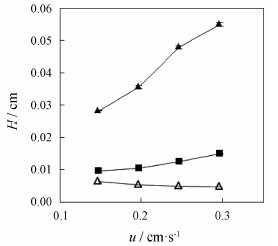
|
Figure 1 Plate heights for meloxicam and uracil on β-cyclodextrin column. ▲: Plate heights for meloxicam (HR); ■: Plate heights for uracil (HM,C); △: Plate heights for theoretical non-retained substance (HM,T); n = 3,x± s |
根据van Deemter方程,对美洛昔康和不保留物质尿嘧啶的H-u关系进行了拟合 (表 1)。美洛昔康和不保留物质尿嘧啶的van Deemter方程拟合结果中,C项均大于A项、 B项,分别是0.194 4和0.071 7 cm,表明它们的塔板高度 (H) 主要由药物与β-环糊精结合的动力学过程贡献。理论不保留物质应不与β-环糊精发生相互作用,塔板高度 (HM,T) 中C项应比较小或接近于零,但尿嘧啶的van Deemter方程中以C项为主,因此有必要根据公式 (7) 对尿嘧啶的塔板高度HM,C进行校正,获得理论不保留物质的塔板高度HM,T。此外,表 1中尿嘧啶的B项 (大于美洛昔康的B项约4倍),校正后为0.000 8 cm2·s−1,接近美洛昔康的B项,进一步说明由于尿嘧啶分子量小,扩散系数D较大,故B项对尿嘧啶的色谱峰展宽贡献较大,需要校正。
|
|
Table 1 Fitting results of the van Deemter equation for meloxicam and uracil on β-cyclodextrin column |
当流速由低到高变化时,美洛昔康、对乙酰氨基酚在β-环糊精柱上的保留逐渐减弱,保留时间tR逐渐减小,分别为41.12~21.28 min和1.31~0.65 min; 色谱峰变窄,半峰宽W1/2逐渐降低,分别为7.28~5.26 min和0.16~0.11 min (图 2)。
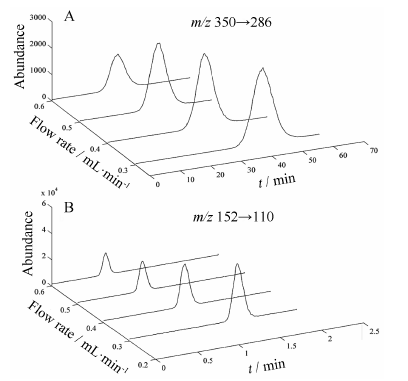
|
Figure 2 Typical multiple reaction monitoring chromatograms for drugs on β-cyclodextrin column at different flow rates. A: Meloxicam; B: Acetaminophen |
在计算得到HM,T的基础上,根据公式 (4) 可计算koff,app。不同流速条件下 (0.3、0.4、0.5和0.6 mL·min−1),在β-环糊精柱上保留强、出峰晚的美洛昔康,其koff,app分别为0.18 ± 0.01、0.17 ± 0.01、0.15 ± 0.01和0.15 ± 0.00 s−1,对乙酰氨基酚的koff,app分别为14.72 ± 0.29、9.52 ± 0.43、7.98 ± 0.28和7.25 ± 0.24 s−1 (表 2)。上述数据表明,单流速计算koff,app时,随着流速增加,美洛昔康、对乙酰氨基酚与β-环糊精相互作用的koff,app逐渐减小 (图 3),由此可见,仅通过单流速测定koff,app,结果误差较大。
|
|
Table 2 The koff,app values of meloxicam and acetaminophen by the single and multiple flow rate methods. n = 3,x± s |
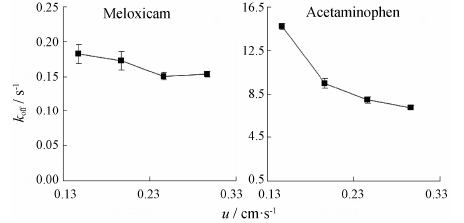
|
Figure 3 Effect of the flow rate on the koff,app determined by the single flow rate method. n = 3,x± s |
根据公式 (4),以美洛昔康0.3、0.4、0.5、0.6 mL·min−1 4个流速条件下的HR-HM对(uk)/(1+k)2作图(图 4),线性关系良好 (相关系数为0.992),直线斜率为15.70 ± 0.54,截距为0.01 ± 0.00 (接近于零),进一步表明美洛昔康的塔板高度主要受固定相传质阻抗影响。根据直线的斜率可计算美洛昔康与β-环糊精相互作用的koff,app,即多流速条件下的koff,app为0.13 ± 0.00 s−1。
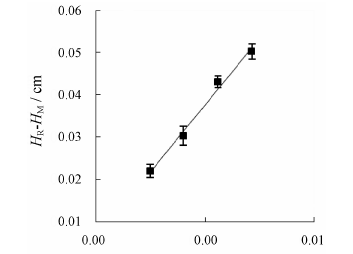
|
Figure 4 Plot of (HR-HM,T) versus (uk)/(1+k)2 according to Eq. 4 for injections of meloxicam and uracil on β-cyclodextrin column [the fitting equation is y = (15.70 ± 0.54) x − (0.01 ± 0.00)],with the correlation coefficient of 0.992,n = 3 |
由于流速对koff,app的测定结果有一定影响,本文考察了对乙酰氨基酚的流速范围 (0.2~0.8 mL·min−1) 是否适用于美洛昔康。结果,由于美洛昔康与环糊精
作用相对较强,流速为0.3 mL·min−1时,美洛昔康的保留时间已约为41 min,半峰宽约为7 min,当流速为0.2 mL·min−1时,已不能将药物很好洗脱,且溶质与β-环糊精的相互作用会达到平衡,不能反映其动力学过程; 当流速为0.8 mL·min−1时,则柱压较高,会 损耗色谱柱的寿命。因此,考虑到实验效率及色谱柱寿命两方面因素,选择0.3、0.4、0.5和0.6 mL·min−1进行测定。不同药物之间进行推广时,以“能把药物洗脱下来,又具有可以接受的柱压”为主要原则,考虑到误差计算时涉及到线性回归,应≥3个流速进行测定。
此外,本文对比了单流速与多流速的测定结果 (表 2),单流速法中高流速的测定结果与多流速法接近,与文献[18, 19]结果一致。以弱保留的对乙酰氨基酚为例,在0.3 mL·min−1时koff,app是14.72 ± 0.29 s−1,约为高流速结果 (7.25 ± 0.24 s−1) 的2倍,为多流速拟合结果 (4.83 ± 0.10 s−1) 的3倍,差异较大。考虑到上述流速的影响,对于本文中的β-环糊精柱 (50 mm × 2.1 mm,5 μm),单流速测定时0.6 mL·min−1可获得相对较为准确、可靠的koff,app。
文献[24]报道采用毛细管电泳 (ECEEM) 方法,测定4种非甾体抗炎药与α-CD、β-CD的动力学常数。本文结果 (koff,app在0.13~14.72 s−1之间) 与ECEEM法测定得到的结果 (koff,app在4.3~33 s−1之间) 较为接近[25],表明本法koff,app测定结果准确、可靠。由于对乙酰氨基酚在前期实验中对样品浓度、流速、流动相组成等因素研究的比较深入,且保留时间短,故作为内部参照对象,用于柱效的监控。本文测得对乙酰氨基酚的koff,app为 (4.83 ± 0.10 s−1),较前期测定结果相对偏大 [前期以10 mmol·L−1 NH4Ac为流动相 (pH 6.80),紫外检测器,多流速法测得对乙酰氨基酚的koff,app值为1.82 ± 0.01 s−1 [12]]。原因是本文为更好地洗脱美洛昔康,流动相中加入了17% 乙腈,有机溶剂的添加会使koff,app增大[13]。本文结果表明已建立的基于塔板高度校正技术的定量亲和色谱法,除适用于紫外检测器外,同样适用于质谱检测,大大扩展了可检测药品的范围。同时,高灵敏度能降低供试品浓度,有利于延长β-环糊精色谱柱的使用寿命,同时也为多种药物koff,app的同时测定奠定了理论基础。动力学参数kon,app表示药物与β-环糊精结合快慢的正向结合速率常数,koff,app表示反向解离速率常数,结合平衡常数K则反映药物与β-环糊精间亲和能力的大小[26]。本文测得美洛昔康在pH为6.80、温度为25 ℃条件下,koff,app为0.13 ± 0.00 s−1,K为12.53 L·mol−1 (由相溶解度法测定[27]),通过公式 (1) 计算kon,app为1.63 L·mol−1·s−1。
结论本文基于定量亲和色谱技术,对常规不保留物质的塔板高度进行了校正,发展了测定药物-β-环糊精超分子表观解离速率常数koff,app的定量亲和色谱−质谱方法,测得多流速条件下美洛昔康的koff,app为0.13 ± 0.00 s−1,进而得到表观结合速率常数kon,app为1.63 L·mol−1·s−1。利用质谱检测器高灵敏度的优点,大大降低了待测物质的进样浓度,有利于延长色谱柱的使用寿命。本法简便快速、重复性好,为评价药物与β-环糊精相互作用动力学提供了新的方法。
| [1] | Bai XL, Gao YL. Combined effect of cosolvent andcyclodextrin on solubilization of insoluble drugs [J]. ActaPharm Sin (药学学报), 2006, 41: 950-955. |
| [2] | Xia Y, Qiu LY, Jin Y. Preparation and characterizationof indomethacin/poly(N-isopropylacrylamide)-β-cyclodextrincomplex with temperature-sensitivity [J]. Acta Pharm Sin(药学学报), 2005, 40: 187-192. |
| [3] | Li X, Guo Z, Hao JB, et al. Synergetic taste masking of lipidcoating and β-cyclodextrin inclusion [J]. Acta Pharm Sin (药学学报), 2014, 49: 392-398. |
| [4] | Banker MJ, Clark TH. Plasma/serum protein bindingdeterminations [J]. Curr Drug Metab, 2008, 9: 854 -859. |
| [5] | He XY, Coombs D, Myszka DG, et al. A theoretical andexperimental study of competition between solution andsurface receptors for ligand in a biacore flow cell [J]. BullMath Biol, 2006, 68: 1125 -1150. |
| [6] | Edwards DA. Refining the measurement of rate constants inthe BIAcore [J]. Math Biol, 2004, 49: 272 -292. |
| [7] | Tong ZH, Hage DS. Characterization of interaction kineticsbetween chiral solutes and human serum albumin by usinghigh-performance affinity chromatography and peak profiling[J]. J Chromatogr A, 2011, 1218: 6892 -6897. |
| [8] | Schiel JE, Hage DS. Kinetic studies of biological interactionsby affinity chromatography [J]. J Sep Sci, 2009, 32: 1507 -1522. |
| [9] | Hage DS, Anguizola JA, Bi C, et al. Pharmaceutical andbiomedical applications of affinity chromatography: recenttrends and developments [J]. J Pharm Biomed Anal, 2012,69: 93-105. |
| [10] | Zhang H. Electrochemical and fluorescence spectral study oninclusion complexes of p-acetaminophen with β-cyclodextrin[J]. J Ningxia Univ Nat Sci (宁夏大学学报 自然科学),2011, 32: 258−261. |
| [11] | Wang RL, Sun TJ, Pei XL, et al. Inclusion Interaction ofmeloxicam with β-cyclodextrin derivatives [J]. Chin J ApplChem (应用化学), 2008, 25: 1221−1224. |
| [12] | Li HY, Ge JW, Guo T, et al. Determination of the kineticrate constant of cyclodextrin supramolecular systems by highperformance affinity chromatography [J]. J Chromatogr A,2013, 1305: 139-148. |
| [13] | Wang CF, Ge JW, Zhang JW, et al. Multianalyte determinationof the kinetic rate constants of drug-cyclodextrin supermoleculesby high performance affinity chromatography [J]. J ChromatogrA, 2014, 1359: 287-295. |
| [14] | Bohne C. Supramolecular dynamics studied using photophysics[J]. Langmuir, 2006, 22: 9100 -9111. |
| [15] | Kirkup L, Foot M, Mulholland M. Comparison of equationsdescribing band broadening in high-performance liquid chromatography[J]. J Chromatogr A, 2004, 1030: 25 -31. |
| [16] | Walker EA, Palframan JF. Techniques in gas chromatography.2. Developments in van Deemter rate theory of columnperformance - a review [J]. Analyst, 1969, 94: 609. |
| [17] | Denizot FC, Delaage MA. Statistical-theory of chromatography-new outlooks for affinity chromatography [J]. Proc NatlAcad Sci USA, 1975, 72: 4840-4843. |
| [18] | Yoo MJ, Hage DS. Evaluation of silica monoliths in affinitymicrocolumns for high-throughput analysis of drug-proteininteractions [J]. J Sep Sci, 2009, 32: 2776 -2785. |
| [19] | Hage DS, Anguizola J, Barnaby O, et al. Characterizationof drug interactions with serum proteins by using highperformanceaffinity chromatography [J]. Curr Drug Metab,2011, 12: 313-328. |
| [20] | Wilke CR, Chang P. Correlation of diffusion coefficients indilute solutions [J]. Am Inst Chem Eng, 1955, 1: 264 -270. |
| [21] | Poling BE, Prausnitz JM, John Paul OC. The Properties ofGases and Liquids: Chapter four [M]. 5th ed. New York:Pressure-Volume-Temperature Relationships of Pure Gases and Liquids, 2000: 33−34. |
| [22] | Schiel JE, Ohnmacht CM, Hage DS. Measurement ofdrug-protein dissociation rates by high-performance affinitychromatography and peak profiling [J]. Anal Chem, 2009, 81:4320-4333. |
| [23] | Malik A, Jinno K. Determination of void dead volume ofliquid-chromatographic columns containing β-cyclodextrin asthe stationary phase. 1. Existing methods for the determinationof LC column dead volume a survey of literature [J].Chromatographia, 1990, 30: 135 -137. |
| [24] | Al-Soufi W, Reija B, Felekyan S, et al. Dynamics ofsupramolecular association monitored by fluorescence correlationspectroscopy [J]. Chemphyschem, 2008, 9: 1819 -1827. |
| [25] | Mironov GG, Okhonin V, Gorelsky SI, et al. Revealingequilibrium and rate constants of weak and fast noncovalentinteractions [J]. Anal Chem, 2011, 83: 2364 -2370. |
| [26] | Kang J, Kumar V, Yang D, et al. Cyclodextrin complexation:influence on the solubility, stability, and cytotoxicity ofcamptothecin, an antineplastic agent [J]. Eur J Pharm Sci,2002, 15: 163-170. |
| [27] | Bandarkar FS, Vavia PR. An optimized commercially feasiblemilling technique for molecular encapsulation of meloxicam inβ-cyclodextrin [J]. Drug Dev Ind Pharm, 2011, 37: 1318 -1328. |
 2015, Vol. 50
2015, Vol. 50


