2. 中国海洋大学医药学院, 海洋药物教育部重点实验室, 山东 青岛 266003
2. Key Laboratory of Marine Drugs(Ministry of Education), School of Medicine and Pharmacy, Ocean University of China, Qingdao 266003, China
柳珊瑚 (Muriceides collaris) 俗称海扇或海鞭,属腔肠动物门珊瑚纲八放珊瑚亚纲低等海洋无脊椎动物。广泛分布于亚热带从潮间带到4 000米的海洋中。我国有7科45种,主要分布于广东、海南沿海海域[1, 2]。Guaiane型倍半萜为柳珊瑚中具有代表性 的萜类成分之一[3],已分别在柳珊瑚Paramuricea[4]、Menella verrucosa[5]、Bebryce grandicalyx[6]、Pseudopterogorgia americana[7, 8]、Hicksonella guishanensis[9]、Acanthogorgia vagae[10]、Calicogorgia granulosa[11]等中发现。该类成分若具有芳香型骨架一般呈明显颜色,失去芳香性颜色也消失。此外,文献也证实guaiane型倍半萜具有抗肿瘤、抗真菌、免疫调节等多种生物活性[4, 8, 11, 12]。
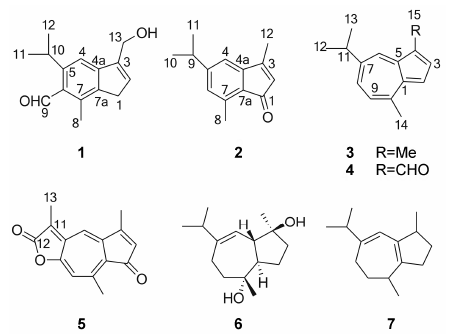
柳珊瑚于2006年4月采自广西省北海市涠洲 岛海域。为了寻找结构新颖的海洋活性成分,本课题组对柳珊瑚进行了较系统地化学成分研究,得到7 个guaiane型倍半萜,包括1个新化合物6-formyl-5- isopropyl-3-hydroxymethyl-7-methyl-1H-indene (1)、1个新天然产物5-isopropyl-3,7-dimethyl-1H-indene- 1-one (2)[13]及5个已知化合物: guaiazulene (3)[12]、4- formyl-7-isopropyl-10-methylazulene (4)[14]、sesquiterpene ketolactone (5)[15]、alismoxide (6)[16]和guaia-1 (5),6- diene (7)[17] (图 1)。除化合物3、5和6外[18],其他成分均首次从M. collaris中分离得到。
|
Figure 1 Structures of compounds |
无色油状物,高分辨质谱HR-ESI-MS给出其分子式为C15H18O2 (准分子离子 [M+H]+ m/z 231.139 0,calcd. 231.138 5),不饱和度为7。IR (KBr)光谱特征吸收为3 219和1 680 cm-1,提示分子中存在羟基和羰基。在化合物1的1H NMR谱中,低场区给出了1个醛基氢信号δ 10.72 (1H,s,H-9)、1个芳香氢信号δ7.37 (1H,s,H-4) 和1个烯氢信号δ6.68 (1H,br t,J = 1.8 Hz,H-2); 高场区给出了3个甲基氢信号δ 2.59 (3H,s,H-8) 和1.33 (6H,d,J = 6.6 Hz,H-11,H-12)、1个连氧亚甲基氢信号δ4.75 (2H,d,J = 1.5 Hz,H-13)、1个亚甲基氢信号δ 3.36 (2H,br d,J = 1.8 Hz,H-1) 和1个次甲基氢信号δ3.82 (1H,m,H-10)。13C NMR (DEPT) 谱共显示15个碳信号: 3个甲基 (δ 16.8,C-8; 24.4,C-11; 24.4,C-12)、2个亚甲基 (δ 37.2,C-1; 59.6,C-13)、4个次甲基 (δ 133.5,C-2; 114.7,C-4; 194.2,C-9; 28.5,C-10) 和6个季碳 (δ 144.3,C-3; 147.4,C-4a; 151.4,C-5; 129.1,C-6; 135.1,C-7; 141.9,C-7a),提示化合物1拥有双环骨架,也证实分子中存在醛基片断 (δ 10.72,194.2)。1H-1H COSY中,氢信号H-10与H3-11、H3-12相关,推断分子中还存在异丙基片断。进一步的结构分析是在通过1H-1H COSY和HMQC实现碳氢信号全归属的基础上进行的 (表 1)。
|
|
Table 1 1D and 2D NMR spectroscopic data of compound 1 (J in Hz,CDCl3) (Spectra were recorded at 600 MHz for 1H and 150 MHz for 13C using TMS as internal standard) |
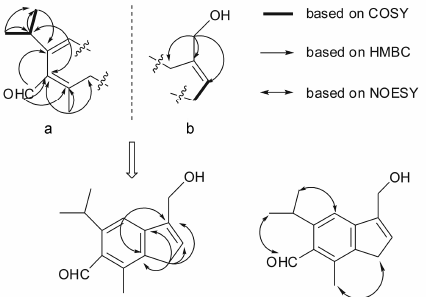
在化合物1的HMBC谱中(图 2),氢信号H3-11、H3-12与C-10、C-5相关,H-9与C-5、C-6、C-7相关及H3-8与C-6、C-7、C-7a相关,说明分子中的异丙基、醛基和甲基基团分别连接于C-5、C-6和C-7位,结合相关信号H-4/C-6、C-10,可以构建结构片断a; 由HMBC相关信号H-13/C-2、C-3、C-4a,可判断分子中剩余的基团羟甲基 (δ 4.75,59.6) 在C-3位上,再结合1H-1H COSY相关信号H-2/H-1,可以构建结构片断b。在a和b两个片断中,包含13C NMR谱中的所有碳信号。最后,通过HMBC相关信号H-4/C-3、C-7a,H-1/C-4a、C-7a连接片断a和b,建立化合物1的结构如图 1所示。NOSEY谱给出的H-1/H3-8,H3-11、H3-12/H-4、H-9的相关信号可以进一步佐证化合物1的结构
|
Figure 2 Key HMBC,1H-1H COSY and NOESY correlations of compound 1 |
淡黄色油状物,其1H NMR谱的整体特征与化合物1相似,显示4个甲基氢信号: δ 1.25 (6H,d,J = 7.1 Hz,H-10,H-11)、2.49 (3H,s,H-8)、2.20 (3H,d,J = 1.6 Hz,H-12); 1个烯氢信号δ 5.62 (1H,q,J = 1.6 Hz,H-2); 2个芳香氢信号δ 6.79 (1H,br s,H-4)、6.84 (1H,br s,H-6); 1个次甲基氢信号δ 2.87 (1H,m,H-9),提示分子中存在异丙基基团。13C NMR (DEPT) 谱共给出了14个碳信号: 4个甲基、4个次甲基和6个季碳。仔细对比分析化合物2和1的1D NMR谱,发现在化合物2中少了1个醛基和两个亚甲基信号,但增加了1个单峰烯氢、1个双峰甲基 (J = 1.6 Hz) 和1个羰基季碳信号,推测化合物2与1的差别应发生在分子骨架C-1、C-3和C-6上。通过HMQC分析确定了分子中所有碳氢间的连接关系。在HMBC谱中,H3-10与C-5、C-9、C-11相关,H3-8与C-6、C-7、C-7a相关,证明在化合物2中碳环骨架的5位和7位分别连接1个异丙基和1个甲基基团。化合物2的1H-1H COSY谱中只有H3-10、H3-11/H-9相关信号,说明羰基位于C-1位。以上分析确定化合物2的结构为5-isopropyl-3,7-dimethyl-1H-indene-1-one,其1H和13C NMR数据与文献[13]报道基本一致,但文献中仅对部分碳氢信号进行了指认。根据化合物2的1D和2D NMR谱对分子中所有的碳氢信号进行了全归属,见表 2。化合物2为首次发现于自然界的新天然产物。
|
|
Table 2 1H,13C NMR and HMBC data of compound 2 ( J in Hz,CDCl3 ) (Spectra were recorded at 600 MHz for 1H and 150 MHz for 13C using TMS as internal standard) |
从柳珊瑚中分离得到的化合物3~7均为guaiane型倍半萜,这些化合物结构上的相似性提示其存在着明显的内在生源关系,推测其可能的生物合成途径如图 3所示。化合物3符合休克尔4n+2规则,具有芳香性,应该是这些化合物的前体成分。化合物3通过不同程度的氧化、缩合、脱水反应可分别生成化合物4和5; 通过还原反应生成化合物7,化合物7再经过还原、氧化反应最终生成化合物6。

|
Figure 3 Possible biosynthetic pathway and biogenetic relationship of compounds 3-7 |
高分辨质谱用美国Waters公司Q-TOF-ULTIMA- GLOBAL型质谱仪测定; NMR由日本JEOL公司JNM-ECP600型核磁共振仪测定,TMS内标; IR用美国NICOLET公司NEXUS 470FT-IR型红外光谱仪 测定; HPLC在美国Agilent 1100高效液相色谱仪,Kromasil半制备柱 (ODS,10 mm × 250 mm,10 μm) 上完成; 薄层硅胶和柱色谱硅胶均由青岛海洋化工厂提供; 柱色谱所用ODS为北京金欧亚科技发展有限公司产品; Sephadex LH-20由Amersham Pharmacia Biotech AB生产; 常用有机试剂均为国产分析纯。
柳珊瑚于2006年4月采自中国南海涠洲岛海域,种属由中国科学院南海海洋研究所邹仁林研究员鉴定。标本存放于中国海洋大学医药学院天然药物化学一室,样品编号GXWZ-01。
1 提取与分离将冷冻贮藏的柳珊瑚样品 (干重3.7 kg) 破碎后,室温下用甲醇动态冷浸提取3次,提取液减压浓缩,甲醇溶解脱盐,得提取物总浸膏109.8 g。将总浸膏混悬于适量水中,等体积乙酸乙酯萃取,萃取液真空浓缩得乙酸乙酯部分37.3 g。乙酸乙酯部分经200~300目硅胶柱色谱,石油醚-丙酮梯度洗脱分为8个部位(A~H)。部位A进一步硅胶柱色谱,石油醚-丙酮梯度洗脱得12个组分A-1~A-12。组分A-5经HPLC纯化 (甲醇-水,90∶10,v/v; 1.5 mL·min-1) 得化合物3(tR = 14.2 min,7.6 mg); 部位C硅胶色谱反复分 离(氯仿-甲醇,80∶1,石油醚-丙酮10∶1),HPLC纯化 (甲醇-水,75∶25,v/v; 1.5 mL·min-1),得化合物6 (tR = 30.5 min,2.8 mg); 部位D进一步硅胶柱色谱,石油醚-丙酮,10∶1,洗脱得7个组分D-1~D-7。组分D-3以石油醚-丙酮10∶1多次硅胶柱色谱,再经HPLC纯化 (甲醇-水,80∶20,v/v; 1.5 mL·min-1) 得化合物4 (tR = 23.5 min,1.4 mg) 和化合物7(tR = 32.0 min,3.5 mg)。组分D-4经HPLC (甲醇-水,60∶40,v/v; 1.5 mL·min-1) 纯化得化合物5(tR = 48.2 min,1.1 mg) 和化合物1 (tR = 45.0 min,1.7 mg); 部位J以石油醚-丙酮 (15∶1和90∶1) 反复硅胶柱色谱,经HPLC纯化 (甲醇-水,75∶25,v/v; 1.5 mL·min-1),得化合物2 (tR = 13.2 min,1.3 mg)。
2 结构鉴定 化合物1无色油状物; IR (KBr) νmax 3 219,1 680,1 439,1 226,1 186,906,884,783,663,545,413 cm-1; ESI-MS m/z 231.1 [M+H]+; HR-ESI-MS m/z 231.139 0 [M+H]+ (calcd. for C15H19O2,231.138 5); 1H、13C NMR数据见表 1。
化合物2淡黄色油状物; 1H、13C NMR数据见 表 2。
化合物3蓝色无定形粉末; 1H NMR (CDCl3,600 MHz) δ: 8.20 (1H,s,H-6),7.62 (1H,d,J = 3.7 Hz,H-2),7.41 (1H,d,J = 10.3 Hz,H-8),7.22 (1H,d,J = 3.3 Hz,H-3),7.01 (1H,d,J = 10.6 Hz,H-9),3.08 (1H,m,H-11),2.83 (3H,s,H-14),2.67 (3H,s,H-15),1.36 (6H,d,J = 7.0 Hz,H-12/13); 13C NMR (CDCl3,150 MHz) δ: 137.2 (s,C-1),136.1 (d,C-2),112.7 (d,C-3),125.2 (s,C-4),136.2 (s,C-5),133.3 (d,C-6),139.9 (s,C-7),134.9 (d,C-8),125.0 (d,C-9),144.3 (s,C-10),38.3 (d,C-11),24.8 (q,C-12/13),24.1 (q,C-14),12.9 (q,C-15)。以上数据与文献[12] 一致,故鉴定化合物3为guaiazulene。
化合物4紫红色无定形粉末; 1H NMR (CDCl3,600 MHz) δ: 10.32 (1H,s,H-15),9.73 (1H,br d,H-6),8.18 (1H,d,J = 4.6 Hz,H-3),7.73 (1H,dd,J = 10.6,1.8 Hz,H-8),7.51 (1H,d,J = 10.6 Hz,H-9),7.27 (1H,d,J = 4.3 Hz,H-2),3.24 (1H,m,H-11),2.94 (3H,s,H-14),1.41 (6H,d,J = 7.0 Hz,H-12/13); 13C NMR (CDCl3,150 MHz) δ: 144.3 (s,C-1),115.6 (d,C-2),141.7 (d,C-3),125.6 (s,C-4),139.8 (s,C-5),137.8 (d,C-6),149.8 (s,C-7),137.5 (d,C-8),131.4 (d,C-9),147.9 (s,C-10),38.6 (d,C-11),24.6 (q,C-12/13),24.8 (q,C-14),186.7 (d,C-15)。以上数据与文献[14]一致,故鉴定化合物4为4-formyl-7-isopropyl-10-methylazulene。
化合物5黄色针状结晶; 1H NMR (CDCl3,600 MHz) δ: 6.86 (1H,s,H-6),6.55 (1H,s,H-9),6.24 (1H,br q,H-3),2.70 (3H,s,H-14),2.32 (3H,d,J = 1.4 Hz,H-15),2.12 (3H,s,H-13); 13C NMR (CDCl3,150 MHz) δ: 127.0 (s,C-1),195.1 (s,C-2),132.6 (d,C-3),160.7 (s,C-4),145.9 (s,C-5),114.6 (d,C-6),143.4 (s,C-7),160.0 (s,C-8),116.9 (d,C-9),144.7 (s,C-10),116.9 (s,C-11),169.2 (s,C-12),8.5 (q,C-13),22.3 (q,C-14),14.3 (q,C-15)。以上数据与文献[15]一致,故鉴定化合物5为sesquiterpene ketolactone。
化合物6无色油状物; [α]20 D+10.6 (c 0.11,MeOH); 1H NMR (CDCl3, 600 MHz) δ: 5.47 (1H,d,J = 1.9 Hz,H-6),2.23 (1H,m,H-11),2.04,1.89,1.74,1.68,1.63,1.60,1.60,1.59,1.58,1.57 (10H,m),1.20 (3H,s,H-14),1.19 (3H,s,H-15),0.98 (6H,d,J= 6.4 Hz,H-12/13); 13C NMR (CDCl3,150 MHz) δ: 50.1 (d,C-1),21.6 (t,C-2),35.4 (t,C-3),80.2 (s,C-4),48.0 (d,C-5),121.1 (d,C-6),149.7 (s,C-7),24.6 (t,C-8),40.5 (t,C-9),79.2 (s,C-10),37.2 (d,C-11),21.6 (q,C-12/13),21.2 (q,C-14),22.4 (q,C-15)。以上数据与文献[16]一致,故鉴定化合物6为alismoxide。
化合物7无色油状; 1H NMR (CDCl3,600 MHz) δ: 5.60 (1H,d,J = 1.8 Hz,H-6),2.69,2.63,2.04,2.00,1.94,1.85,1.73,1.70,1.44,1.41,1.22 (11H,m),1.00 (3H,d,J = 6.6 Hz,H-15),0.97 (3H,d,J = 6.6 Hz,H-14),0.95 (3H,d,J = 7.0 Hz,H-12),0.94 (3H,d,J = 7.0 Hz,H-13)。以上数据与文献[17]一致,故鉴定化合物7为guaia-1 (5),6-diene。
| [1] | Huang H, Li XB, He JG, et al. Species diversity and distributionof gorgonian at Xuwen, Zhanjiang, Guangdong province[J]. J Trop Oceanogr (热带海洋学报), 2007, 26: 60-67. |
| [2] | Wen YM, Qi SH, Zhang S. Studies on chemical constituentsof gorgonian Junceella fragilis from South China Sea [J]. JTrop Oceanogr (热带海洋学报), 2007, 26: 73-77. |
| [3] | Faulkner DJ. Marine natural products [J]. Nat Prod Rep,2001, 18: 1-49. |
| [4] | Srinivasa Reddy N, Reed JK, Longley RE, et al. Two newcytotoxic linderazulenes from a deep-sea gorgonian of thegenus Paramuricea [J]. J Nat Prod, 2005, 68: 248-250. |
| [5] | Zhang W, Guo YW, Mollo E, et al. Menverins A-D, newhighly oxygenated guaiane lactones from Hainan gorgonianMenella verrucosa (Brundin) [J]. Helv Chim Acta, 2004, 87:2919-2925. |
| [6] | Aknin M, Rudi A, Kashman Y, et al. Bebryazulene, a newguaiane metabolite from the Indian ocean gorgonian coral,Bebryce grandicalyx [J]. J Nat Prod, 1998, 61: 1286-1287. |
| [7] | Rodriguez AD, Boulanger A, Martinez JR, et al. Sesquiterpenelactones from the caribbean sea plume Pseudopterogorgiaamericana [J]. J Nat Prod, 1998, 61: 451-455. |
| [8] | Rodriguez AD, Boulanger A. New guaiane metabolites fromthe caribbean gorgonian coral, Pseudopterogorgia americana[J]. J Nat Prod, 1997, 60: 207-211. |
| [9] | Shao ZY, Zhu DY, Guo YW. Studies on the chemicalconstituents of Hicksonella guishanensis Zou [J]. Nat ProdRes Dev (天然产物研究与开发), 2001, 13: 1-4. |
| [10] | Zhang W, Guo YW, Mollo E, et al. Chemical studies on thesesquiterpenes from the Chinese gorgonian Acanthogorgiavagae Aurivillius [J]. Chin J Nat Med (中国天然药物), 2003,1: 13-15. |
| [11] | Seo Y, Rho JR, Geum N, et al. Isolation of guaianoidpigments from the gorgonian Calicogorgia granulose [J]. JNat Prod, 1996, 59: 985-986. |
| [12] | Fusetani N, Matsunaga S, Konosu S. Bioactive marinemetabolites I. Isolation of guaiazulene from the gorgonianEuplexaura erecta [J]. Experientia, 1981, 37: 680 -681. |
| [13] | Matsubara Y, Takekuma SI, Yokoi K, et al. Autoxidationof guaiazulene and 4,6,8-trimethylazulene in polar aproticsolvent: structural proof for products [J]. Bull Chem SocJpn, 1987, 60: 1415-1428. |
| [14] | Fang LZ, Yang WQ, Dong ZJ, et al. A new azulene pigmentfrom the fruiting bodies of the basidiomycete Lactariushatsudake (Russulaceae) [J]. Acta Bot Yunnan (云南植物研究), 2007, 29: 122-124. |
| [15] | Ahmad VU, Yasmeen S, Ali Z, et al. Taraxacin, a newguaianolide from Taraxacum wallichii [J]. J Nat Prod, 2000,63: 1010-1011. |
| [16] | Peng GP, Tian G, Huang XF, et al. Guaiane-type sesquiterpenoidsfrom Alisma orientalis [J]. Phytochemistry, 2003, 63:877-881. |
| [17] | Friedel HD, Matusch R. Isolation and structure elucidation ofepimeric 1(5),6-guaiadienes from Tolubalsam [J]. Helv ChimActa, 1987, 70: 1616-1622. |
| [18] | Zhu HY, Li PL, Tang XL, et al. Studies on the chemicalconstituents of the South China Sea from gorgonian Muriceidescollaris [J]. Chin J Mar Drugs (中国海洋药物), 2013, 32:21-25. |
 2015, Vol. 50
2015, Vol. 50


