2. 活性物质的发现与适药化研究北京市重点实验室, 北京 100050
2. Beijing Key Laboratory of Active Substance Discovery and Druggability Evaluation, Beijing 100050, China
抑郁症是现代社会一种常见而易被忽略的精神疾病,近年来抑郁症患病率不断增加,已经成为影响人类健康和生活质量的疾病之一,也是导致自杀的重要原因[1, 2]。所以,寻找更优秀的抗抑郁药成为科学家的重要目的[3, 4, 5]。目前临床使用的各类抗抑郁药中,5-HT再摄取抑制剂 (SSRIs) 使用最广,但同时它也存在各种不足,不是理想的治疗药物。已知的发病机制显示,抑郁症和体内两种神经递质—5-羟基 色胺 (5-HT) 和去甲肾上腺素 (NE) 的关系最为密切,5-HT和NE双重再摄取抑制剂 (SNRIs) 由于对5-HT和NE的双重作用,对于严重抑郁症、难治抑郁症的治疗效果明显优于单一作用SSRIs。已上市的万拉法新 (vanlafaxine) 和度洛西汀 (duloxetine),作为5-HT/NE再摄取双重抑制活性的抗抑郁药正在成为临床首选的抗抑郁药物 (结构见图 1)。因此,发展新型5-HT/NE 再摄取双重抑制剂,使之成为新的更高效、更低毒的抗抑郁药的研究方向[6, 7, 8]。
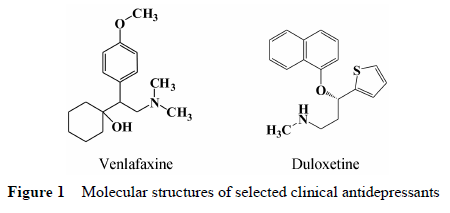
|
Figure 1 Molecular structures of selected clinical antidepressants |
本课题组利用Catalyst软件包,以具有抑制5-HT再摄取作用和NE再摄取作用的化合物作为研究对 象,分别建立5-HT和NE再摄取抑制剂的三维药效团模型,其中5-HT的药效团模型由4个化学特征组成: 1个氢键受体 (HA)、1个疏水中心 (HY)、1个芳环 (RA) 和1个正电中心 (PI); NE的药效团模型由1个氢键受体 (HA)、两个疏水中心 (HY) 和1个正电中心 (PI) 组成[9]。通过所建立的5-HT和NE药效团模型,曾设计合成了一类二芳基、哌嗪基脒类新结构类型的化合物,药理结果发现这类化合物具有较好的5-HT再摄取抑制活性和NE再摄取抑制活性,证明了所建立的 5-HT和NE药效团模型具有较好的指导意义[10, 11, 12]。
本文基于前期设计的5-HT/NE双重再摄取抑制先导结构[10] (图 2中通式A),结合已经建立的5-HT和NE三维药效团模型,应用骨架迁越的策略[13],设计了新的结构类型分子 (图 2中I类和II类),以期能够找到高效、低毒的新结构类型抗抑郁化合物。所设计的异吲哚啉类化合物具有如下主要特征: ① 保留已有先导结构中二芳基的顺式结构 ,这是保证具有
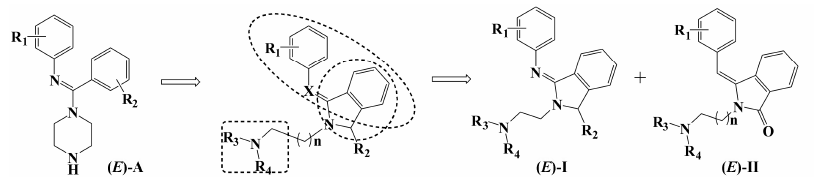
|
Figure 2 Design of novel antidepressants based on existing lead compound |
一定5-HT和NE再摄取抑制活性的主要结构片段; ② 应用骨架迁越的策略,打开哌嗪环,同时引入一个异吲哚啉片段,以此构建出新的分子结构又不破坏已知的药效团片段; ③ 打开先导结构中的哌嗪环后,引入链状烷烃,增加分子柔性,降低构象能量,有利于同一分子以不同构象来满足5-HT和NE的再摄取药效团的要求; ④ 在异吲哚啉上引入1个羰基或羟基 (R2),在分子上增加1个新的氢键受体,以此提高5-HT或NE的再摄取抑制活性; ⑤ I类和II类化合物的主要区别在于碳氮双键和碳碳双键的变换。
本文利用Discovery Studio 2.5软件将两类新化合物与已经建立的5-HT和NE药效团模型进行匹配,计算结果表明新设计的两类分子均能够与5-HT再摄取抑制剂和NE再摄取抑制剂药效团模型相匹配,保留了二者所必需的结构片段,说明所设计新化合物具有一定的可靠性 (图 3是化合物I-12和II-11与自行构建的5-HT和NE药效团模型匹配图)。最终合成了新结构类型的异吲哚啉类化合物共30个,通过1H NMR、HR-MS对化合物结构进行了确证,完成了体外5-HT再摄取抑制活性和NE再摄取抑制活性的测定,以及初步的整体动物的抗抑郁活性评价和急性毒性实验评价。药理结果显示,所设计的I和II类新化合物都具有一定的5-HT和NE再摄取抑制活性,而I类新化合物在初步的整体动物抗抑郁活性评价中表现出与阳性对照药相近的抗抑郁效果以及较低的毒副作用,显示出了可深入研究的潜力。
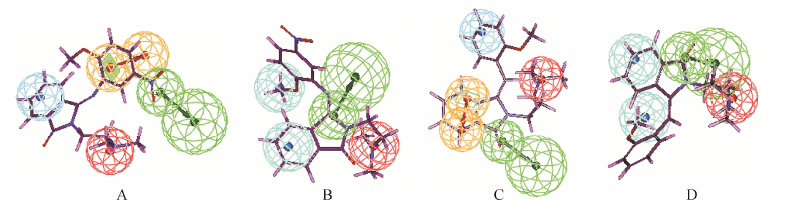
|
Figure 3 Mapping of compound I-12 and II-11 on the hypothesis model 5-HT (A,C) and on the hypothesis model NE (B,D) |
以邻甲酸苯甲酸甲酯为原料,与不同取代基团的苯胺得到相应的酰胺中间体,再进一步酰氯化后,与链状伯胺反应并同时关环得到I类化合物I-1~I-13 (合成路线1); I-1和I-8进一步还原可以得到化合物I-14、I-15 (合成路线2)。由邻苯二甲酸酐为原料,与不同取代基团的苯乙酸反应得到相应的苯酞衍生物,再与链状伯胺反应得到II类化合物的顺反异构体,通过柱色谱分离得到所需的反式异构体,再盐酸化得到II类化合物的盐酸盐II-1~II-15 (合成 路线3)。

|
Scheme 2 Synthesis route of compounds I-14 and I-15 |
化合物的结构和理化数据见表 1、2。
|
|
Table 1 Physical and HR-MS and 1H NMR (300 MHz) data of compounds I and II |
|
|
Table 2 Inhibition data of 5-HT and NE reuptake for compounds I and II. a: Percent inhibition measured at a concentration of 1×10-5 mol·L-1 |
所设计的I和II两类化合物在空间结构上碳氮双键和碳碳双键需要为反式异构体,这样与已有先导结构中反式结构保持一致。经过NOE图谱证明,所设计的两类新化合物均为E型异构体。
从化合物I-1的400 MHz-1D-NOE图谱 (图 4) 可以看到,如果化合物I-1为E型结构,氯苯上的4个氢为两个d峰,可以根据电荷密度判断靠近高场的双峰含有Ha,当对Ha进行NOE照射时,具有空间响应的一个峰是氯苯上另一个双峰,以及靠近Ha的异吲哚啉上的Hb,以此可以确定出Hb的化学位移值; 反之,如果化合物I-1为Z型结构,则当对Ha进行NOE照射时,不会出现Hb的响应峰。

|
Figure 4 400 MHz-1D-NOE (CDCl3) of compound I-1 |
从化合物II-2的500 MHz-2D-NOE图谱 (图 5) 可以看到,如果化合物II-2为E型结构,根据I-1化合物的氢谱图和氢数目可以首先确定II-2的Hb (芳香区的高场峰),另外根据峰型和氢数目可以判断出苯环上5个氢的氢峰为聚在一起的m峰,说明Ha夹在m峰里; 根据图中与Hb有空间关系的响应位置,可以判断苯环上Ha的化学位移值在7.48左右。反之,如果化合物II-2为Z型结构,则当对Hb进行NOE照射时,不会出现苯环上Ha的响应峰。
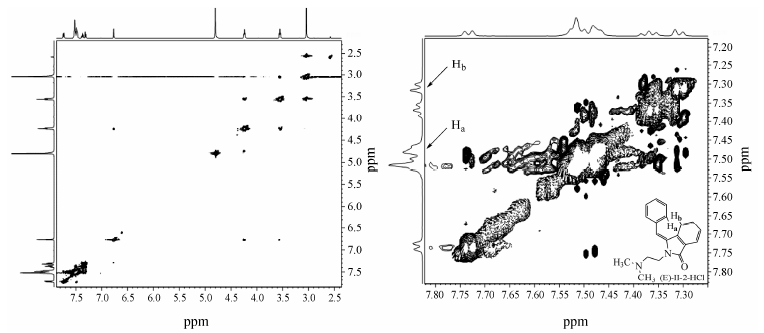
|
Figure 5 500 MHz-2D-NOE (D2O) of compound II-2 |
所有化合物经过体外5-HT和NE再摄取抑制活性的评价,从表 2中的活性结果看到,I类和II类新化合物均具有一定的5-HT和NE再摄取双重抑制活性。在1×10-5 mol·L-1浓度下,有1个化合物的5-HT再摄取抑制活性大于80%,有4个化合物的NE再摄取抑制活性大于80%,有7个化合物的5-HT和NE再摄取双重抑制活性均大于60%,其中化合物I-3的双重抑制活性与对照药度洛西汀接近。从结构上看,当其他基团一致时,I类化合物中R1为供电基团时会提高5-HT和NE再摄取抑制活性,I类化合物中R2为羰基的化合物抑制活性要优于R2为羟基的化合物抑制活性; II类化合物的5-HT和NE再摄取抑制活性普遍较低,不同取代基化合物的活性规律不太明确; 含有脒键结构的I类化合物的5-HT或NE再摄取抑制活性明显要强于不含有脒键结构的II类化合物,说明脒键结构片段是重要的药效团。
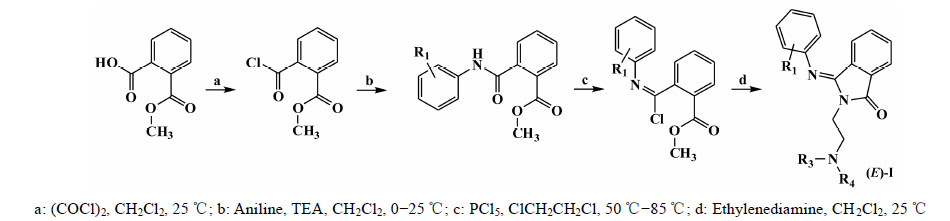
|
Scheme 1 Synthesis route for isoindoline class of new compounds (I-1 - I-13) |

|
Scheme 3 Synthesis route for isoindoline class of new compounds (II-1 − II-15) |
初步的整体动物抗抑郁活性药效学实验结果显示 (小鼠悬尾不动实验: 表 3),与阳性对照药度洛西汀相同剂量时,I类化合物中的I-3和I-8具有良好的抗抑郁活性,并且化合物I-3与度洛西汀抗抑郁效果相当; II类化合物II-2和II-7也有一定的抗抑郁活 性,但不如度洛西汀。另外,在初步的急性毒性实验评价中,在200和400 mg·kg-1剂量下,所测试的小鼠都未出现死亡,提示化合物I-3的LD50值可能大于400 mg·kg-1,具有较低的毒副作用,在合理范围内。
|
|
Table 3 The effect of four compounds in the rat test predictive of antidepressant activity. n = 6-8,x± s. “-” not tested |
综上所述,所设计的I类化合物具有一定的5-HT和NE再摄取双重抑制活性、较好的体内抗抑郁活性以及较低的毒副作用,基本达到寻找具有5-HT和NE再摄取双重抑制作用的新类型化合物的目标,值得进一步研究。
实验部分Yanaco-500型显微熔点仪 (温度未校正); Varian Mercury 300/400型核磁共振仪,TMS为内标; LC/MSD TOF质谱仪 (Agilent Technologies)。柱色谱硅胶为H型 (青岛海洋化工厂); 实验所用试剂均为市售分析纯。
1 化合物的合成 1.1 化合物I-1~I-13的合成[以1-(4-氯-苯亚胺)-2- (N,N-二乙基)-氨乙基-异吲哚啉-3-酮 (化合物I-1) 为例]
2-(4-氯苯胺)羰基-苯甲酸甲酯的合成反应瓶中加入邻甲酸苯甲酸甲酯1 g (5.5 mmol) 和适量干燥的二氯甲烷,加一滴DMF,室温搅拌下滴加草酰氯0.78 g (6.1 mmol),然后室温继续搅拌2 h。减压蒸干,用干燥的二氯甲烷溶解待用。反应瓶中加入4-氯苯 胺0.70 g (5.5 mmol),用适量干燥的二氯甲烷搅拌溶解,加入干燥的三乙胺0.55 g (5.5 mmol),冰浴冷却,搅拌下滴加上述酰氯溶液,加毕,室温继续搅拌2 h。减压蒸除溶剂,得到的固体用10% 氢氧化钠溶液和水依次洗涤,烘干,得白色固体1.56 g (收率82%),mp 128~130 ℃。
1-(4-氯-苯亚胺)-2-(N,N-二乙基)-氨乙基-异吲哚啉-3-酮 (化合物I-1) 的合成反应瓶中加入2-(4-氯苯胺) 羰基-苯甲酸甲酯0.50 g (1.7 mmol) 及经过干燥的1,2-二氯乙烷10 mL ,在50 ℃下搅拌30 min,然后加入五氯化磷0.35 g (1.7 mmol),在85 ℃搅拌反 应2 h。减压蒸干,剩余物冷至室温,用干燥二氯甲烷溶解后,冰浴冷却后滴加到N,N-二乙基乙二胺0.20 g (1.7 mmol)和三乙胺0.20 g (1.9 mmol) 的二氯甲烷溶液中,室温搅拌反应2 h,减压蒸除溶剂,剩余物加乙醚和饱和碳酸钠水溶液,振摇,静置分层,分出有机层,用蒸馏水洗涤两遍,有机层用无水硫酸钠干燥,之后蒸出溶剂得到粗品,粗品通过硅胶柱色谱分离纯化,得到固体0.43 g (收率72%),mp 70~72 ℃。
化合物I-2~I-13的合成方法与化合物I-1相 同,所有化合物的理化数据、光谱数据及质谱数据见表 1。
1.2 化合物I-14、I-15的合成[1-(4-氯-苯亚胺)-2-(N,N-二乙基)-氨乙基-异吲哚啉-3-羟基 (化合物I-14) 为例]
反应瓶中加入0.50 g化合物I-1 (1.4 mmol) 和 干燥四氢呋喃15 mL,再加入0.11 g四氢铝锂 (95%,2.8 mmol),室温下搅拌2 h,向母液中加5 mL蒸馏 水后,减压蒸除大部分四氢呋喃,剩余物加乙醚和蒸馏水,振摇,静置分层,分出有机层,用蒸馏水洗涤两遍,有机层用无水硫酸钠干燥,之后蒸出溶剂得到粗品 (产品未测定羟基的R或S构型),粗品通过硅 胶柱色谱分离纯化,得到固体0.28 g (收率56%),mp 81~83 ℃。
化合物I-15的合成方法与化合物I-14相同,两个化合物的理化数据、光谱数据及质谱数据见表 1。
1.3 化合物II-1~II-15的合成[以1-(4-甲氧基苄烯)- 2-(N,N-二乙基)-氨乙基-异吲哚啉-3-酮盐酸盐 (化合物II-1) 为例]
3-(4-甲氧基苄烯)-苯酞的合成反应瓶中加入邻苯二甲酸酐2.5 g(17 mmol) 和4-甲氧基苯乙酸3.4 g(20 mmol),加热至220 ℃,再加入醋酸钠0.7 g (9 mmol),搅拌4 h后,反应结束。反应物用乙酸乙酯溶解后,用蒸馏水洗涤两遍,有机层用无水硫酸钠干燥,之后蒸出溶剂得到粗品,粗品由重结晶方法得黄色晶体1.96 g (收率46%),mp 148~149 ℃。顺反结构未确证,直接进行下一步。
1-(4-甲氧基苄烯)-2-(N,N-二乙基)-氨乙基-异吲哚啉-3-酮盐酸盐 (化合物II-1) 的合成反应瓶中加入3-(4-甲氧基苄烯)-苯酞1.0 g(4 mmol),加入5 mL醋酸,加热至回流后,再加入N,N-二乙基乙二胺0.93 g (8 mmol),搅拌4 h后,低压蒸出醋酸。剩余物加乙醚和饱和碳酸钠水溶液,振摇,静置分层,分出有机层,用蒸馏水洗涤两遍,有机层用无水硫酸钠干燥,之后蒸出溶剂得到顺反异构混合物。将混合物进行柱色谱纯化,分离得到E型产品 (Z/E ≈ 1/9)。再向E型产品中加入适量氯化氢-乙醇溶液,重结晶析出白色固体0.94 g (收率61%),mp 163~165 ℃。
化合物II-2~II-15的合成方法与化合物II-1相同,所有化合物的理化数据、光谱数据及质谱数据见表 1。
2 药理活性评价本文合成的所有化合物通过大鼠突触体[3H]-5-HT再摄取抑制实验和[3H]-NE再摄取抑制实验。该实验可用来检测化合物是否抑制大鼠脑突触体的再摄取功能,作为5-HT和NE再摄取抑制活性指标,用来评价化合物作为抗抑郁药的潜在价值[14]。采用的阳性对照药为度洛西汀。所有样品的体外抑制活性均在1×10-5 mol·L-1浓度下进行检测,结果见表 2。
对于体外5-HT再摄取抑制活性和NE再摄取抑制活性好的化合物,挑选出4个化合物测定并计算5个浓度水平的抑制率,得出量效曲线,计算出IC50值。同时,对这4个化合物进行了初步的整体动物抗抑郁药效学实验 (一个剂量下的小鼠悬尾不动实验),该实验用来评价待测样品的抗抑郁效果,阳性对照药为度洛西汀,结果见表 3。其中,[3H]-NE再摄取抑制实验中4个化合物的量效关系不明确,故未能得到IC50值。
另外,对化合物I-3进行了初步的急性毒性实验评价。
| [1] | Dilsaver SC, Chen YW, Swann AC, et al. Suicidality inpatients with pure and depressive mania [J]. Am J Psychiatry,1994, 151: 1312-1315. |
| [2] | Schatzberg AF. New indications for antidepressants [J]. JClin Psychiatry, 2000, 61 (S11): 9-17. |
| [3] | Rakofsky J, Holtzheimer P, Nemeroff C. Emerging targetsfor antidepressant therapies [J]. Curr Opin Chem Biol, 2009,13: 291-302. |
| [4] | Wrobel MZ, Chodkowski A, Herold F, et al. Synthesis andbiological evaluation of novel pyrrolidine-2,5-dione derivativesas potential antidepressant agents [J]. Eur J Med Chem, 2013,63: 484-500. |
| [5] | Helguera AM, Perez-Garrido A, Gaspar A, et al. CombiningQSAR classification models for predictive modeling of humanmonoamine oxidase inhibitors [J]. Eur J Med Chem, 2013,59: 75-90. |
| [6] | Shaw AM, Boules M, Zhang Y. Antidepressant-like effectsof novel triple reuptake inhibitors, PRC025 and PRC050 [J].Eur J Pharmacol, 2007, 555: 30-36. |
| [7] | Prins J, Olivier B, Korte SM. Triple reuptake inhibitors fortreating subtypes of major depressive disorder: the monoaminehypothesis revisited [J]. Expert Opin Investig Drugs, 2011,20: 1107-1130. |
| [8] | Shelton RC. The dual-action hypothesis: does pharmacologymatter- [J]. J Clin Psychiatry, 2004, 65: 5 -10. |
| [9] | Qin F, Guo YS, Yang GZ. Pharmacophore identification andcomparison of serotonin/norepinephrine reuptake inhibitors [J].Acta Chim Sin (化学学报), 2009, 67: 2258-2268. |
| [10] | Yang J, Wang XF, Yang GZ. Design, synthesis and activityevaluation of novel selective serotonin reuptake inhibitors [J].Chem J Chin Univ (高等学校化学学报), 2007, 28: 1503-1507. |
| [11] | Yang J, Wang XF, Yang GZ. Design, synthesis and in vitroevaluation of phenylbenzamidine derivatives as SSRIs [J].Chin Chem Lett, 2007, 18: 814 -816. |
| [12] | Qin F, Yang J, Yang GZ. Design, synthesis and 5-HT/NE dualreuptake inhibition activity of phenylbenzamidine derivatives[J]. Chem J Chin Univ (高等学校化学学报), 2009, 30: 938-944. |
| [13] | Guo ZR. Medical Chemistry (药物化学专论) [M]. Beijing:People’s Medical Publishing House, 2012: 78 -89. |
| [14] | Vogel HG. Drug Discovery and Evaluation-PharmacologicalAssays [M]. 2nd ed. Springer-Verlag Berlin and HeidelbergGmbH & Co. K, 2006: 390-391. |
 2015, Vol. 50
2015, Vol. 50


