2. 中日友好医院临床医学研究所, 北京 100029;
3. 河北医科大学第四医院, 河北 石家庄 050011
2. Institute of Clinical Medical Sciences, China-Japan Friendship Hospital, Beijing 100029, China;
3. The Fourth Hospital of Hebei Medical University, Shijiazhuang 050011, China
丹参是一种广泛应用于心脑血管系统疾病治疗的传统药物。丹酚酸A、B和C均是从丹参中提取分离得到的多酚类化合物,具有多种药理学活性,化学结构如图 1所示。其中,丹酚酸A具有良好的抗氧化、抗炎和抗血小板聚集的作用[1, 2]。丹酚酸A可以对抗多种细胞氧化应激损伤,保护CCl4造成的鼠急性肝损伤,同时具有良好的抗肝纤维化的作用,肝保护效果明显[3, 4, 5, 6, 7]。丹酚酸A还具有良好的心肌保护作用,在心肌缺血的治疗上具有较好的应用前景[8, 9]。此外,丹酚酸A对大鼠半乳糖性白内障的形成也具有明显的抑制作用[10],同时也能增强化疗药物的抗肿瘤作用[11]。本文重点侧重于静脉注射丹酚酸A在恒河猴体内的药代动力学性质的评价,在此基础上进行了方法的优化,首次完成了恒河猴血浆中丹酚酸A、B和C同时测定的方法学建立与考察。
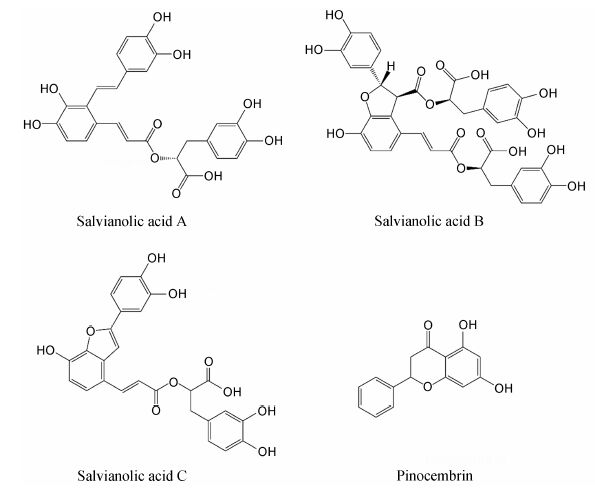
|
Figure 1 Chemical structures of salvianolic acid A,B,C and pinocembrin (IS) |
已有报道丹酚酸A在犬体内静脉注射的药代动力学特点,但其给药剂量为50 μg·kg-1[12],而丹酚酸A在心肌缺血或脑缺血疾病治疗中通常的有效给药剂量为毫克级[8, 13, 14, 15, 16, 17, 18, 19, 20, 21],毫克级的给药量使丹酚酸A体内暴露量超过线性范围几十至几百倍,导致血浆稀释方法学不易满足规定的限度要求。本文为了评价恒河猴静脉注射丹酚酸A 2.5、5和10 mg·kg-1后的体内过程,进行了测定方法的优化与改变,建立了恒河猴血浆中快速测定丹酚酸A的新方法。另外,由于丹酚酸A、B和C均为丹参中重要的酚酸类化合物,并且3种酚酸类化合物在市售药品中往往互为组成成分或相关物质,因此丹酚酸A测定的同时往往需要监测丹酚酸B和C的浓度。于是,本研究对前述方法进行了拓展,使其能同时测定猴血浆样品中丹酚酸A、B和C,且提高了检测的灵敏度,为丹酚酸A、B和C在猴或人体内的同时测定提供了实验依据。
材料与方法 仪器设备Agilent 1200高效液相色谱仪、Agilent 6110单四极杆质谱仪。
化学试剂丹酚酸A、B和C (HPLC分析纯度大于98%) 和匹诺塞林 (HPLC分析纯度大于98%) 均由中国医学科学院药物研究所提供。乙腈和甲醇均为LC-MS级别 (J.T. Baker,USA), 甲酸 (HPLC级) 购自TEDIA (Fairfield,USA),实验用水制备于Milli-Q Reagent water system纯水机 (Millipore,MA,USA),其他化学试剂均为分析纯。
实验动物恒河猴12只,雌雄各半,体重为4.5~5.6 kg (北京协尔鑫生物资源研究所,许可证号SCXK2010-0007),动物福利和实验过程遵循中国医学科学院动物伦理委员会的规定。
LC-MS条件实验采用Agilent 1200 HPLC系统,色谱柱为Agilent Zorbax SB-C18 (3.5 μm,2.1 mm × 100 mm),柱温为30 ℃。流动相为乙腈-水(含0.05%甲酸),以0.3 mL·min-1的速度进行梯度洗脱。梯度程序为0~5 min内逐步从15% 的乙腈提高到85% 乙腈,然后在5.01 min,流动相的比例瞬间回到15% 的乙腈,平衡5 min。高效液相色谱仪通过ESI源连接到Agilent 6110单四极杆质谱仪上。质谱检测为负离子监测模式。干燥气流为10.0 L·min-1,干燥气温度为350 ℃,喷雾器压力为35.0 psig,毛细管电压为3 000 V。质谱检测器以选择性离子监测模式 (SIM) 运行,丹酚酸A、B、C和内标的m/z分别为493、717、491和255,碎裂电压分别为75、120、120 和75 V。
丹酚酸A、B和C溶液的配制精密称取丹酚酸A、B或C的标准品适量,用甲醇配制成1 mg·mL-1溶液作为储备液备用。使用前精密吸取丹酚酸A、B或C的储备液用甲醇稀释成系列所需浓度的工作溶液。
内标溶液的配制准确称取匹诺塞林适量,用甲醇配制成1 mg·mL-1的匹诺塞林内标储备液。使用前用甲醇稀释储备液为0.1 mg·L-1内标工作溶液。
单独测定丹酚酸A的血浆样品制备与处理取丹酚酸A系列浓度工作溶液各100 μL、猴空白血浆50 μL、内标工作液100 μL、抗坏血酸溶液 (5 mg·mL-1) 10 μL和盐酸 (1 mol·L-1) 10 μL混合,涡旋3 min,13 400 r·min-1离心10 min,取上清进样10 μL进行LC-MS分析,得到标准曲线的测定结果。标准曲线的浓度在0.098~25 mg·L-1内。质控样品的制备方法同标准曲线,低、中和高浓度分别为0.195、4.688和18.75 mg·L-1。血浆样品前处理过程中取血浆50 μL于1.5 mL离心管中,加入内标工作液 (0.1 mg·L-1) 100 μL、甲醇100 μL、抗坏血酸 (5 mg·mL-1) 10 μL和盐酸 (1 mol·L-1) 10 μL,混合,涡旋3 min,13 400 r·min-1离心10 min,取上清液进样10 μL进行LC-MS分析。对于浓度高于最高定量限的样品,实验过程中先用空白猴血浆稀释 10倍再进行测定。
同时测定丹酚酸A、B和C的血浆样品制备与处理取丹酚酸A、B和C系列浓度工作溶液各100 μL、猴空白血浆150 μL、内标工作液100 μL、抗坏血酸溶液 (15 mg·mL-1) 10 μL和盐酸 (3 mol·L-1) 10 μL混合,涡旋3 min,13 400 r·min-1离心10 min,取上清液于40 ℃水浴下氮吹仪吹干,然后用流动相75 μL复溶,进样20 μL进行LC-MS分析,得到标准曲线的测定结果。丹酚酸A、B和C的标准曲线浓度均在5~1 000 ng·mL-1内。质控样品的制备方法同标准曲线,丹酚酸A、B和C的浓度选择均为10、250和750 ng·mL-1。血浆样品前处理过程中取血浆150 μL于1.5 mL离心管中,加入内标工作液 (0.1 mg·L-1) 100 μL、甲醇300 μL、抗坏血酸 (15 mg·mL-1) 10 μL和盐酸 (3 mol·L-1) 10 μL,混合,涡旋3 min,13 400 r·min-1离心10 min,取上清液于40 ℃水浴下氮吹仪吹干,然后用流动相75 μL复溶,进样20 μL进行LC-MS分析。
方法特异性考察了6个不同个体空白血浆样品色谱图、空白血浆样品加丹酚酸和内标 (IS) 的色谱图及猴静脉注射丹酚酸后的色谱图,评估空白血浆中的物质对于丹酚酸的测定是否存在干扰。
方法线性、准确度和精密度该方法的线性是通过对丹酚酸与内标的峰面积比值和浓度进行加权最小二乘回归得到。定量下限 (LLOQ) 的信号噪音之比至少为10∶1,并且准确度偏差小于20% (RE%),同时精密度的变异系数要求小于20%(RSD %)。日内准确度和精密度通过在同一天内测定3个浓度的质控样品5次来确定。日间准确度和精密度是通过连续测定5天3个浓度的质控样品,每天5次重复来确定。准确度和精密度分别由RE和RSD来表示。
方法回收率和基质效应丹酚酸的回收率是指质控样品中丹酚酸峰面积值与丹酚酸直接溶解在空白血浆制备的上清液的峰面积值之比。基质效应是指空白血浆上清液溶解的丹酚酸的峰面积值与用流动相溶解的丹酚酸的峰面积值之比。
方法稳定性单独测定丹酚酸A的方法稳定性分别考察了处理前室温放置4 h、长期放置 (-80 ℃放置30天)、反复冻融3次、处理后进样盘放置24 h以及稀释10倍的稳定性。同时测定丹酚酸A、B和C的方法的稳定性分别考察了处理前室温放置12 h、反复 冻融3次和处理后进样盘放置12 h的稳定性。
药代动力学研究恒河猴随机分成3组,每组4只,雌雄各半,分别于前肢静脉注射给予2.5、5和 10 mg·kg-1的丹酚酸A (丹酚酸A粉末用生理盐水溶解)。注射前以及注射后的2、5、10、20、30、60、120、240、480和720 min于猴注射对侧前肢采血约0.5 mL置于含枸橼酸钠离心管中,4 ℃,5 000 r·min-1离心10 min,取上层血浆存于 -80 ℃备用,测定时采用单独测定丹酚酸A的血浆样品处理方法进行处理。药代动力学参数由DAS 3.0软件采用非房室模型计算获得。应用剂量相关性的统计分析模型 (power model),对药代动力学参数的C2 min和AUC的剂量相关性进行分析[22, 23]。模型公式为P = α × Dβ1Ln(P) = β0 + β1Ln(D),其中P代表药代动力学参数C2 min和AUC,D是剂量,β1代表换算后的公式的斜率。理想的剂量相关性模型中β1 = 1 (P = α × D),此时的药代动力学参数P和剂量D相关性良好。
结果与讨论 1 单独测定猴血浆丹酚酸A的方法学考察1.1 特异性
特异性考察结果表明丹酚酸A和内标的保留时间分别为6.5和8.6 min。在保留时间范围内均没有内源性物质或其他物质的干扰,基线噪音较小,可满足定量测定要求。
1.2 线性、准确度和精密度该方法标准曲线的浓度范围为0.098~25 mg·L-1,y = 0.089 3 x + 0.000 4 (R² = 0.999 8,n = 5),最低定量限为0.098 mg·L-1。丹酚酸A测定的日内和日间精密度RSD在3.52%~8.77% 之间,日内和日间准确度的偏差在 -6.15%~7.83% 之间,提示该方法准确、可靠、重现性好,符合新药临床前药代动力学研究生物样品定量分析的要求。
1.3 回收率和基质效应丹酚酸A在3个浓度条件下的回收率分别为 (102.71 ± 6.91) %、(100.46 ± 3.85) % 和 (99.53 ± 3.27) %,其RSD分别为6.73%、3.84% 和3.29%。同时,基质效应分别为 (99.66 ± 3.92) %、(100.07 ± 2.26) % 和(99.92 ± 2.95) %,其RSD分别为3.93%、2.26% 和2.96%,表明血浆基质对待测化合物无明显的离子抑制或增强效应,不干扰目标化合物的测定。
1.4 稳定性丹酚酸A在不同的稳定性考察条件下的RE介于 -12.82%~8.19% 之间,RSD介于1.48%~7.16% 之间,表明丹酚酸A在上述样品处理及放置过程中均稳定,能够满足恒河猴血浆中丹酚酸A的测定。
2 丹酚酸A在猴体内的药代动力学丹酚酸A在静脉注射2 min时低、中、高剂量的血药浓度分别为 (28.343 ± 6.426)、(45.679 ± 12.301) 和 (113.293 ± 24.364) mg·L-1,给药4 h后,丹酚酸A血药浓度低于最低定量限。药代动力学的参数结果表明丹酚酸A在猴体内的清除速度较快。所得的药时曲线见图 2,其对应的药代动力学参数见表 1。
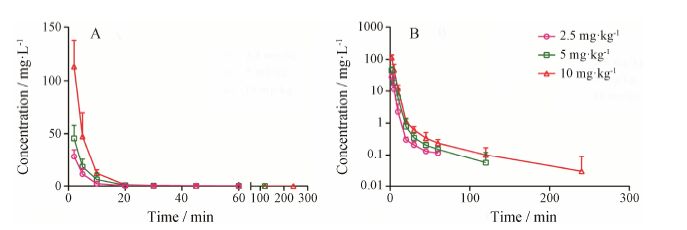
|
Figure 2 Mean plasma concentration-time curves of salvianolic acid A (Sal A). A: Mean plasma concentration-time curves; B: Semi-logarithmic curves. n = 4,x± s |
|
|
Table 1 Major pharmacokinetic parameters of Sal A in Rhesus monkey. n = 4,x± s |
剂量相关性结果表明Ln(C2 min)、Ln(AUC0-t) 和 Ln(AUC0-∞) 对LnD的斜率β1分别为1.001、1.050和1.034,均接近于1,剂量相关性良好。对剂量相关性进行统计分析的实验中,以换算得到的90% 置信区间在0.7427~1.258作为判别标准[24]。C 2 min的90% 置信区间在0.7427~1.258内,表明在2.5~10 mg·kg-1剂量内C2 min的剂量相关性具有统计学意义。而AUC0-t和AUC0-∞的90% 置信区间分别为0.7953~1.304和0.7782~1.289,略超出0.7427~1.258的范围,表明虽然其剂量相关性较好,但没有统计学意义。
3 丹酚酸A、B和C猴血浆中同时测定方法学考察
为了同时测定恒河猴血浆中的丹酚酸A、B和C,并提高检测丹酚酸A方法的灵敏度,改进的方法提高了血浆用量,应用甲醇沉淀蛋白并离心。本法特异性考察见图 3,丹酚酸A、B、C和内标的保留时间分别为6.5、6.3、7.0和8.6 min。丹酚酸A、B和C的回收率介于86.37%~105.48% 之间,基质效应介于89.10%~105.48% 之间,满足测定的要求。丹酚酸A、B和C的标准曲线质量浓度在5~1 000 ng·mL-1内,标准曲线分别为y = 0.0016 x - 0.000 3、y = 0.003 6 x + 0.003 2和y = 0.002 5 x + 0.003 2,R2分别为0.999 8、0.999 8和0.997 2。另外,3种化合物的日内和日间精密度RSD在0.30%~12.45% 之间,日内和日间准确度的偏差在-11.86%~12.17% 之间,提示该方法准确、可靠、重现性好,符合新药临床前药代动力学研究生物样品定量分析的要求。方法稳定性考察了处理前室温放置12 h、反复冻融3次和处理后进样盘放置
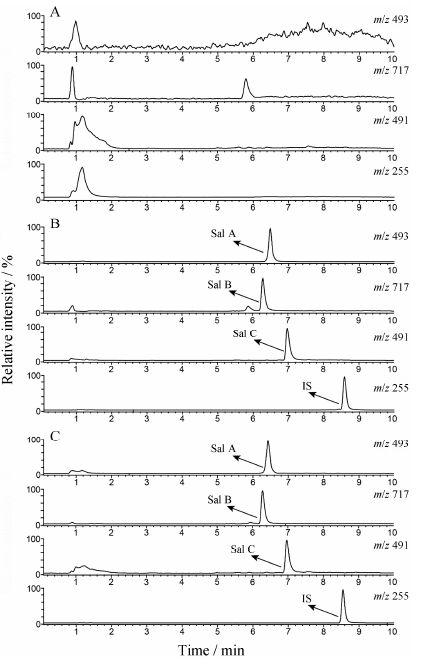
|
Figure 3 Typical chromatograms of salvianolic acids and IS. A: Blank Rhesus monkey plasma; B: Blank Rhesus monkey plasma spiked with salvianolic acids and IS; C: Rhesus monkey plasma sample at 2 min after intravenous injection of salvianolic acids spiked with IS |
12 h的稳定性,丹酚酸A、B和C在各浓度的偏差不超过20%,表明上述样品处理及放置过程基本稳定。
含丹酚酸类化合物的猴血浆样品处理过程中,加入抗坏血酸和盐酸,可明显抑制丹酚酸类化合物的分解或解离,能够获得较好的回收率和稳定性。在样品的处理过程中,若采用甲醇沉淀蛋白,离心,吸取上清液直接上样的方法,简便快速、节省时间,适合血药浓度高且不宜过多倍数稀释的样品的测定; 而采用甲醇沉淀血浆蛋白,离心,吸取上清液于氮吹仪上水浴吹干,再复溶进样的方法,则可以获得较低的检测限,但操作步骤繁琐,较为耗费时间和人力。上述两种方法各有优缺点,在应用过程中可参考样品中药物的浓度和实验目的来选择具体的方法。
结论
本文建立了恒河猴含丹酚酸A血浆的处理和含量测定的LC-MS方法,并成功地应用于丹酚酸A在恒河猴体内的药代动力学特征研究。另外,由于丹酚酸A、B和C具有相似的分子结构且都属于丹参中的重要活性成分,本文在丹酚酸A测定方法的基础上进行了优化,首次完成了恒河猴血浆中丹酚酸A、B和C同时测定的方法学建立与考察。对恒河猴静脉注射丹酚酸A的药代动力学参数研究表明,丹酚酸A在2.5~10 mg·kg-1的剂量内具有较好的相关性,本研究对丹酚酸A的临床前研究及临床应用具有一定的参考与借鉴价值。
| [1] | Fan HY, Fu FH, Yang MY, et al. Antiplatelet and antithrombotic activities of salvianolic acid A [J]. Thromb Res, 2010, 126: e17-e22. |
| [2] | Huang ZS, Zeng CL, Zhu LJ, et al. Salvianolic acid A inhibits platelet activation and arterial thrombosis via inhibition of phosphoinositide 3-kinase [J]. J Thromb Haemostasis, 2010, 8: 1383-1393. |
| [3] | Wu ZM, Wen T, Tan YF, et al. Effects of salvianolic acid A on oxidative stress and liver injury induced by carbon tetrachloride in rats [J]. Basic Clin Pharmacol Toxicol, 2007, 100: 115-120. |
| [4] | Tsai MK, Lin YL, Huang YT. Effects of salvianolic acids on oxidative stress and hepatic fibrosis in rats [J]. Toxicol Appl Pharmacol, 2010, 242: 155-164. |
| [5] | Zhang HA, Gao M, Zhang L, et al. Salvianolic acid A pro-tects human SH-SY5Y neuroblastoma cells against H2O2-induced injury by increasing stress tolerance ability [J]. Biochem Biophys Res Commun, 2012, 421: 479-483. |
| [6] | Xu XM, Hu Y, Zhai XH, et al. Salvianolic acid A preconditioning confers protection against concanavalin A-induced liver injury through SIRT1-mediated repression of p66shc in mice [J]. Toxicol Appl Pharmacol, 2013, 273: 68-76. |
| [7] | Zhang H, Liu YY, Jiang Q, et al. Salvianolic acid A pro-tects RPE cells against oxidative stress through activation of Nrf2/ HO-1 signaling [J]. Free Radical Biol Med, 2014, 69: 219- 228. |
| [8] | Wang SB, Tian S, Yang F, et al. Cardioprotective effect of salvianolic acid A on isoproterenol-induced myocardial infarction in rats [J]. Eur J Pharmacol, 2009, 615:125-132. |
| [9] | Jiang BH, Li DF, Deng YP, et al. Salvianolic acid A, a novel matrix metalloproteinase-9 inhibitor, prevents cardiac remodeling in spontaneously hypertensive rats [J]. PLoS One, 2013, 8: e59621. |
| [10] | Du GH, Qiu Y, Tian YE, et al. Preventon of galactose- induced cataractogenesis in rats by salvianolic acid [J]. Acta Pharm Sin (药学学报), 1995, 30: 561-566. |
| [11] | Zhang SH, Su J, Zhen YS. Salvianolic acid A inhibits nucleoside transport and potentiates the antitumor activity of chemotherapeutic drugs [J]. Acta Pharm Sin (药学学报), 2004, 39: 496-499. |
| [12] | Sun JL, Zhang L, Song JK, et al. Pharmacokinetic study of salvianolic acid A in beagle dog after oral administration by a liquid chromatography-mass spectrometry method: a study on bioavailability and dose proportionality [J]. J Ethnopharmacol, 2013, 148: 617-623. |
| [13] | Du GH, Zhang JT. Protective effects of salvianolic acid A against impairment of memory induced by cerebral ische-mia- reperfusion in mice [J]. Chin Med J, 1997, 110: 65-68. |
| [14] | Song YP, Kong LS, Wu J, et al. Comparison of the effect of salvianolic acid A and B on acute myocardial ischemia of rats [J]. Chin J Inf Tradit Chin Med (中国中医药信息杂志), 2007, 14: 36−38. |
| [15] | Jiang M, Guo LP, Zhou WY, et al. Effect of salvianolic acid A in ICAM-1 expression in focal brain ischemia-reperfusion [J]. Liaoning J Tradit Chin Med (辽宁中医杂志), 2009, 36: 469-471. |
| [16] | Jiang M, Guo LP, Li J, et al. Effect of salvianolic acid A in CD11b/CD18 expression in focal brain ischemia-reperfusion [J]. Liaoning J Tradit Chin Med (辽宁中医杂志), 2008, 35: 1425-1426. |
| [17] | Yang XY, Qiang GF, Zhang L, et al. Myocardial protection from ischemia-reperfusion injury by saivianolic acid A in rats [J]. Chin Pharmacol Bull (中国药理学通报), 2011, 27: 1072−1076. |
| [18] | Lin LL, Wang W, Cheng MH, et al. Protection of different components of danshen in cerebral infarction in mice [J]. CNS Neurosci Ther, 2012, 18: 511-512. |
| [19] | Wang SB, Pang XB, Zhao Y, et al. Protection of salvianolic acid A on rat brain from ischemic damage via soluble ep-oxide hydrolase inhibition [J]. J Asian Nat Prod Res, 2012, 14: 1084-1092. |
| [20] | He H, Li X, Wang HD, et al. Effects of salvianolic acid A on plasma and tissue dimethylarginine levels in a rat model of myocardial infarction [J]. J Cardiovasc Pharmacol, 2013, 61: 482-488. |
| [21] | Li YJ, Duan CL, Liu JX. Salvianolic acid A promotes the acceleration of neovascularization in the ischemic rat myocardium and the functions of endothelial progenitor cells [J]. J Ethnopharmacol, 2014, 151: 218-227. |
| [22] | Smith BP, Vandenhende FR, DeSante KA, et al. Confi-dence interval criteria for assessment of dose proportionality [J]. Pharm Res, 2000, 17:1278-1283 |
| [23] | Gough K, Hutchison M, Keene O, et al. Assessment of dose proportionality: report from the statisticians in the pharmaceutical industry/pharmacokinetics UK joint working party [J]. Drug Inf J, 1995, 29: 1039-1048. |
| [24] | Hummel J, McKendrick S, Brindley C, et al. Exploratory assessment of dose proportionality: review of current ap-proaches and proposal for a practical criterion [J]. Pharm Stat, 2009, 8: 38-49. |
 2015, Vol. 50
2015, Vol. 50


